- Головна
- /
- Статті
- /
- Кардіологія
- /
- Диагностика и лечение фибрилляции предсердий
Диагностика и лечение фибрилляции предсердий

Фибрилляция предсердий (ФП) продолжает оставаться одним из самых распространенных нарушений ритма сердца. Пароксизмальной или персистирующей формой ФП страдают 2,3 млн жителей США и 4,5 млн – стран Евросоюза. В США и в странах ЕС частота госпитализаций по поводу ФП за последние 20 лет увеличилась на 66%.
Затраты на лечение больных с фибрилляцией предсердий в странах ЕС приближаются к 13,5 млрд евро (15,7 млрд долларов США), данные о затратах на лечение больных с ФП в США не опубликованы. В связи с этим тщательный и компетентный анализ данных об относительной пользе или риске диагностических мероприятий и способов лечения способствует разработке методических рекомендаций, повышающих эффективность медицинского обслуживания, улучшающих исход заболеваний, а также благоприятно влияет на общую стоимость медобслуживания путем перераспределения ресурсов в сторону наиболее эффективных стратегий лечения. Рекомендации помогут врачам расположить по приоритетам задачи диагностики и лечения пациентов с ФП согласно следующим шагам:
• контролирования частоты сердечных сокращений;
• предотвращения тромбообразования;
• коррекции нарушений ритма (если возможно).
В последних рекомендациях Американского колледжа кардиологов, Американской кардиологической ассоциации и Европейского кардиологического общества по ведению пациентов с фибрилляцией предсердий
(ACC/AHA/ECC 2006 Guidelines for Management of Patients With Atrial Fibrillation) на основании анализа большого количества исследований проводилось сравнение
эффективности стратегий лечения ФП: восстановление и удержание синусового ритма или контроль частоты сердечных сокращений (ЧСС), предупреждение развития тромбоэмболических осложнений, анализ методик проведения антикоагулянтной терапии, даются рекомендации по диагностике и лечению больных с ФП. Проанализированы достижения нефармакологических методов лечения – методик катетерной абляции, приведены показания для их проведения.
Фибрилляция предсердий – разновидность наджелудочковых тахиаритмий, характеризующаяся некоординированной электрической активностью предсердий с последующим ухудшением их сократительной функции. На электрокардиограмме (ЭКГ) характерным признаком ФП является замещение нормальных зубцов Р быстрыми осцилляциями, или волнами фибрилляции, различных размеров и форм, связанными с неправильными частыми сокращениями желудочков при ненарушенном атриовентрикулярном (АВ) проведении. Частота сокращений желудочков при ФП зависит от электрофизиологических свойств АВ узла, уровня активности симпатической и парасимпатической нервной системы, а также действия лекарственных препаратов. Равные интервалы RR возможны при наличии АВ блокады или сопутствующей желудочковой тахикардии.
У больных с искусственными водителями ритма (ИВР) для диагностики ФП может потребоваться временное отключение ИВР, чтобы выявить фибрилляционную активность предсердий. При постоянной тахикардии с неправильным ритмом и широкими комплексами QRS можно с большей степенью вероятности предположить наличие ФП с проведением по дополнительным путям или ФП с сопутствующей блокадой ножек пучка Гиса. Очень высокая частота сердечных сокращений (> 200 уд/мин) свидетельствует о наличии дополнительного проводящего пути.
Сопутствующие нарушения ритма
ФП может протекать изолированно или в сочетании с другими аритмиями, чаще всего с трепетанием предсердий или предсердными тахикардиями. Трепетание предсердий может развиваться при лечении антиаритмическими препаратами с целью профилактики рецидива ФП. Трепетание предсердий – более организованное нарушение ритма, чем ФП, и характеризуется наличием на ЭКГ «зубьев
пилы» (F-волн), отражающих возбуждение предсердий через правильные промежутки времени. F-волны особенно хорошо выражены во II, III и aVF отведениях, причем изоэлектрическая линия между отведениями отсутствует. Без лечения частота сокращений предсердий обычно
варьирует от 240 до 320 уд/мин с направленными вниз
F-волнами во II, III и aVF отведениях и направленными вверх волнами в отведении V1.
Волна возбуждения в правом предсердии может быть направлена в противоположную сторону, что отражается на ЭКГ наличием положительных F-волн во II, III и aVF отведениях и отрицательных F-волн в отведении V1. Трепетание предсердий обычно встречается в сочетании с АВ блокадой в соотношении 2:1, что выражается частотой желудочковых сокращений 120-160 уд/мин чаще всего – 150 уд/мин. Выделяют несколько разновидностей трепетания предсердий, однако общепризнанной классификации не существует. Трепетание может переходить в фибрилляцию предсердий, а ФП – способствовать развитию трепетания. На ЭКГ может наблюдаться сочетание обоих заболеваний, что отражает изменение электрической активации предсердий.
Другие разновидности предсердных тахикардий –
АВ риэнтри тахикардии и АВ узловые риэнтри тахикардии – также могут вызывать ФП. При других предсердных тахикардиях зубцы Р выявляются четко и разделены изоэлектрической линией в одном или более ЭКГ отведении. Морфология зубца Р может помочь выявлению происхождения тахикардии. Недавно была открыта уникальная разновидность предсердной тахикардии, чаще всего зарождающаяся в легочных венах, при которой наблюдается частота желудочковых сокращений > 250 уд/мин, которая часто переходит в ФП. Электрофизиологические исследования с внутрисердечным картированием (мэпингом) могут помочь в дифференцировании между различными типами предсердных аритмий и выявлении механизмов их развития.
Классификация ФП
Фибрилляция предсердий имеет полиморфную клиническую картину и может встречаться как при наличии органического заболевания миокарда и его проявлений, так и изолированно. Предложены различные классификации этого заболевания. Одна схема основана на ЭКГ-проявлениях, другая – на записи эпикардиальных или внутриполостных потенциалов или бесконтактного картирования электрической активности предсердий. Предложено также несколько клинических классификаций, но ни одна из них не отражает всех аспектов ФП. Для того чтобы представлять пользу для клиники, классификация должна быть основана на достаточном количестве характеристик и иметь практическое применение.
Приступ ФП может купироваться самостоятельно или потребовать медицинского вмешательства. Со временем особенности течения заболевания можно охарактеризовать с точки зрения количества пароксизмов, продолжительности, частоты, характера начала и возможных факторов развития, а также эффекта от проводимого лечения, однако в том случае, когда приступ ФП встречается у
пациента впервые, все эти характеристики точно определить невозможно. Хотя клиническая картина со временем может меняться, с клинической точки зрения важно охарактеризовать особенности аритмии на данный момент.
Для описания ФП использовались различные термины, такие как «острая», «хроническая», «пароксизмальная»,
«интермиттирующая», «постоянная», «персистирующая» и «перманентная», однако большое их количество затрудняет проведение сравнительных исследований данного заболевания относительно эффективности терапевтических стратегий. Схема
классификации, предложенная в этих рекомендациях, представляет собой плод консенсуса, вызванный общим стремлением к простоте и клиническому единообразию.
Клиницисту следует выделять впервые выявленный эпизод ФП независимо от того, сопровождался он какими-либо клиническими проявлениями или купировался самостоятельно. Следует учитывать, что длительность приступа ФП может быть неопределенной, а предыдущие эпизоды – проходить незамеченными.
Пароксизмальная форма – приступ длится менее 7 дней, в большинстве случаев – менее 24 ч, ритм восстанавливается спонтанно.
Персистирующая форма – длится более 7 дней, спонтанно не купируется.
Постоянная форма – кардиоверсия неэффективна или не проводилась.
Как пароксизмальная, так и персистирующая форма ФП могут быть рецидивирующими.
Если у пациента было 2 приступа или более, то ФП считается рецидивирующей. Если приступ купируется самостоятельно, то его повторение считается проявлением пароксизмальной формы. Фибрилляция предсердий,
которая сохраняется в течение определенного времени, это персистирующая ФП. В этом случае способ купирования аритмии при помощи медикаментозной терапии или электрической кардиоверсии не влияет на название.
Персистирующая ФП может быть как первым проявлением аритмии, так и логическим завершением повторных приступов пароксизмальной ФП. Категория персистирующей ФП также включает в себя случаи длительно существующей ФП (например, более 1 года), при которых
кардиоверсия оказалась неэффективной или не показана, обычно эта форма переходит в постоянную.
Вышеуказанная терминология относится к эпизодам ФП длительностью > 30 с, не связанным с обратимой причиной. Вторичная ФП, возникающая во время острого инфаркта миокарда, операций на сердце, при перикардите, миокардите, гипертиреозе, тромбоэмболии легочной артерии (ТЭЛА), пневмонии или при другом остром заболевании легких, рассматривается отдельно. Это связано с тем, что при исчезновении причинного фактора существует малая вероятность развития повторного эпизода аритмии. В этой ситуации ФП не является основной проблемой, и одновременное лечение причинного фактора и приступа ФП обычно завершается купированием аритмии без ее рецидива в дальнейшем.
Термин «изолированная ФП» имеет много определений, но в общем применяется к ФП, возникающей у пациентов молодого и среднего возраста (до 60 лет) без клинических или эхокардиографических признаков сердечно-легочного заболевания. Прогноз в отношении тромбоэмболии или смертности у таких больных благоприятный. Однако со временем пациенты из группы
изолированной ФП переходят в другую категорию по
мере старения или развития сердечно-сосудистых заболеваний, сопровождающихся увеличением левого предсердия (ЛП). Соответственно растет риск развития
тромбоэмболии и смертельного исхода. Условно термин «неклапанная ФП» применяется в тех случаях, когда
нарушение ритма возникает при отсутствии ревматического порока митрального клапана или протезированного митрального клапана.
Обследование пациента с ФП
Начальное обследование пациента с подозрением на ФП или с ее наличием включает в себя характеристику этого заболевания как пароксизмальной или персистирующей формы, определение его причины и ассоциированных сердечных и внесердечных факторов. Внимательный сбор анамнеза поможет разработать рациональный конкретный план обследования, который будет служить эффективным руководством к лечению. Уже после первой встречи с пациентом можно разработать план обследования и начать лечение. Задержка в лечении может быть обусловлена отсутствием документов, регистрирующих нарушение ритма, и необходимостью дополнительного наблюдения в связи с этим.
Минимальное обследование больных с ФП включает:
1. Анамнез заболевания и данные объективного осмотра для выявления:
• наличия и природы симптомов, связанных с ФП;
• клинического типа ФП (впервые выявленной, пароксизмальной, персистирующей или постоянной);
• начала первого приступа, сопровождавшегося симптоматикой, или даты обнаружения ФП;
• частоты, длительности, провоцирующих факторов и способов купирования ФП;
• эффективности любых лекарственных препаратов, назначенных ранее;
• наличие любого органического заболевания сердца или других обратимых состояний (например, гипертиреоза или употребления алкоголя).
2. Электрокардиография для выявления:
• ритма (подтверждения ФП);
• гипертрофии ЛЖ;
• длительности зубца Р и морфологии волн фибрилляции;
• предвозбуждения;
• блокады ветвей пучка Гиса;
• инфаркта миокарда в прошлом;
• других предсердных аритмий;
• длины интервалов RR, QRS и QT в динамике с целью оценки действия антиаритмических препаратов.
3. Эхокардиография для выявления:
• заболеваний клапанов сердца;
• размеров левого и правого предсердий;
• размеров ЛЖ и его функционирования;
• пикового давления в правом желудочке (легочной гипертензии);
• гипертрофии ЛЖ;
• тромба в левом предсердии (низкой чувствительности);
• заболевания перикарда.
4. Исследование функции щитовидной железы, почек и печени:
• при первом приступе ФП;
• при трудности контроля желудочкового ритма.
В качестве дополнительных методов исследования могут понадобиться один или несколько тестов:
1. Тест шестиминутной прогулки:
• для оценки адекватности контроля ЧСС.
2. Тест толерантности к физической нагрузке:
• при сомнительной адекватности контроля ЧСС (постоянной ФП);
• для индуцирования ФП, связанной с физической нагрузкой;
• для исключения наличия ишемии миокарда перед началом лечения препаратами группы IC.
3. Холтеровское мониторирование:
• при сомнении в определении типа ФП;
• для оценки контроля ритма.
4. Чреспищеводная эхокардиография:
• для выявления тромба в левом предсердии (в ушке левого предсердия);
• для проведения кардиоверсии.
5. Электрофизиологическое исследование:
• для выяснения механизма развития тахикардии с широкими комплексами QRS;
• для выяснения аритмии, предрасполагающей к ФП, например, трепетания предсердий или пароксизмальной наджелудочковой тахикардии;
• для поиска участков абляции или блокады (изменения) АВ проведения.
6. Рентгенография грудной клетки:
• для оценки состояния легочной паренхимы при подозрении в объективном обследовании;
• для оценки состояния легочного сосудистого русла при подозрении в объективном обследовании.
Для диагностирования ФП необходимо наличие ее признаков хотя бы в одном отведении ЭКГ во время приступа. Эту задачу можно облегчить методом просмотра ЭКГ записей во время пребывания в реанимации, холтеровского мониторирования или записей, полученных по телефону или другим путем. В случаях пароксизмальной формы ФП в установлении диагноза может помочь переносной электрокардиограф, который позволяет получить полную ЭКГ запись приступа. Если приступы происходят часто, можно применить 24-часовое холтеровское мониторирование. Если эпизоды нечасты, то большую пользу принесет специальное устройство для временной регистрации ЭКГ, позволяющего пациенту при развитии приступа передать необходимые данные на записывающее устройство. На рентгенограмме грудной клетки можно выявить увеличение камер сердца и признаки сердечной недостаточности (СН), однако наибольшую ценность это исследование представляет для выявления патологии легких и оценки состояния легочных сосудов. В рутинной оценке больных с ФП это исследование уступает по информативности эхокардиографии. Двухмерную трансторакальную эхокардиографию следует проводить всем пациентам с ФП при начальном обследовании с целью определения размеров ЛП и левого желудочка (ЛЖ), толщины стенки и функции ЛЖ, а также для исключения бессимптомного поражения клапанов или заболевания перикарда или гипертрофической кардиомиопатии. Оценка систолической и диастолической функции ЛЖ помогает принять решения о проведении антиаритмической и антитромботической терапии. Тромб следует искать в ЛП и его ушке, однако его редко можно обнаружить без чреспищеводной эхокардиографии.
Принципы лечения
Лечение больных с ФП включает три не взаимоисключающие задачи: контроль ЧСС, профилактику тромбоэмболических осложнений и лечение аритмии. Ранее описанные стратегии лечения включали стратегии контроля ритма и контроля ЧСС. Под стратегией контроля ЧСС подразумевалось контролирование частоты сокращения желудочков, не предпринимая попыток восстановления ритма и его поддержания. Стратегия контроля синусового ритма подразумевает восстановление синусового ритма и его удержание. Эта стратегия предполагает также контроль частоты синусового ритма. В зависимости от результатов стратегии должны изменяться в случае неэффективности. Независимо от выбранной стратегии всем больным необходимо проводить антитромботическую терапию, направленную на предупреждение тромбоэмболий.
Фармакологические и нефармакологические методы лечения
Фармакологические препараты и методы абляции являются эффективными как для контроля ритма, так и для контроля ЧСС, и в определенных условиях хирургические методы лечения могут быть предпочтительными. Независимо от выбранных методов лечения необходима антикоагулянтная терапия, которая должна проводиться на основании имеющихся у больного факторов риска развития инсульта независимо от того, какой ритм у пациента – синусовый или ФП. Для больных, у которых выбрана стратегия восстановления синусового ритма, медикаментозная терапия является тактикой первого выбора, абляция левого предсердия – тактикой второго выбора, особенно у лиц с симптоматической ФП. У некоторых пациентов в основном молодого возраста с выраженными симптомами ФП радиочастотная абляция предпочтительнее медикаментозной терапии.
Контроль ритма или контроль ЧСС?
Основания для восстановления и поддержания синусового ритма у пациентов с ФП – уменьшение симптомов, профилактика тромбоэмболий, предотвращение развития кардиомиопатии. Часто считается, что восстановление синусового ритма решает все эти проблемы, однако существует недостаточное количество исследований, доказывающих, что при восстановлении и поддержании синусового ритма эти цели достигаются.
Теоретически восстановление и поддержание синусового ритма снижают риск развития тромбоэмболий и соответственно уменьшают потребность в антикоагулянтах, однако препараты для контроля ритма более безопасны, чем антиаритмические средства. В результате проведенных рандомизированных исследований оценки этих стратегий не установлено достоверных отличий в продолжительности жизни, частоте возникновения инсультов и смертности.
Кардиоверсия
Восстановление синусового ритма часто производят при персистирующей ФП в плановом порядке. Однако если аритмия является основным фактором острой СН, гипотензии или ухудшения симптоматики у больных с ИБС, восстановление синусового ритма следует проводить немедленно. При кардиоверсии всегда существует риск тромбоэмболии, который существенно снижается при начале антикоагулянтной терапии до процедуры, повышается – при наличии ФП более 48 часов.
Способы восстановления синусового ритма
Синусовый ритм восстанавливается фармакологически и при помощи электрического разряда. До того, как восстановление ритма при помощи электрического разряда стало обычной процедурой, широко использовались
лекарственные средства. Разработка новых препаратов сделала фармакологическую конверсию популярной,
хотя и продолжают оставаться некоторые недостатки – риск развития лекарственной желудочковой тахикардии типа «пируэт» или другой жизнеугрожающей аритмии. Фармакологическая кардиоверсия все еще менее эффективна, чем электрическая. Однако для электрической кардиоверсии требуется местная или общая анестезия, а для фармакологической – нет. Риск тромбоэмболии или инсульта одинаково существует как при первом виде кардиоверсии, так и при втором. Рекомендации по антикоагуляции при кардиоверсии также аналогичны для обоих способов и приведены в разделе по профилактике тромбоэмболий.
Фармакологическое восстановление ритма
Лекарственный подход проще, но менее эффективен. В некоторых случаях фармакологическое восстановление ритма (ФВР) может быть выполнено даже в домашних условиях. Наиболее высокий риск – токсичность антиаритмических средств. В этом разделе рассматриваются препараты, которые были применены в течение сравнительно короткого периода времени для восстановления синусового ритма. На качество подобных исследований негативно влияют небольшой размер выборки, отсутствие стандартных критериев включения, разные промежутки времени от начала приема препарата до оценки его эффективности и произвольный выбор дозы. При разработке этих методических указаний основной акцент был сделан на контролируемые плацебо исследования.
Фармакологическая кардиоверсия наиболее эффективна в течение 7 дней после начала приступа ФП. У большинства таких пациентов это первый приступ ФП. У половины больных с недавно развившейся ФП в течение 24-48 часов происходит спонтанная кардиоверсия. Спонтанное восстановление синусового ритма реже происходит у больных с длительностью ФП более 7 дней до начала лечения, а эффективность терапии у пациентов с постоянной формой ФП – значительно ниже.
Некоторые препараты обладают отсроченным началом действия, и поэтому восстановление синусового ритма происходит через несколько дней. В некоторых исследованиях было выявлено, что фармакотерапия укорачивала время восстановления синусового ритма по сравнению с плацебо, не влияя на процент пациентов, у которых синусовый ритм сохранялся более 24 часов. Терапия, направленная на фармакологическую кардиоверсию, может ускорить восстановление синусового ритма у больных с недавно развившейся ФП, однако через 24-48 часов ее преимущество весьма мало, и она намного менее эффективна у больных с
персистирующей формой ФП.
Относительная эффективность различных средств зависит от разновидности мерцательной аритмии, однако больные с трепетанием предсердий также были включены во многие исследования антиаритмических препаратов. Доза, способ введения, время начала приема препаратов влияют на эффективность, и эти факторы максимально учитывались при разработке данных рекомендаций. В результатах рандомизированных исследований редко сообщается о других препаратах, которые одновременно принимают пациенты, исходя из предположения о том, что они равномерно распределены среди больных. У нескольких групп исследователей имеется недостаточное количество отчетов, и поэтому не понятно, включены ли в эти исследования одни и те же когорты пациентов или разные. О побочных эффектах препаратов также сообщается с различной степенью скрупулезности, однако сведения о их токсичности учитываются в данных рекомендациях. Возможные взаимодействия между противоаритмическими препаратами и антикоагулянтами (как повышающие, так и снижающие эффективность антикоагулянтов) всегда представляют собой важную клиническую проблему. Важность проблемы еще более увеличивается при подготовке к плановой кардиоверсии.
Дополнительное назначение антиаритмического препарата для повышения вероятности восстановления и поддержания синусового ритма может усилить или ослабить антикоагулянтное действие препаратов и повысить риск кровотечения или тромбоэмболических осложнений.
Рекомендации по применению фармакологических препаратов для восстановления синусового ритма при ФП представлены в таблицах 1, 2, 3. Алгоритмы фармакологического лечения ФП – в схемах 1, 2, 3, 4. Все препараты, приведены ниже, разрешены к применению в США и странах Европы, однако не все они рекомендованы для лечения ФП. В каждой категории средства перечислены по алфавиту.
Электрическая кардиоверсия
Кардиоверсия постоянным током представляет собой нанесение электрического разряда, синхронизированного с внутренней активностью сердца, обычно с зубцом R на ЭКГ. Эта методика не допускает нанесения разряда во время уязвимой фазы сердечного цикла – 60-80 мс до и 20-30 мс после вершины зубца Т. Электрическая кардиоверсия используется для нормализации всех патологических сердечных ритмов, кроме фибрилляции желудочков. Под термином «дефибрилляция» подразумевается асинхронный разряд, который применяют лишь для лечения фибрилляции желудочков, но не ФП.
Успех кардиоверсии ФП зависит от характера основного заболевания сердца и плотности тока, приложенного к миокарду предсердий. Последнее, в свою очередь, зависит от напряжения на конденсаторе дефибриллятора,
выходного сигнала, размера и положения электродов и трансторакального сопротивления (импеданса). Плотность тока снижается по мере увеличения сопротивления в области данной конкретной поверхности электрода. Импеданс зависит от размера и материала, из которого изготовлены электроды, контактного слоя между электродами и кожей, расстояния между электродами, размера туловища, фазы дыхательного цикла, количества произведенных разрядов и интервала между ними. Надлежащий учет каждой из этих переменных важен для достижения успеха кардиоверсии.
Электрическое сопротивление между электродами и кожей можно свести к минимуму путем использования пропитанных раствором электролитов подушечек. Легочная ткань, располагающаяся между электродами и сердцем, снижает проведение тока, поэтому разряды, нанесенные во время выдоха и при сжатии грудной клетки, действуют на сердце сильнее. Электроды большого размера приводят к уменьшению сопротивления, однако если они очень большие, плотность тока через миокард становится недостаточной для восстановления синусового ритма, в то время как электроды небольшого размера могут вызывать слишком большую плотность потока и повреждать миокард.
Независимыми прогностическими факторами успешной кардиоверсии являются прямолинейные двухфазные разряды, сопротивление грудной клетки и длительность ФП. В своем первом описании кардиоверсии Лаун (Lown) и сотр. отметили, что передне-задняя конфигурация электрода лучше, чем его передне-переднее расположение, однако другие исследователи с этим не согласны. Передне-заднее расположение электродов позволяет току достаточной мощности достичь достаточной для
дефибрилляции массы миокарда предсердий, когда имеются патологические изменения обоих предсердий (как например у больных с дефектом межпредсердной перегородки или кардиомиопатиями), поскольку образующееся силовое поле захватывает часть стенки правого предсердия. Недостатком такой конфигурации является сравнительно большое расстояние между электродами и наличие легочной ткани между передним электродом и сердцем, особенно у больных с
эмфиземой. Помещение переднего электрода слева от грудины уменьшает расстояние между электродами и количество промежуточной легочной ткани. Превосходство
одной конфигурации над другой точно не установлено,
однако известно, что электроды следует помещать прямо на стенку грудной клетки, а не на ткань молочной железы.
Другие варианты расположения электродов приводят к уменьшению эффективного потока через основные части сердца, поэтому их применение не приветствуется. В рандомизированном контролируемом исследовании у 301 пациента, которым предстояла плановая наружная кардиоверсия, была исследована эффективность переднелатерального (верхушка желудочка и правая подключичная область) и
передне-заднего (грудина и левая лопаточная область) расположения электродов. Общий положительный результат чаще наблюдался при передне-заднем расположении (87%), чем при передне-латеральном (76%), а потребности в энергии были ниже при передне-заднем. В связи с тем, что оптимальная конфигурация для каждого конкретного больного неизвестна, при отсутствии эффекта врач должен подумать об изменении расположения электродов.
Частота положительных результатов электрической кардиоверсии варьируется в пределах 70-90%. Эти различия частично можно объяснить разными характеристиками пациентов, а также различными толкованиями понятия «положительный результат». Промежуток времени, в течение которого оценивается кардиоверсия, может
варьировать от периода непосредственно после кардиоверсии до нескольких дней. Если ФП имеется у пациента уже более года, то шансы на восстановление и поддержание синусового ритма путем кардиоверсии уменьшаются.
С течением времени доля ревматического поражения сердца среди этиологических факторов ФП уменьшилась, а средний возраст популяции больных с ФП увеличился, в то время как заболеваемость изолированной ФП остается неизменной. Эти факторы затрудняют сравнение недавно полученных и более ранних данных относительно исхода кардиоверсии. В крупном
последовательном наблюдении с участием группы пациентов с планируемой кардиоверсией 24% из них были отнесены к группе больных с ИБС, 24% – к пациентам с ревматическим поражением клапанов,
15% имели изолированную ФП, 11% – артериальную гипертензию, 10% – кардиомиопатию, 8% – неревматические поражения клапанов и 2% проходили лечение по поводу гипертиреоза. У 70% пациентов в течение 24 часов после кардиоверсии сохранялся синусовый ритм. Множественный анализ показал, что короткая продолжительность ФП, наличие трепетания предсердий и молодой возраст являются независимыми прогностическими факторами успешной кардиоверсии, в то время как увеличение ЛП, органическое заболевание сердца и кардиомегалия были прогностическими факторами неудачной кардиоверсии. Разработана схема, отражающая вероятность успеха для облегчения принятия решения и улучшения экономической эффективности путем отказа от кардиоверсии у пациентов с небольшой вероятностью сохранения синусового ритма.
Имеются данные, что через 3 дня после проведения первичной кардиоверсии у 100 пациентов частота ее успешности составила 86%. При вторичной кардиоверсии на фоне терапии хинидином или дизопирамидом после неудачной попытки восстановления ритма эта цифра возросла до 94%. Синусовый ритм сохранялся лишь у 23% пациентов через 1 год наблюдения и у 16% – через 2. У больных со срывом ритма повторная кардиоверсия на фоне антиаритмической терапии привела к восстановлению и поддержанию синусового ритма у 40 и 33% пациентов в течение 1 и 2 лет наблюдения соответственно. У больных с
повторным срывом ритма третья кардиоверсия привела к восстановлению и поддержанию синусового ритма в 54% случаев в течение 1 года наблюдения и в 41% – 2 лет. Таким образом, синусовый ритм может быть восстановлен путем кардиоверсии постоянным током у значительной части больных с ФП, однако при этом наблюдается высокая частота рецидивов, которую можно значительно снизить в
результате проведения антиаритмической терапии. Перечень антиаритмических препаратов и их эффективность приведены в таблице 4. Для больных с неудачной попыткой кардиоверсии в качестве дополнительных методов можно использовать изменение положения электродов, одновременное назначение ибутилида внутривенно и повышение мощности разряда путем использования двух дефибрилляторов. Ожидается, что использование кардиоверсии с двухфазной кривой уменьшит необходимость дополнительных мер.
Лечение всеми вышеперечисленными препаратами, кроме бета-блокаторов и амиодарона, следует начинать в стационаре. Следовательно, необходимо установить терапевтические концентрации препаратов в плазме крови во время кардиоверсии и в течение несколько недель после нее для увеличения шансов на успех. После восстановления синусового ритма у пациентов, принимающих препараты, удлиняющие интервал QT, следует наблюдать в стационаре в течение 24-48 часов для оценки влияния замедления ЧСС на гемодинамику и принятия немедленных адекватных мер в случае развития тахикардии типа «пируэт».
Предварительная антиаритмическая терапия может быть начата уже амбулаторно или в стационаре непосредственно перед электрической кардиоверсией. Первичные цели – повышение вероятности восстановления синусового ритма (например путем снижения порога кардиоверсии) и профилактика рецидива ФП. Среди рисков предварительной терапии можно назвать возможность парадоксального увеличения порога дефибрилляции, как наблюдалось при приеме флекаинида, ускоренный желудочковый ритм во время насыщения препаратами групп IA и IC при отсутствии средства, блокирующего АВ проведение, и желудочковые проаритмии. Стационарное лечение с использованием пропафенона внутрь, начатое за 2 дня до электрической кардиоверсии, не влияло ни на средний порог
дефибрилляции, ни на частоту восстановления синусового ритма, по сравнению с плацебо (84 и 82% соответственно). Однако данный препарат полностью подавлял немедленные рецидивы в течение 10 минут, поэтому у 84% пациентов (против 65%) в конце процедуры
наблюдалось восстановление синусового ритма, и у 74% больных (против 53%) синусовый ритм сохранялся через 2 дня после кардиоверсии.
Пропафенон в сочетании с верапамилом предотвращал немедленные рецидивы ФП после кардиоверсии, и профилактика подострых рецидивов также улучшалась при комплексной терапии этими средствами в течение 3 дней до и 3 дней после кардиоверсии. В исследовании, в котором приняли участие 100 пациентов, случайным образом выбранных для электрической кардиоверсии с или без предварительного лечения ибутилидом (III группа), восстановление синусового ритма наблюдалось у всех 50 больных, принимавших ибутилид, и лишь у 36 из 50 лиц, не принимавших препарат. У 14 пациентов с безуспешной кардиоверсией вначале синусовый ритм был восстановлен впоследствии при повторении кардиоверсии после лечения ибутилидом. Предварительное лечение амиодароном также эффективно у больных с неудачной первой попыткой электрической кардиоверсии. Стандартная терапия дофетилидом включает в себя предварительное лечение, которое может привести к восстановлению синусового ритма и без электрошока, и может снизить порог дефибрилляции, однако неизвестно, усиливает ли препарат восстановление синусового ритма после электрошока и снижает ли количество немедленных рецидивов. Дополнительное применение магния не повышает вероятность восстановления синусового ритма.
Предварительная антиаритмическая терапия наиболее подходит пациентам, у которых уже были неудачные попытки электрической кардиоверсии и тем, у кого развились немедленные или подострые рецидивы ФП. У больных с поздними рецидивами и у пациентов, впервые подвергающиеся электрической кардиоверсии по поводу персистирующей ФП, предварительное лечение необязательно.
Рекомендации по фармакологической кардиоверсии ФП
1. Применение флекаинида, дофетилида, пропафенона или ибутилида рекомендуется для фармакологической кардиоверсии ФП (класс I, уровень доказательности А).
2. Применение амиодарона является средством выбора для фармакологической кардиоверсии ФП (класс IIа, уровень
доказательности А).
3. Применение разовой дозы пропафенона или флекаинида для купирования персистирующей ФП в амбулаторных условиях необходимо начинать с предварительного лечения в стационарных условиях для подтверждения его безопасности и отбора больных без дисфункции синусового и AV узлов, блокад ножек пучка Гиса, удлиненного интервала QT, синдрома Brugada или структурных заболеваний сердца (класс IIа, уровень доказательности С).
4. Применение амиодарона может быть предпочтительным в амбулаторных условиях при пароксизмальной или персистирующей ФП, когда быстрое восстановление синусового ритма не является необходимым (класс IIа, уровень доказательности С).
5. Применение хинидина или прокаинамида может рассматриваться для фармакологической кардиоверсии ФП, но эффективность этих препаратов не установлена (класс IIb, уровень доказательности С).
6. Дигоксин и соталол не рекомендуются для проведения фармакологической кардиоверсии из-за побочных эффектов (класс III, уровень доказательности А).
7. Хинидин, прокаинамид, дизопирамид и дофетилид нельзя назначать в амбулаторных условиях для восстановления синусового ритма (класс III, уровень доказательности С).
Продолжение читайте в следующем номере.
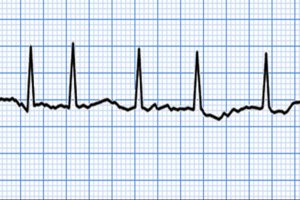 Киевское городское терапевтическое общество
Киевское городское терапевтическое общество Тема заседания: мерцательная аритмия
 Стратификация пациентов с фибрилляцией предсердий и профилактика тромбоэмболических осложнений
Стратификация пациентов с фибрилляцией предсердий и профилактика тромбоэмболических осложнений
 Новые рекомендации ACC/AHA/ESC по ведению пациентов с фибрилляцией предсердий
Новые рекомендации ACC/AHA/ESC по ведению пациентов с фибрилляцией предсердий
 Как выбрать оптимальный препарат для профилактики и лечения венозного тромбоза, основываясь на научных фактах?
Как выбрать оптимальный препарат для профилактики и лечения венозного тромбоза, основываясь на научных фактах?
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення


