Фсме-Иммун инструкция, аналоги и состав
| Показания: | Вакцина ФСМЕ-ІМУН показана для активної (профілактичної) імунізації осіб віком від 16 років та старше проти кліщового енцефаліту (КЕ).Вакцина ФСМЕ-ІМУН Джуніор показана для активної (профілактичної) імунізації дітей віком від 1 до 15 років проти кліщового енцефаліту (КЕ).Вакцинація проводиться у відповідності з офіційною рекомендацією стосовно необхідності і часу проведення вакцинації проти КЕ. |
| Форма випуска: | Суспензія для ін’єкцій по 0,5 мл (1 доза для дорослих) або 0,25 мл (1 доза для дітей) у попередньо заповненому одноразовому шприці № 1 |
| Производитель, страна: | БАКСТЕР АГ, Австрія |
| Действующее вещества: | 1 доза вакцини 0,25 мг містить вірусу кліщового енцефаліту (штам Neudrfl) 1,2 - 1,2 мкг;1 доза вакцини 0,5 мг містить вірусу кліщового енцефаліту (штам Neudrfl) 1,2 - 2,4 мкг;1 - адсорбований на гідроксиді алюмінію, гідратований (0,17 міліграма Al3+)2 - вирощений на культурі фібробластних клітин курячих ембріонів (клітинах CEF) |
| МНН: | Encephalitis, tick borne, inactivated, whole virus - Вакцина клещевого энцефалита культур. очищ. инакт. |
| Регистрация: | 875/12-300200000з 07.07.2015 по 23.07.2017. Приказ 527 від 19.08.2015 |
| Код АТХ: |
Склад:
діюча речовина: encephalitis, tick borne, inactivated, whole virus;
1 доза вакцини 0,25 мг містить вірусу кліщового енцефаліту (штам Neudörfl) 1,21,2 мкг;
1 доза вакцини 0,5 мг містить вірусу кліщового енцефаліту (штам Neudörfl) 1,2 2,4 мкг;
1 - адсорбований на гідроксиді алюмінію, гідратований (0,17 міліграма Al3+)
2 - вирощений на культурі фібробластних клітин курячих ембріонів (клітинах CEF)
допоміжні речовини: гідроксид алюмінію, гідратований (Al3+), сироватковий альбумін людини, натрію хлорид, динатрію фосфатдигідрат Na2HPO4 x 2H2O, калію дигідрофосфат KH2PO4, сахароза, формальдегід, протаміну сульфат, неоміцин і гентаміцин, вода для ін’єкцій.
Лікарська форма. Суспензія для ін’єкцій.
Основні фізико-хімічні властивості: після струшування вакцина являє собою білувату, опалесцентну суспензію.
Фармакотерапевтична група.
Вакцини проти енцефаліту. Інактивована вірусна вакцина проти кліщового енцефаліту.
КОД АТХ J07B A01.
Імунологічні і біологічні властивості.
Фармакодинаміка.
Фармакодинамічний ефект вакцини полягає у створенні достатньо високої концентрації антитіл до вірусу кліщового енцефаліту для забезпечення захисту від вірусу кліщового енцефаліту.
Коефіцієнт захисту попереднього та існуючого покоління вакцин проти кліщового енцефаліту був визначений під час безперервного моніторингового дослідження, яке охоплювало все населення Австрії з 1984 року. У цьому моніторинговому дослідженні було встановлено, що коефіцієнт захисту після другої вакцинації становив понад 90 % і понад 97 % – після завершення схеми первинної вакцинації (3 щеплення). У цьому ж моніторинговому дослідженні за період з 1994 по 2003 рік було встановлено, що коефіцієнт захисту у дітей становив понад 98 % після завершення схеми первинної вакцинації (3 щеплення). Виходячи з результатів наступного моніторингового дослідження, що охоплювало все населення Австрії, у період з 2000 по 2006 роки, розрахований коефіцієнт захисту становив 99 %, при відсутності статистичних значимих відмінностей між віковими групами у регулярно вакцинованих осіб. Коефіцієнт захисту після перших двох щеплень має, щонайменше, таку саму величину після регулярної вакцинації, тобто до завершення базового курсу вакцинації третім щепленням, однак він суттєво нижчий у тих, хто проходив нерегулярну вакцинацію.
У деяких клінічних дослідженнях вакцини ФСМЕ-ІМУН Джуніор сероконверсія була визначена як підвищення вихідної величини, визначеної методом твердофазного імуноферментного аналізу (ELISA), більше 126 Віденських од./мл або титр NT не менше 10 після вакцинації. Зведені дані щодо частоти серопозитивності за результатами ELISA та NT через 21 день після другої та третьої вакцинацій при застосуванні стандартної схеми імунізації представлені у таблиці 1 і таблиці 2.
Таблиця 1.
Звичайна схема імунізації, сумарні показники серопозитивної реакції1, визначені методом ELISA та NT
|
Діти віком 1-5 років |
ELISA2 |
NT2 |
||
|
Щеплення |
2-е |
3-є |
2-е |
3-є |
|
Показник серопозитивної реакції1, % (n/N) |
99,4 (501/504) |
100,0 (493/493) |
98,5 (196/199) |
99,5 (193/194) |
Таблиця 2.
Звичайна схема імунізації, сумарні показники серопозитивної реакції1, визначені методом ELISA та NT
|
Діти віком 6-15 років |
ELISA2 |
NT2 |
||
|
Щеплення |
2-е |
3-є |
2-е |
3-є |
|
Показник серопозитивної реакції1, % (n/N) |
97,1 (496/511) |
99,8 (505/506) |
95,5 (274/287) |
99,7 (289/290) |
1 - оцінка на 21 день після кожного щеплення
2 - порогове значення серопозитивної реакції: ELISA > 126 Віденських одиниць на мл, NT > 1:10
Через 5 місяців після другої вакцинації більше ніж у 97 % дітей віком 1-5 років та більше ніж у 93 % дітей віком 6-15 років були визначені серопозитивні рівні КЕ-антитіл за даними ELISA та NT.
У клінічних дослідженнях вакцини ФСМЕ-ІМУН серопозитивна реакція була визначена за допомогою методу твердофазного імуноферментного аналізу (ELISA) величина більше 126 Віденських од./мл або титр NT не менше 10. Сумарні показники серопозитивної реакції, визначені методом ELISA і NT через 21 день після другої і третьої вакцинації за звичайною і швидкою схемою імунізації, наведені в таблицях 3 і 4.
Таблиця 3.
Звичайна схема імунізації, сумарні показники серопозитивної реакції1, визначені методом ELISA та NT, в осіб віком від 16 до 65 років.
|
ELISA2 |
NT2 |
|||
|
Щеплення |
2-е |
3-є |
2-е |
3-є |
|
Показник серопозитивної реакції1, % (n/N) |
87,5 (420/480) |
98,7 (825/836) |
94,8 (330/348) |
99,4 (714/718) |
Таблиця 4.
Швидка схема імунізації, сумарні показники серопозитивної реакції1, визначені методом ELISA, і NT
|
ELISA2 |
NT2 |
|||
|
Щеплення |
2-е |
3-є |
2-е |
3-є |
|
Показник серопозитивної реакціїв осіб віком від 16 до 49 років, % (n/N) |
86,6 (168/194) |
99,4 (176/177) |
97,4 (189/194) |
100,0 (177/177) |
|
Показник серопозитивної реакціїв осіб віком від 50 років, % (n/N) |
72,3 (125/173) |
96,3 (155/161) |
89,0 (154/173) |
98,8 (159/161) |
1 - оцінка на 21 день після кожного щеплення
2 - порогове значення серопозитивної реакції: ELISA > 126 Віденських одиниць на мл, NT > 1:10
Найвищий показник серопозитивної реакції, визначений методом ELISA, і величина NT в обох вікових групах були досягнуті після третього щеплення.
Прискорена імунізація за допомогою препарату ФСМЕ-ІМУН забезпечувала вищу частоту серопозитивності за даними NT уже через 14 днів після другої вакцинації (89,3 %) та через 7 днів після третьої вакцинації (91,7 %).
Результати дослідження з метою подальшого спостереження, в яких вивчалася персистенція антитіл до вірусу КЕ, також підтверджують необхідність першої ревакцинації не пізніше ніж через 3 роки після первинної імунізації. У дорослих віком до 50 років частота серопозитивності, визначеної за допомогою NT, залишалась високою до 5 років після першої ревакцинації (94,5 %); лише дещо нижча частота (> 80 %) спостерігалася в учасників дослідження віком ≥ 50 років.
Вакцинація препаратом ФСМЕ-ІМУН індукує статистично еквівалентні титри нейтралізуючих антитіл до вірусу КЕ проти Європейського, Сибірського та Далекосхідного штамів вірусу КЕ, а також відбувається дещо нижча, але ефективна індукція нейтралізуючих антитіл проти вірусу Омської геморагічної лихоманки.
Фармакокінетика.
Не застосовно.
Клінічні характеристики.
Показання.
Вакцина ФСМЕ-ІМУН показана для активної (профілактичної) імунізації осіб віком від 16 років та старше проти кліщового енцефаліту (КЕ).
Вакцина ФСМЕ-ІМУН Джуніор показана для активної (профілактичної) імунізації дітей віком від 1 до 15 років проти кліщового енцефаліту (КЕ).
Вакцинація проводиться у відповідності з офіційною рекомендацією стосовно необхідності і часу проведення вакцинації проти КЕ.
Протипоказання.
Гіперчутливість до препаратів альбуміну, будь-якої допоміжної речовини або залишків речовин, що використовуються у процесі виробництва (формальдегіду, неоміцину, гентаміцину, протамінсульфату). Слід враховувати ймовірність перехресних алергічних реакцій з іншими (крім неоміцину та гентаміцину) аміноглікозидами.
Тяжка гіперчутливість до яєць, курячих білків (анафілактична реакція після внутрішнього вживання яєчного білка) та до латексу (наприклад, анафілактична реакція) може зумовити тяжкі алергічні реакції у сенсибілізованих осіб.
Особливі заходи безпеки.
Перед використанням вакцину потрібно довести до кімнатної температури. Перед введенням добре струсити шприц для ретельного перемішування суспензії. Після струшування ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор являє собою білувату, опалесцентну, гомогенну суспензію. Перед введенням вакцину потрібно візуально перевірити на наявність сторонніх включень і/або зміну зовнішнього вигляду. У разі виявлення таких відхилень вакцину слід знищити.
Будь-яку невикористану вакцину або відходи потрібно утилізувати у відповідності з місцевими вимогами.
Дотримуйтесь такої процедури зняття запобіжника голки:
1. Тримайте шприц в нижній частині запобіжника голки, надітого на скляну ємність.
2. Великим і вказівним пальцем другої руки візьміться за верхню частину запобіжника голки і проверніть її, щоб зламати запайку (яка дає змогу проконтролювати відкривання).
3. Зніміть від’єднану частину запобіжника з голки рухом вгору.

Вакцину ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор потрібно використати негайно після зняття запобіжника голки.
Щоб уникнути втрати стерильності і/або закупорювання голки не слід залишати її без захисту на тривалий час. Тому запобіжник голки слід знімати лише після струшування і безпосередньо перед використанням.
Лікар повинен задокументувати введення вакцини і записати номер партії. На кожному заправленому шприці нанесений знімний ярлик для документування.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Не проводилися дослідження взаємодії з іншими вакцинами і лікарськими засобами. Інші вакцини одночасно з ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор слід вводити лише у відповідності з офіційними рекомендаціями. Якщо одночасно потрібно робити ін’єкції інших вакцин, вводити їх потрібно у різних місцях і бажано в різні кінцівки.
В осіб, які проходять імуносупресивну терапію, захисний імунологічний ефект може бути не досягнутий.
Особливості застосування.
Як і у випадку з іншими вакцинами, які вводяться шляхом ін’єкції, потрібно завжди мати готовим все необхідне для невідкладної терапії і контролю на випадок появи рідкісних анафілактичних реакцій після введення вакцини.
Мало виражена алергія до яєчного білка або латексу зазвичай не є протипоказанням до вакцинації вакциною ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор. Тим не менш, вакцинацію таким особам слід робити лише під належним наглядом та за умови наявності готових засобів для екстреного усунення реакцій гіперчутливості.
Концентрації калію і натрію становлять менше 1 ммоль на дозу, тобто в основному вакцини не містять калію і натрію.
Слід уникати внутрішньовенного введення, тому що це може призвести до тяжких реакцій, у тому числі реакцій гіперчутливості з шоком.
У дітей, особливо дуже малих, після першої імунізації може спостерігатися лихоманка. Загалом лихоманка проходить протягом 24 годин. Частота появи лихоманки після другої вакцинації загалом менша, ніж після першої вакцинації. Дітям з лихоманковими судомами або високою температурою після вакцинації в анамнезі може знадобитися жарознижувальна профілактика або лікування.
Якщо знадобиться провести серологічне дослідження для визначення необхідності у наступних щепленнях, слід провести кількісні аналізи у кваліфікованій лабораторії. Це пов’язано з тим, що перехресні реакції з попередньо існуючими антитілами через природний вплив або попередню вакцинацію проти інших флавівірусів (японський енцефаліт, жовта лихоманка, вірус Денге) можуть дати «хибно-позитивні» результати.
У випадку відомого або підозрюваного аутоімунного захворювання у реципієнта необхідно оцінити ступінь ризику зараження кліщовим енцефалітом у порівнянні з несприятливим впливом вакцини ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор на хід аутоімунного захворювання.
Слід бути обережним при розгляді питання щодо необхідності проведення вакцинації особам, у яких спостерігаються церебральні розлади, такі як активні демієлінізуючі розлади чи недостатньо контрольована епілепсія.
Вакцинацію проти КЕ слід відкласти в осіб, які страждають від гострих захворювань (з лихоманкою або без). Дані стосовно профілактичної дії вакцини після експозиції збудника відсутні.
Як і всі інші вакцини, вакцина ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор не може забезпечити абсолютний захист всіх вакцинованих від інфекції, появі якої вона має запобігти. Детальна інформація стосовно застосування препарату у осіб з порушеною функцією імунної системи та пацієнтів, які приймають імуносупресивну терапію, а також осіб літнього віку наведена у розділі «Спосіб застосування та дози».
При укусах кліщів можуть передаватися й інші інфекції, а не лише кліщовий енцефаліт, у тому числі деякі патогени, які іноді викликають клінічну картину, що нагадує кліщовий енцефаліт. Вакцина проти КЕ не забезпечує захисту від інфекції боррелії. Тому потрібно ретельно вивчити появу клінічних ознак і симптомів можливої інфекції КЕ у вакцинованого щодо можливих альтернативних причин.
Застосування у період вагітності або годування груддю.
Дані щодо застосування препарату ФСМЕ-ІМУН вагітним жінкам відсутні.
Невідомо, чи потрапляє ФСМЕ-ІМУН або його метаболіти у грудне молоко.
У цьому зв’язку вакцину ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор потрібно призначати вагітним жінкам і матерям, які годують груддю, лише якщо це необхідно в екстреному порядку для захисту від інфекції кліщового енцефаліту, і після ретельної оцінки ризику і користі.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Малоймовірно, щоб вакцина ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор впливала на рухові навички дитини (наприклад, в процесі гри на вулиці чи їзди на велосипеді ) та здатність людини керувати транспортними засобами і використовувати машини. Тим не менш, слід враховувати, що може спостерігатися погіршення зору і запаморочення.
Спосіб застосування та дози.
Схема первинної вакцинації
Схема первинної вакцинації однакова для всіх осіб і складається з трьох щеплень вакциною ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор.
Перше щеплення проводиться в обраний день, а друге – з інтервалом в 1-3 місяці після першого. Якщо потрібно швидко досягти імунітету, друге щеплення можна провести через два тижні після першого. Після введення перших двох доз досягається достатній захист протягом сезону активності кліщів-переносників. Третє щеплення проводиться через 5-12 місяців після другого. Очікується, що після введення третьої дози захист триватиме щонайменше 3 роки.
Щоб виробити імунітет до початку сезонної активності кліщів, яка припадає на весну, перше і друге щеплення бажано проводити у зимові місяці. Ідеально було б завершити курс вакцинації третім щепленням протягом того ж сезону активності кліщів або щонайменше до початку наступного такого сезону.
|
Базова імунізація |
Доза |
Звичайна схема |
Схема швидкої імунізації |
|
1-ша доза |
0,25 мл або 0,5 мл |
Довільна дата |
Довільна дата |
|
2-га доза |
0,25 мл або 0,5 мл |
1-3 місяці після 1-ї вакцинації |
14 днів після 1-ї вакцинації |
|
3-тя доза |
0,25 мл або 0,5 мл |
5-12 місяців після 2-ї вакцинації |
5-12 місяців після 2-ї вакцинації |
Бустер-дози
Діти віком від 1 до 15 років
Перша бустер-доза вводиться не пізніше, ніж через 3 роки після третього щеплення.
Наступні бустер-дози вводяться кожні 5 років після останньої бустер-дози.
|
Бустер-доза |
Доза |
Час |
|
1-ша бустер-доза |
0,25 мл |
Через 3 роки після 3-ї вакцинації |
|
Наступні бустер-дози |
0,25 мл |
Кожні 5 років |
Особи віком від 16 до 60 років
Перша бустер-доза вводиться не пізніше, ніж через 3 роки після третього щеплення.
Наступні бустер-дози вводяться бустер-дози вводяться кожні 5 років після останньої бустер-дози.
Особи старші 60 років
Загалом для осіб, старших 60 років, інтервали введення бустер-доз не повинні перевищувати трьох років.
|
Бустер-доза (вік ≥ 16 - < 60 років) |
Доза |
Час |
|
1-ша бустер-доза |
0,5 мл |
Через 3 роки після 3-ї вакцинації |
|
Наступні бустер-дози |
0,5 мл |
Кожні 5 років |
|
Бустер-доза (вік ≥ 60 років) |
Доза |
Час |
|
Усі бустер-дози |
0,5 мл |
Кожні 3 роки |
Подовження інтервалів між будь-якими дозами (при застосуванні схеми первинної вакцинації та при проведенні ревакцинацій) може спричинити недостатній захист вакцинованих проти інфекції у проміжний період.
Особи з ураженою імунною системою (у тому числі ті, які піддаються імуносупресивній терапії)
Відсутні специфічні клінічні дані щодо рекомендованої базової дози. Однак можна розглянути можливість визначення концентрації антитіл через чотири тижні після другого щеплення і проведення додаткового щеплення у разі відсутності свідчень сероконверсії у відповідний момент часу. Те ж саме стосується будь-якого з наступних введень препарату.
Спосіб введення
Вакцину вводять внутрішньом’язово у плече (дельтоподібний м’яз плеча).
Дітям молодше 18 місяців незалежно від розвитку і стану харчування дитини вакцинація проводиться в стегно (латеральний широкий м’яз стегна). Слід бути обережним, щоб уникнути помилкового внутрішньовенного введення. Внутрішньовенне введення може спричинити тяжку гіперчутливість.
Введення вакцини повинно бути задокументовано лікарем із записом партії препарату. Залежно від місцевих рекомендацій вакцину можна вводити підшкірно за необхідності (в осіб із розладами згортання крові).
Діти.
Вакцину ФСМЕ-ІМУН Джуніор застосовують дітям згідно рекомендацій у розділі «Спосіб застосування та дози».
Передозування.
Про випадки передозування не повідомлялося. При цьому, зважаючи на форму випуску вакцини, випадкове передозування через введення надмірного об’єму малоймовірне. Отримані повідомлення про введення дітям лікарської форми препарату, призначеної для дорослих. Ймовірно, що у таких випадках ризик небажаних реакцій зростає.
Побічні реакції.
Розрахована частота базується на побічних реакціях після першої вакцинації, про які повідомлялося у відкритому дослідженні застосування ФСМЕ-ІМУН Джуніор дітям (2417 осіб) віком від 1 до 15 років. Підвищена температура вимірювалася ректально у дітей віком до 3 років і перорально у дітей віком від 3 років. Аналіз включає будь-яку лихоманку, тимчасово пов’язану з вакцинацією незалежно від причинного зв’язку.
Частота появи лихоманки після першої вакцинації у дітей:
віком від 1 до 2 років (n=262): слабка лихоманка (38-39 °С) у 27,9 %; помірна лихоманка (39,1-40,0 °С) у 3,4 %; відсутність випадків тяжкої лихоманки (вище 40 °C);
віком від 3 до 15 років (n=2519): слабка лихоманка у 6,8 %; помірна лихоманка у 0,6 %; відсутність випадків тяжкої лихоманки.
Частота появи лихоманки після другої вакцинації загалом менша, ніж після першої вакцинації. Загальна частота появи лихоманки після другої вакцинації складала 15,6 % (41/263) у дітей віком від 1 до 2 років і 1,9 % (49/2522) – у дітей віком від 3 до 15 років.
В рамках активного контролю за результатами клінічного застосування у дітей віком від 1 до 12 років частота опублікованих випадків лихоманки (вимірюваної ректально) після першої вакцинації становила 23,7 % у дітей віком від 1 до 3 років (n=1198) і 13,7 % – у дітей віком від 4 до 12 років (n=234).
Наведені далі в цьому розділі побічні ефекти перелічені у відповідності з рекомендованими критеріями визначення частоти:
дуже часті: > 1/10
часті: > 1/100 і <1/10
нечасті: > 1/1000 і <1/100
рідкісні: > 1/10000 і <1/1000
дуже рідкісні: <1/10000.
|
Клас системи органів |
Частота |
|||
|
Дуже часті |
Часті |
Нечасті |
Рідкісні |
|
|
Розлади кровоносної і лімфатичної систем |
Лімфаденопатія |
|||
|
Розлади імунної системи |
Гіперчутливість Анафілактична реакція Погіршення аутоімунного розладу |
|||
|
Метаболічні розлади і розлади травлення |
Зниження апетиту |
|||
|
Психічні розлади |
Збуджений стан (спостерігається у дітей віком від 1 до 5 років) Безсоння |
|||
|
Розлади нервової системи |
Головний біль |
|||
|
Шлунково-кишкові розлади |
Нудота Блювання |
|||
|
Розлади кістково-м’язової системи і сполучної тканини |
Міальгія Артралгія |
|||
|
Загальні розлади та ураження місця введення |
Біль у місці введення (в одного учасника дослідження могло спостерігатися більше 1 явища) |
Гіпертермія Набряк місця введення, затвердіння місця введення, еритема місця введення Втома і нездужання у дітей віком від 6 до 15 років* |
Свербіж та крововилив у місці ін’єкції |
|
* Підвищення температури тіла частіше спостерігалось у дітей молодшого віку, ніж у старших (тобто дуже часто і часто відповідно). Частота підвищення температури тіла після другої та третьої вакцинацій є звичайно нижчою, ніж після першої вакцинації.
Побічні реакції, що спостерігалися під час післяреєстраційного застосування препарату ФСМЕ-ІМУН Джуніор.
Розлади з боку імунної системи: анафілактична реакція, гіперчутливість
Розлади з боку нервової системи: енцефаліт, судоми (включаючи фебрильні), менінгізм, полінейропатія, розлади чутливості та рухова дисфункція (геміпарез/геміплегія, парез лицьового нерва, параліч/парез, неврит, дизестезія, гіпоестезія, парестезія), запаморочення.
Розлади з боку органа зору: порушення/погіршення зору, фотофобія, біль в оці.
Розлади з боку органа слуху та рівноваги: шум у вухах.
Розлади з боку органів дихання, грудної клітки та середостіння: задишка.
Розлади з боку травного тракту: біль у животі, діарея.
Розлади з боку шкіри та підшкірної клітковини: кропив’янка, висип (еритематозний, макуло-папульозний, везикулярний), еритема, свербіння, гіпергідроз.
Розлади з боку опорно-рухового апарату, сполучної та кісткової тканини: біль у шиї, м'язово-скелетна скутість (у тому числі скутість у шийному відділі хребта), біль у кінцівках.
Загальні розлади та реакції у місці введення препарату: порушення ходи, озноб, грипоподібне захворювання, загальна слабкість, набряк.
Частота нижче представлена для кожної вакцинації і розрахована на основі аналізу об'єднаних даних про побічні реакції, що спостерігалися в учасників 7 клінічних досліджень препарату ФСМЕ-ІМУН віком від 16 до 65 років включно, які отримали 3 вакцинації (у 3512 учасників дослідження після першої вакцинації, у 3477 – після другої вакцинації та у 3274 – після третьої вакцинації).
Наведені далі в цьому розділі побічні ефекти перелічені у відповідності з рекомендованими критеріями визначення частоти:
дуже часті: > 1/10
часті: > 1/100 і <1/10
нечасті: > 1/1000 і <1/100
рідкісні: > 1/10000 і <1/1000
дуже рідкісні: <1/10000.
|
Клас системи органів |
Частота |
|||
|
Дуже часті |
Часті |
Нечасті |
Рідкісні |
|
|
Розлади кровоносної і лімфатичної систем |
Лімфаденопатія |
|||
|
Розлади імунної системи |
Гіперчутливість |
|||
|
Розлади нервової системи |
Головний біль |
Сонливість |
||
|
Розлади органа слуху та рівноваги |
Вертиго* |
|||
|
Шлунково-кишкові розлади |
Нудота |
Блювання |
Діарея Біль у животі |
|
|
Розлади кістково-м’язової системи і сполучної тканини |
Міальгія Артралгія |
|||
|
Загальні розлади та ураження місця введення |
Реакції місця введення, наприклад, біль |
Втома Нездужання |
Гіпертермія Реакції у місці ін’єкції, такі як: · крововилив |
Реакції у місці ін’єкції, такі як: · еритема · затвердіння · набряк · свербіння · парестезія · відчуття тепла |
* Частота вертиго визначена на основі частоти повідомлень про явище після першої вакцинації (n=3512). Вертиго не спостерігалося після другої чи третьої вакцинації.
Побічні реакції, що спостерігалися під час післяреєстраційного застосування препарату ФСМЕ-ІМУН.
Інфекційні та паразитарні захворювання: оперізуючий герпес (спровокований у раніше інфікованих пацієнтів).
Розлади з боку імунної системи: преципітація або погіршення перебігу аутоімунних розладів (наприклад, розсіяного склерозу), анафілактична реакція.
Розлади з боку нервової системи: демієлінізуючі розлади (гострий розсіяний енцефаломієліт, синдром Гійєна-Барре, мієліт, поперечний мієліт), енцефаліт, судоми, асептичний менінгіт, менінгізм, порушення чутливості та порушення рухової функції (параліч/парез лицьового нерва, параліч/парез, неврит, дизестезія, гіпоестезія, парестезія), невралгія, неврит зорового нерва, запаморочення.
Розлади з боку органа зору: порушення зору, фотофобія, біль в оці.
Розлади з боку органа слуху та рівноваги: шум у вухах.
Розлади з боку серця: тахікардія.
Розлади з боку органів дихання, грудної клітки та середостіння: задишка.
Розлади з боку шкіри та підшкірної клітковини: кропив'янка, висип (еритематозний, макуло-папульозний), свербіння, дерматит, еритема, гіпергідроз.
Розлади з боку опорно-рухового апарату, сполучної та кісткової тканини: біль у спині, набряк суглобів, біль у шиї, м'язово-скелетна скутість (у тому числі скутість у шийному відділі хребта), біль у кінцівках.
Загальні розлади та реакції у місці введення препарату: порушення ходи, озноб, грипоподібне захворювання, загальна слабкість, набряк, порушення рухливості у суглобі у місці ін'єкції по типу болю в суглобі, виникнення вузликів і запалення.
Термін придатності.
2,5 роки.
Умови зберігання.
Зберігати при температурі від 2 до 8 °С. Не заморожувати! Зберігати в оригінальній упаковці, щоб захистити від світла.
Зберігати у місці, недоступному для дітей!
Несумісність.
Через відсутність досліджень на сумісність вакцину ФСМЕ-ІМУН або ФСМЕ-ІМУН Джуніор не можна змішувати з іншими лікарськими препаратами.
Упаковка.
0,25 мл або 0,5 мл суспензії для ін’єкцій у попередньо заповненому одноразовому шприці (скло типу I) з пробкою (хромбутил ізопренова гума) з приєднаною голкою (модель складання шприца Readyject). По 1 шприцу з голкою вкладають в картонну коробку разом з інструкцією про застосування.
Категорія відпуску.
За рецептом.
Виробник.
Бакстер АГ (Baxter AG).
Місцезнаходження виробника.
Індустріштрассе 67 А - 1221 Відень, Австрія/Industriestrasse 67 А - 1221 Vienna, Austria.



 Генитальный герпес
Генитальный герпес
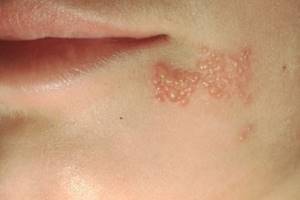 Простий герпес: патогенез, клініка та лікування
Простий герпес: патогенез, клініка та лікування
 Кагоцел в лечении генитального герпеса
Кагоцел в лечении генитального герпеса
 Глазные капли Окоферон в лечении различных форм офтальмогерпеса
Глазные капли Окоферон в лечении различных форм офтальмогерпеса