- Головна
- /
- Статті
- /
- Ендокринологія. Цукровий діабет
- /
- Ревматические маски эндокринной патологии
Ревматические маски эндокринной патологии
За последние годы современная эндокринология достигла значительных успехов в познании многообразных проявлений влияния гормонов на процессы жизнедеятельности организма. Особая роль принадлежит эндокринной системе в механизмах воспроизводства, обмена информацией, иммунологического контроля. Эндокринная система оказывает сложное влияние на структуру и функции костно-мышечных тканей. Любые нарушения функции отдельных эндокринных желез рано или поздно могут привести к развитию патологии костей и суставов, мышц, внутренних органов.
Достаточно часто в клинической картине эндокринного заболевания симптомы поражения опорно-двигательного аппарата или сердечно-сосудистой системы выступают на передний план. Такие больные от терапевта попадают на консультацию к ревматологу с предварительными диагнозами – деформирующий остеоартроз, ревматоидный полиартрит, болезнь Бехтерева, ревматизм и т. д. В этой ситуации важно избежать соблазна оперировать хорошо знакомыми нозологиями, в рамки которых при поверхностном отношении можно втиснуть клинические проявления эндокринных артропатий. Следует обращать внимание на общую симптоматику – слабость, утомляемость, изменение внешнего вида больного, массы тела, наличие полиурии, полидипсии, мышечной слабости, судорожного синдрома. При возникновении подозрений на эндокринную патологию дальнейшие вопросы диагностики и лечения решают совместно с эндокринологом. Следует помнить, что при адекватной и длительной компенсации эндокринных расстройств, изменения со стороны опорно-двигательного аппарата и сердечно-сосудистой системы способны частично или полностью регрессировать.
Изменения опорно-двигательного аппарата при СД
Сахарный диабет (СД) – наиболее распространенная эндокринопатия. Заболеваемость сахарным диабетом среди детей и подростков колеблется в пределах 0,1-0,3% (c учетом недиагностированных форм). Распространенность его в отдельных странах превышает 6%. Ежегодно количество вновь диагностированных случаев составляет 6-10% общего числа эндокринной патологии, количество больных каждые 10-15 лет удваивается. По возрастным характеристикам больные диабетом распределяются следующим образом: 5% – дети до 15 лет; старше 40 лет – около 80%, старше 65 лет– 40% всего контингента больных.
Катаболическая направленность обмена при данном заболевании приводит к нарушению белковой матрицы скелета, вымыванию кальция и развитию остеопороза. Однако диффузный остеопороз редко достигает клинически значимой выраженности, проявляясь только в замедлении срастания переломов.
Более ярким синдромом является диабетическая остеоартропатия, возникающая при тяжелых формах диабета, нередко у молодых лиц (25-30 лет). Многие авторы считают, что диабетическая артропатия может развиться спустя 5-8 лет после начала заболевания, если не проводится систематическое лечение СД. Чаще поражаются суставы нижних конечностей, обычно голеностопные (10% больных), предплюсне-плюсневые (60%), плюсне-фаланговые (30%); реже – коленные, тазобедренные.
Процесс, как правило, односторонний, в 20% случаев может быть двухсторонним. Клиническая картина складывается из болевого синдрома в области пораженных суставов, деформации суставов, иногда с припухлостью. Часто болевой синдром выражен слабо или отсутствует, несмотря на изменения, подтверждаемые рентгенологически. Это связано с сопутствующей нейропатией и расстройствами чувствительности.
Рентгенологические изменения различны: от умеренного эпифизарного остеопороза, субхондрального склероза с краевыми остеофитами до патологической перестройки костной ткани, напоминающей перелом, вплоть до развития остеолизиса, секвестрации. Гистологически выявляются участки резорбции кости, разрастание соединительной ткани, асептические некрозы. Чаще эти изменения локализуются в плюсневых костях. Из-за нарушения глубокой чувствительности легко возникают растяжения связок, неустойчивость свода стопы, что одновременно с лизисом фаланг приводит к деформации стопы и ее укорочению. На фоне успешного лечения диабета данные симптомы могут регрессировать.
Характерный симптомокомплекс различных нарушений в стопах при сахарном диабете именуют диабетической стопой. Это осложнение чаще развивается у пожилых людей. Различают нейропатическую стопу, к которой относят:
- нейропатические язвы;
- диабетическую остеоартропатию стопы (часто с формированием сустава Шарко);
- нейропатический отек стопы;
- ишемическую стопу с развитием гангрены конечности.
Более подробно остановимся на формировании сустава Шарко при СД.
Заболевание начинается с покраснения, отека стопы, иногда с болевым синдромом. Нередко прослеживается связь с предшествующей травмой, декомпенсацией СД. В начальной стадии рентгенологические изменения отсутствуют, в дальнейшем на рентгенограммах обнаруживаются переломы костей стопы, явления остеолиза, фрагментация костей с репаративными процессами. Типична дезорганизация суставов стопы, стопа приобретает вид «мешка, наполненного костями» (по описанию английских авторов).
Костные изменения прогрессируют в течение нескольких месяцев после появления первых симптомов. Клинически определяется уплощение стопы, патологические движения в суставах. Боль на поздних стадиях отсутствует в связи с выраженной нейропатией. Интересно, что данные изменения аналогичны развивающимся при перерезке чувствительных стволов (т. е. при деафферентации). Прогноз ухудшается при присоединении трофических язв, их инфицировании, а также развитии флегмон и остеомиелита.
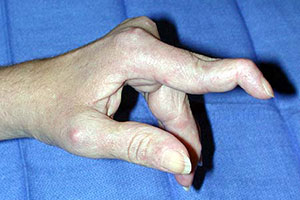
В последние годы активно изучается синдром ограничения подвижности суставов при СД. Впервые синдром тугоподвижности кисти описан у четырех больных с длительно текущим инсулинозависимым сахарным диабетом. В 1971 году G. Lung и соавторы впервые применили термин «диабетическая рука» (main diabetique), в возникновении ревматических расстройств верхней конечности они подчеркивали значение сопутствующей диабетической нейропатии.
Клинически синдром тугоподвижности проявляется безболезненным ограничением подвижности суставов, чаще проксимальных межфаланговых, пястно-фаланговых. Возможно поражение лучезапястных, локтевых, плечевых, голеностопных суставов. Нередко имеется сочетание с другими ревматическими расстройствами – сгибательной контрактурой кисти, контрактурой Дюпюитрена, флексорным тендосиновитом, первичным остеоартрозом (узелки Гебердена и Бушара), синдромом запястного канала, альгодистрофией, плече-лопаточным периартритом. Это дало основание для выделения термина «диабетическая артропатия верхней конечности».
По критериям А.Л. Розенблюма и соавторов, выделяют следующие степени проявления синдрома ограничения подвижности:
- легкую: нарушено разгибание проксимальных межфаланговых суставов при нормальной подвижности пястно-фаланговых суставов;
- среднюю: при ограничении разгибания проксимальных межфаланговых, а также пястно-фаланговых суставов;
- тяжелую: если наблюдается ограничение разгибания не только перечисленных суставов, но и крупных суставов конечности.
Безболезненное ограничение разгибания пястно-фаланговых и проксимальных межфаланговых суставов часто сочетается с изменениями кожи кистей. Она становится блестящей, восковидной, иногда изменения со стороны кожи преобладают. В этих случаях говорят о псевдосклеродермических поражениях при сахарном диабете.
Патогенез синдрома тугоподвижности дискутируется, высказывается предположение о влиянии сосудистой ишемии на структуру и синтез коллагена, несомненно участие нейропатий в патогенезе этого синдрома.
Учитывая распространенную иммунокомплексную концепцию патогенеза диабетических микроангиопатий, нельзя исключить влияния иммунных расстройств на развитие артропатий при диабете.
Отмечают достоверное сочетание синдрома тугоподвижности суставов с ретинопатией у молодых больных с инсулинозависимым сахарным диабетом. Наличие этого синдрома позволяет прогнозировать развитие нефропатии.
Лечение больных диабетической остеоартропатией проводится под наблюдением эндокринолога. Хорошая и длительная компенсация диабета – залог успешной терапии таких больных. В комплексной терапии обязательно используют средства, улучшающие реологические свойства крови – ангиопротекторы (продектин), дезагреганты (тиклид, трентал). Полезно сочетать таблетированный прием с внутривенными инфузиями низкомолекулярных декстранов (реополиглюкина), агапурина, трентала.
Перспективно применение полиненасыщенных жирных кислот, простагландина Е1 (вазапростан – 20-40 мг в 250 мл изотонического раствора в/в – 5-20 инфузий), показана и гипербарическая оксигенация. При отсутствии противопоказаний положительный эффект может быть достигнут при назначении лазеротерапии, противовоспалительная терапия проводится по обычным схемам.
Изменения опорно-двигательного аппарата и сердечно-сосудистой системы при заболеваниях щитовидной железы
Гипертиреоз (тиреотоксикоз) – гиперметаболический синдром, развивающийся при избытке тиреоидных гормонов в организме. Выявляется в рамках трех заболеваний: диффузный токсический зоб, узловой токсический зоб и тиреотоксическая аденома. Наиболее распространенной нозологией является диффузный токсический зоб, заболевание чаще регистрируется среди городского населения в возрасте от 20 до 50 лет, в основном у женщин. В настоящее время патогенез развития диффузного токсического зоба (ДТЗ) связывают с продукцией тироидстимулирующих антител.
Повышенный уровень тиреоидных гормонов приводит к отрицательному минеральному балансу с потерей кальция, что проявляется усиленной резорбцией кости при сниженном кишечном всасывании этого минерала. У больных гипертиреозом обнаруживаются низкие уровни метаболита витамина D – 1,25(ОН)2D, иногда гиперкальциемия и снижение уровня паратгормона в сыворотке крови. Клинически все эти нарушения приводят к развитию диффузного остеопороза. Возможны боли в костях, патологические переломы, коллапс позвонков, формирование кифоза.
Артропатия при тиреотоксикозе развивается редко, по типу гипертрофической остеоартропатии с утолщением фаланг пальцев и периостальными реакциями. Описан тиреоидный акральный синдром (претибиальная микседема, выраженное утолщение пальцев и гипертрофическая остеоартропатия), встречающийся у больных, получающих лечение по поводу тиреотоксикоза. Чаще, чем артропатия, наблюдается миопатия с развитием мышечной слабости, иногда миалгиями.
Наиболее ярким проявлением тиреотоксикоза является поражение сердечно-сосудистой системы, что при незначительном увеличении щитовидной железы, отсутствии глазных симптомов в сочетании с субфибриллитетом, общей слабостью, остеомиалгиями, похуданием заставляет проводить дифференциальный диагноз с острой ревматической лихорадкой, диффузными болезнями соединительной ткани.
Патогенез сердечно-сосудистых расстройств при тиреотоксикозе связывают с повышенной чувствительностью миокарда к катехоламинам и непосредственным влиянием избытка тироксина на миокард, что приводит к формированию гиперкинетического типа гемодинамики. Из-за возросшего потребления кислорода и неспособности организма компенсировать эти затраты сердечная мышца начинает работать в условиях гипоксии. Развивается тяжелое обменно-дистрофическое поражение миокарда – тиреотоксическая миокардиодистрофия.
Клиническими проявлениями заболевания являются кардиалгии и различные нарушения ритма в виде наджелудочковых тахикардий, экстрасистолий и мерцательной аритмии, формирование недостаточности кровообращения. При тиреотоксической мерцательной аритмии риск тромбоэмболий так же высок, как при ревматическом митральном стенозе. Возможность развития мерцательной аритмии при субклиническом гипертиреозе усложняет диагностику. Особенности мерцательной аритмии при тиреотоксикозе – ее рефрактерность к обычным терапевтическим дозам сердечных гликозидов и хорошая эффективность β-блокаторов и препаратов, снижающих концентрацию тироксина. Конечно же, во многом сомнения помогает рассеять ультразвуковое исследование миокарда.
Поражение эндокарда с формированием клапанных пороков для тиреотоксической миокардиодистрофии абсолютно нетипично. Сложнее обстоит дело при интактных клапанах и наличии диффузных изменений миокарда, когда проводится дифференцированный диагноз между ревмокардитом, миокардитом и тиреотоксической миокардиодистрофией. В этом случае внимательно оценивают анамнестические и клинические данные. Связь со стрептококковой или вирусной инфекцией, повышенный уровень антистрептококковых антител, увеличение острофазовых показателей, с одной стороны, наличие увеличения щитовидной железы и уровня тиреоидных гормонов, с другой, позволяют сформулировать диагноз.
Гипотиреоз – состояние, характеризующееся снижением уровня тиреоидных гормонов в сыворотке крови. Различают первичный гипотиреоз, который является синдромом следующих заболеваний:
- аномалии развития щитовидной железы (дисгенез и эктопия);
- эндемический зоб и кретинизм;
- подострый тиреоидит;
- аутоиммунный тиреоидит;
- тиреоидэктомия;
- тиреостатическая лекарственная терапия;
- тиреоидит Риделя;
- рак щитовидной железы.
Вторичный гипотиреоз развивается вследствие недостаточности ТТГ (врожденной или приобретенной) и чаще – гипопитуитаризма. Третичный гипотиреоз связан с поражением гипоталамических центров, секретирующих тиролиберин. В отдельную группу выделяют периферический гипотиреоз, когда концентрация тиреоидных гормонов в сыворотке нормальная, но повышена резистентность тканей к этим гормонам вследствие уменьшения числа рецепторов и синтеза антител к тиреоидным гормонам.
Клиническая картина гипотиреоза может развиваться при синдроме низкого содержания Т3, когда нарушена конверсия Т4 в Т3.Недостаточный уровень тиреоидных гормонов в органах и тканях ведет к снижению окислительных процессов и термогенеза, накоплению продуктов обмена, что вызывает тяжелые функциональные нарушения ЦНС, развитие дистрофии тканей с формированием своеобразного слизистого отека (микседемы) за счет пропитывания тканей мукополисахаридами.
Довольно часто при этой патологии развиваются ревматические синдромы, в частности артропатии и миопатии. Клинически гипотиреоидная миопатия проявляется мышечной слабостью и миалгиями. Характерно снижение мышечной силы без видимой атрофии, напротив, иногда наблюдается псевдогипертрофия мышц за счет пропитывания мукопротеинами. Мышечная масса увеличивается, мышцы становятся плотными, тугоподвижными, хорошо контурируются (синдром Гоффманна). Чаще поражаются проксимальные отделы конечностей. Могут наблюдаться судороги, замедленная релаксация. Выраженность миопатии пропорциональна тяжести гипотиреоза.
Артропатия развивается у 20-25% больных микседемой и проявляется небольшой болью в суставах, припуханием мягких тканей, суставной ригидностью, иногда появлением невоспалительного выпота в полости суставов. У некоторых больных в синовиальной жидкости обнаруживают кристаллы пирофосфата кальция или ураты, не вызывающие четкой воспалительной реакции, что объясняют снижением функциональной активности нейтрофильных лейкоцитов. Обычно поражаются коленные, голеностопные и мелкие суставы рук, на рентгенограммах выявляют околосуставной остеопороз. Имеются сообщения о деструктивной артропатии с поражением коленных суставов (Bland et al.,1979), хотя прогрессирующая деструкция, образование эрозий нехарактерны.
Лабораторные признаки воспаления обычно не выражены, у больных артропатией возможно небольшое увеличение СОЭ, у пациентов с первичной микседемой и четкой миопатией иногда может быть повышен уровень мышечных ферментов в сыворотке крови, наблюдаться асимптомная гиперурикемия.
При лечении тиреоидными гормонами явления миопатии и артропатии убывают параллельно с признаками микседемы. Ликвидация артропатии на фоне лекарственного эутиреоза в течение первого года и более подтверждает диагноз.
Влияние гипотиреоза на развитие скелета наглядно демонстрирует описание больных со щитовидной недостаточностью и кретинизмом. Они имеют маленький рост (около метра) и непропорционально укороченные конечности. Эффекты гипотиреоза у растущего ребенка проявляются поздним появлением и медленным ростом постнатальных центров окостенения. Рентгенологически постнатальные центры окостенения демонстрируют неправильное обызвествление в виде точечных эпифизов. Заместительная терапия тиреоидными гормонами нередко приводит к фактическому исчезновению эпифизарных изменений в течение двух лет (П.А. Ревелл, 1993).
У взрослых больных гипотиреозом наблюдается снижение клеточной активности в костях, умеренный остеопороз развивается лишь при длительном и тяжелом течении.
Следует отметить, что у 30-80% больных гипотиреозом выявляется наличие жидкости в перикарде. В сочетании с другими проявлениями гипотиреоидного серозита (гидротораксом, асцитом) это может вызывать сложности при постановке диагноза и необходимость исключения диффузных заболеваний соединительной ткани. Выпот в перикарде накапливается медленно, объем его от 10-30 до 100-150 мл. Тампонада сердца развивается очень редко. При исследовании экссудата выявляют его невоспалительный характер. В отличие от аутоиммунных заболеваний, когда явления полисерозита возникают при высокой воспалительной активности, лабораторные изменения при гипотиреоидном полисерозите минимальны.
Специфично поражение миокарда при гипотиреозе с развитием отека, набухания миофибрилл, тоногенной дилатацией полостей сердца, что приводит к увеличению размеров сердца на рентгенограммах и расширению границ сердечной тупости при перкуссии. Эффективная заместительная терапия тиреоидными гормонами способствует регрессии указанных симптомов.
Изменения опорно-двигательного аппарата при заболеваниях паращитовидных желез
Паращитовидные железы (две пары – верхние и нижние) вырабатывают паратгормон (ПТГ), оказывающий влияние на фосфорно-кальциевый обмен, мишенями ПТГ являются почки и кости. ПТГ усиливает процессы резорбции кости, повышает активность остеобластов, что проявляется остеолитическим действием, при этом в сыворотке крови повышается содержание кальция и фосфатов.
Гиперпаратиреоз – повышенное содержание паратгормона в сыворотке. Различают первичный гиперпаратиреоз, который развивается при аденоме или карциноме щитовидной железы; вторичный – при реактивной гиперпродукции ПТГ гиперфункционирующими железами в ответ на снижение кальция в сыворотке при ХПН, нарушенном кишечном всасывании и т. д.; третичный, возникающий при длительно текущем вторичном гиперпаратиреозе по принципу гиперфункция–гиперплазия–опухоль. Частота встречаемости первичного гиперпаратиреоза 1:4000, чаще болеют женщины (3:1) в возрасте от 40 до 60 лет, в 50% случаев заболевание диагностируют при случайном выявлении гиперкальцемии, в остальных случаях преобладают симптомы мочекаменной болезни.
Клиническая картина первичного гиперпаратиреоза складывается из синдрома гиперкальциемии, который проявляется тошнотой, рвотой, общей слабостью, недомоганием, миалгиями, мышечной слабостью, полиурией, полидипсией, кальцинозом. Все эти изменения грубо коррелируют с уровнем кальция в сыворотке крови.
В зависимости от преобладающего поражения той или иной системы выделяют несколько клинических форм первичного гиперпаратиреоза: костную, почечную, желудочно-кишечную, сердечно-сосудистую и другие.
Поражения костной системы протекают в виде генерализованной фиброзно-кистозной остеодистрофии (болезнь Реклинхаузена).
Клинические проявления: боли в костях при пальпации, иногда деформация костей, патологические переломы, часто поражаются кости грудной клетки и позвоночника с формированием деформаций – увеличением грудного кифоза, деформируются грудинно-ключичные, грудинно-реберные сочленения. В последнее время увеличилось число бессимптомных форм, когда изменения в костях являются рентгенологической «находкой».
Для рентгенологической картины характерен распространенный остеопороз с равномерной зернистостью, мелконоздреватым «милиарным» рисунком, при его прогрессировании резко истончается кортикальный слой костей, утрачивается рентгенологический рисунок костной структуры, появляются костные кисты, которые, увеличиваясь, деформируют кость, вызывая локальные вздутия, выпячивания (псевдоостеопорозная форма).
Встречаются кисты с множественными перемычками (типа мыльных пузырей), такие образования напоминают гигантоклеточные опухоли – остеобластомы. При гистологическом исследовании выявляются гигантоклеточная или фиброретикулярная ткань, иногда пропитанная гемосидерином («бурые» опухоли). Вероятность гиперпаратиреоза всегда нужно иметь в виду при постановке диагноза остеобластомы, для его исключения необходимы рентгенологическое исследование скелета и определение уровня кальция и паратгормона в крови. При постановке диагноза может помочь и локализация поражения: при гиперпаратиреозе «бурая» опухоль обычно развивается в диафизах длинных трубчатых костей, в ребрах, нижней челюсти, костях черепа, обнаружение гигантских клеток в дистальном конце кости у коленного сустава у 20-30-летних пациентов говорит в пользу остеокластомы.
В области свода черепа на фоне остеопороза иногда встречаются участки перестройки кости с пятнистым склерозом («педжетоидного» типа). Характерна локализация патологических переломов – трубчатые кости, ребра, позвонки.
Артропатия при гиперпаратиреозе – следствие поражения субхондральной кости. Кистовидная перестройка эпифизов напоминает изменения при остеоартрозе, очень характерны явления поднадкостничного рассасывания костного вещества, чаще всего в концевых фалангах кистей, реже в области акромиального конца ключицы, верхних краев ребер.
При ремодуляции кости происходит образование очагов кальциноза в хряще, что является причиной варусных или вальгусных деформаций конечностей. Очень часто при данном заболевании обнаруживаются явления хондрокальциноза (пирофосфатной артропатии) с развитием острых псевдоподагрических приступов. На рентгенограммах в проекции суставной щели выявляют тени хондрокальциноза, повторяющие контур суставной поверхности кости.
Миопатия развивается у всех больных первичным гиперпаратиреозом. Клинически она проявляется миалгиями, прогрессирующей мышечной слабостью, больше страдают проксимальные группы мышц, особенно нижних конечностей. Возникают затруднения при ходьбе, больные спотыкаются, падают, испытывают затруднения при посадке в транспорт. Развиваются «утиная походка», разболтанность суставов, формируется плоскостопие из-за мышечной релаксации. Явления мышечной гипотонии вызывают снижение нервно-мышечной возбудимости за счет гиперкальцемии. Больные из-за резкой слабости прикованы к постели иногда еще до появления патологических переломов. Такая мышечная симптоматика требует проведения дифференцированного диагноза с ДБСТ, прежде всего – с ревматической полимиалгией и дерматомиозитом.
Диагностика первичного гиперпаратиреоза проводится в два этапа: первый – обнаружение гиперкальцемии (доказанный нормокальцемический гиперпаратиреоз встречается редко); второй – исключение других причин гиперкальцемии, таких как миеломная болезнь, саркоидоз, передозировка витамина D, метастазы злокачественных опухолей и т. д.
В отличие от других состояний, сопровождающихся гиперкальцемией, при первичном гиперпаратиреозе выявляют высокую концентрацию хлоридов и низкий уровень бикарбонатов в плазме, а также повышенный или нормальный уровень паратгормона. При гиперкальциемиях другого генеза соотношение хлоридов и бикарбонатов обратное, уровень паратгормона всегда снижен. При нормальном содержании кальция в сыворотке у больных гиперпаратиреозом применение гипотиазида в дозе 1г в сутки приводит к повышению кальция, у здоровых лиц этого не происходит. Назначение гидрокортизона (100-200 мг/сут в течение 10 дней) или НПВС не приводит к изменению уровня кальция у больных гиперпаратиреозом, а при саркоидозе, миеломной болезни, передозировке витамина D, метастазах гиперкальцемия уменьшается.
При наличии клинических и лабораторных данных, свидетельствующих о первичном гиперпаратиреозе, необходим активный поиск аденомы паращитовидных желез с использованием компьютерной томографии, ЯМР. Хирургическое удаление опухоли приводит к исчезновению клинической симптоматики и обратному развитию костных изменений. Из консервативных методов лечения возможно назначение нетиазидных диуретиков, препаратов кальцитонина, в частности миокальцика, по 5-10 МЕ на кг массы тела в сутки в/м или по 100-200 МЕ в сутки в виде назального спрея.
Поражение опорно-двигательного аппарата при заболеваниях гипофиза
Акромегалия – это заболевание встречается относительно редко, в основе его возникновения лежит повышенный синтез соматотропного гормона, как правило, вследствие аденомы гипофиза. Соматотропный гормон усиливает пролиферацию хряща и кости, происходит рост кистей, стоп, нижней челюсти. В клинической картине выделяют несколько синдромов:
- суставной (акромегалическая остеоартропатия);
- неврологический (височная гемианопсия);
- метаболический (гипергликемия, гиперфосфатемия).
Артропатия проявляется симптоматикой выраженного остеоартроза мелких и средних суставов с необычной крепитацией при движениях. На рентгенограммах выявляют выраженные периостальные образования костной ткани, чередующиеся с очагами остеопороза. В отличие от воспалительных артропатий при внешне деформированных суставах суставные щели не изменены, а иногда могут даже расширять, при акромегалической артропатии никогда не бывает анкилозов, часто – гипермобильность суставов. Увеличение суставных сумок, пролиферация хряща, уплотнение околосуставных тканей могут симулировать наличие выпота в суставах. Нередки явления хондрокальциноза, довольно часто встречается синдром запястного канала.
Характерное поражение позвоночника при акромегалии описывают как спондилез Эрдгейма, он характеризуется высоко расположенным шейно-грудным кифозом с компенсаторным поясничным лордозом. Болевой синдром, как правило, не выражен, объем движений сохранен. На рентгенограммах наблюдают расширение, вогнутость тел позвонков, на профильных снимках – картину непрерывной полосы по переднему краю позвонков.
Похожие изменения происходят и при старческом анкилозирующем гиперостозе, иногда при этом приходится проводить дифференцированный диагноз с болезнью Бехтерева. Диагностика обычно не представляет сложности, учитывая характерный внешний вид таких больных.
Лечение заключается в хирургическом удалении аденомы гипофиза или использовании лучевой терапии. Из медикаментозных средств используют антагонисты дофамина. Если удается снизить концентрацию соматостатина, то клинические проявления акромегалии, включая изменения в суставах, костях, регрессируют.
Источники: www.rheumatology.org.ua
www.rusmedserv.com
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Сопутствующая аутоиммунная патология при заболеваниях щитовидной железы
Сопутствующая аутоиммунная патология при заболеваниях щитовидной железы
 Хирургия щитовидной железы: за и против
Хирургия щитовидной железы: за и против
 Современные подходы к диагностике и лечению злокачественных опухолей щитовидной железы
Современные подходы к диагностике и лечению злокачественных опухолей щитовидной железы
 Киевское городское терапевтическое общество
Киевское городское терапевтическое общество