- Головна
- /
- Статті
- /
- Неврологія
- /
- Направленная иммунотерапия: окрелизумаб в сравнении с интерфероном бета-1а при рецидивирующем рассеянном склерозе
Направленная иммунотерапия: окрелизумаб в сравнении с интерфероном бета-1а при рецидивирующем рассеянном склерозе
Несмотря на то, что в современной клинической практике доступны несколько подходов симптом-модифицирующей терапии рецидивирующих форм рассеянного склероза (РС), это нейродегенеративное заболевание продолжает прогрессировать (в т.ч. бессимптомно, когда субклиническая активность заболевания оценивается при помощи МРТ).
Соответственно, неврологический дефицит таких пациентов нарастает. Таким образом, сохраняется острая необходимость в более эффективных методах лечения РС с приемлемыми профилями безопасности.[1, 2]
Роль B-клеток в патогенезе рассеянного склероза: новые данные
Актуальность проблемы поисков новых способов лечения РС, как и высокая распространенность этого заболевания, предопределяют активность в исследовательском поле, которая в отдельных случаях приносит достаточно впечатляющие результаты. В частности, относительно недавно пересмотр результатов предыдущих исследований позволил установить, что центральное место в патогенезе РС занимает определенный тип B-клеток.
Ранее было отмечено, что B-клетки в значительном количестве присутствуют в структурах центральной нервной системы пациентов с РС. Так, CD20+ B-клетки (В-лимфоциты, презентирующие антиген CD20) часто обнаруживаются в ликворе пациентов с различными формами РС, а у пациентов с рецидивирующе-ремиттирующим РС увеличенный уровень B-лимфоцитов в ликворе прямо взаимосвязан с повышенной скоростью прогрессирования нейродегенерации. При этом у здоровых лиц, как правило, не наблюдается значительного содержания В-лимфоцитов в ЦНС. [3,4]
Таким образом, была сформулирована гипотеза, подтвердившаяся впоследствии: B-клетки, в частности, презентирующие антиген CD20, играют ключевую роль в поражении миелиновой оболочки и аксонов в процессе эскалации РС.
Сегодня считается, что В-клетки участвуют в развитии рассеянного склероза посредством нескольких механизмов:
- антиген-презентации,
- выработки аутоиммунных антител (аутоантител),
- цитокиновой регуляции;
- образования эктопических лимфоидных комплексов в оболочках мозга, что, вероятно, является фактором корковой демиелинизации и нейродегенерации. [5,6]
Таким образом, полученные данные посодействовали тому, что поиски средств для этиопатогентической терапии РС обрели новый вектор и стали более целенаправленными. Относительно недавно специалисты компании Roche смогли получить первые результаты – новое моноклональное антитело, действие которого избирательно направлено на В-лимфоциты, презентующие антиген CD20 – а также проверить препарат в дальнейших исследованиях.
Окрелизумаб: профиль препарата
Окрелизумаб (ocrelizumab) – гуманизированное моноклональное антитело, селективно нацеленное на антиген CD20, экспрессирующийся на поверхности определенных B-лимфоцитов (предшественников, зрелых и B-клетках памяти). Однако при этом окрелизумаб не воздействует на лимфоидные стволовые или на зрелые плазматические клетки, поскольку на их поверхности отсутствуют CD20-рецепторы. [7]
Связываясь с рецепторами CD20 на поверхности определенных В-лимфоцитов, окрелизумаб избирательно истощает популяции этих клеток, что приводит к снижению выраженности аутоиммунных процессов, лежащих в основе патогенеза РС. Крайне важно, что окрелизумаб истощает CD20-экспрессирующие В-клетки высокоселективно: это позволяет пациенту сохранить способность к восстановлению общей популяции В-клеток и, соответственно, поддерживать баланс гуморального иммунитета. [8,9]
Дизайн препарата был разработан с учетом соображений безопасности. Так, моноклональное антитело было создано гуманизированным с целью снижения иммуногенности, и данный эффект был подтвержден в соответствующем исследовании.[10]
Что касается непосредственного терапевтического ответа, то В-клеточное истощение достигается посредством нескольких механизмов, таких как:
- антителозависимый клеточно-опосредованный фагоцитоз,
- антителозависимая клеточно-опосредованная цитотоксичность,
- комплементзависимая цитотоксичность,
- индукция апоптоза. [11]
Результаты предварительных исследований позволили сделать выводы о том, что окрелизумаб обладает значительным потенциалом для изменения течения РС и снижения темпов инвалидизации пациентов с РС. Так, в двух базовых исследованиях (OPERA I и OPERA II) окрелизумаб уже продемонстрировал значимые улучшения по сравнению со стандартом терапии (как по клиническим конечным точкам, так и по результатам визуальной диагностики).
Об исследованиях OPERA
В исследования OPERA I и OPERA II приняло участие в совокупности 1 656 пациентов с рецидивирующими формами РС (рецидивиркюще-ремиттирующий РС и вторично прогрессирующий РС с рецидивами).
OPERA I и OPERA II – рандомизированные, двойные слепые, двойные маскированные, международные многоцентровые исследования III фазы, в которых оцениваются эффективность и безопасность окрелизумаба (доза 600 мг в виде внутривенной инфузии каждые 6 месяцев) в сравнении с интерфероном бета-1а (доза 44 мкг в виде подкожной инъекции три раза в неделю) у пациентов с рецидивирующими формами РС.
В качестве первичной конечной точки в исследованиях OPERA была принята годовая частота рецидивов (ARR), как определено в протоколе, за два года (96 недель). Вторичные конечные точки включали в себя время начала подтвержденного прогрессирования инвалидизации, общее количество поражений на T1-взвешенных изображениях с контрастированием гадолинием, а также общее количество новых и/или увеличения гиперинтенсивных поражений на T2-взвешенных изображениях, обнаруживаемых при МРТ исследовании мозга.
В этих двух исследованиях использовались идентичные протоколы, однако они проводились независимо в разных центрах. В комплексе OPERA I и OPERA II проводились в 307 центрах, расположенных в 40 странах мира.
ClinicalTrials.gov
Сравнение моноклонального антитела с интерфероном
В сравнивалась эффективность нового экспериментального иммунотерапевтического препарата окрелизумаб с интерфероном бета-1а в контексте этиопатогенетического лечения рассеянного склероза. Спонсор, компания F. Hoffmann–La Roche, организовала исследование в рамках исследований и в согласовании с координационным комитетом OPERA I и OPERA II.
В испытаниях III фазы две группы из 821 (из OPERA I) и 835 (из OPERA II) пациентов с рецидивирующим рассеянным склерозом были случайным образом распределены в группы:
- приема окрелизумаба в дозе 600 мг (в\в) каждые 24 недели или
- подкожного введения интерферона бета-1а в дозе 44 мкг три раза еженедельно в течение 96 недель.
В выборку (все пациенты, рандомизированные для анализа – 1656) вошли пациенты в возрасте от 18 до 55 лет с диагнозом рассеянного склероза (согласно к пересмотренным критериям Макдональда 2010). [12]
Показатель расширенной шкала оценки степени инвалидизации (EDSS) составил при скрининге от 0 до 5,5 (в диапазоне значений от 0 до 10,0, где более высокие показатели указывают на большую степень дисфункции). [13]
У участников было задокументировано в истории болезни как минимум два клинических рецидива в течение предыдущих 2 лет или один клинический рецидив в течение года непосредственно перед скринингом; МРТ головного мозга подтверждала аномалии, соответствующие клинической картине РС; в течение не менее чем за 30 дней перед скринингом не отмечалось неврологических ухудшений.
Ключевыми критериями исключения были: диагноз первично-прогрессирующего рассеянного склероза, история терапии, нацеленной на B-лимфоциты, или другими иммунодепрессантами; продолжительность заболевания более 10 лет в сочетании с оценкой EDSS 2,0 или менее при скрининге.
В качестве первичной конечной точки в исследовании была принята частота рецидивов на человеко-год наблюдения.
Также было принято 10 иерархически упорядоченных вторичных конечных точек, в которых преимущественно оценивались неврологический статус участников и степень прогрессирования инвалидизации (посредством EDSS, комплексной функциональной шкалы оценки рассеянного склероза (MSFC), физической подшкалы шкалы SF-36, МРТ, осмотров, при которых отмечались темпы прогрессирования неврологического дефицита на разных отрезках времени).
Дополнительными конечными точками были приятны: фармакокинетика, фармакодинамика и иммуногенность окрелизумаба; профиль безопасности окрелизумаба. Статистический анализ проводился на программном обеспечении SIENA/X. Результаты, как дискретные, так и объединенные, представлены в таблице 1.
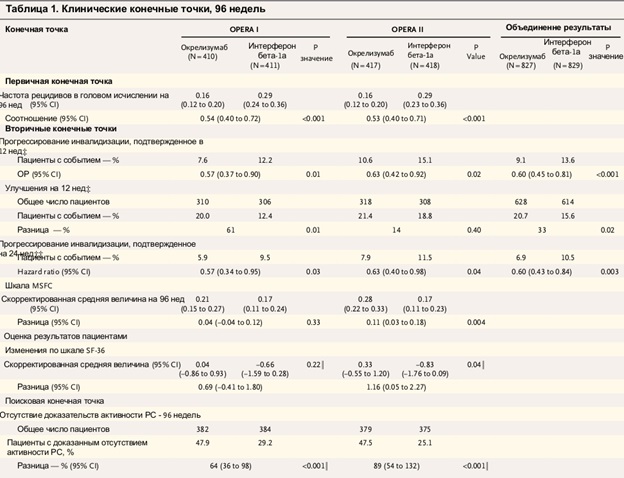
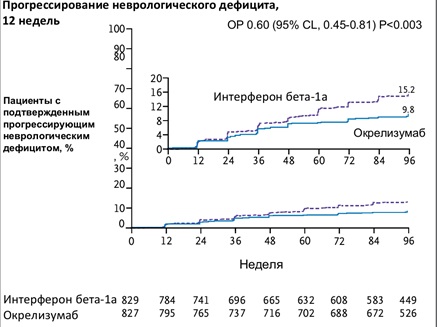
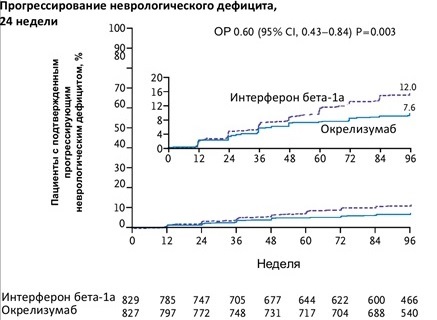
Разницу по ключевым вторичным конечным точкам можно оценить также на диаграммах (кривые на 12 и 24 недели исследования).
Литература
- Winkelmann A, Loebermann M, Reisinger EC, Hartung HP, Zettl UK. Disease-modifying therapies and infectious risks in multiple sclerosis. Nat Rev Neurol 2016;12:217-233
- Cree BA, Gourraud PA, Oksenberg JR, et al. Long-term evolution of multiple sclerosis disability in the treatment era. Ann Neurol 2016;80:499-510
- Ireland SJ, et al. Autoimmunity 2012;45(5):400–14.
- Cepok S, et al. Brain 2005;128(pt 7):1667–76.
- Li R, Rezk A, Miyazaki Y, et al. Proinflammatory GM-CSF-producing B cells in multiple sclerosis and B cell depletion therapy. Sci Transl Med 2015;7:310ra166-310ra166
- Genain CP, Cannella B, Hauser SL, Raine CS. Identification of autoantibodies associated with myelin damage in multiple sclerosis. Nat Med 1999;5:170-175
- Sorensen PS, Blinkenberg M. The potential role for ocrelizumab in the treatment of multiple sclerosis: current evidence and future prospects. Ther Adv Neurol Disord 2016;9:44-52
- Martin F, Chan AC. B cell immunobiology in disease: evolving concepts from the clinic. Annu Rev Immunol 2006;24:467-496
- DiLillo DJ, Hamaguchi Y, Ueda Y, et al. Maintenance of long-lived plasma cells and serological memory despite mature and memory B cell depletion during CD20 immunotherapy in mice. J Immunol 2008;180:361-371
- Kappos L, Li D, Calabresi PA, et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet 2011;378:1779-1787
- Klein C, Lammens A, Schäfer W, et al. Epitope interactions of monoclonal antibodies targeting CD20 and their relationship to functional properties. MAbs 2013;5:22-33
- Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011;69:292-302
- Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an Expanded Disability Status Scale (EDSS). Neurology 1983;33:1444-1452
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
