Метастатические поражения костного мозга при злокачественных новообразованиях у детей
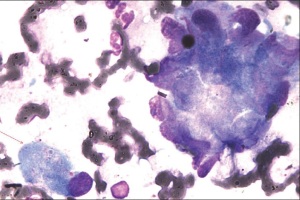
В последние годы усилия онкологов сконцентрированы на разработке иммуноцитохимических и молекулярно-генетических методов диагностики морфологически сходных, но различных по происхождению опухолей детского возраста (нейробластома, саркома Юинга, рабдомиосаркома), характеризующихся ранним развитием метастазов в костном мозге.
 Миелоидный костный мозг относится к числу органов, где чаще всего оседают опухолевые клетки и скрыто развиваются метастазы. Располагаясь в мельчайших капиллярах и имплантировавшиеся в синусах на ранних этапах метастазирования, клетки новообразований могут быть обнаружены в пунктатах и трепанобиоптатах костного мозга задолго до появления клинических и рентгенологических признаков поражения костей. Частота выявления опухолевых клеток в костном мозге при новообразованиях различной локализации колеблется в значительных пределах и определяется гистологической структурой опухоли, клинической стадией заболевания, чувствительностью и специфичностью примененных методов исследования (морфологических, иммуноцитохимических, молекулярно-генетических).
Миелоидный костный мозг относится к числу органов, где чаще всего оседают опухолевые клетки и скрыто развиваются метастазы. Располагаясь в мельчайших капиллярах и имплантировавшиеся в синусах на ранних этапах метастазирования, клетки новообразований могут быть обнаружены в пунктатах и трепанобиоптатах костного мозга задолго до появления клинических и рентгенологических признаков поражения костей. Частота выявления опухолевых клеток в костном мозге при новообразованиях различной локализации колеблется в значительных пределах и определяется гистологической структурой опухоли, клинической стадией заболевания, чувствительностью и специфичностью примененных методов исследования (морфологических, иммуноцитохимических, молекулярно-генетических).
У пациентов детского возраста с солидными опухолями наиболее часто метастазы в костный мозг и кости обнаруживаются при нейробластоме, саркоме Юинга, рабдомиосаркоме, ретинобластоме, медуллобластоме. Нередко признаки поражения костного мозга определяются уже в момент установления диагноза. Особенно часто инфильтрация костного мозга опухолевыми клетками отмечается у детей в возрасте до 1 года. Метастазы в костном мозге могут диагностироваться на сравнительно поздних стадиях заболевания у детей с остеогенной саркомой, фибросаркомой, различными формами рака. При таких новообразованиях, как нефробластома, гепатобластома, опухоли ЦНС, за исключением медуллобластомы, метастазирование в костный мозг наблюдается редко.
В детской практике метастазы опухолей почти с одинаковой частотой обнаруживаются в гистологических срезах трепанобиоптатов и в мазках, полученных при пункции костного мозга в 2-4 точках.
Симптомы, обусловленные метастатическим поражением костного мозга, вариабельны и не являются специфическими. К их числу относятся боли в костях скелета, развитие анемии, геморрагические проявления, вызванные тромбоцитопенией, инфекционные осложнения, связанные с нейтропенией. При исследовании периферической крови у ряда больных могут наблюдаться лейкоцитоз или лейкопения, эозинофилия, нейтрофилез, лимфоцитоз и моноцитоз. Нередко отмечается лейкоэритробластическая реакция, сопровождающаяся появлением в крови эритро- и нормобластов, а также незрелых гранулоцитов.
Нейробластома возникает из эмбриональных нейробластов, мигрирующих из нейрального гребешка в ганглии симпатической нервной системы и надпочечники. Относится к числу наиболее распространенных солидных новообразований у детей (7-10% всех опухолей детского возраста). Средний возраст заболевших составляет около 2 лет. У одной трети больных заболевание диагностируется на первом году жизни.
Наиболее часто первичная опухоль локализуется в надпочечниках (32%), паравертебрально в забрюшинном пространстве (28%), в заднем средостении (15%), значительно реже в области малого таза (6%) и шеи (2%).
Нейробластома способна к раннему гематогенному метастазированию. Почти у 50% детей во время поступления в клинику наблюдаются метастазы в костный мозг и кости, лимфатические узлы.
Клинические проявления у детей с нейробластомой во многом определяются локализацией первичной опухоли, регионарных или отдаленных метастазов. Во многих случаях общие симптомы являются неспецифическими, наблюдающимися при других распространенных в детском возрасте заболеваниях.
Диагностика нейробластомы и очагов метастазирования осуществляется до начала терапии на основе результатов компьютерной томографии, магнитно-резонансного исследования и сканирования с использованием 99mTc. С целью установления метастатического поражения проводится пункция костного мозга грудины и (или) билатеральная трепанобиопсия гребешков подвздошной кости.
При лабораторном исследовании у детей с нейробластомой в сыворотке крови и моче могут определяться повышенный уровень опухолеассоциированных маркеров: метаболитов катехоламинов, нейронспецифической енолазы, ферритина, лактатдегидрогеназы, ганглиозидов (GD2, GD1b, GT1b).
Современная гистологическая классификация периферических нейробластических опухолей (ПНО), предложенная Международным комитетом по патологии нейробластом на основе адаптации ранее существовавших систем Yoshi и Shimada, включает четыре категории новообразований:
- нейробластому (с бедной стромой из Шванновских клеток);
- ганглионейробластому со смешанным клеточным составом (богатую Шванновской стромой);
- ганглионейрому (с преобладающим стромальным компонентом);
- ганглионейробластому нодулярную со сложным строением (богатую стромой, с преобладанием стромы и бедную стромой).
Подобная классификация представляет ценность только при исследовании адекватного биопсийного материала, полученного до начала терапии. Цитоморфологические признаки опухолевых клеток (уровень дифференцирования нейробластов, соотношение митотически делящихся клеток и клеток с признаками кариорексиса, доля стромального компонента) с учетом возраста ребенка позволяют подразделить ПНО на подгруппы с благоприятным и неблагоприятным прогнозом.
В настоящее время все большее значение приобретают биологические прогностические факторы, основанные на результатах иммунофенотипирования и молекулярно-генетического анализа клеток нейробластомы.
Одной из наиболее распространенных и признанных является Международная система клинического стадирования нейробластомы (INSS), которая во многом основывается на гистологическом изучении удаленной при оперативном вмешательстве опухоли и пораженных лимфатических узлов, дополненном данными иммуногистохимического и электронномикроскопического исследований; изучении мазков из пунктата или гистологических препаратов трепаната костного мозга. Эти же критерии используются для оценки полноты ремиссии после проведенной терапии.
Для отличия клеток нейробластомы от имеющих сходные структурные и цитологические признаки опухолей иной тканевой природы все шире применяются иммуногистохимические методы с использованием панели маркерных моноклональных антител. Проводится иммунофенотипирование клеток в замороженных, фиксированных в формалине и заключенных в парафин срезах опухолей и в мазках из пунктатов костного мозга при его метастатическом поражении. В диагностическую панель включаются антитела к нейронспецифической енолазе, синаптофизину, хромогранину А, антигену Leu-7 (CD57), общелейкоцитарному антигену (CD45), нейрофиламентам, виментину, десмину, белку S-100, антигену MIC2 (CD99), миоглобину, актину. Это позволяет надежно на гистогенетической основе дифференцировать метастазы нейробластомы в костный мозг и различные цитологические варианты наиболее частых у детей острых лимфобластных лейкозов Т- и В-клеточного происхождения, метастазы ретинобластомы и медуллобластомы, а также других новообразований, состоящих из малых округлых синих клеток (small blue round cell tumоrs). При исследовании гистологических срезов по маркерным гистогенетическим признакам нейробластому удается отличить от ряда других опухолей: мелкоклеточной остеогенной саркомы, мезенхимальной хондросаркомы и ряда других более редко встречающихся в детском возрасте новообразований.
В нашем институте были проанализированы тонкоигольные пунктаты опухолей и мазки костного мозга грудины и гребешков подвздошной кости у 88 детей с нейробластомой (табл.). У 50 больных (57%) уже в момент поступления в отделение детской онкологии Института онкологии АМН Украины по данным цитологического и иммуноцитохимического исследований было выявлено метастатическое поражение костного мозга.
При обследовании детей с метастазами нейробластомы диффузный характер поражения костного мозга был выявлен в 45 случаях, очаговый – у 5 больных. Помимо этого, с помощью рутинных цитоморфологических и иммуноцитохимических методов микрометастазы и отдельные опухолевые клетки в костном мозге были обнаружены в различные сроки наблюдения еще у 20 (23%) больных, подвергавшихся терапии. В ряде случаев актуальным в диагностическом плане была дифференциация метастазов нейробластомы, рабдомиосаркомы, медуллобластомы, острого лимфобластного лейкоза и ранних этапов лейкемизации неходжкинских лимфом. С этой целью использовались результаты цитохимических исследований (определение активности кислой фосфатазы, щелочной фосфатазы, кислой неспецифической эстеразы, PAS-реакция) и маркерные иммунофенотипические признаки, представленные в таблице.
При определении активности кислой фосфатазы в цитоплазме клеток нейробластомы и метастазов в костном мозге отмечалось слабое диффузное или мелкогранулярное окрашивание. Реакция при определении активности щелочной фосфатазы и кислой неспецифической эстеразы была отрицательной. При выявлении PAS-положительных веществ наблюдалось слабое диффузное окрашивание цитоплазмы опухолевых клеток.
При иммуноцитохимическом исследовании (АВС-АР метод) на поверхностных мембранах клеток первичной опухоли и метастазов, как правило, определялись антигены нейробластомы, Leu-7 (CD57) и CD56. Экспрессия нейрофиламентов отмечалась в клетках более дифференцированных опухолей. В части клеток нейробластом обнаруживались хромогранин А и синаптофизин. Отрицательными были результаты реакций при выявлении различных типов цитокератинов, десмина, общелейкоцитарного антигена (CD45), антигена MIC2 (CD99).
Прогностическое значение имело определение экспрессии гликопротеина CD44, с которым связывают реализацию метастатического потенциала различных типов новообразований, на поверхностных мембранах клеток нейробластомы. Гликопротеин CD44 (H-CAM, Pgp-1) с молекулярной массой 85 кД имеет сходство с лектинами С типа. Его лигандами являются гиалуроновая кислота, коллаген I и IV типов, фибронектин, ламинин. Он участвует в межклеточных взаимодействиях, прикреплении лейкоцитов к эндотелиальным клеткам, агрегации лейкоцитов, хоминге клеток в периферические органы лимфопоэза. Экспрессия гликопротеина CD44 на мембранах клеток нейробластомы служит показателем благоприятного прогноза.
Все большее практическое значение в плане прогноза и выбора методов терапии больных нейробластомой приобретают результаты цитогенетических и молекулярно-генетических исследований. Прежде всего это касается хромосомы 1 – делеций, ведущих к утрате материала из короткого плеча (1р) и дополнительных сегментов длинного плеча (1q). Подобные аномалии отмечаются у 33% пациентов. У 42% больных с нейробластомой наблюдаются также аномалии хромосомы 17.
К числу приоритетных прогностических критериев должны быть отнесены амплификации онкогена N-myc, делеция 1р, степень плоидности хромосом.
Саркома Юинга. К категории так называемых злокачественных опухолей детского и юношеского возраста, при которых развиваются ранние метастазы в костный мозг, относятся новообразования семейства сарком Юинга. Они включают недифференцируемую типичную саркому Юинга и ее внескелетный аналог, злокачественную мелкоклеточную нейроэктодермальную опухоль торако-абдоминальной области (опухоль Аскина), а также группу примитивных нейроэктодермальных новообразований мягких тканей и костей (PNET). Опухоли, относящиеся к семейству сарком Юинга, имеют нейроэктодермальное происхождение и гистогенетически связаны с клетками нервного гребешка. В процессе эмбриогенеза клетки нервного гребешка, распространяясь по сомитам, участвуют в образовании элементов симпатической периферической нервной системы. Они же являются возможным источником развития опухолей.
Саркома Юинга является второй по частоте злокачественной опухолью костей после остеогенной саркомы у детей. Пик заболеваемости (57,5%) приходится на второе десятилетие жизни, т. е. на период формирования и созревания костного скелета. Поражаются практически все отделы костного скелета, но наиболее часто плоские кости таза, ребра, лопатка, кости лицевого черепа, диафизы длинных трубчатых костей – бедренной, большой и малой берцовой. Примерно у 20-25% больных уже в момент установления диагноза определяются отдаленные метастазы – в легких, костях и костном мозге.
Клиническая симптоматика заболевания во многом определяется локализацией первичной опухоли. Основными симптомами являются локальная боль и припухлость, нарушения функции конечности. Опухоли тазовых костей из-за незначительной болезненности в течение долгого периода времени остаются нераспознанными. У больных с саркомой Юинга, особенно при наличии метастазов, могут обнаруживаться и такие общие признаки, как потеря массы тела, повышение температуры. При лабораторном исследовании может определяться непостоянное увеличение уровня ЛДГ и ферритина в сыворотке крови, изменения в свертывающей системе крови.
Рентгенография пораженных костей позволяет установить литический и смешанный, литический и склеротический характеры процесса. Компьютерная томография первичного опухолевого очага дает возможность получить ценную информацию о степени поражения окружающих мягких тканей и о распространении процесса по костномозговому каналу. Поиск отдаленных метастазов включает обязательную рентгенографию и компьютерную томографию грудной клетки, сцинтиграфию с использованием 99mTc, магнитно-резонансную томографию. Проводится пункционная биопсия костного мозга из нескольких точек и трепанобиопсия костного мозга подвздошной кости.
Для установления верифицированного диагноза обязательным является проведение открытой (эксцизионной) биопсии, позволяющей получить достаточное количество репрезентативного материала для последующего гистологического изучения, которое при необходимости может быть дополнено результатами иммуногистохимического и молекулярно-генетического анализов.
Важным вспомогательным методом в диагностике саркомы Юинга является цитологическое исследование мазков из материала, полученного при пункционной биопсии, которое позволяет при паноптической окраске более детально изучить цитоморфологические и цитохимические особенности опухолевых клеток. В цитологических препаратах у больных саркомой Юинга обычно определяется большое скопление опухолевых клеток, располагающихся разрозненно или образующих небольшие скопления или комплексы в виде «псевдорозеток». Опухолевые элементы достаточно мономорфные, средних или мелких размеров. Ядерно-цитоплазматическое отношение очень высокое. Ядра округлой формы располагаются в клетках центрально, реже эксцентрично. На фоне мелкодисперсной структуры ядерного хроматина изредка могут быть обнаружены нуклеолы. В умеренно или интенсивно базофильной цитоплазме иногда отмечаются признаки вакуолизации.
При цитохимическом исследовании установлены некоторые различия саркомы Юинга и других форм опухолей детского возраста из малых округлых синих клеток. Так, в цитоплазме клеток опухоли Юинга при PAS-реакции в подавляющем большинстве случаев отмечается интенсивное окрашивание с отложением конечных продуктов в виде крупных гранул и блоков. Реакция при определении активности щелочной фосфатазы в клетках саркомы Юинга, в отличие от остеогенной саркомы, отрицательная, а активность кислой фосфатазы колеблется от слабой до умеренной при диффузно-гранулярном окрашивании цитоплазмы клеток. Активность миелопероксидазы, нафтол-AS-D-хлорацетатэстеразы и кислой неспецифической эстеразы в клетках опухоли Юинга и PNET практически не выявляется.
Результаты иммуногистохимических исследований свидетельствуют о важном значении в диагностике PNET и саркомы Юинга определения на поверхностных мембранах клеток гликопротеина р30/32 (CD99) – продукта гена MIC2 [37]. Клетки этих опухолей почти в 100% случаев реагировали с антителами 013, НВА71, 12Е7 к антигену. Практически у всех больных с новообразованиями семейства Юинга отмечается диффузное или фокальное окрашивание цитоплазмы опухолевых клеток при выявлении виментина [8, 19]. К числу дополнительных маркеров, выявление которых может быть использовано при диагностике PNET и саркомы Юинга, относятся антиген CD57 (Leu-7), белок S-100, белки нейрофиламентов, синаптофизин, обнаруживаемые в 40% случаев. Хромогранин выявляется в опухолевых клетках у 20% больных, реакция на десмин и общелейкоцитарный антиген (CD45) практически во всех случаях отрицательная.
Результаты молекулярно-генетических исследований также могут быть использованы для раннего выявления метастазов в костный мозг и проведения дифференциальной диагностики саркомы Юинга, PNET и других «мелко-кругло-синеклеточных» опухолей детского возраста. Установлено, что в клетках саркомы Юинга в 90% случаев отмечается транслокация t(11;22)(q24;q12) с вовлечением генов FLI-1 и EWS.
Рабдомиосаркома – злокачественная опухоль, возникающая из примитивных мезенхимальных клеток, коммитированных к развитию в поперечно-полосатую мышечную ткань. Является наиболее частой в гетерогенной группе сарком мягких тканей, на долю которых приходится 6,5% всех злокачественных опухолей детского возраста. Почти в 70% случаев опухоль диагностируется у детей в возрасте до 10 лет. Отмечается два пика заболеваемости: у детей 2-5 лет и в подростковом возрасте.
Рабдомиосаркома может развиваться в различных органах: в орбите глаза, носоглотке, на лице и шее, в органах мочеполового тракта (мочевой пузырь, предстательная железа, влагалище, вульва, матка), в забрюшинном пространстве, средостении, в зоне расположения мышц нижних и верхних конечностей, в мышцах туловища. Это чрезвычайно агрессивная опухоль, обладающая высокой степенью злокачественности, способная к диссеминации как лимфогенным, так и гематогенным путем. Примерно 20% больных поступают в клинику уже при наличии метастазов. Наиболее часто метастазы обнаруживаются в легких, лимфатических узлах, костях и костном мозге, редко в печени, головном мозге. Начальные признаки и симптомы заболевания во многом определяются локализацией опухоли, ее распространением на окружающие ткани и топографией отдаленных метастазов.
Для установления диагноза необходима открытая биопсия с получением достаточного количества материала для проведения рутинного гистологического исследования, иммуногистохимического и молекулярно-генетического анализов. Данные тонкоигольной пункционной биопсии имеют вспомогательное значение, позволяют точнее охарактеризовать цитоморфологические, цитохимические и иммунофенотипические признаки клеток новообразования. Выполняется также биопсия пораженных лимфатических узлов, стернальная пункция и билатеральная трепанобиопсия костного мозга гребешков подвздошной кости.
Проведению биопсии предшествует полное клиническое и лабораторное обследование, использование данных УЗИ, компьютерной и магнитно-резонансной томографии, радиоизотопного сканирования костей скелета.
Предоперационная система стадирования, основанная на TNM-классификации Международного агентства по изучению рака (MAИР) и использующаяся европейской группой по изучению сарком мягких тканей (SIOP), учитывает размеры первичной опухоли и степень инвазии окружающих тканей, состояние регионарных лимфатических узлов и наличие или отсутствие отдаленных метастазов. Послеоперационная система TNM (pTNM) базируется на результатах изучения гистологической структуры опухоли, оценке полноты ее удаления (данные микроскопического выявления резидуальных опухолевых клеток) и степени поражений лимфатических узлов, полученных во время оперативного вмешательства.
Важное прогностическое значение, особенно при использовании современной протокольной терапии, имеют результаты патогистологического исследования, позволяющие выделить основные формы рабдомиосарком. Выделяют эмбриональную, альвеолярную и более редкую у детей плеоморфную формы рабдомиосарком.
Эмбриональная рабдомиосаркома, в том числе и ботриоидная, наиболее частая у детей, встречается в участках, где нет поперечно-полосатых мышц. Вероятно, ее возникновение связано с проявлениями дисэмбриоплазии. Выделяют круглоклеточный, миксоидный и пучковый варианты эмбриональной рабдомиосаркомы.
Альвеолярная рабдомиосаркома характеризуется наличием псевдожелезистых и псевдоальвеолярных структур, разделенных соединительнотканными прослойками. Просвет альвеол заполняют овальные и округлые клетки типа эмбриональных миобластов.
Плеоморфная рабдомиосаркома состоит из мелких округлых, овальных или веретенообразных клеток, количественное соотношение которых может варьировать. Возможно наличие полиморфных гигантских многоядерных клеток, напоминающих миосимпласты.
У больных с эмбриональной рабдомиосаркомой (особенно при ботриоидном и веретеноклеточном вариантах) прогноз лучше, чем у детей с альвеолярной рабдомиосаркомой.
Дифференциальная диагностика эмбриональной рабдомиосаркомы и других опухолей из малых округлых клеток с базофильной цитоплазмой крайне сложна. Важную роль играет применение иммуногистохимических методов с использованием антител к известным гистогенетическим маркерам (виментину, мышечному актину, десмину и т. д.). Положительная реакция с антителами к виментину наблюдается во всех клетках при различных формах рабдомиосарком. Столь же надежным маркером служит определение различных эпитопов десмина. В значительном числе случаев в ядрах опухолевых клеток выявляется продукт гена мышечного дифференцирования MyoD1, один из регуляторных белков, контролирующих дифференцирование и определяющих иммунофенотип клеток мышечной ткани. С различной частотой в клетках рабдомиосаркомы определяется экспрессия антигена CD99 (продукта гена MIC2), антигена CD57, редко нейронспецифической енолазы, синаптофизина, хромогранина А.
По данным цитогенетических исследований и проточной цитофлуориметрии существует связь между содержанием ДНК в ядрах опухолевых клеток и прогнозом у больных рабдомиосаркомой. Более благоприятный прогноз отмечен при наличии анэуплоидии. К числу специфических молекулярно-генетических аномалий относится транслокация t(2;13)(q35;q14), обнаруживаемая с высокой частотой при альвеолярной рабдомиосаркоме.
 Синдром раздраженного кишечника: принципы диагностики и терапии
Синдром раздраженного кишечника: принципы диагностики и терапии
 Диагностика ишемической болезни сердца. Оценка болевого синдрома и данных анамнеза
Диагностика ишемической болезни сердца. Оценка болевого синдрома и данных анамнеза
 Диагностика и лечение заболеваний органов пищеварения
Диагностика и лечение заболеваний органов пищеварения
 Побочное действие лекарственных средств. Дифференциальная диагностика аллергических, токсико-аллергических и псевдоаллергических реакций
Побочное действие лекарственных средств. Дифференциальная диагностика аллергических, токсико-аллергических и псевдоаллергических реакций
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
