- Головна
- /
- Статті
- /
- Отоларингологія
- /
- Еще раз о термине «вирусно-бактериальная инфекция»
Еще раз о термине «вирусно-бактериальная инфекция»

Большинство педиатров согласится, что наиболее частыми жалобами пациентов и их родителей являются лихорадка, насморк и/или боль в горле. Ежегодно врачи осматривают около 40% детей до 6 мес. и свыше 60% детей в возрасте от 6 мес. до 5 лет только по поводу лихорадки, которая в большинстве случаев является проявлением самоограничивающейся острой респираторной вирусной инфекции (ОРВИ) [1].
Тем не менее в этой ситуации перед врачом возникает задача не пропустить серьезное бактериальное заболевание, с одной стороны, и не назначить лишних исследований и препаратов – с другой.
Ключевые слова: ОРВИ, боль в горле вирусно-бактериальная инфекция лечение, гексэтидин, Гексорал
На практике все оказывается не так просто: например, многие родители требуют усиления лечения антибиотиком, тем более что у детей, особенно младшего возраста, острые респираторные заболевания (ОРЗ) могут иметь затяжное течение. Кроме того, формулировка диагноза «вирусно-бактериальная инфекция», видимо, сама по себе дает повод врачу назначить антибиотик. Термин «вирусно-бактериальная инфекция» принят к употреблению только в России, им можно обозначить инфекцию респираторного тракта, вызванную одновременно и вирусом, и микробом, хотя совпадение длительности инкубационного, продромального периода и времени развития клинических проявлений крайне маловероятно. Можно обозначить им и последовательное присоединение бактериальной инфекции к вирусной, что бывает достаточно часто, но в этих случаях правильнее назвать последнюю, обозначив форму бактериального заболевания (например, «грипп, осложненный острым средним отитом»). Это тем более важно, что нет строгих доказательств эффективности антибиотиков в предотвращении бактериальных осложнений ОРВИ [2].
Поэтому использование термина «вирусно-бактериальная инфекция» стимулирует получившее широкое распространение неоправданное применение антибиотиков при ОРВИ и острых тонзиллитах (ОТ) [3].
Кроме того, такая формулировка диагноза у детей с ОРЗ (особенно затянувшимся) в амбулаторной практике нередко служит поводом для микробиологического исследования материала из носа и горла «на флору», а положительные результаты посева (чаще высев стафилококков, гемофильной палочки или пневмококков) как бы доказывает правомерность назначения антибиотиков.
Носительство патогенной флоры в носоглотке достаточно часто наблюдается у детей, а при наличии определенных условий может быть фактором риска развития острого среднего отита (ОСО), риносинусита, пневмонии. Такими условиями могут быть эндогенные причины (анатомические особенности, нарушение пневматизации полости среднего уха вследствие увеличения аденоидов и т. д.) или экзогенные (снижение мукоцилиарного клиренса и/или иммунного ответа, например при гриппе и других инфекциях). Пневмококки и гемофильная палочка остаются главными возбудителями этих заболеваний, но борьба с их носительством предусматривает вакцинацию (против S. pneumoniae и H. influenzae типа b), а не антибактериальную терапию [4–6]. Носительство S. aureus в полости носа может наблюдаться почти у четверти здоровых лиц и не рассматривается как фактор риска каких-либо осложнений у людей с сохранным иммунитетом [7].
Так как выделение флоры из носа у детей с ОРЗ в подавляющем большинстве случаев не позволяет судить о точном диагнозе и этиологии заболевания, целесообразность такого исследования весьма сомнительна, и оно не рекомендуется авторитетными документами [5].
Наличие флоры в полости рта и горле также не считается диагностически значимым, за исключением острых тонзиллитов, при которых высев S. pyogenes является показанием для назначения антибактериальной терапии.
В полости рта может быть выявлено более 700 серотипов бактерий, из которых свыше 50% не культивированы. При обследовании взрослых здоровых лиц в ротоглотке флора оказывается намного богаче, чем в полости носа. В одном из исследований у 5 здоровых людей был выявлен 141 вид бактерий, из которых более 60% не культивированы [9]. При этом наличие в горле или полости рта кишечной флоры, нередко наблюдаемое у детей, находящихся на стационарном лечении (особенно получающих антибиотики), указывает на нарушение биоценоза и может способствовать развитию внутрибольничной инфекции.
Если при респираторной инфекции мы сталкиваемся с частым излишним назначением культурального исследования из носа и горла, то при остром тонзиллите, случае, когда результат этого исследования реально необходим для верификации диагноза и назначения этиотропной терапии, ситуация прямо противоположная.
Известно, что ОТ в большинстве случаев вызваны вирусами и не требуют лечения антибиотиком [10]. Основной бактериальный возбудитель S. pyogenes – β-гемолитический стрептококк группы А (БГСА) – обусловливает до 15–30% случаев ОТ у детей. Только БГСА-тонзиллиты требуют антибактериального лечения ввиду возможности развития как гнойных осложнений, так и острой ревматической лихорадки, гломерулонефрита, PANDAS-синдрома и др. Этиологическая диагностика ОТ важна как для эрадикации стрептококка, так и отказа от ненужных антибиотиков при вирусных формах заболевания [11]. Это тем более важно, т. к. вирусные и бактериальные формы ОТ имеют схожую клиническую симптоматику и фарингоскопическую картину (налеты на небных миндалинах встречаются в 80–90% случаев), и различить их удается иногда лишь по наличию катаральных явлений, конъюнктивита при вирусных тонзиллитах [12, 13]. Более того, уровень маркеров бактериального воспаления (лейкоцитоз, С-реактивный белок, прокальцитонин) также не позволяет отличить БГСА-тонзиллиты от вирусных [11].
Несмотря на важность бактериологического исследования для исключения или подтверждения БГСА-инфекции, на практике оно выполняется редко. По европейским данным, культуральное исследование при ОТ назначается 54% больных, а выполняется лишь 4,2% [14]. По результатам многоцентрового исследования ФАЭТОН, в России частота назначения системных антибиотиков при ОТ у взрослых составила 93–100%, тогда как бактериологическое исследование было проведено лишь у 2% пациентов. Создание экспресс-тестов на БГСА существенно облегчило этиологическую диагностику, однако пока, к сожалению, в России этот метод широко не применяется.
Целью данного исследования явилось изучение диагностической ценности бактериологического исследования материала из верхних дыхательных путей, в т. ч. с определением чувствительности флоры к антибиотикам при различных ОРЗ, а также оценка эффективности местной терапии вирусных тонзиллитов у детей.
Материалы и методы. В Научном центре здоровья детей проводится мониторинг распространенности пневмококковой инфекции, в рамках которого у госпитализированных детей, в т. ч. в отделении диагностики и восстановительного лечения, проводилось бактериологическое исследование мазков из носо- и ротоглотки с их типированием и определением чувствительности к антибиотикам. В рамках этой работы мы провели исследование частоты носительства патогенной и условно-патогенной флоры в полости носа и в горле у детей с вирусными инфекциями (ОРВИ – только назофарингит, бронхиолит/обструктивный бронхит, круп) и бактериальными (острый средний отит, пневмония), в т. ч. поступавших с диагнозом «вирусно-бактериальная инфекция» и продолжавших лихорадить на фоне антибактериальной терапии. Все больные размещались в индивидуальные боксы, что исключало перекрестную инфекцию. Оценка устойчивости пневмококков оценивалась по системе EUCAST.
В контрольную группу были отнесены пациенты с инфекцией иной локализации (инфекция мочевых путей, гастроэнтерит), а также дети, находившиеся в отделении на плановом обследовании. Внимание уделялось получению антибактериальной терапии в течение последних 2 мес. до госпитализации, поскольку это могло повлиять на состав флоры.
Всего было обследовано 292 ребенка в возрасте от 19 дней до 17 лет. В основную группу вошли 144 больных с ОРЗ, в контрольную – 121 пациент.
РЕЗУЛЬТАТЫ
Частота носительства пневмотропной флоры в полости носа существенно различалась в зависимости от формы патологии (табл. 1). Носителями были практически все больные с ОСО, вне зависимости от того, лечился ребенок антибиотиками или нет. При этом более половины высевов составляли пневмококки и гемофильная палочка. При другом бактериальном заболевании – пневмонии, пневмотропная флора выделялась значительно реже – всего в 1/3 случаев, причем мы ни разу не высеяли пневмококк, хотя у большинства детей именно пневмококковая этиология пневмонии была наиболее вероятна.
|
Дети с ОРЗ 144 |
Контрольная группа 121 |
||||||
|---|---|---|---|---|---|---|---|
|
Пневмония 19 |
Круп 11 |
Бронхиолит 22 |
ОРВИ 70 |
ОСО 22 |
Всего с ОРЗ 144 |
||
| Str. pneumoniae | – | 1 | 7 | 4 | 7 | 19 | 9 |
| H. influenzae | 3 | 1 | 3 | 5 | 6 | 18 | 8 |
| M. catarrhalis | 1 | 3 | 2 | 5 | 3 | 14 | 13 |
| St. aureus | 3 | 1 | 1 | 5 | 5 | 15 | 32 |
| Всего | 7 | 6 | 13 | 19 | 21 | 66 | 62 |
| % | 37 | 55 | 59 | 27 | 95 | 39 | 51 |
При вирусных инфекциях нижних дыхательных путей – бронхиолите и обструктивном бронхите, а также крупе пневмотропы высевались в 55–60% случаев, причем, как и при ОСО, пневмококки и гемофилюс составляли около половины; влияния предшествующей терапии мы также не выявили. При вирусных назофарингитах (ОРВИ) структура высева была такой же, но его частота – в 2 раза ниже.
В целом частота носительства у детей с ОРЗ (43%) не отличалась существенно от таковой в контрольной группе (51%), однако там более половины штаммов составлял S. aureus, тогда как при ОРЗ – всего 23%. Вместе с этим пневмококки и гемофилюс составляли 27 и 56% соответственно.
Исследование лекарственной чувствительности выделенных пневмококков дало неожиданные результаты. Все 28 тестированных штаммов были чувствительны к амоксициллину, но из них к пенициллину, 14- и 15-членным макролидам и клиндамицину были чувствительны только 12, тогда как 7 – резистентны. Таким образом, всего из 28 штаммов сниженную чувствительность к пенициллину имели 12 (43%), к макролидам и клиндамицину – 11 (39%) штаммов. Резистентными к пенициллину были 2 штамма пневмококков из 4, выделенных у детей из контрольной группы. Устойчивыми к ко-тримоксазолу оказалось 25% штаммов.
Все тестированные штаммы гемофильной палочки были чувствительными к амоксициллину.
Частота носительства кишечной флоры в ротоглотке оценивалась в тех же группах пациентов; высевались Klebsiella pneumoniae и E. coli, а также неферментирующие глюкозу микроорганизмы (Acinetobacter, Pseudomonas aeruginosa) (табл. 2). У детей с респираторной инфекцией, не получавших антибиотики, носительство этой флоры составило 28%, у получавших – 16%, в контрольной группе – 15%.
| Дети с ОРЗ 171 |
Контрольная группа 121 |
|||||||
|---|---|---|---|---|---|---|---|---|
|
Пневмония 19 |
Круп 11 |
Бронхиолит 22 |
ОРВИ 70 |
ОСО 22 |
Тонзиллит 27 |
Всего 171 |
||
| Klebsiella | 2 | 1 | 1 | 3 | 1 | 1 | 9 | 4 |
| E. coli | – | 1 | – | 4 | – | – | 5 | 6 |
| Неферментирующие | – | 4 | 2 | 10 | 4 | 2 | 22 | 8 |
| Всего | 2 | 6 | 3 | 17 | 5 | 3 | 36 | 18 |
| % | 10 | 52 | 14 | 24 | 23 | 11 | 21 | 15 |
Частота назначения бактериологического исследования при ОТ у детей. Из 98 госпитализированных в 2013 г. в нашу клинику детей с ОТ лишь двоим по месту жительства было назначено исследование на дифтерию; посев или экспресс-тест на БГСА не были назначены ни разу. В клинике БГСА-этиология ОТ была подтверждена у 9 больных (9%), однако системные антибиотики по месту жительства были назначены половине пациентов с ОТ (в половине случаев – аминопенициллины, в ¼ – цефалоспорины, в 17% – макролиды; 2 и более препаратов были назначены каждому 7-му ребенку).
Очевидно, что педиатру поликлиники при отсутствии экспресс-тестов на выявление БГСА (пока не вошедших в стандарты оказания медицинской помощи в России) было проще назначить антибиотик, чем вызвать сестру для взятия мазка и наблюдать за больным до получения ответа лаборатории. Кроме того, как среди родителей, так и врачей существует некий стереотип боязни налетов на небных миндалинах. Из госпитализированных детей в 37% случаев поводом для назначения антибиотика с последующей госпитализацией послужили именно налеты на миндалинах при нормальном самочувствии ребенка.
В соответствии с международными рекомендациями [15, 16], мы назначаем системные антибиотики только детям с положительным результатом культурального исследования или экспресс-теста на БГСА: аминопенициллины курсом на 10 дней, цефуроксим аксетил – на 5 дней. Однако, когда пациент уже получил антибиотик до госпитализации, бактериологическое исследование в любом случае покажет отрицательный результат, так что судить об этиологии приходится на основании эффекта антибиотика, а если он был назначен на 4–5-е сутки болезни – по уровню антистрептолизина-О.
Установление диагноза БГСА-тонзиллита существенно упрощает лечение больного – мы крайне редко видим неэффективность антибиотика. Эти пациенты редко жалуются на сильную боль в горле, тогда как у детей с вирусными тонзиллитами она выражена, как и значительная заложенность носа. Помимо жаропонижающих и туалета носа (с эффективной аспирацией слизи), у таких детей весьма желательно использование местных антисептических и смягчающих препаратов. Применение антисептиков может быть оправдано и при других ОРЗ с учетом значительной обсемененности полости рта несвойственной ей флорой.
Использование антисептических препаратов. Наличие болевого синдрома при ОТ и вирусных фарингитах ставит вопрос о применении местного лечения. Из-за возможности повреждения слизистой оболочки втирание, например спиртового раствора Люголя, не рекомендуется, тем более что он обладает местнораздражающим действием. У маленьких детей, которые не умеют полоскать горло и не смогут рассасывать таблетки, предпочтительна форма топических препаратов в виде спрея (из-за опасности ларингоспазма немногие спреи, в их числе гексэтидин, разрешены с 3-летнего возраста). Гексэтидин – действующее вещество препарата Гексорал®, имеет высокий профиль безопасности и может применяться 2 раза в день, что значительно повышает комплаентность [17]. Доказана его эффективность в инактивации рино- и РС-вируса, вирусов гриппа А (H5N1, H7N9, H1N1), вируса простого герпеса 1-го типа [18, 19]. Гексэтидин бактерициден в отношении S. pyogenes как с низким (4 мг/л), так и высоким значением МПК (16 мг/л) [20]. Кроме того, этот препарат разрушает биопленки и препятствует их образованию, что потенцирует эффективность как системного антибиотика, так и непосредственную антисептическую активность гексэтидина [21]. У детей с ОТ результатами ранее проведенных исследований было показано статистически значимое ускорение в купировании симптомов тонзиллофарингита при лечении гексэтидином и его хорошая переносимость [22, 23].
Мы применяем Гексорал® уже в течение нескольких лет и ни разу не регистрировали развитие нежелательных побочных эффектов. Его эффективность мы изучили на группе в 79 детей с ОТ (8 – со стрептококковой этиологией, 13 – с инфекционным мононуклеозом, 38 – с респираторно-вирусными ОТ и у 20 детей с гриппом (15 детей имели грипп А и 5 детей – В)). Все дети предъявляли жалобы на боль в горле. Из 79 детей с подобными жалобами местную терапию гексэтидином получали 68 детей (11 детей были младше 3 лет). Помимо гексэтидина, 8 детям со стрептококковым тонзиллитом были назначены антибиотики, пациентам с гриппом вводили осельтамивир. Остальные дети с ОТ получали только симптоматическую терапию (туалет носа, жаропонижающие препараты, системные глюкокортикостероиды у 4 детей с инфекционным мононуклеозом).
Гексорал® у всех детей, независимо от этиологии тонзиллита, ускорял улучшение фарингоскопической картины уже через сутки; 57% детей отметили субъективное облегчение болевого синдрома после первого орошения гексэтидином, к концу вторых суток лечения у всех детей купировались неприятные ощущения в горле.
Из 68 детей, лечившихся гексэтидином, у 31 до начала лечения из горла высевалась кишечная флора; у 18 из них проводилось повторное культуральное исследование, которое выявило рост только нормальной флоры полости рта.
Опрос по оценке вкусовых качеств Гексорала в виде спрея показал, что из 68 респондентов (41 ребенок старше 5 лет и 27 взрослых (родители пациентов)) 78% оценили препарат как приятный на вкус, 12,5% – как терпимый и в 9% случаев препарат не понравился на вкус. 24% взрослых имели его в домашней аптечке.
Клинический случай.
Лиза М., 12 лет. Поступила на 3-й день фебрильной лихорадки с жалобами на боль в горле, затруднение носового дыхания.
При поступлении: гиперемия конъюнктив, резкое затруднение носового дыхания за счет увеличения аденоидов, скудное слизисто-гнойное отделяемое в общих носовых ходах, яркая гиперемия задней стенки глотки, небных миндалин, миндалины II степени с плотными белыми налетами, симметричный отек передних небных дужек, боль в горле при глотании (рис. 1). Переднешейные лимфатические узлы увеличены до 3–3,5 см, подвижные, безболезненные, эластической консистенции. Печень +3 см из-под края реберной дуги, селезенка +1,5 см. В общем анализе крови: лейкоциты 17×109/л, нейтрофилы 8,2×109/л. Был заподозрен инфекционный мононуклеоз, подтвержденный высоким (>160 Ед/мл) титром Ig M к вирусу Эпштейна – Барр. Экспресс-тест на стрептококк отрицательный. Посев мазка из горла выявил рост Staphylococcus aureus и Acinetobacter junii.
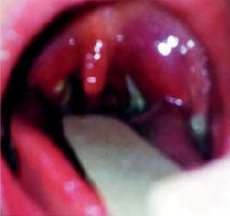
Рисунок 1. Фарингоскопическая картина при поступлении
К назальным деконгестантам и жаропонижающим при высокой лихорадке был добавлен местно Гексорал® в виде спрея дважды в день. Через сутки отмечено уменьшение отека передних небных дужек и размеров миндалин, облегчение глотания (рис. 2). Боль в горле полностью купировалась в начале 2-х суток лечения с прогрессивным улучшением фарингоскопической картины (рис. 3, 4), лихорадка купировалась самостоятельно в начале 6-х суток болезни. В этот же день был выполнен повторный посев мазка из горла, выявивший рост нормальной флоры полости рта.
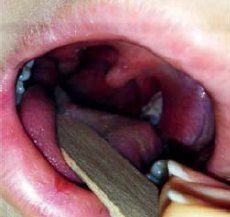
Рисунок 2. 2-й день лечения
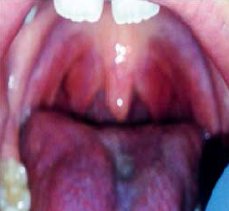
Рисунок 3. 3-й день лечения

Рисунок 4. 4-й день лечения
Таким образом, у ребенка с типичным течением инфекционного мононуклеоза основные жалобы сводились к боли в горле, которая с успехом купировалась на фоне лечения гексэтидином. Фарингоскопическая картина улучшилась раньше, чем купировалась лихорадка.
ОБСУЖДЕНИЕ
Проведенный нами анализ частоты носительства пневмотропной флоры в полости носа еще раз показал отсутствие корреляции ее наличия и бактериальной этиологии процесса, что делает нерациональным культуральное исследование материала из носа и глотки у большинства детей с лихорадкой, учитывая одинаковую частоту высева патогенной флоры у детей с ОРЗ и у детей из контрольной группы. Использовать положительные результаты посева для оправдания термина «вирусно-бактериальная инфекция», как и антибактериального лечения (фактически «лечения анализов») абсолютно неправомерно.
Факт усиленного размножения пневмококков и гемофильной палочки (но не стафилококков) в дыхательных путях при ОРВИ и гриппе известен в литературе. Вероятно, одним из способствующих факторов является большое количество слизи в респираторном тракте, затрудняющей эвакуацию микроорганизмов и служащей для них питательной средой [24]. В случае бронхиолитов, при которых присоединение бактериальной инфекции наблюдается очень редко [25–27], несомненна защитная роль сужения просвета бронхов, препятствующего проникновению пневмококков в легкое. Обилие флоры в носоглотке при ОСО, очевидно, играет роль в развитии микробного воспаления.
Существенно более важным является высокий уровень резистентности пневмококков у носителей. До последнего времени считалось, что в целом уровень устойчивости пневмококков в России невелик (11% к пенициллину и менее 10% к макролидам), хотя в детских коллективах он был намного выше [28]. Однако в последние годы ситуация изменилась, устойчивость пневмококков к пенициллину и макролидам резко возросла [29, 30], о чем говорят и наши данные. При этом назначение антибактериальной терапии до заболевания практически не влияло на частоту выделения из носа пневмотропной флоры.
Эти данные показывают, что нам следует пересмотреть критерии определения групп риска с возможной устойчивостью пневмококков, которых мы придерживались ранее (дети, посещающие ДДУ, получающие антибиотики до заболевания и т. д.). Видимо, сейчас нужно считать возбудителя устойчивым к пенициллинам, макролидам и ко-тримоксазолу у всех детей с пневмококковыми заболеваниями и, соответственно, повысить рекомендуемые начальные дозы амоксициллина и амоксициллин/клавуланата до 80–100 мг/кг/сут, как это практикуется в странах с высоким распространением резистентных штаммов пневмококка [31, 32]. Кроме того, необходимо отказаться от назначения макролидов при респираторных инфекциях, за исключением случаев, вызванных атипичными возбудителями.
Наши данные показали практически полное отсутствие амбулаторных назначений бактериологических исследований для выявления БГСА при ОТ, что приводит к избыточному назначению антибиотиков при этой патологии (9 из 10 больных). С учетом высокой заболеваемости тонзиллитом (8,8% детского населения в год) нетрудно представить себе астрономическую цифру ненужных курсов антибиотиков в масштабах страны [33]. Использование экспресс-теста на участке позволяет избавить до 90% больных ОТ детей от лечения антибиотиками и сэкономить значительные средства [33].
Отказ от антибактериальной терапии вирусных тонзиллитов не снимает задачу оптимизации их лечения, в частности применения местных смягчающих и антисептических средств. Эти средства также полезны и при стрептококковых формах, а также у детей с ОРВИ, сопровождающимися кишечным синдромом, имеющих значительную обсемененность полости рта кишечной и неферментирующей глюкозу флорой. Наш опыт применения препарата гексэтидина у детей старше 3-х лет показал эффективность и обоснованность такого подхода.
ЛИТЕРАТУРА
- Hay AD. The prevalence of symptoms and consultations in pre-school children in the Avon Longitudinal Study of Parents and Children (ALSPAC): A prospective cohort study. Family Practice, 2005, 22(4): 367–374.
- Союз педиатров России, Международный Фонд охраны здоровья матери и ребенка. Научно-практическая программа «Острые респираторные заболевания у детей. Лечение и профилактика». М., 2002 г.
- Canli H, Saatci E, Bozdemir N, Akpinar E, Kiroglu M. The antibiotic prescribing behaviour of physicians for acute tonsillopharyngitis in primary care. Ethiop Med J, 2006, 44(2): 139-43.
- Casey JR, Pichichero ME. Changes in frequency and pathogens causing acute otitis media in 1995–2003. Pediatr Infect Dis J, 2004, 23(9): 824–828.
- Fokkens WJ, Lund VJ, Mullol J. et al., European Position Paper on Nasal Polyps 2012. Rhinology, 2012, 50(23): 1-298.
- Таточенко В.К. Антибиотико- и химиотерапия инфекций у детей, М. ИПК Континент-Пресс, 2008: 256.
- Choi CS(1), Yin CS, Bakar AA, Sakewi Z, Naing NN, Jamal F, Othman N. Nasal carriage of Staphylococcus aureus among healthy adults. J Microbiol Immunol Infect, 2006, 39(6): 458-64.
- Lemon KP, Klepac-Ceraj V, Schiffer HK, Brodie EL, Lynch SV, Kolter R. Comparative analyses of the bacterial microbiota of the human nostril and oropharynx. Mbio, 2010, 22;1(3). Pii: e00129-10. doi: 10.1128/mBio.00129-10.
- Aas JA, Paster BJ, Stokes LN, Olsen I, Dewhirst FE. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol, 2005, 43(11): 5721-32.
- Свистушкин В.М. Эмпирическая антибактериальная терапия при острых воспалительных заболеваниях верхних отделов дыхательных путей. Русский медицинский журнал, 2005, 13(4): 216–219.
- Brook I, Dohar JE. Management of group A beta-haemolytic streptococcal pharyngotonsillitis in children. J Fam Pract, 2006, 55(12): 1–11.
- Cheng CC, Huang LM, Kao CL, Lee PI, Chen JM, Lu CY, Lee CY, Chang SY, Chang LY. Molecular and clinical characteristics of adenoviral infections in Taiwanese children in 2004-2005. Eur J Pediatr, 2008, 167(6): 633-40.
- Таточенко В.К., Бакрадзе М.Д., Дарманян А.С. Острые тонзиллиты в детском возрасте: диагностика и лечение. Фарматека, 2009, 14: 65-69.
- Vranjes Z, Katic V, Vinter-Repalust N, Jurkovic L, et al. Acute infections of the upper respiratory tract-factors that contribute to diagnosis and antibiotic prescription decisions. Acta Med Croatia, 2007, 61(1): 83-90.
- Stanford T Shulman, 1 Alan L. Bisno, and Management of Group A Streptococcal Pharyngitis: 2012 Update by the Infectious Diseases Society of America Clinical Infectious Diseases Advance Access, 2012 – Р 1-17.
- Chiappini E, Principi N, Mansi N et all. Manage ment of acute pharyngitis in children: summary of the Italian National Institute of Health guidelines. Clin Ther, 2012, 34(6): 1442-1458.
- Ernst CP, Canbek K, Dillenburger A, Willershausen B. Clinical study on the effectiveness and side effects of hexetidine and chlorhexidine mouthrinses versus a negative control. Quintessence Int. 2005 Sep. Vol. 36 (8). Р. 641–652.
- Сайдискис Р ДЖ. Заключительный отчет исследования ополаскивателя для полости рта. Кафедра Изучения биологии полости рта и черепно-лицевой области. Стоматологический факультет университета Мэриленд, Балтимор, Мэриленд, 1997. – 22 стр.
- Отчет о научно-исследовательской работе. Изучение противовирусной активности гексэтидина in vitro в отношении ряда вирусов, вызывающих острые респираторные инфекции. ФГБУ «НИИ вирусологии им. Д.И. Иванов ского». М., 2014: 1–35.
- Эйдельштейн И.А., Козлов Р.С., Чагарян А.Н. Чувствительность клинических штаммов Streptococcus pyogenes к антисептическому препарату гексэтидину и антимикробным препаратам для системного применения. Клин микробиол антимикроб химиотер, 2014, 16(3): 212-218.
- Поляков Д.П. Принципы антибактериальной терапии стрептококкового тонзиллофарингита. Вопросы современной педиатрии, 2014, 13(2): 83-88.
- Геппе Н.А., Дронов И.А. Роль местных антимикробных средств в терапии тонзиллофарингита у детей. Доктор.ру. 2012, 9(77): 11–15.
- Gorman SP, McGovern JG, Woolfson AD, Adair CG, Jones David S. The concomitant development of poly(vinyl chloride)-related biofilm and antimicrobial resistance in relation to ventilator-associated pneumonia. Biomaterials, 2001, 22: 2741–2747.
- Катосова Л.К. Клинико-биологическая оценка пневмотропной флоры при острых и хронических бронхолегочных болезнях у детей. Автореф. Дисс. Докт. М., 1990, 47 с.
- Ralston S, Hill V, Waters A. Occult serious bacterial infection in infants younger than 60 to 90 days with bronchiolitis: A systematic review. Arch Pediatr Adolesc Med., 2011, 165(10): 951-956.
- American Academy of Pediatrics. Diagnosis and Management of Bronchiolitis. Pediatrics, 2006, 118 (4): 1774 -1793.
- Карраро С., Занконато С., Баральди Е. Бронхиолит. От эмпиризма до научных доказательств. Лечащий врач, 2011, 6: 24-28.
- Козлов Р.С., Сивая О.В., Кречикова О.И. с соавт. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. (Результаты многоцентрового проспективного исследования ПеГАС). Клин. микробиол. антимикроб. химиотер., 2010, 12(4): 1-13.
- Сидоренко С.В., Грудинина С.А., Филимонова О.Ю. Резистентность к макролидам и линкозамидам среди Streptococcus pneumoniae и Streptococcus pyogenes в Российской Федерации. Клиническая фармакология и терапия, 2008, 17(2): 1-4.
- Mayanskiy N, Alyabieva O, Ponomarenko A, Lazareva L, Katosova A, Ivanenko T, Kulichenko L, Namazova-Baranova A. Baranov. Serotypes and antibiotic resistance of noninvasive Streptococcus pneumoniae circulating in pediatric hospitals in Moscow, Russia. International Journal of Infectious Diseases, 2014, 20: 58–62.
- World Health Organization. Porcket book of hospital care for children. Guidelines for management of common childhood illnesses. 2nd edn. Geneva: WHO. 2013. p 438.
- Bradley JS, Byington CL, Shah SS, Alverson B, Carter ER, Harrison C, Kaplan SL, Mace SE, McCracken GH Jr, Moore MR, St Peter SD, Stockwell JA, Swanson JT. Executive summary: the management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis., 2011 53(7): 617-30.
- Черкасова Е.Н. Оптимизация диагностики и лечения острого тонзиллита у детей в амбулаторных условиях. Дисс. канд. мед. наук. 2015, 104 с.
А.С. ПОЛЯКОВА, к.м.н., В.К. ТАТОЧЕНКО, д.м.н., профессор, Научный центр здоровья детей, Москва
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
