- Головна
- /
- Статті
- /
- Отоларингологія
- /
- Отчет о результатах изучения роли, этиологии и устойчивости к антимикробным препаратам, включая гексеэтидин, клинических штаммов Streptococcus pyogenes
Отчет о результатах изучения роли, этиологии и устойчивости к антимикробным препаратам, включая гексеэтидин, клинических штаммов Streptococcus pyogenes
Streptococcus pyogenes (стрептококки группы А) является наиболее распространенной причиной бактериального фарингита.
1 Сокращения и принятые обозначения
БГСА – β-гемолитический стрептококк серогруппы А
МПК – минимальная подавляющая концентрация – минимальная концентрация антимикробного препарата, подавляющая видимый рост микроорганизма
МПК50 – минимальная подавляющая концентрация антимикробного препарата для 50% исследованных штаммов
МПК90 – минимальная подавляющая концентрация антимикробного препарата для 90% исследованных штаммов
Р – «резистентный» микроорганизм – лечение инфекций, вызванной данным микроорганизмом, соответствующим антимикробным препаратом, даже при использовании доз, превышающих стандартные терапевтические дозы, будет неэффективным
У/Р – «умеренно резистентный» микроорганизм – лечение инфекции, вызванной данным микроорганизмом, соответствующим антимикробным препаратом может быть эффективным либо при использовании доз, превышающих стандартные терапевтические дозы, либо при локализации инфекции в локусах, где возможно достижение высоких концентраций антибиотика в силу его фармакокинетических особенностей
Ч – «чувствительный» микроорганизм – лечение инфекции, вызванной данным микроорганизмом, соответствующим антимикробным препаратом в стандартных терапевтических дозах, скорее всего, будет эффективным
АТСС (American Type Culture Collection) – Американская коллекция типовых культур микроорганизмов
КОЕ- колониеобразующие единицы
Time-killing curve method – метод построения и оценки временной кривой гибели микроорганизмов in vitro
Dorset Egg Medium – среда для транспортировки Streptococcus spp.
CLSI/NCCLS (Clinical and Laboratory Standards Institute/National Committee for Clinical Laboratory Standards) – Институт клинических и лабораторных стандартов/Национальный комитет по клиническим лабораторным стандартам (США)
2 Введение
Streptococcus pyogenes (стрептококки группы А) является наиболее распространенной причиной бактериального фарингита. Пенициллин считается препаратом выбора для лечения фарингита и других неинвазивных стрептококковых инфекций, а макролиды рекомендуются в качестве альтернативных средств, при наличии аллергических реакций у пациента на β–лактамные препараты. Несмотря на хорошую чувствительность S.pyogenes к пенициллину и макролидным антибиотикам, есть сообщения о росте популяции нечувствительных микроорганизмов к этим препаратам в различных странах [1,4]. Для санирования горла при бактериальных фарингитах в качестве антисептического аэрозоля используется гексорал (активное вещество Hexetidine), противомикробное действие которого связано с подавлением окислительных реакций метаболизма микроорганизмов. Препарат обладает широким спектром антибактериального и противогрибкового действия, а также оказывает слабое анестезирующее действие на слизистую оболочку.
Для оценки активности антимикробных препаратов, в соответствии с рекомендациями CLSA, применяется два методологических подхода: определение минимальных подавляющих концентраций (МПК) и анализ временной кривой гибели бактерий [3]. Данные МПК используются в качестве опорных значений для описания активности антибактериальных препаратов в отношении определенного вида микроорганизма in vitro. Однако, метод построения и оценки временной кривой гибели микроорганизмов in vitro позволяет более точно проанализировать количество активно размножающихся бактерий в определенные промежутки воздействия ингибирующего вещества, а также используется для выявления антагонизма или синергизма между двумя (или более) антимикробными препаратами и определения степени толерантности.
Целью настоящего исследования было исследование активности антимикробных препаратов в отношении S.pyogenes, выделенных у пациентов с инфекциями различной локализации, и характеристика антимикробного действия гексэтидина на основании анализа временных кривых роста-отмирания микроорганизмов.
3 Цель исследования
- Собрать репрезентативную коллекцию клинических штаммов S.pyogenes (БГСА – β-гемолитический стрептококк серогруппы А) из различных регионов России.
- Исследовать in vitro активность гексэтидина и антимикробных препаратов, использующихся для системной терапии стрептококковых инфекций, в отношении Streptococcus pyogenes.
- Оценить активность гексэтидина используя анализ временной кривой гибели бактерий in vitro.
4 Общий дизайн исследования
Данная работа явилась проспективным многоцентровым микробиологическим исследованием, включающим 12 центров в 10 городах Центрального, Южного, Приволжского, Уральского, Сибирского и Дальневосточного федеральных округов России в ходе которого изучалась устойчивость S. pyogenes к антимикробным препаратам и гексэтидину.
В исследование включались пациенты с клинически и лабораторно подтвержденной инфекцией. Идентификацию БГСА в локальных лабораториях проводили с помощью рутинных методов, принятых в каждой лаборатории. Все собранные микроорганизмы доставлялись в центральную лабораторию НИИАХ, где проводилась реидентификация 100% штаммов и определение чувствительности методом разведений в бульоне. Параллельно с оценкой МПК гексэтидина, in vitro проводилось изучение временной кривой гибели (Time-kill method) S. pyogenes для оценки антибактериальной активности препарата.
5 Материалы и методы
5.1 Центры-участники
В исследование включены клинические штаммы S. pyogenes, выделенные в 12 центрах (рис.1) Центрального (Москва, Смоленск, Ярославль, Калуга), Южного (Краснодар), Приволжского (Пермь), Уральского (Екатеринбург – 3 центра), Сибирского (Иркутск, Томск) и Дальневосточного (Хабаровск) Федеральных округов России.
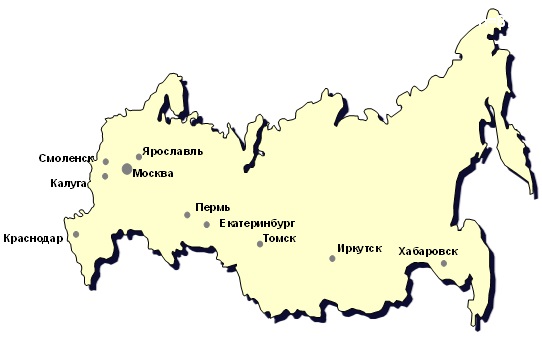
Рис. 1. Центры-участники исследования
5.2 Отбор клинических штаммов
В каждом центре проводился отбор последовательных клинически значимых штаммов S. pyogenes, выделенных от пациентов с инфекциями различной локализации.
5.3 Выделение, идентификация, транспортировка и хранение штаммов
Центры-участники были обеспечены питательными средами (колумбийский агар [bioMerieux, Франция]), дисками с бацитрацином 0,04 ЕД [bioMerieux, Франция] для предварительной идентификации S. pyogenes, а также модифицированной средой Dorset Egg Medium [НИИАХ, Смоленск] для пересылки штаммов в центральную микробиологическую лабораторию НИИАХ.
В центральной лаборатории для субкультивирования микроорганизмов использовали колумбийский агар [bioMerieux, Франция] c добавлением 5% дефибринированной лошадиной крови. Инкубация проводилась в атмосфере с повышенным содержанием СО2 (5%) при температуре +35°С в течение 24 ч. Реидентификация S. pyogenes осуществлялась на основе морфологии колоний на кровяном агаре, наличия β-гемолиза, отрицательной каталазной реакции, чувствительности к бацитрацину 0,04 ЕД, и положительных результатов латекс-агглютинации с использованием набора «Slidex Strepto-Kit» [bioMerieux, Франция].
После реидентификации штаммы хранили в криопробирках, содержащих триптиказо-соевый бульон [bioMerieux, Франция] с добавлением 30% стерильного глицерина [Sigma, США] при температуре -70°С, до момента тестирования.
5.4 Определение чувствительности
В соответствии с рекомендациями CLSI/NCCLS [2] исследование чувствительности S. pyogenes с определением МПК проводили методом микроразведения в катион-сбалансированном бульоне Мюллера-Хинтон (BBL, США) с добавлением лизированной лошадиной крови (итоговая концентрация 5%).
Для приготовления бактериальной суспензии чистую суточную культуру микроорганизмов разводили в стерильном 0,9% растворе хлорида натрия до мутности, эквивалентной 0,5 по стандарту МакФарланда [DEN-1 McFarland Densitometr, BIOSAN, Латвия].
Полученную взвесь S. pyogenes в стандартной концентрации кое/мл с помощью многоканальной пипетки вносили в лунки микротитровальных планшетов, которые инкубировались при температуре 35°С в течение 20-24 ч в обычной атмосфере.
В ходе исследования определялась чувствительность S. pyogenes к 9 антимикробным препаратам: пенициллину, эритромицину, клиндамицину, левофлоксацину, тетрациклину, хлорамфениколу, ко-тримоксазолу, ванкомицину и гексэтидину.
При тестировании использовали двойные серийные разведения химически чистых субстанций антибиотиков: пенициллин (Sigma, Германия), эритромицин (Polfa, Польша), клиндамицин (Pfizer, США), левофлоксацин (Fluka, Германия), тетрациклин (Sigma, Германия), хлорамфеникол (Fluka, Германия), ко-тримоксазол (Sigma, Германия), ванкомицин (Eli Lilly, США), гексэтидин (SIGMA-ALDRICH, Германия).
Для тестирования гексэтидина из общей выборки S. pyogenes были отобраны штаммы, изолированные из назофарингеального материала пациентов, что составило 274 культуры.
Критерии интерпретации результатов представлены в табл. 1. Категория «нечувствительный» объединяла штаммы, обладавшие умеренным и высоким уровнем резистентности.
5.5 Контроль качества
Контроль качества тестирования с использованием референтных штаммов S. pneumoniae ATCC®49619 и S.pyogenes ATCC®19615, при каждой постановке чувствительности проводили в соответствии со стандартами CLSI (2010 г.). Допустимые значения МПК для S. pneumoniae представлены в табл. 1.
|
Антибиотик |
S. pyogenes |
S.pneumoniae |
||
|---|---|---|---|---|
|
Ч |
У/Р |
Р |
||
|
Пенициллин |
≤ 0,12 |
- |
- |
0,25-1 |
|
Эритромицин |
≤ 0,25 |
0,5 |
≥ 1 |
0,03-0,12 |
|
Клиндамицин |
≤ 0,25 |
0,5 |
≥ 1 |
0,03-0,12 |
|
Тетрациклин |
≤ 2 |
4 |
≥ 8 |
0,12-0,5 |
|
Левофлоксацин |
≤ 2 |
4 |
≥ 8 |
0,5-2 |
|
Хлорамфеникол |
≤ 4 |
8 |
≥ 16 |
2-8 |
|
Триметоприм/сульфаметоксазол |
≤ 2 |
4-8 |
> 8 |
0,12/2,4-1/19 |
|
Ванкомицин |
≤ 1 |
– |
– |
0,12-0,5 |
5.6 Анализ временной кривой гибели микроорганизмов
Антимикробная активность гексэтидина была исследована с помощью анализа временной кривой гибели микроорганизмов с использованием метода микроразведений в бульоне в соответствии с рекомендациями CLSI/NCCLS [3]. В исследование были включены S.pyogenes с МПК гексэтидина равной 4 мг/л и 16 мг/л. Для выполнения процедуры была выбрана конечная концентрация гексэтидина соответствующая 1х, 2х и 4х кратному увеличению МПК для каждого исследуемого штамма S.pyogenes. В каждый флакон, содержащий 5 ml MHB, 5% дефибринированной лошадиной крови от общего объема и гексэтидин в необходимой концентрации, был внесен тестируемый микроорганизм, находящийся в логарифмической фазе роста. Итоговая концентрация микробных клеток во флаконе составила 5 × 105 КОЕ/мл. Флаконы инкубировались при +35°С в обычной атмосфере. Отобранные аликвоты суспензии (50 мкл) были инокулированы на чашки, содержащие колумбийский агар [bioMerieux, Франция] c добавлением 5% дефибринированной лошадиной крови, с использованием Automated Spiral Plater (Spiral Biotech), через 0, 2, 4, 6, 8, 10 и 24 часа.
Все исследования проводили в повторах для исследованных штаммов, а в качестве отрицательного контроля использовали флаконы без гексэтидина. Инкубирование чашек проводилось в атмосфере с повышенным содержанием СО2 (5%) при температуре +35°С. Подсчет растущих колоний осуществляли с использованием формул и таблиц расчета пакета SpiralBiotech QCountTM в соответствующих разведениях. Антимикробная активность препарата была интерпретирована как бактерицидная, если погибало 99,9% (≥3 log10) микроорганизмов от общего количества КОЕ/ml, содержащихся во внесенном инокулюме в нулевой точке. Бактериостатическая активность определялась как гибель менее чем 99,9% (<3 log10) микроорганизмов от общего количества КОЕ/ml, внесенных во флакон для культивирования.
5.7 Методы обработки данных и статистического анализа
Ввод данных, статистическая обработка и анализ полученных результатов производился с использованием программного обеспечения компьютерных программ Microsoft® Office Excel 2010, SAS версия 6.12 (SAS Institute, США) и M-Lab (НИИАХ, Смоленск).
6 Результаты
6.1 Распределение штаммов по центрам
В исследование включено 589 клинических штаммов S. pyogenes. Количество штаммов S. pyogenes, полученных в каждом из 12 центров исследования представлено на рис. 2.
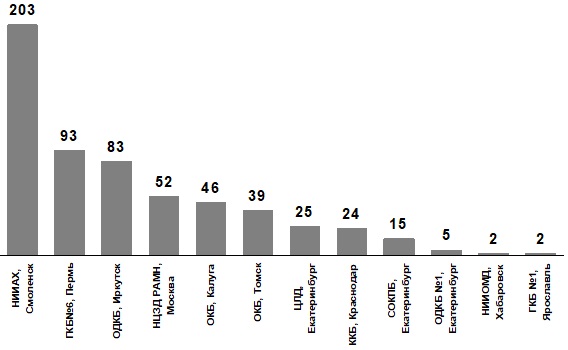
Рис. 2. Распределение штаммов S. pyogenes по центрам
6.2 Резистентность штаммов S. pyogenes
Обобщенные результаты определения чувствительности S. pyogenes представлены в табл. 2.
|
Антибиотик |
Ч, |
У/Р, |
Р, |
МПК50, |
МПК90, |
Диапазон МПК, мг/л |
|
Пенициллин |
100 |
0 |
0 |
0,03 |
0,03 |
0,03-0,125 |
|
Эритромицин |
97 |
0,3 |
2,7 |
0,03 |
0,06 |
0,03-2 |
|
Клиндамицин |
99,3 |
0 |
0,7 |
0,03 |
0,03 |
0,03-2 |
|
Тетрациклин |
60,1 |
1,7 |
38,2 |
0,125 |
32 |
0,125-64 |
|
Левофлоксацин |
100 |
0 |
0 |
0,5 |
1 |
0,015-2 |
|
Хлорамфеникол |
87,3 |
0,3 |
12,4 |
2 |
32 |
0,06-64 |
|
Триметоприм/ сульфаметоксазол |
100 |
0 |
0 |
0,125 |
0,25 |
0,03-1 |
|
Ванкомицин |
100 |
0 |
0 |
0,5 |
0,5 |
0,03-1 |
|
Гексэтидин |
- |
- |
- |
8 |
16 |
0,03-64 |
Кроме необходимости учета данных по чувствительности, важная роль в прогнозировании ситуации с резистентностью принадлежит распределению штаммов по значениям МПК.
β-Лактамы
S. pyogenes сохраняет высокую чувствительность к пенициллинам. Чувствительными к пенициллину были 100% штаммов БГСА. Значения МПК50 и МПК90 S. pyogenes, составили 0,03 мг/л (рис.3).
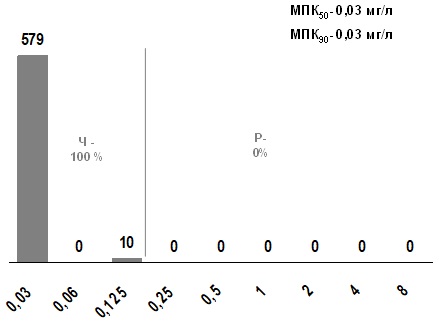
Рис. 3. Распределение МПК пенициллина для S. pyogenes
Макролиды и линкозамиды
Распределение S. pyogenes по значениям МПК к эритромицину представлено на рис. 4.
Следует отметить, что в целом представители этой группы обладают высокой in vitro активностью: общая частота нечувствительных штаммов не превышает 10,5%. Уровни нечувствительности к эритромицину 3%, МПК90 эритромицина составляет 0,06 мг/л.
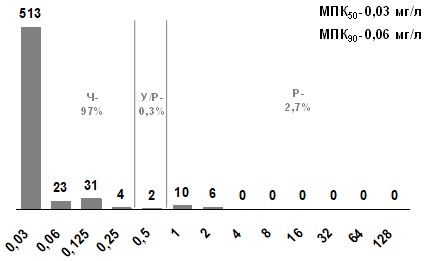
Рис. 4. Распределение МПК эритромицина для S. pyogenes
Уровень нечувствительности к клиндамицину составляет 0,7%, а МПК90 клиндамицина 0,03 мг/л. Учитывая незначительный уровень резистентности к клиндамицину, можно предположить, что это обусловлено циркуляцией штаммов, имеющих ген mefA (М-фенотип), который отвечает за активный выброс из микробной клетки 14-членных макролидов (эритромицин и кларитромицин), но не обеспечивает резистентность к 16-членным макролидам.
Распределение штаммов по значениям МПК клиндамицина представлено на рис. 5.
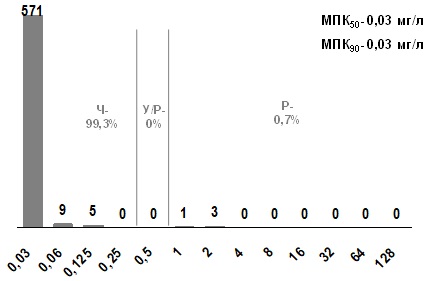
Рис. 5. Распределение МПК клиндамицина для S. pyogenes
Фторхинолоны
Левофлоксацин характеризовался высоким уровнем активности в отношении исследованных штаммов S. pyogenes (рис. 6) МПК90 левофлоксацина 1 мг/л.
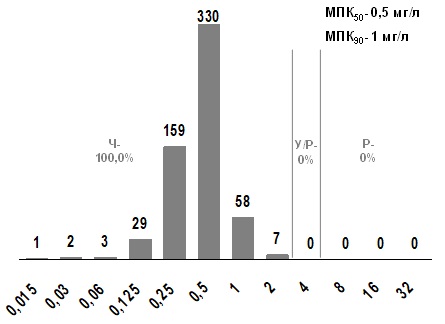
Рис. 6. Распределение МПК левофлоксацина для S. pyogenes
Тетрациклины
К тетрациклину нечувствительны были 39,9% исследованных изолятов S. pyogenes (рис. 7). В чувствительной субпопуляции 322 штамма имеют МПК ≤0,125 мг/л, соответствующее значению, наблюдаемому у «диких» изолятов. Нечувствительные штаммы представлены двумя субпопуляциями: с низким (1,7%) и высоким (38,2%) уровнями резистентности с МПК, соответственно, 4 и ≥8 мг/л. Преобладание чувствительных штаммов подтверждается значением МПК50 (0,125 мг/л). В то же время, МПК90 (32 мг/л) находится в диапазоне высокой резистентности. Резистентность к тетрациклину среди эритромицинорезистентных штаммов БГСА была значительно выше (94,4% - 17 из 18 штаммов), чем среди эритромициночувствительных штаммов (36,4% - 208 из 571 штамма).
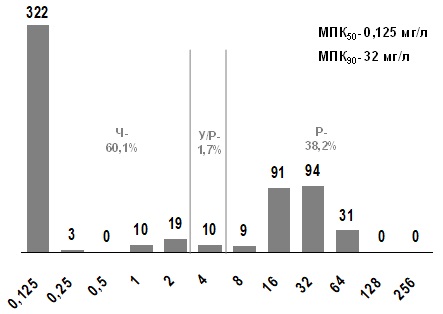
Рис. 7. Распределение МПК тетрациклина для S. pyogenes
Триметоприм/сульфаметоксазол
Триметоприм/сульфаметоксазол характеризовался высокой активностью в отношении тестированных штаммов БГСА (100%). МПК50 и МПК90 составили соответственно 0,125 мг/л и 0,25 мг/л и находятся в диапазоне высокой чувствительности (рис. 8).
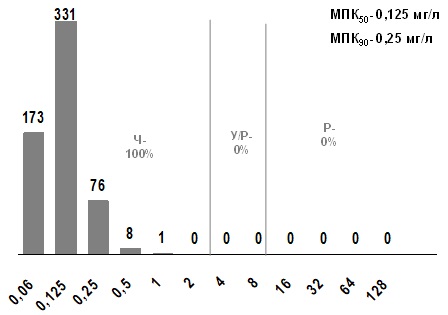
Рис. 8. Распределение МПК триметоприма/сульфаметоксазола для S. pyogenes
Хлорамфеникол
К хлорамфениколу нечувствительны 12,7% изолятов (рис. 9). МПК50 составляет 2 мг/л и находятся в диапазоне чувствительности. В то же время, МПК90 (32 мг/л) находится в диапазоне высокой резистентности.
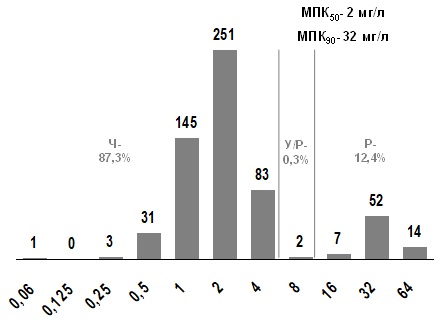
Рис. 9. Распределение МПК хлорамфеникола для S. pyogenes
Гликопептиды
Ванкомицин проявляют 100% активность в отношении всех исследованных штаммов. МПК90 составляют, соответственно, 0,5 и 1 мг/л (рис. 10).
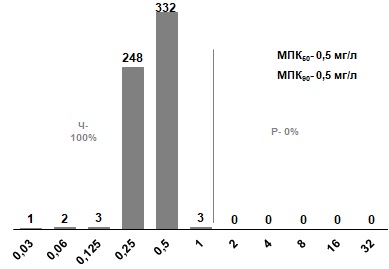
Рис. 10. Распределение МПК ванкомицина для S. pyogenes
Гексэтидин
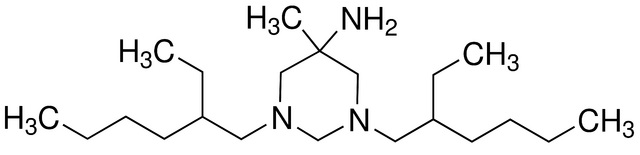
Химическое название субстанции 1,3-бис(2-Этилгексил)гексагидро-5-метил-5-пиримидинамин.
Hexetidine, mixture of stereoisomers
В исследование было включено 274 штамма S. pyogenes, выделенные из ротоглотки. Штаммы, выделенные из других источников или видов клинического материала, в исследование не включались. Поскольку на настоящий момент не существует критериев интерпретации для препарата, оценивались показатели МПК50 и МПК90, которые составили 8 мг/л и 16 мг/л соответственно (рис.11).
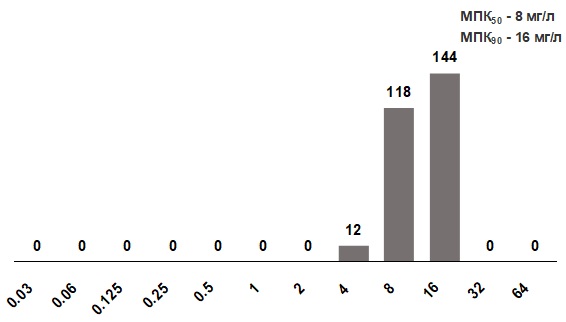
Рис. 11. Распределение МПК гексэтидина для S. pyogenes
Для оценки активности гексэтидина в отношении S. pyogenes (МПК=4 мг/л) и S. pyogenes (МПК=16 мг/л) были построены временные кривые роста-отмирания (рис.12).
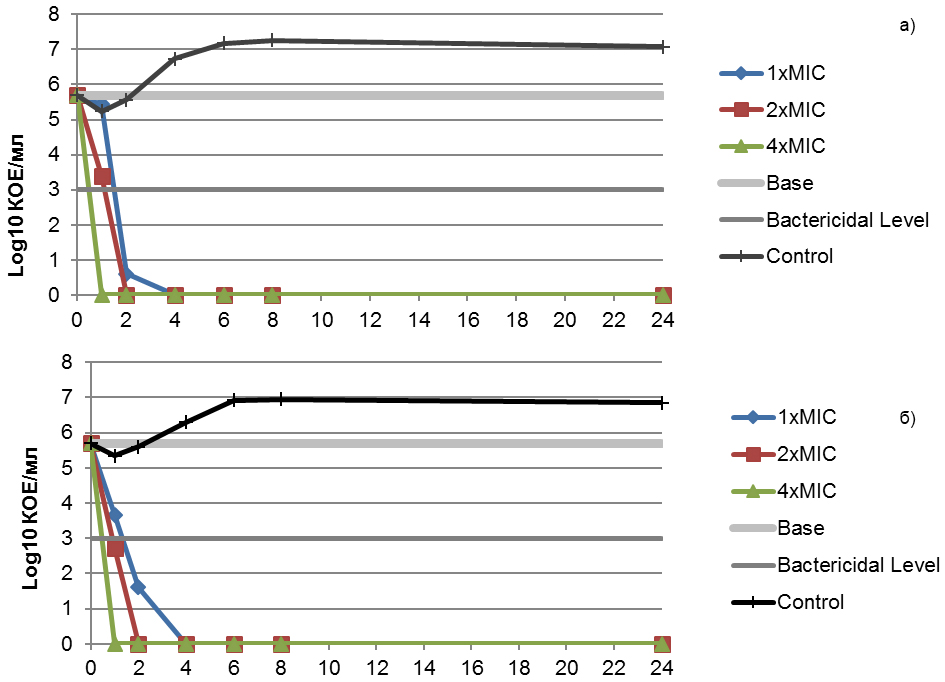
Рис. 12. Кривые роста-отмирания S. pyogenes (МПК=4 мг/л) (а) и S. pyogenes (МПК=16 мг/л) (б) для гексэтидина.
Гексэтидин демонстрирует бактерицидную активность как в отношении S. pyogenes с низким значением МПК (4 мг/л), так и с высоким значением МПК (16 мг/л), через 24 часа инкубирования. Снижение более чем на 3 log10 видимого роста микроорганизмов наблюдается через 4 часа культивирования для всех выбранных концентраций гексэтидина.
Время гибели S.pyogenes дополнительно оценивалось для нескольких концентраций гексэтидина входящих в состав различных лекарственных форм. Данные анализа для двух штаммов S.pyogenes представлены в табл. 3.
|
Концентрация |
0,2 % |
0,1 % |
0,05 % |
МПК, |
|---|---|---|---|---|
|
Время гибели, час |
2 часа |
2 часа |
4 часа |
4 |
|
Время гибели, час |
4 часа |
- |
- |
16 |
7 Выводы
- В настоящее время β-лактамные антибиотики (пенициллины) сохраняют 100% in vitro активность в отношении S. pyogenes, и могут быть рекомендованы для эмпирической и этиотропной терапии инфекций, вызванных БГСА, в качестве препаратов выбора.
- Резистентность к макролидам и линкозамидам находится на низком уровне ( 0,7%-10,5%), вследствие чего, их можно рассматривать в качестве альтернативы β-лактамам.
- Штаммов, резистентных к «респираторным фторхинолонам» (левофлоксацин) выявлено не было, что позволяет рассматривать эти препараты как возможную альтернативу β-лактамам и макролидам при терапии осложненных и неосложненных инфекций кожи и мягких тканей, вызванных БГСА.
- Ванкомицин и триметоприм-сульфаметоксазол демонстрируют 100% активность в отношении тестированных штаммов S. pyogenes.
- Наименьшей активностью среди всех исследованных препаратов обладают тетрациклин и хлорамфеникол, нечувствительными к которым являются, соответственно, 39,9% и 12,7% штаммов, что в сочетании с их фармакодинамическими характеристиками свидетельствует о невозможности использования этих антибиотиков в качестве потенциальных препаратов эмпирической терапии инфекций, вызванных БГСА, в Российской Федерации в настоящее время.
- Гескэтидин демонстрирует бактерицидную активность в отношении S. pyogenes с высоким значением МПК (16 мг/л) и низким значением МПК (4 мг/л).
Мониторинг антибиотикорезистентности S. pyogenes позволяет оценить состояние антимикробной резистентности и прогнозировать её дальнейшее развитие. Полученные данные также являются объективной основой для создания и обновления национальных руководств по терапии инфекций, вызванных БГСА.
8 Список литературы
- Megged O, Assous M. (2013). Inducible clindamycin resistance in β-hemolytic streptococci and Streptococcus pneumoniae. Isr Med Assoc J. 15(1):27-30
- National Committee for Clinical Laboratory Standards. (2000). Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically—Fifth Edition Approved Standard M7-A5 NCCLS, Wayne, PA.
- NCCLS. (1999). National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing (6th ed.). Methods for Determining Bactericidal Activity of Antimicrobial Agents. Approved Standards. M26-A.
- Wajima T, Morozumi M, Chiba N. (2013). Associations of macrolide and fluoroquinolone resistance with molecular typing in Streptococcus pyogenes from invasive infections, 2010-2012. Int J Antimicrob Agents. 42(5):447-9.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
