- Головна
- /
- Статті
- /
- Отоларингологія
- /
- Роль местных антимикробных средств в терапии тонзиллофарингита у детей
Роль местных антимикробных средств в терапии тонзиллофарингита у детей

Цель работы — на основании обзора современной научной литературы оценить роль местных антимикробных средств в терапии тонзиллофарингита у детей.
Основные положения. Воспаление глотки и/или нёбных миндалин (тонзиллофарингит) — одна из основных причин обращения за медицинской помощью. Заболевание имеет разнообразную этиологию (вирусы, бактерии, грибы, их ассоциации). Обязательная системная антибактериальная терапия требуется только при стрептококковом тонзиллофарингите, поэтому необходима верификация данной этиологии. При иной этиологии заболевания и в случаях ассоциации возбудителей в качестве антимикробной терапии целесообразно использовать местные средства, одним из которых является гексэтидин. Препарат обладает активностью в отношении бактерий и грибов (в том числе в форме биопленок), ряда вирусов; его эффективность и безопасность установлены в ходе нескольких клинических исследований.Заключение. Данные научной литературы свидетельствуют об эффективности и безопасности гексэтидина для местной терапии тонзиллофарингита, в том числе у детей.
Ключевые слова: дети, тонзиллофарингит, местные антисептики, гексэтидин.
Среди причин обращения за медицинской помощью боль в горле занимает второе место по частоте (после кашля). Данный симптом может иметь разное происхождение, но в подавляющем большинстве случаев оказывается проявлением тонзиллофарингита — воспаления глотки и/или нёбных миндалин. При этом чаще всего острый тонзиллофарингит является синдромом ОРВИ [9, 12, 17, 24, 34].
Современные принципы лечения данного заболевания включают два основных направления — этиотропную и симптоматическую терапию. Однако среди микробных агентов, играющих важную роль в этиологической структуре острого тонзиллофарингита, единственным, при выявлении которого требуется обязательное назначение системной антибактериальной терапии, является β-гемолитический стрептококк группы А (БГСА). Это связано с высокой частотой развития ранних гнойных или поздних негнойных осложнений стрептококковой инфекции (острой ревматической лихорадки, постстрептококкового гломерулонефрита). Результаты масштабных эпидемиологических исследований показывают, что в 15–36% случаев острого тонзиллофарингита у детей и в 5–17% у взрослых этиологическим фактором заболевания является БГСА. В то же время как зарубежные, так и российские фармакоэпидемиологические исследования свидетельствуют о том, что 70–95% пациентов, обратившихся к врачу с болью в горле, получают системные антибиотики [3, 12, 24]. Таким образом, назначение системной антибактериальной терапии при остром тонзиллофарингите в большинстве случаев необоснованно. Более того, в нашей стране боль в горле часто рассматривается пациентами как основание для использования антибактериальных средств без назначения врача [1].
Цель работы — на основании обзора современной научной литературы оценить роль местных антимикробных средств в терапии тонзиллофарингита у детей.
Принципы верификации этиологии тонзиллофарингита
Рациональное применение антибактериальной терапии требует лабораторного выявления БГСА у пациентов с острым тонзиллофарингитом, поскольку на основании клинических данных однозначно судить об этиологии заболевания не представляется возможным [8, 17]. Для диагностики стрептококковой инфекции в настоящее время используются классическое бактериологическое исследование и экспресс-тесты на БГСА. Достоинство первого метода заключается в возможности не только выявить различных возбудителей (бактерии, грибы), но и определить их чувствительность к антибактериальным средствам. Однако данное исследование выполняется только в специализированных лабораториях, куда с соблюдением ряда условий должен быть доставлен материал. При этом для проведения анализа требуется несколько дней [5, 8].
В последние годы для выявления БГСА особое значение приобретают экспресс-тесты, позволяющие при осмотре больного подтвердить логику врача в течение нескольких минут. Благодаря их использованию становится возможным очень быстро верифицировать стрептококковую этиологию тонзиллофарингита и своевременно назначить антибактериальную терапию, а также отказаться от ее необоснованного применения в случае иной этиологии процесса. Внедрение подобных тестов на БГСА в ряде зарубежных стран привело к существенному снижению частоты необоснованного назначения системной антибактериальной терапии при боли в горле [21, 28]. Однако многие методики экспресс-диагностики обладают невысокой диагностической точностью [5, 8].
В настоящее время в России зарегистрирована диагностическая система «Стрептатест», основанная на иммунохроматографическом выявлении специфического антигена, которая приближена к бактериологическому методу по чувствительности и специфичности в отношении БГСА. Данная система компактна, но при этом включает в себя все необходимое для проведения исследования [5].
Принципы этиотропной терапии тонзиллофарингита
Препаратами выбора при лечении стрептококкового тонзиллофарингита являются природные пенициллины и полусинтетические аминопенициллины, поскольку они сохраняют активность в отношении БГСА в 100% случаев. Однако начиная с 80-х годов прошлого столетия отмечается нарастающая частота клинической и микробиологической неэффективности пенициллина при заболевании данной этиологии: в некоторых исследованиях частота эрадикации БГСА составляла менее 75%. В качестве основной причины несоответствия чувствительности БГСА к антибиотикам in vitro и эффективности препаратов in vivo было установлено наличие в ротоглотке у пациентов различных копатогенных бактерий, продуцирующих β-лактамазы, которые ферментируют природные пенициллины и полусинтетические аминопенициллины [15, 22, 27]. Особенно часто указанная ситуация наблюдается у пациентов с рецидивирующим острым тонзиллофарингитом. В качестве метода преодоления данной проблемы предлагается использование при стрептококковом тонзиллофарингите антибиотиков, устойчивых к β-лактамазам [27]. Возможно также совместное применение системного антибиотика и местного антимикробного препарата. В этом случае отмечается синергизм системного и местного этиотропного средств как за счет повышения активности против БГСА, так и за счет устранения действия копатогенной флоры [18, 20].
Помимо БГСА возбудителями острого тонзиллофарингита могут быть и некоторые другие бактерии (β-гемолитические стрептококки групп C и G, анаэробы, Chlamydia pneumoniae, Mycoplasma pneumoniae и др.), а также грибы (в подавляющем большинстве случаев рода Candida). Весьма часто при остром вирусном тонзиллофарингите происходит активация условно патогенной бактериальной микрофлоры ротоглотки, в результате чего этиологическим фактором становятся вирусно-бактериальные ассоциации. Учитывая прогрессирующий повсеместный рост резистентности бактериальных возбудителей к антибиотикам в результате их широкого применения, при нетяжелых бактериальных (кроме вызванных БГСА), вирусно-бактериальных и грибковых тонзиллофарингитах рекомендуется отказаться от системной антибактериальной терапии в пользу местных антимикробных препаратов [4, 17].
При хроническом тонзиллофарингите определенную этиологическую роль также играет БГСА, однако существенно возрастает значение и других бактериальных возбудителей — Staphylococcus aureus, Haemophilus influenzae, различных анаэробных бактерий. Большинство указанных бактерий продуцируют β-лактамазы и обладают иными механизмами устойчивости к антибактериальным препаратам [14, 32]. При обострении хронического тонзиллита без выраженного нарушения общего состояния в качестве этиотропной терапии рекомендуется применение местных антимикробных препаратов [4].
Исследования последних лет свидетельствуют о том, что в патогенезе инфекционно-воспалительных процессов важнейшую роль играет формирование биопленок — бактериальных и грибковых сообществ, в которых бактерии погружены в образуемый ими полимерный матрикс. Микроорганизмы в составе биопленок устойчивы к воздействию иммунологических защитных механизмов организма и многих антибактериальных препаратов. В настоящее время получены данные, что образование бактериальных биопленок в миндалинах является одной из основных причин хронизации тонзиллофарингита [16]. В ряде исследований показано, что биопленки выявляются на поверхности миндалин у большинства детей с хроническим тонзиллофарингитом [11, 19]. Для их лечения при лор-инфекциях применяются механическое воздействие, а также поверхностно-активные вещества, в частности ряд антисептиков [29].
Таким образом, местные антимикробные средства играют важную роль в этиотропной терапии как острого, так и хронического тонзиллофарингита. Основные представители этой группы лекарственных средств, применяемые при данном заболевании, представлены в таблице. Одним из перспективных препаратов среди них является гексэтидин (Гексорал).
| Антисептик | Спектр активности | Форма выпуска | Возрастные ограничения | Примечания |
|---|---|---|---|---|
| Амбазон (Фарингосепт) | Грамположительные и грамотрицательные бактерии | Таблетки для рассасывания | Применяется с трех лет | |
| Амилметакреазол + дихлорбензиловый спирт (Стрепсилс и др.) | Грамположительные и грамотрицательные бактерии, грибы | Таблетки для рассасывания | Применяется с пяти лет | Существуют формы в комбинации с аскорбиновой кислотой, левоментолом или лидокаином |
| Бензалкония хлорид (Септолете и др.) | Грамположительные бактерии, грибы рода Candida, некоторые липофильные вирусы | Пастилки, таблетки для рассасывания | Применяется с четырех лет | Существует форма в комбинации с маслом листьев мяты перечной, тимолом, маслом эвкалипта, левоментолом |
| Гексэтидин (Гексорал и др.) | Грамположительные и грамотрицательные бактерии, грибы | Раствор, аэрозоль | Применяется с трех лет | Хорошо адгезируется на слизистой оболочке |
| Деквалиния хлорид (Ларипронт и др.) | Грамположительные и грамотрицательные бактерии, грибы | Таблетки для рассасывания | Не установлены | Существует форма в комбинации с лизоцимом |
| Бензилдиметил-миристоиламино-пропиламмоний (Мирамистин и др.) | Грамположительные и грамотрицательные бактерии, грибы, вирусы | Раствор | Не установлены | |
| Октенидин + феноксиэтанол (Октенисепт) | Грамположительные и грамотрицательные бактерии, грибы, липофильные вирусы | Раствор | Применяется с восьми лет | |
| Повидон-йод (Йокс и др.) | Грамположительные и грамотрицательные бактерии, грибы, вирусы, простейшие | Раствор, спрей | Применяется с шести лет | Существует форма в комбинации с аллантоином |
| Хлоргексидин (Себидин и др.) | Грамположительные и грамотрицательные бактерии, грибы, вирусы | Раствор, спрей, таблетки и пастилки для рассасывания | Детский возраст — с осторожностью | Существуют формы в комбинации с аскорбиновой кислотой, лидокаином, тетракаином |
Антисептические свойства гексэтидина
Гексэтидин — антисептик с широким антибактериальными противогрибковым действием, в том числе в отношении микробных биопленок. Кроме того, он обладает местным анальгетическим эффектом, что дает возможность рассматривать его при тонзиллофарингите как средство не только этиотропной, но и симптоматической терапии. Важная особенность данного препарата — высокий профиль безопасности. Выраженная активность гексэтидина в отношении различных бактерий и грибов была установлена в ряде исследований как in vitro, так и in vivo [23]. Кроме этого, имеются экспериментальные данные о том, что он обладает противовирусной активностью [30].
В рандомизированном, двойном слепом перекрестном исследовании у 10 здоровых добровольцев было показано, что после обработки полости рта данным препаратом количество аэробных и анаэробных бактерий, а также грибов рода Candida существенно снижается [33].
Большой интерес представляет двойное слепое перекрестное исследование, в котором сравнивалась активность различных местных антисептиков против аэробных и анаэробных бактерий в полости рта. У 12 взрослых добровольцев после бактериологического исследования слюны полость рта промывалась антисептиком (в группе сравнения — дистиллированной водой), после чего проводилось троекратное контрольное бактериологическое исследование слюны (через 15, 40 и 60 минут). Помимо гексэтидина (0,1%) из жидких антисептиков использовались тиротрицин (0,067%), перекись водорода (3%) и этиловый спирт (40%). Как видно на рисунке, число колониеобразующих единиц (КОЕ) аэробных и анаэробных бактерий в случае использования гексэтидина было существенно меньше, чем после обработки полости рта другими средствами. При этом его эффект, в отличие от других препаратов, был относительно стабилен в течение часа после обработки [25].
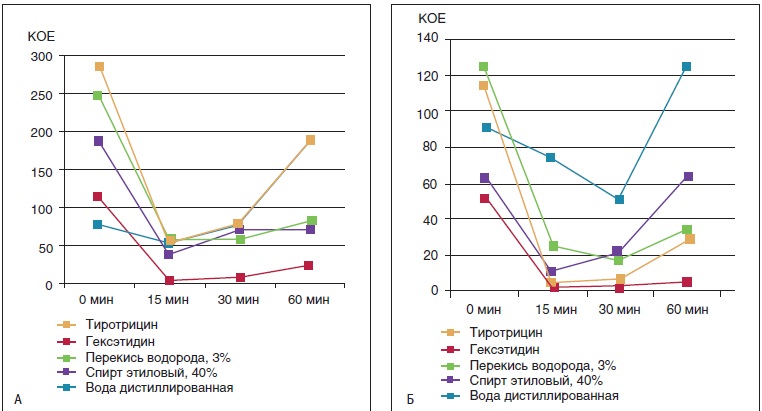
Рис. Микробиологический эффект обработки полости рта антисептиками: А — в отношении аэробных бактерий [25]; Б — в отношении анаэробных бактерий, КОЕ
Важнейшей особенностью гексэтидина является то, что он оказывает более интенсивное воздействие на бактериальные биопленки, чем активный в их отношении антибиотик из группы цефалоспоринов III поколения — цефтазидим [13, 31]. Учитывая высокую безопасность гексэтидина для тканей организма, в настоящее время предложена методика пропитывания им интубационных трубок с целью профилактики вентилятор-ассоциированной пневмонии за счет предотвращения развития на поверхности трубки биопленок [31]. Также установлено, что данный препарат не только обладает активностью в отношении грибов, но и нарушает их адгезию к слизистой оболочке, тем самым препятствуя образованию биопленок [26].
Результаты клинических исследований гексэтидина
Эффективность и безопасность гексэтидина при тонзиллофарингитах у детей были определены в ряде клинических исследований. Так, его применение при остром тонзиллофарингите (в том числе осложненном) у 82 подростков и взрослых показало, что использование препарата ведет к существенному снижению уровня микрофлоры в полости рта и способствует уменьшению сроков госпитализации [6]. Включение гексэтидина в терапию ОРВИ у детей с хронической лор-патологией сокращает длительность как местных, так и системных симптомов заболевания [10].
В Университетской клинической детской больнице Первого Московского государственного медицинского университета им. И. М. Сеченова было проведено рандомизированное сравнительное исследование по использованию местных препаратов при респираторных инфекциях, сопровождающихся болью в горле и воспалением в ротоглотке, у 50 детей в возрасте 3–12 лет с разными соматическими патологиями (бронхиальной астмой, ювенильным ревматоидным артритом, заболеваниями ЖКТ и мочевыделительной системы). В основной группе (n = 25) пациентам назначали гексэтидин (Гексорал в форме аэрозоля), в группе сравнения (n = 25) — местный противовоспалительный препарат бензидамин в виде спрея. Группы были сопоставимы по возрасту и полу. Перед началом терапии всем проводилось бактериологическое исследование, в ходе которого у большинства (76%) больных в ротоглотке были выявлены S. aureus, Moracella catarrhalis, S. pneumoniae и другие условно патогенные бактерии. Случаев обнаружения БГСА при бактериологическом исследовании не было, отсутствие данного возбудителя подтверждалось также отрицательным результатом экспресс-диагностики («Стрептатест»). Продолжительность терапии в обеих группах составляла от 5 до 7 дней в зависимости от интенсивности воспалительных изменений и их динамики. У детей, получавших гексэтидин, статистически значимо быстрее происходили купирование тонзиллофарингита, а также нормализация изменений показателей общего анализа крови (СОЭ, уровня лейкоцитов). Переносимость местной терапии была хорошей, в ходе исследования нежелательных лекарственных реакций отмечено не было [7].
Заключение
На сегодняшний день в научной литературе представлены исследования, свидетельствующие об эффективности и безопасности применения гексэтидина для местной терапии тонзиллофарингита, в том числе у детей.
Препарат на основе гексэтидина Гексорал выпускается в двух лекарственных формах — аэрозоль и раствор для местного применения. Он рекомендуется для детей старше трех лет и взрослых при различных инфекционно-воспалительных заболеваниях полости рта, в том числе при фарингите и ангине. При тяжелых вариантах заболеваний Гексорал следует применять в составе комплексной терапии.
Литература
- Андреева И. В. Фармакоэпидемиология антибактериальных препаратов у населения: Автореф. дис. … канд. мед. наук. Смоленск, 2003. 21 с.
- Государственный регистр лекарственных средств. URL: grls.rosminzdrav.ru/default.aspx (дата обращения — 26.10.2012).
- Козлов С. Н. Фармакотерапия острого тонзиллофарингита в амбулаторной практике: результаты многоцентрового фармакоэпидемиологического исследования / С. Н. Козлов, Л. С. Страчунский, С. А. Рачина // Терапевт. арх. 2004. Т. 76. № 5. С. 45–51.
- Лопатин А. С. Лечение острого и хронического фарингита // Рос. мед. журн. 2001. Т. 9. № 16–17. С. 58–61.
- Отвагин И. В. Современные аспекты диагностики инфекций, вызванных стрептококками группы А / И. В. Отвагин, Н. С. Соколов // Клин. микробиология и антимикроб. химиотерапия. 2011. Т. 13. № 3. С. 223–230.
- Сочетанная местная терапия при заболеваниях ротоглотки / Н. Л. Кунельская [и др.] // Вестн. оториноларингологии. 2008. № 2. С. 62–66.
- Старостина Л. С. Эффективность местной терапии заболеваний полости рта и глотки у детей с соматической патологией / Л. С. Старостина, М. Д. Великорецкая // Consilium Medicum. Педиатрия. 2011. № 1. С. 83–85.
- Шпынев К. В. Современные подходы к диагностике стрептококкового фарингита / К. В. Шпынев, В. А. Кречиков // Клин. микробиология и антимикроб. химиотерапия. 2007. Т. 9. № 1. С. 20–33.
- Этиопатогенетическая терапия острых фарингитов: методические рекомендации / Сост. С. В. Рязанцев. СПб., 2007. 40 с.
- Эффективность Стоматидина при острых респираторных заболеваниях у детей, протекающих с поражениями лимфоидной ткани ротоглотки / Д. В. Усенко [и др.] // Инфекц. болезни. 2010. № 1. С. 88–91.
- Al-Mazrou K. A. Adherent biofilms in adenotonsillar diseases in children / K. A. Al-Mazrou, A. S. Al-Khattaf // Arch. Otolaryngol. Head Neck Surg. 2008. Vol. 134. № 1. P. 20–23.
- Antibiotic treatment of children with sore throat / J. A. Linder [et al.] // JAMA. 2005. Vol. 294. № 18. P. 2315–2322.
- Antiseptic activity of some antidental plaque chemicals on Streptococcus mutans biofilms / E. Le Magrex [et al.] // Pathol. Biol. 1993. Vol. 41. № 4. P. 364–368.
- Bacteriologic comparison of tonsil core in recurrent tonsillitis and tonsillar hypertrophy / J. H. Jeong [et al.] // Laryngoscope. 2007. Vol. 117. № 12. P. 2146–2151.
- Brook I. The role of beta-lactamase-producing bacteria in the persistence of streptococcal tonsillar infection // Rev. Infect. Dis. 1984. Vol. 6. № 5. P. 601–607.
- Chole R. A. Anatomical evidence of microbial biofilms in tonsillar tissues: a possible mechanism to explain chronicity / R. A. Chole, B. T. Faddis // Arch. Otolaryngol. Head Neck Surg. 2003. Vol. 129. № 6. P. 634–636.
- Consensus document on the diagnosis and treatment of acute tonsillopharyngitis / Pürez P. R. [et al.] // An. Pediatr. Barc. 2011. Vol. 75. № 5. P. 1–13.
- Cooper A. J. Диагностика и подходы к лечению при инфекционном воспалении глотки / A. J. Cooper, M. F. Scott, S. A. Rollnick // Вестн. оториноларингологии. 2008. № 5. С. 57–58.
- Demonstration of bacterial cells and glycocalyx in biofilms on human tonsils / R. E. Kania [et al.] // Arch. Otolaryngol. Head Neck Surg. 2007. Vol. 133. № 2. P. 115–121.
- Effect of chlorhexidine gluconate and benzydamine hydrochloride mouth spray on clinical signs and quality of life of patients with streptococcal tonsillopharyngitis: multicentre, prospective, randomised, double-blinded, placebo-controlled study / C. Cingi [et al.] // J. Laryngol. Otol. 2011. Vol. 125. № 6. P. 620–625.
- Evaluation of a rapid antigen detection test in the diagnosis of streptococcal pharyngitis in children and its impact on antibiotic prescription / H. C. Maltezou [et al.] // J. Antimicrob. Chemother. 2008. Vol. 62. № 6. P. 1407–1412.
- Failure of penicillin to eradicate group A streptococci during an outbreak of pharyngitis / A. S. Gastanaduy [et al.] // Lancet. 1980. Vol. 6. № 2. P. 498–502.
- Kapic’ E. Hexetidine — an oral antiseptic / E. Kapic’, F. Becic’, E. Becic’ // Med. Arh. 2002. Vol. 56. № 1. P. 43–48.
- Linder J. A. Antibiotic treatment of adults with sore throat by community primary care physicians: a national survey, 1989–1999 / J. A. Linder, R. S. Stafford // JAMA. 2001. Vol. 286. № 10. P. 1181–1186.
- Matula C. Decontamination of the oral cavity. Effect of six local anti-microbial preparations in comparison to water and parafilm as controls / C. Matula, M. Hildebrandt, G. Nahler // J. Int. Med. Res. 1988. Vol. 16. № 2. P. 98–106.
- Physicochemical characterization of hexetidine-impregnated endotracheal tube poly(vinyl chloride) and resistance to adherence of respiratory bacterial pathogens / D. S. Jones [et al.] // Pharm. Res. 2002. Vol. 19. № 6. P. 818–824.
- Pichichero M. E. Empiric antibiotic selection criteria for respiratory infections in pediatric practice // Pediatr. Infect. Dis. J. 1997. Vol. 16. Suppl. 3. P. S60–64.
- Portier H. New strategies for angina case management in France / H. Portier, M. Grappin, P. Chavanet // Bull. Acad. Natl. Med. 2003. Vol. 187. № 6. P 1107–1116.
- Smith A. Eradicating chronic ear, nose, and throat infections: a systematically conducted literature review of advances in biofilm treatment / A. Smith, F. J. Buchinsky, J. C. Post // Otolaryngol. Head Neck Surg. 2011. Vol. 144. № 3. P. 338–347.
- Sydiskis R. J. Mouthwash study final report — University of Maryland Dental School. Baltimore, 1997. Data on file.
- The concomitant development of poly(vinyl chloride)-related biofilm and antimicrobial resistance in relation to ventilator-associated pneumonia / S. P. Gorman [et al.] // Biomaterials. 2001. Vol. 22. № 20. P. 2741–2747.
- Tonsil surface and core cultures in recurrent tonsillitis: prevalence of anaerobes and beta-lactamase producing organisms / I. J. Mitchelmore [et al.] // Eur. J. Clin. Microbiol. Infect. Dis. 1994. Vol. 13. № 7. P. 542–548.
- Wile D. B. Hexetidine (‘Oraldene’): a report on its antibacterial and antifungal properties on the oral flora in healthy subjects / D. B. Wile, J. R. Dinsdale, D. H. Joynson // Curr. Med. Res. Opin. 1986. Vol. 10. № 2. P. 82–88.
- Worrall G. J. Acute sore throat // Can. Fam. Physician. 2007. Vol. 53. № 11. P. 1961–1962.
Н. А. Геппе, И. А. Дронов
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
