- Головна
- /
- Статті
- /
- Стоматологія. Захворювання порожнини рота
- /
- Анализ влияния хлоргексидина на жизнеспособность и состав бактерий зубного налета на основе профилирования уровня выживаемости и показателей структурной целостности мембраны
Анализ влияния хлоргексидина на жизнеспособность и состав бактерий зубного налета на основе профилирования уровня выживаемости и показателей структурной целостности мембраны

Для моделирования налета в межзубных промежутках использовались многовидовые биопленки, которые выращивались на гидроксилапатитовом субстрате в ферментаторе биопленки с постоянной толщиной. Для визуального исследования биопленки помещались в раствор, содержащий флуоресцентные индикаторы целостности мембраны. С помощью конфокального лазерного сканирующего микроскопа (КЛСМ) определялась структура и пространственное распределение жизнеспособности клеток внутри биопленки. Хлоргексидин глюконат (ХГГ) добавлялся в раствор до достижения концентраций 0,05% и 0,2% (вес/объем) перед тем, как производилась цейтраферная съемка. Анализ фотографий показал, что экспозиция к 0,2% раствору ХГГ приводила к уменьшению толщины биопленки со скоростью 1,176 мкм/мин-1 по оси Z, а также вызывала изменения в общих показателях флуоресцентных измерений и показателях профиля жизнеспособности биопленки после временнóго интервала от 3 до 5 минут. При концентрации раствора ХГГ 0,05% общие показатели флуоресцентных измерений, 5 минут спустя после добавления раствора, изменялись в очень незначительной степени, однако, вместе с тем, воздействие раствора, зависящее от времени, явно определялось. Наиболее выраженным индикатором действия раствора ХГГ с течением времени было изменение профиля жизнеспособности. Полученные результаты дают основания полагать, что вполне возможно использовать флуоресцентные индикаторы целостности мембраны и анализ профиля жизнеспособности для оценки распространения бактерицидного эффекта мембраноактивных антимикробных соединений в биопленке.
С.К.Хоуп и М.Уилсон, отделение микробиологии, департамент инфекционных заболеваний и иммунологии, Институт стоматологии имени Джорджа Истмена при Лондонском университетском колледже, Лондон, Великобритания
Чувствительность бактерий, входящих в состав биопленки, к действию антимикробных соединений значительно меньше (в 10-1000 раз) по сравнению с планктонными (свободно плавающими) микроорганизмами того же вида.
В этом явлении можно выделить два аспекта, которые обусловлены как прямой, так и случайной (непрямой) модальностью биопленки. Прямые адаптационные механизмы резистентности вырабатываются в ответ на плотность клеток; такие механизмы включают в себя замедление скорости роста, продуцирование персистирующих клеток и активацию тех процессов, которые принято обозначать термином «quorum sensing», то естьтак называемые массовые коммуникационные ощущения у бактерий.
Медленно растущие бактерии по своей сути являются менее чувствительными к действию антимикробных соединений и, хотя персистирующие клетки могут составлять лишь небольшую часть всего микробного сообщества биопленки, они особенно неуязвимы к попыткам их уничтожения. В ходе процесса quorum sensing бактерии выделяют в местную микросреду сигнальные молекулы, концентрация которых увеличивается как функция плотности популяции. Когда бактерия определяет, что концентрация сигнальных молекул достигла критических показателей, происходят изменения в экспрессии генов. В результате начинается активация вирулентности, компетенции и множественного деления.
Непрямая резистентность к действию антимикробного препарата обусловлена физическими свойствами биопленки, включая совместное прикрепление к поверхностям и сопротивление проникновению макромолекул вовнутрь биопленки с помощью экзополисахаридного матрикса (ЭПСМ). ЭПСМ способен также выполнять функции матрикса ионного обмена и благодаря этому препятствовать проникновению положительно заряженных антимикробных соединений с низкой молекулярной массой.
Бактериальный зубной налет («зубные бляшки») является биопленкой, которая образуется на твердых поверхностях ротовой полости. В отсутствие лечения процесс развития биопленки может привести к серьезным осложнениям, например, кариесу, гингивиту и пародонтиту. Стандартный метод удаления зубного налета предполагает использование обычной или электрической зубной щетки, а также полоскания рта в течение 30 секунд с помощью специальной жидкости, обладающей антибактериальными свойствами. Подобные ополаскиватели для рта содержат раствор этилового спирта, а также антимикробное соединение, например, хлоргексидин глюконат (ХГГ), хотя существует и много других составов. ХГГ также является компонентом многих других дезинфицирующих средств и антисептиков. ХГГ (C22H30Cl2N102C6H12O7) является катионным полибигуанидом (бисбигуанидом) с молекулярной массой 898 Да. Он обладает антибактериальным действием широкого спектра, что сочетается с низкой токсичностью для млекопитающих и способностью прикрепляться к коже и слизистым оболочкам. Молекула ХГГ вступает в реакцию с отрицательно заряженными группами на поверхности клетки, что приводит к необратимой утрате компонентов цитоплазмы, повреждению мембраны и ингибиции (замедлению процесса выделения ферментов). В повышенных концентрациях ХГГ вызывает тяжелое повреждение клеток, коагуляцию цитоплазмы и преципитацию белков и нуклеиновых кислот. Концентрация раствора ХГГ в 0,2% считается наиболее эффективной для ополаскивания полости рта и рассматривается в стоматологии как золотой стандарт.
В ходе экспериментов in vitro было установлено, что ополаскивание рта с помощью ХГГ в течение 30 секунд оказывает очень незначительное воздействие на количество жизнеспособных бактерий, которые можно обнаружить в биопленках. Так, в частности, было доказано, что ХГГ в концентрации 0,2% является неэффективным средством борьбы с зубным налетом даже после экспозиции (биопленки) к этому антисептику в течение 5 минут. Для того чтобы обеспечить уничтожение бактерий на уровне 2-log10 до 5- log10, необходимо воздействие такого раствора ХГГ на протяжении 60 минут.
Для конфокальной лазерной сканирующей микроскопии (КЛСМ) применяется узкий сфокусированный луч лазера и точечная диафрагма, что позволяет получить серию снимков различных слоев внутри биологического образца, которую принято называть «стек изображений». Анализ снимков, полученных с помощью КЛСМ, проводится в сочетании с окрашиванием образцов, что позволяет определить структуру и пространственное распределение выживаемости микроорганизмов внутри биопленки. Эти методы были усовершенствованы для изучения живых и погибших бактерий в определенных популяциях. Сравнение пространственного распределения живых и погибших бактерий позволяет составить профили жизнеспособности.
В ходе такого изучения используется флуоресценция изображения и глубина оптической секции в стеке изображений, полученных с помощью КЛСМ. Профили жизнеспособности обычно регистрируют переход от флуоресценции живых бактерий до флуоресценции погибших микроорганизмов по мере проникновения в толщину биопленки. Это явление также можно наблюдать в горизонтальной плоскости; во внешних слоях поверхности биопленки наблюдается больше флуоресценции, характерной для живых бактерий по сравнению с внутренними слоями, где больше флуоресценции, указывающей на присутствие большого числа погибших микроорганизмов.
Набор для флуоресцентного окрашивания образцов BacLight LIVE/DEAD stain (Molecular Probes, Eugene, Oreg.) является двухкомпонентной системой, в которой используется краситель SYTO9 и йодид пропидия (пропидистый йодид), что позволяет проводить дифференцирование между живыми и погибшими бактериальными клетками соответственно. Бактерии с поврежденными мембранами окрашиваются как погибшие, в то время как микроорганизмы с неповрежденными мембранами окрашиваются красителем как жизнеспособные.
Хотя это правило не является обязательным для каждой бактерии в каждой ситуации, надежности такой системы вполне достаточно для выявления разницы в жизнеспособности бактерий в зависимости от глубины расположения слоя в биопленке даже в многовидовых популяциях. Поскольку ХГГ повреждает клеточные мембраны, его бактерицидное действие может быть определено в режиме реального времени с помощью красителей из набора BacLight LIVE/DEAD stain. В ходе исследования мы использовали метод КЛСМ в сочетании с флуоресцентными индикаторами целостности мембраны для мониторирования в режиме реального времени воздействия ХГГ на биопленки ротовой полости с точки зрения изменения их профиля жизнеспособности.
Материалы и методы
Выращивание биопленки и отбор образцов. Метод выращивания микроэкосистемы зубного налета в ферментаторе с постоянной толщиной биопленки (CDFF; University of Wales, Cardiff, United Kingdom) был неоднократно и подробно описан ранее. В ходе нашего исследования гидроксилапатитовые диски (Clarkson Chromatography Products, South Williamsport, Pa.), уменьшенные до толщины 200 мкм, использовались для выращивания биопленки зубного налета, имитирующей биопленку образующуюся в межзубных промежутках. Содержимое ферментатора CDFF подвергалось воздействию атмосферного воздуха через пористый фильтр с размером пор 0,2 мкм (Whatman, Poole, Dorset, United Kingdom). Для выращивания бактерий использовался 1 л «искусственной слюны», сложного по составу раствора, содержавшего муцин. Раствор закачивался в ферментатор со скоростью 0,72 мл/мин-1, так чтобы весь объем поступил в ферментатор в течение 24 часов. С другой стороны, в ферментатор также добавлялась стерильная искусственная слюна со скоростью 0,72 мл/мин-1 до момента завершения эксперимента приблизительно 30 дней спустя после его начала.
Биопленки достигли стабильного состояния через 7 дней. Диски были извлечены из ферментатора на 17-й и 27-й день после инокуляции. Затем биопленки, пребывающие в стабильном состоянии (но с колониями микроорганизмов различного возраста), были исследованы на предмет того, можно ли определить воздействие ХГГ на профили жизнеспособности обитающих в них бактерий.
КЛСМ и применение ХГГ. Для исследования биопленок с помощью метода конфокальной лазерной сканирующей микроскопии (КЛСМ) были приготовлены 2 раствора. Был приготовлен 10%-й раствор из 20%-го препарата (Sigma-Aldrich Co. Ltd., Gillingham, United Kingdom). Раствор для изучения с помощью КЛСМ содержал 8 мл дистиллированной воды (дH2O) и по 2 мкл каждого из двух компонентов А и В из набора красителей BacLight LIVE/DEAD.
Гидроксилапатитовый диск, содержащий биопленку, окунался в 1 мл физиологического раствора для удаления остатков питательной среды и свободных клеток. Затем диск поверхностью с биопленкой вверх помещался в чашку для выращивания клеточных культур (Bibby Sterilin Ltd., Stone, United Kingdom), после чего в чашку аккуратно наливался раствор для визуализации. Объем раствора был подобран так, чтобы он покрывал диск и биопленку полностью. Затем чашка помещалась в темноту на 10 минут. Биопленки исследовались с помощью микроскопа на неподвижном столике. Для исследования применялся микроскоп модели DMLFS; Leica Microsystems, Milton Keynes, United Kingdom) с головкой лазерного сканирования Leica TCS SP2. Использовались объективы водной иммерсии с линзами х20 и х40 (Leica). Для исследования использовались области биопленок, содержавшие стеки (или «возвышения»), которые могли быть выделены в конфокальном поле зрения микроскопа.
Вначале выполнялось пробное сканирование произвольной области биопленки для определения оптимальных настроек фотоэлектронного умножителя (РМТ) и оси Z (верхнее и нижнее положение стека изображений). Позднее в ходе исследования эмпирическим путем было установлено, что наилучшие результаты получались в том случае, когда поле зрения микроскопа устанавливалось несколько больше, чем это определялось предварительным сканированием.
Несмотря на то, что этот метод приводил к некоторому ухудшению качества изображения с точки зрения яркости пикселей, он позволял определять количественные характеристики флуоресценции и за пределами уровня оригинального изображения. Такое изменение настроек фотоэлектронного умножителя помогало добиться уменьшения насыщенности цвета.
Программное обеспечение КЛСМ было настроено таким образом, чтобы обеспечить серию снимков, снятых в режиме цейтраферной съемки (XYZt) с интервалами 30 сек. либо 60 сек. в зависимости от толщины стека. Сканирование производилось в режиме 8 бит при разрешении 512 на 512 пикселей. Такое относительно низкое качество изображений было выбрано для того, чтобы минимизировать время сканирования. Размер шага по оси Z был главным определяющим фактором времени сканирования и именно это значение подвергалось изменениям для того чтобы добиться оптимального соотношения качества изображения и разрешения на определенный момент времени. Продолжительность каждой серии цейтраферной съемки составляла от 10 до 15 минут.
Сразу же после окончания первого сканирования изображений, полученных с помощью цейтраферной съемки, в чашки для выращивания клеточных культур добавлялось 160 мкл 10% раствора ХГГ, для того чтобы в конечном итоге концентрация антисептика в 8 мл раствора для визуализации составила 0,2% (вес/объем). Раствор ХГГ вводился с помощью пипетки (Eppendorf AG, Hamburg, Germany), размещенной перпендикулярно к поверхности диска. Это обеспечивало максимальное смешивание и, вместе с тем, снижало опасность повреждения биопленки потоком жидкости.
Аналогичным образом в чашки для выращивания культур вводились 40 мкл 10% раствора ХГГ, что обеспечивало концентрацию антисептика в 8 мл раствора для визуализации 0,05% (вес/объем). С помощью программного обеспечения Leica TCS NT проводилось сохранение изображений на оптический диск в формате TIFF.
Была проведена также серия экспериментов с помощью метода КЛСМ, в ходе которых ХГГ к раствору для визуализации не добавлялся.
Анализ изображений. Для анализа стеков изображений использовалось приложение, основанное на технологии Java, (ImageJ (8; W. Rasband, ImageJ 1.29x [PC-Windows] freeware, ). Отдельные файлы в формате TIFF преобразовывались с помощью специально созданного плагина ImageJ в приемлемые для работы. Соответствующие команды ImageJ приведены ниже в скобках.
Проекционные изображения собирались для каждой временнóй точки и канала флуоресценции для получения единого изображения, основанного на сумме значений яркости пикселей в пределах стека изображений (ImageJ: z-project).
Проекционные изображения конвертировались из 32-битных в 8-битные как для каналов жизнеспособных клеток, так и для каналов нежизнеспособных клеток (ImageJ: plot z-axis profile). Саггитальные (вид в вертикальном разрезе) покадровые проекции были получены с помощью аналогичных методов.
Профили интенсивности флуоресценции оригинальных стеков изображений по оси Z определялись как для флуоресцентных каналов жизнеспособных клеток, так и для каналов нежизнеспособных клеток(ImageJ: plot z-axis profile). Эти первичные данные затем экспортировались в программу обработки электронных таблиц (Microsoft Excel), после чего процесс повторялся вновь для каждой точки в серии покадровых изображений. После конвертации профилей оси Z в «табличный» формат проводилась нормализация данных – то есть, максимальное значение флуоресценции для каждого канала в определенный момент времени получало значение 1 единицы.
После этого начиналось конструирование профилей жизнеспособности, для чего проводилось вычитание нормализованных значений профилей нежизнеспособности по оси Z из соответствующих значений профилей жизнеспособности и размещение данных напротив значений глубины оптической секции биопленки.
Степень сжатия биопленки, определяемая с помощью саггитальной проекции, измерялись с помощью отслеживания местоположения объектов. Этот процесс включал в себя регистрацию расположения отличительных черт по оси Z в стеке изображений, как, например, верхняя часть биопленки либо особенно яркая микроколония, и отслеживание изменения этих свойств с течением времени. Вычислялось соответствующее увеличение яркости изображения, вызванное увеличением флуоресценции на единицу объема, после чего это значение факторизовалось в сумму значений проекционной флуоресценции.
Результаты
В данном исследовании представлены три типа биопленок, подвергавшихся воздействию ХГГ; биопленка 1 использовалась для измерения общей флуоресценции и уменьшения толщины биопленки при концентрации ХГГ 0,2%, в то время как биопленки 2 и 3 использовались для получения профилей толщины при концентрациях ХГГ 0,2% и 0,05% соответственно. Предварительные эксперименты показали, что экспозиция по ХГГ вызывала увеличение флуоресценции оптической секции в пределах биопленки, что приводило к насыщенности полученного изображения, т.е. к появлению большого числа пикселей с максимальной яркостью (данные не приведены). Это явление можно объяснить наблюдавшимся сжатием биопленки, что вызывало соответствующее увеличение флуоресценции на единицу объема (то есть, в пределах толщины оптической секции).
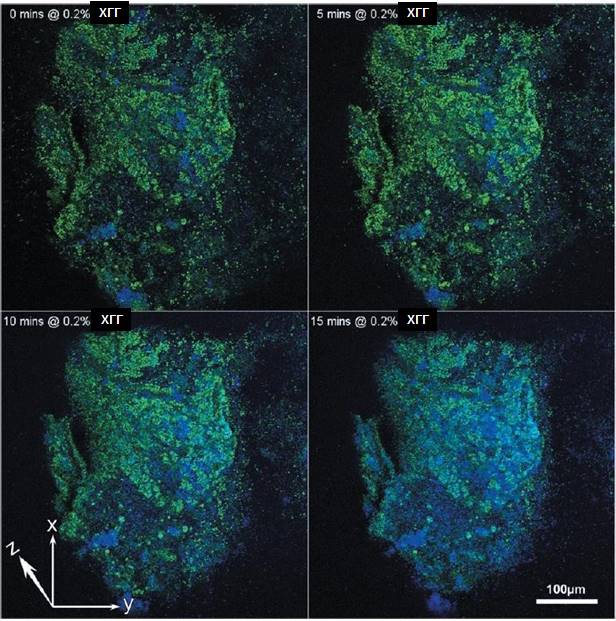
Рисунок 1. Проекции по оси Z из серий покадровых изображений, полученных с помощью КЛСМ, демонстрируют изменения в биопленке 1 зубного налета после воздействия 0,2% раствора ХГГ в присутствие красителя BacLight LIVE/DEAD. Зеленый цвет представляет канал жизнеспособности; синий – канал нежизнеспособности.
После добавления 0,2% раствора ХГГ на проекционных покадровых изображениях можно увидеть изменения в жизнеспособности биопленки 1 зубного налета и изменения в ее структуре (Рис. 1). Сагиттальная проекция (Рис. 2) демонстрирует, что 0,2% раствор ХГГ вызывал сжатие биопленки со скоростью 1,176 мкм/мин-1, что было установлено с помощью наблюдения за объектом в течение 15 минут (Рис. 3).
Влияние уменьшения толщины образца на увеличение флуоресценции на оптическую секцию определялось с помощью уравнения, приведенного в списке уловных обозначений к Рисунку 3. Количественный анализ общей флуоресценции изображения (проекция биопленки по оси Z; Рис. 1) указывала на то, что флуоресценция, связанная с нежизнеспособностью, начинала изменяться сразу же после экспозиции по 0,2% раствору ХГГ до того, как 4 минуты спустя начиналось ее (флуоресценции) увеличение (Рис. 4а). В то же время флуоресценция, связанная с жизнеспособностью, оставалась относительно стабильной.
Наблюдавшиеся вначале скачки значений флуоресценции были, по всей видимости, обусловлены неизбежной турбулентностью среды, вызванной добавлением раствора ХГГ, что выводило биопленку из состояния покоя. Когда в расчет принималось влияние сжатия биопленки на флуоресценцию оптической секции (уравнение приведено в списке условных обозначений к Рисунку 3), оказалось, что флуоресценция жизнеспособности на самом деле снижалась, в то время как флуоресценция нежизнеспособности увеличивалась (Рис. 4b), что, в принципе, было предсказуемым.
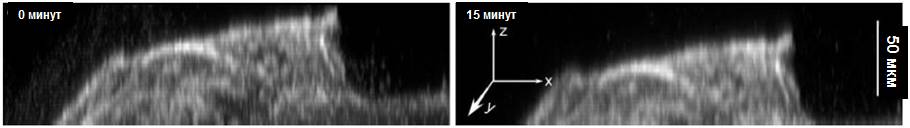
Рисунок 2. Сагиттальная проекция биопленки 1 демонстрирует уменьшение толщины биопленки после воздействия 0,2% раствора ХГГ (показан только канал, связанный с жизнеспособностью бактерий).
После экспозиции биопленки 3 по раствору ХГГ концентрацией 0,05% общая флуоресценция, связанная с жизнеспособностью, не претерпевала каких-либо изменений в течение 15 минут. В то же время флуоресценция, связанная с нежизнеспособностью, незначительно увеличивалась после 5-минутного интервала (Рис. 5а). В данном случае было бы нецелесообразно применять коррекцию яркости с учетом сжатия биопленки, поскольку уменьшение толщины биопленки было незначительным и неоднородным. Кольцевидное сжатие, наблюдавшееся у основания возвышения биопленки, приводило к незначительному угнетению биопленки по краям стека изображений, в то время как наивысшая часть центральной части слегка колебалась (данные не приведены).
Исследование профилей флуоресценции биопленки 2 после воздействия 0,2% раствора ХГГ обнаружило, что пиковые значения и для флуоресценции жизнеспособности, и для флуоресценции нежизнеспособности были более выраженными в стеке изображений с течением времени (Рис. 6). Значения флуоресценции, связанной с жизнеспособностью, начинали увеличиваться через 5 минут вследствие сжатия биопленки (Рис. 6а). Значения флуоресценции, связанной с нежизнеспособностью, также начинали расти 3 минуты спустя после добавления раствора ХГГ. Такие значения флуоресценции подчеркивают существование различий между яркостью пикселей флуоресценции жизнеспособности (от 0 до 10) и нежизнеспособности (от 0 до 45). Однако, такие значения (флуоресценции) не дают основания для вывода о том, что в данном стеке изображений доминируют нежизнеспособные бактерии, поскольку настройки мощности лазера и фотоэлектронного умножителя в основном определяются пользователем.
Исследование профилей флуоресценции биопленки 3 после воздействия 0,05% раствора ХГГ обнаружило менее выраженные изменения (Рис. 7) по сравнению с биопленкой, подвергавшейся воздействию раствора ХГГ с концентрацией 0,2%. В этом случае изменения в профилях флуоресценции были более выраженными по сравнению с изменениями в общей флуоресценции (Рис. 5а).
На Рисунке 8 представлены профили флуоресценции (нормализованная флуоресценция жизнеспособности минус флуоресценция нежизнеспособности против толщины) на разных отрезках времени в биопленке после воздействия 0,2% раствора ХГГ.
На нулевой отметке времени еще до добавления 0,2% раствора ХГГ профиль жизнеспособности в стеке изображений указывает на характерные особенности биопленки (жизнеспособные верхние слои постепенно, с перемещением в глубину переходят в нежизнеспособные). В течение 5-минутного отрезка времени (с 0 мин. до 5 мин.) профиль жизнеспособности изменяется незначительно, хотя он перемещается глубже на стеках изображений по мере сжатия биопленки. После 5 минут воздействия 0,2% раствора ХГГ профиль жизнеспособности перемещается глубже и становится менее выраженным, а после 7-й минуты экспозиции по ХГГ типичный профиль жизнеспособности более не обнаруживается.
При концентрации раствора ХГГ в 0,05% изменения в профиле жизнеспособности являются явными (Рис. 09), хотя и менее выраженными по сравнению с теми, которые наблюдались при концентрации ХГГ в 0,2% (Рис. 8). При такой относительно низкой концентрации ХГГ изменения в жизнеспособности клеток обнаруживались более отчетливо с помощью профилирования жизнеспособности, нежели с помощью измерений общей флуоресценции (Рис. 5а).
Контрольные опыты показали, что погружение биопленок зубного налета в раствор для визуализации не приводит к каким-либо изменениям в целостности клеточных мембран.
****************************
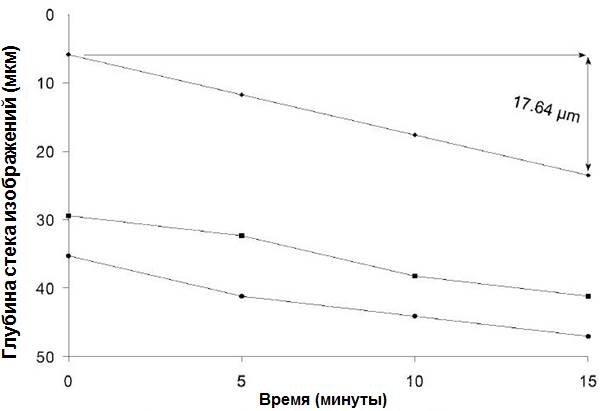
Рисунок 3. Сжатие биопленки 1, определенное с помощью отслеживания объекта после экспозиции по 0,2% раствору ХГГ. Положение 3 свойств по оси Z в стеке изображений отслеживалось с течением времени; «ромбики» на рисунке представляют наивысшие оптические секции, содержащие биопленку. Общая глубина изображения составляла 79,35 мкм; уровень сжатия был равен 1,176 мкм/мин-1. Значения общей флуоресценции изображения подвергались корректировке для компенсации сжатия биопленки в сериях покадровой съемки с помощью уравнения [d – (Δct)/d] x f, в котором Δc – это степень сжатия биопленки (в микрометрах за минуту), t – это время (в минутах), d – общая глубина снимка (в микрометрах), а f – общая флуоресценция изображения (в единицах измерения).
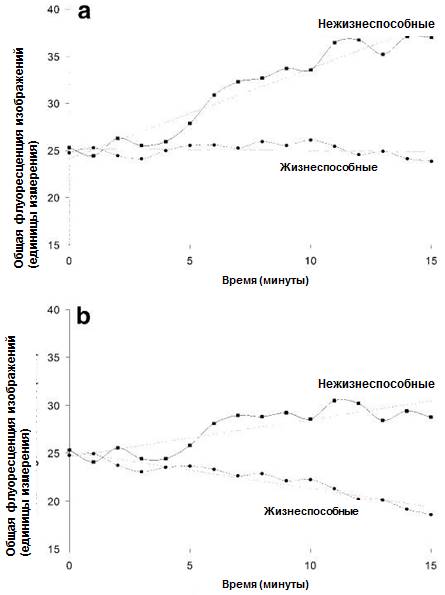
Рисунок 4. Общая флуоресценция стека снимков биопленки 1 зубного налета после экспозиции по 0,2% раствору ХГГ. (А) – предварительные данные. (В) – общая флуоресценция изображения, скорректированная для компенсации сжатия биопленки с помощью формулы, приведенной в описании рисунка 3. Линии общего направления представлены исключительно для ознакомления.
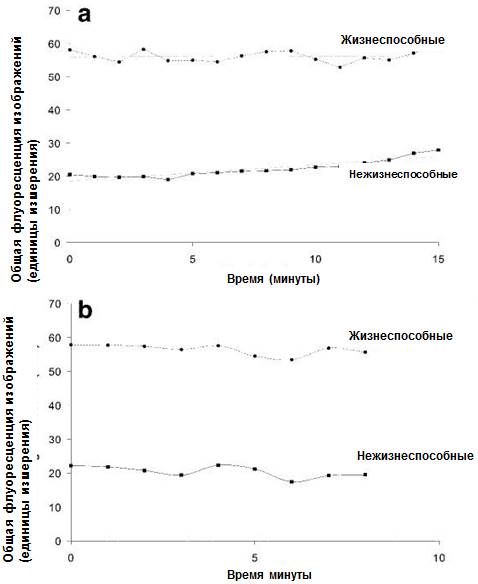
Рисунок 5. (а) Общая флуоресценция стека снимков биопленки 3 зубного налета после экспозиции по 0,05% раствору ХГГ. В этих данных не учитывалась степень сжатия биопленки, поскольку такое сжатие было незначительными и неоднородным. (в) контроль (отсутствие ХГГ).
*********************************
Обсуждение результатов
Ранее для дифференциации между жизнеспособными и нежизнеспособными планктонными бактериями обычно использовались флуоресцентные индикаторы целостности клеточных мембран вместе с проточным цитометрическим анализом. В дальнейшем эта методика применялась для оценки бактерицидных свойств трех распространенных антисептиков, использующихся в составах для полоскания рта: ХГГ, цетилпиридина (цетилпиридиний хлорида) и триклозана. Таким образом, уместно предположить, что с помощью этого метода можно оценивать бактерицидные свойства также и других антимикробных соединений, воздействующих на клеточные мембраны бактерий.
Изучение же свойств тех антимикробных веществ, которые не оказывают прямого воздействия на мембраны клеток (как, например, те, которые воздействуют на белки или синтез полинуклеотидов) с помощью этой методики представляется невозможным.
Результаты, представленные в данном исследовании, демонстрируют, что распространение бактерицидного эффекта мембраноактивных антимикробных соединений в биопленке также может быть отслежено с помощью индикаторов целостности мембраны.
Исследование биопленок, которые были погружены в растворы для визуализации, позволило установить механизм проникновения компонентов водных растворов внутрь биопленок в естественных условиях в отсутствие обезвоживания. Это важный момент, поскольку главным компонентом любой биопленки является вода. Высушивание и/или фиксация в смоле приводят к нарушению структуры пространственного распределения микроорганизмов внутри биопленки.
Физиологический раствор с фосфатным буфером, который обычно применяется для имитации физиологических условий, не может быть использован в составе жидкости для визуализации, поскольку ХГГ вступает в реакцию с соединениями фосфора и свободными атомами хлора. В результате такой реакции происходит реакция двойного разложения и медленная кристаллизация нерастворимых солей. Контрольные эксперименты показали, что добавление к биопленкам раствора для визуализации на основе дистиллированной воды не привод к развитию побочных осмотических эффектов, способных повлиять на структуру биопленки и жизнеспособность бактерий (Рис. 5в).
Во всех медицинских рекомендациях по уходу за зубами и полостью рта содержится совет полоскать рот раствором антисептика в течение 30 секунд, хотя несоблюдение правила может привести к сокращению этого интервала времени. В ходе нескольких последних исследований было установлено, что практически отсутствует разница в показателях индекса зубного налета при применении 0,12% раствора ХГГ для полоскания рта в течение 30 секунд и 0,2% раствора ХГГ в течение 60 секунд. ХГГ может задерживаться в ротовой полости благодаря его способности связываться со слизистыми оболочками, со слюной а также с зубным налетом.
Слюна сохраняет антимикробные свойства 2 часа спустя после полоскания рта 0,2% раствором ХГГ, а рост бактерий в слюне замедляется на протяжении более 12 часов после такого полоскания. Это явление можно объяснить постепенной десорбцией ХГГ в полость рта, что приводит к образованию микросреды с бактериостатическими свойствами, хотя, скорее всего, антимикробный эффект обусловлен связыванием ХГГ с поверхностью зубов.
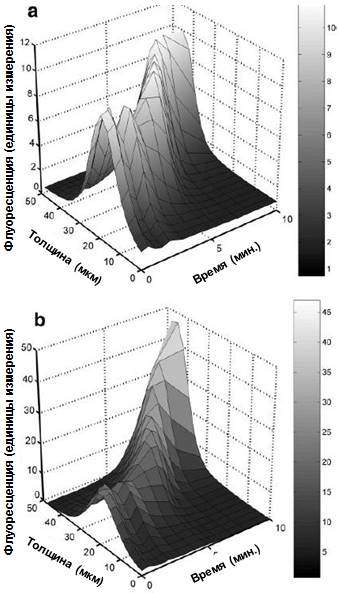
Рисунок 6. Флуоресцентные профили жизнеспособности (а) и нежизнеспособности (в) в толще биопленки 2 после экспозиции к 0,2% раствору ХГГ. Пиковые значения флуоресценции для обоих каналов смещаются с первичного показателя толщины 21 мкм до 45 мкм через 10 минут. В данном случае невозможно провести сравнение значений флуоресценции образцов, поскольку настройки фотоэлектронного умножителя определялись пользователем. Вначале необходимо нормализовать эти данные (то есть, определить максимальное значение, значение 1 единицы) для того чтобы сравнивать пространственные тенденции по каждому каналу.
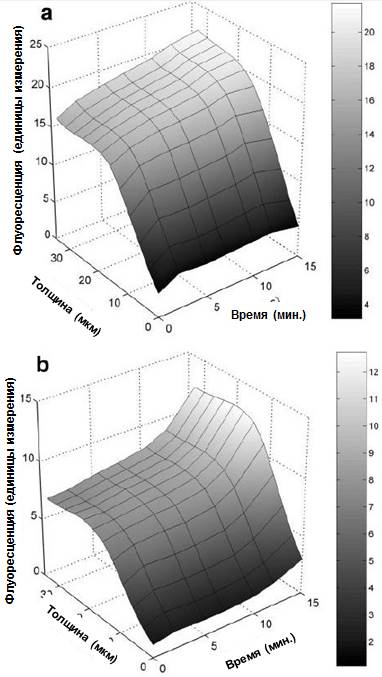
Рисунок 7. Флуоресцентные профили жизнеспособности (а) и нежизнеспособности (в) в биопленке 3 после экспозиции к 0,05% раствору ХГГ.
Изучение массопереноса флуоресцентно-меченых декстранов различного размера (декстран с молекулярным весом от 3 000 [3К-Декс] до 240К-Декс) в биопленках зубного налета обнаружило, что биопленки сами по себе действительно замедляют диффузию макромолекул и что степень такого замедления была выше, чем ожидалось. Такое замедление диффузии было связано с извилистостью матрикса биопленки, или, другими словами, с исключительно извитыми путями диффузии молекул.
Была создана модель диффузии декстранов с молекулярным весом свыше 10К-Декс; однако такая модель не может быть применена к декстранам с молекулярным весом 3К-Декс. Это можно объяснить тем, что размеры «пор» ЭПСМ (экзополисахаридный матрикс) были в диаметре шире 2,6 нм, но уже 4,6 нм. Такие диаметры пор были спрогнозированы в зависимости от диаметра декстранов. К тому же, поскольку молекулярная масса ХГГ (897,77 Да) значительно ниже 3К-Декс, нет оснований полагать, что диффузия ХГГ в биопленку может быть значительно замедлена благодаря эффекту молекулярного сита. Еще более вероятны взаимодействия ионов между положительно заряженными молекулами ХГГ и отрицательно заряженным внеклеточным матриксом. Представляется, что такие взаимодействия ионов снижают коэффициенты диффузии флуоресцентных зондов внутри биопленок Lactococcus lactis и Stenotrophomonas maltophilia почти в 50 раз.
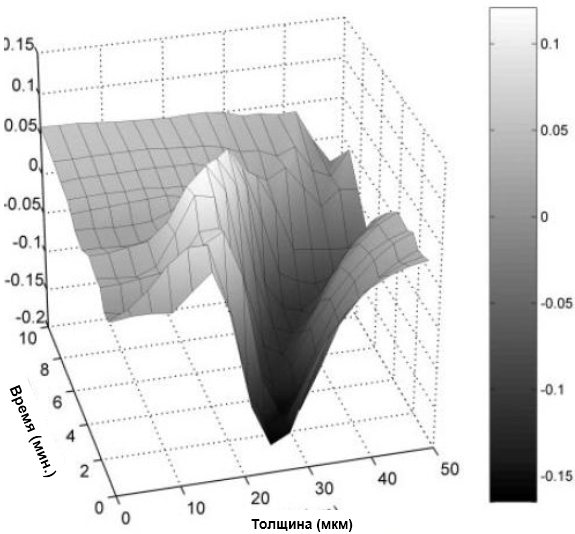
Рисунок 8. Изменения профилей жизнеспособности биопленки зубного налета 2 с течением времени после экспозиции к 0,2% раствору ХГГ соответствуют данным, представленным на Рисунке 6.
В противоположность этому относительно диффузии аминогликозидов, как, например, тобрамицина, в биопленках Pseudomonas aeruginosa можно утверждать, что взаимодействия между положительно заряженными молекулами и отрицательно заряженным матриксом не является основным механизмом проявления резистентности биопленки. Результаты математического моделирования также дают основания полагать, что диффузия растворов, реагирующих стехиометрически, в биопленки замедляется незначительно.
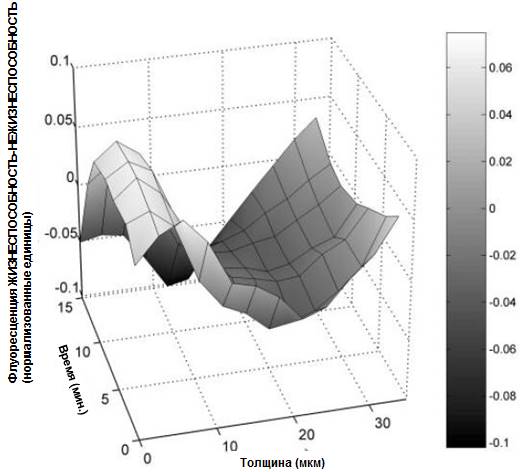
Рисунок 9. Изменения профилей жизнеспособности биопленки зубного налета 3 с течением времени после экспозиции к 0,05% раствору ХГГ соответствуют данным, представленным на Рисунке 7.
Метод математического моделирования применялся для анализа диффузии ХГГ в зубной налет. Если принять, что коэффициент водной диффузии ХГГ в воде при температуре 30 °С (температура раствора, удерживаемого в ротовой полости) составляет 4.2 x 10-6 cм2 с-1, то при биопленке зубного налета толщиной 260 мкм время, необходимое для диффузии через биопленку до нижнего слоя, составит 298 секунд.
Если предположить, что центр структур биопленок, исследованных нами, находится от верхнего слоя на расстоянии не более 50 мкм (Рис. 1), то время диффузии составит порядка 1 минуты. Этот анализ не объясняет в полной мере задержку продолжительностью приблизительно 5 мин. до того, как проявлялся эффект воздействия ХГГ в виде нарушения целостности мембран. Это дает основания полагать, что биопленки зубного налета обладают некоей свойственной им резистентностью к ХГГ, которой, однако, недостаточно для замедления диффузии.
Экспозиция (биопленок) по ХГГ не приводит к немедленной гибели бактерий; установлено, что задержка бактерицидного эффекта составляет 20 секунд для Escherichia coli и Pseudomonas aeruginosa, а для стрептококков ротовой полости такая задержка составляет 30 секунд.
В ходе данного исследования с использованием биопленки, состоящей из оральных бактерий, было установлено, что бактерицидный эффект 0,05% и 0,2% растворов ХГГ проявлялся спустя от 3 до 5 минут. Эта аномалия может указывать на то, что биопленки, состоящие из бактерий ротовой полости, по своей природе менее чувствительны к действию ХГГ по сравнению с планктонными микроорганизмами того же вида. Можно предположить, что интервал времени между повреждением мембраны и проникновением флуоресцентного красителя в клетки будет незначительным, поскольку в этом случае флуорофоры уже будут находиться на очень близком расстоянии к клеткам.
Механизм сжатия биопленок зубного налета после экспозиции к ХГГ, возможно, связан с ионными взаимодействиями между отрицательно заряженным внеклеточным матриксом, который составляет значительную часть объема биопленки, и положительно заряженными молекулами ХГГ. Такие взаимодействия приводят к изменениям физико-химических свойств ЭПСМ: растворимости, гидрофобности и локализованного заряда вдоль полимерных цепочек. Изменения заряда в свою очередь оказывают влияние на третичную структуру цепочек ЭПСМ и степени связывания между прилегающими цепями. В результате взаимодействия ХГГ, обладающего положительным зарядом, и отрицательно заряженными ЭПСМ результирующий заряд матрикса приблизится к нейтральному, что приведет к уменьшению силы отталкивания между заряженными молекулами. В результате этого образуются более тесные связи между полимерными цепями, и уменьшится объем, занимаемый биопленкой. Более компактный матрикс может еще более замедлять диффузию растворов, включая раствор ХГГ, в биопленку из-за стяжения молекулярного сита.
Феномен сжатия биопленки связан с концентрацией ХГГ, поскольку сжатие, которое наблюдалось при концентрации 0,2%, было явным и поддающимся количественному определению, в то время как при концентрации 0,05% сжатие было очень незначительным и неоднородным.
Наблюдение за поведением биопленки 3 при концентрации ХГГ в 0,05% показало появление открытого водного канала. Анализ изображений позволил установить область, занимаема таким каналом (т.е. количество пикселей) увеличилось на 17% в течение 5 минут. Возможно, что конформационные изменения в структуре биопленки как, например, открытие водного канала, вполне могут способствовать дальнейшей диффузии ХГГ в более глубокие слои. В биопленке, подвергавшейся воздействию ХГГ в концентрации 0,5%, также наблюдалось выраженное сжатие (данные не приводятся из-за насыщенности изображения; см. раздел «Материалы и методы).
Вряд ли сжатие биопленки происходило вследствие развития синергетичного эффекта между ХГГ и осмотическим давлением дH2O. Были проведены контрольные эксперименты, в ходе которых физиологический раствор с фосфатным буфером помещался в раствор для визуализации. Хотя в результате развивалась реакция двойного разложения солей, о чем свидетельствовало выпадение белесоватого осадка, можно было наблюдать дальнейшее сжатие биопленки и смещение в сторону флуоресценции нежизнеспособности (данные не приведены).
Необходимо проведение дальнейших исследований, в ходе которых предстоит понять сущность взаимодействия между отсрочкой воздействия ХГГ на жизнеспособность клеток и явно немедленное начало сжатия биопленки. Это в свою очередь позволит определить, какое воздействие оказывали такие эффекты на наблюдения, описанные в этом исследовании, а также определить, способствует ли сжатие биопленки проникновению ХГГ (в нее) или наоборот препятствует. Запланировано также проведение новых экспериментов, которые позволят определить эффективность растворов ХГГ различной концентрации, равно как и эффективность других соединений с антимикробными свойствами. Большой интерес представляет использование более продолжительных интервалов времени, что позволит установить, когда прекращается сжатие биопленки под воздействием ХГГ. Вместе с тем, ограничивающим фактором в данном случае является огромный массив данных.
В то время как измерения общей флуоресценции обеспечивали возможность определять антимикробный эффект ХГГ при концентрации 0,2% (вес/объем) (Рис. 4), эта методика не была достаточно чувствительной для достаточно точного определения бактерицидного эффекта при концентрации антисептика в 0,05% (Рис. 5). Когда толщина биопленки была включена в расчеты в качестве переменной, зависимый от времени бактерицидный эффект 0,05% раствора ХГГ подвергался визуализации значительно легче (Рис. 7) и мог быть исследован и дальше с помощью создания профилей жизнеспособности (Рис. 9).
Нам удалось продемонстрировать, что профили жизнеспособности в биопленке зубного налета изменяются после воздействия ХГГ и выдвинуть предположение, что они (профили жизнеспособности) обладают более высокой чувствительностью при определении антимикробных эффектов низких концентраций ХГГ и, возможно, других мембраноактивных антимикробных соединений по сравнению с общими измерениями флуоресценции (то есть, при использовании неконфокальной флуоресцентной микроскопии).
Полученные данные дают основания полагать, что профилирование жизнеспособности может быть использовано для исследования проникновения и антимикробного воздействия на биопленки как давно существующих, так и новейших мембраноактивных биоцидных соединений. Благодаря включению в анализ стеков изображений функции, связанной с толщиной биопленки, удалось значительно повысить точность измерений общей флуоресценции. Вместе с тем, все еще остается невыясненным влияние феномена сжатия на чувствительность биопленки к ХГГ. В то время как сжатие внеклеточного матрикса, скорее всего, замедляет диффузию молекул в биопленку, открытие водных каналов может способствовать транспорту антимикробного вещества во внутренние отделы биопленки.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
