- Головна
- /
- Статті
- /
- Стоматологія. Захворювання порожнини рота
- /
- Клинические и микробиологические эффекты применения поддесневого биорастворимого чипа с хлоргексидином с контролируемой скоростью высвобождения при лечении пародонтита: многоцентровое исследование
Клинические и микробиологические эффекты применения поддесневого биорастворимого чипа с хлоргексидином с контролируемой скоростью высвобождения при лечении пародонтита: многоцентровое исследование
Микеле Паолантонио, Маттео Д'Анжело, Роберто Феличе Грасси, Джузеппе Перинетти, Раффаэле Пикколомини, Джузеппе Пиццо, Марко Аннунциата, Доменико Д'Архивио, Симонетта Д'Эрколе, Джанна Нарди, Луиджи Гвида J Periodontol 2008;79:271-282
В ходе этого многоцентрового контролируемого рандомизированного клинического и микробиологического исследования было установлено, что применение хлоргексидинового (ХГ) чипа в качестве средства лечения, дополняющего скейлинг и шлифовку поверхности корня, обеспечивает положительный терапевтический эффект при лечении пародонтита умеренной и тяжелой степени тяжести.
Достоверно установлено, что причиной пародонтита является местная бактериальная инфекция – патогенная микрофлора, населяющая зубнолесневые карманы восприимчивых реципиентов. Главным методом лечения пародонтита является механическая обработка поверхности корней, обеспечивающая удаление зубного налета, который содержит бактерии. Скейлинг и шлифовка поверхности корня (СШПК) являются эффективным методом лечения хронического пародонтита. Хотя механическая обработка играет важную роль при удалении зубных бляшек, снижая количество поддесневых бактерий, она в то же время не гарантирует полного удаления патогенов. Кроме того, СШПК требуют немалого количества времени, вызывают у пациента неприятные ощущения, сложны для проведения с технической точки зрения и их эффективность во многом зависит от квалификации и опыта медицинского персонала. В частности, с увеличением глубины десневого кармана эффективность СШПК снижается, в результате чего поддесневые бляшки и отложения зубного камня на поверхности корней остаются нетронутыми. Согласно результатам некоторых исследований, после процедуры скейлинга остаточные отложения зубного камня могут сохраняться на 30% обработанных поверхностей корня зуба.
Для того чтобы преодолеть недостатки этого традиционного метода терапии, для лечения пародонтита умеренной и тяжелой степени тяжести с успехом применяются антибиотики и антисептики как местного, так и системного действия. Однако при системном лечении приходится вводить пациенту повышенные дозы антибиотиков для достижения оптимальной концентрации в очаге заболевания. Это может привести к развитию резистентности, побочных эффектов, взаимодействию лекарственных препаратов и ухудшению приверженности пациента лечению. По этой причине системное применение антибиотиков при пародонтите используется только при лечении пациентов, у которых нет достаточного ответа на традиционное механическое удаление зубных бляшек и зубного камня.
Хотя системное и местное лечение с помощью антибиотиков является эффективным, риск развития бактериальной резистентности рассматривается как противопоказание к их использованию в повседневной практике.
Хлоргексидин (ХГ), обладающий антисептическими свойствами, на протяжении уже более 30 лет с успехом применяется в стоматологической практике для лечения воспалительных заболеваний десен. Это лекарственное средство при местном применении обладает бактерицидными свойствами, оно безопасно, эффективно и не является токсичным. Однако результаты исследований свидетельствуют о том, что орошения десневых карманов с помощью ХГ не обеспечивают должного эффекта при лечении пародонтита, так как не удается добиться значительных концентраций ХГ в десневом кармане на протяжении продолжительного периода времени. Для решения этой проблемы были созданы «средства, обеспечивающие медленное высвобождение лекарственных средств», к которым можно отнести и «средства пролонгированного высвобождения препаратов», обеспечивающие высвобождение ХГ в течение до 24 часов. Сюда же относятся и «средства с контролируемой скоростью высвобождения хлоргексидина», которые обеспечивают поступление препарата в ткани на протяжении более длительного времени. Система с контролируемой скоростью высвобождения ХГ представляет собой биорастворимый чип из гидролизованного желатина, содержащий 2,5 мг ХГ – в последнее время такие системы все чаще применяются для поддесневого воздействия на бактерии, вызывающие пародонтит.
После помещения в десневой карман чип начинает высвобождать ХГ очень медленно в ходе его (чипа) растворения. Чип обеспечивает концентрацию ХГ в десневой жидкости >125 мг/мл на протяжении 7-10 дней. В ходе научных исследований было установлено, что он оказывает ингибирующее воздействие на 99% бактерий, изолированных из пародонтальных карманов.
Результаты многоцентровых клинических исследований указывают на то, что использование чипов с ХГ в качестве средства дополнительной терапии более эффективно для снижения патологического процесса при пародонтозе и обеспечения уровня прикрепления на протяжении 6-9 месяцев по сравнению с СШПК.
Вместе с тем, стоит отметить, что в ходе некоторых исследований было получено подтверждение эффективности чипов с ХГ, выражавшееся также и в улучшении уровней матриксной металлопротеиназы-8 и простагландина Е2, однако в одном исследовании не удалось получить положительный клинический результат при использовании чипов с ХГ.
С учетом всего вышеизложенного целью данного исследования стало получение дополнительных данных о клинических и микробиологических эффектах использования чипов с ХГ в качестве дополнения к СШПК. Данное исследование было многоцентровым – оно проводилось на базе 4-х университетов Италии.
Материалы и методы
В исследовании принимали участие 116 пациентов без системных хронических заболеваний, у которых был выявлен пародонтит умеренной либо тяжелой степени тяжести (возраст от 33 до 65 лет). испытуемые были отобраны сотрудниками кафедр периодонтологии 4-х университетов Италии. У каждого из участников были определены по 2 «точки» проведения эксперимента с глубиной десневых карманов ‡5 мм и кровоточивостью при зондировании (КПЗ). «Точки» эксперимента располагались в 2-х симметричных квадрантах. Эти 2 точки были определены с помощью рандомизации с разделением полости рта так, что в одной точке проводилось только лечение с помощью методов СШПК, а в другой СШПК дополнялось применением 1 чипа с ХГ (СШПК+ХГЧ). В ходе исследования проводилась оценка показателей глубины десневых карманов (ГДК) и относительного уровня прикрепления (ОУП) на исходном уровне до проведения какой-либо терапии, а также 3 и 6 месяцев спустя после начала лечения. Оценка наддесневых бляшек и определение модифицированного десневого индекса проводились после 15 дней, а также по истечении 1 месяца, 3-х и 6 месяцев. Образцы поддесневой микрофлоры отбирались на исходном уровне, а также по истечении 15 дней, 1, 3 и 6 месяцев. Образы выращивались на культуре для определения общего микробного числа (ОМЧ) и исследовались с помощью полимеразной цепной реакции для идентификации 8 известных периодонтопатогенов.
В ходе анализа полученных данных использовалось специальное программное обеспечение для статистики.
Экстракция ДНК проводилась в течение 24-48 часов после отбора образцов. Затем образцы подвергались встряхиванию с помощью лабораторного миксера Вортекс и центрифугированию для сбора клеток. Извлеченная из каждого образца ДНК исследовалась с помощью мультиплекс-ПЦР, для идентификации таких микроорганизмов как Actinobacillus actinomycetemcomitans (Aa), Campylobacter rectus (Cr), Eikenella corrodens (Ec), Fusobacterium nucleatum (Fn), Porphyromonas gingivalis (Pg), Prevotella inter- media (Pi), Treponema denticola (Td), and Tannerella forsythia ([Tf], ранее носившие название T. forsythensis).
Мультиплекс-ПЦР проводилась с использованием праймеров, специфичных к гену 16S рРНК. Каждый анализ проводился однократно; в случае получения результата, вызывавшего сомнения, анализ проводился повторно.
Результаты
Показатели пародонтального индекса (ПИ) и десневого индекса по Мацца (ДИМ) представлены на рисунке 1. Оба метода лечения обеспечивали существенное снижение обоих индексов через 15 дней, и такое снижение сохранялось на протяжении всего периода лечения. Вместе с тем, не было выявлено статистически значимой разницы по эти показателям между обоими методами лечения в каждый отдельно взятый момент времени.
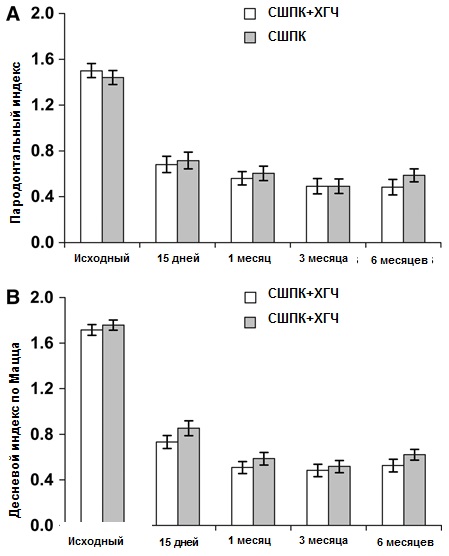
Рисунок 1. ПИ (A) и ДИМ (B) показатели в каждой временной точке для всех десневых карманов(N = 116 для каждой группе). Диаграммы представляют стандартные ошибки среднего значения (SEM). Различия в результатах внутри каждой группы с течением времени были статистически значимыми (все сравнения при P < 0,001). Не было выявлено статистически значимых различий между группами в любой из точек времени.
В то же время показатели глубины десневых карманов (ГДК) и относительного уровня прикрепления (ОУП) заметно улучшились после лечения (рисунки 2-4).
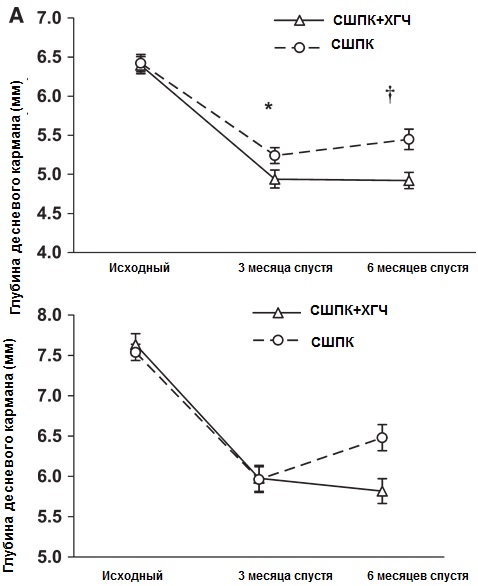
Рисунок 2. ГДК от исходных показателей и 3 и 6 месяцев спустя после начала лечения (N = 116 для каждой группы) (А) и для подгруппы с ГДК ‡7 мм (N = 31 для каждой группы (В). Диаграммы представляют стандартные ошибки среднего значения (SEM). Представлены статистически значимые различия между обеими группами в каждой точке времени.
*P <0.01; †P <0.001.
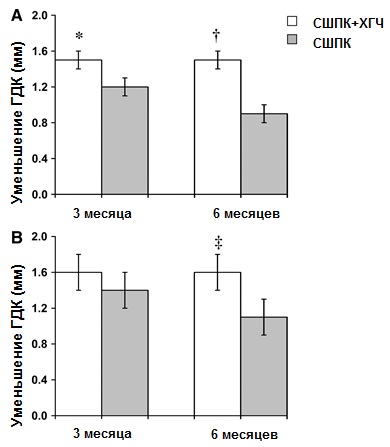
Рисунок 3. Средние показатели уменьшения ГДК от исходных и после 3 и 6 месяцев лечения для всех карманов (N = 116 для каждой группы (А) и для карманов глубиной ‡7мм (N = 31 для каждой группы (В). Представлены статистически значимые различия между обеими группами в каждой точке времени: *P <0.01, †P <0.001; ‡P <0.05.
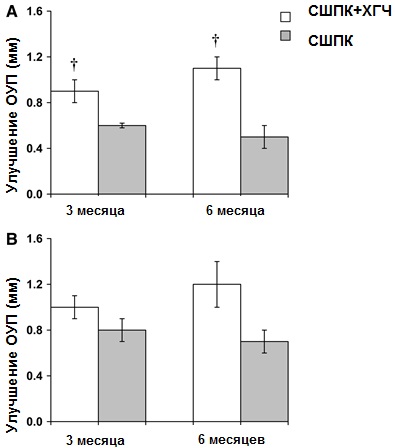
Рисунок 4. Средние показатели динамики ОУП 3 и 6 месяцев спустя после начала лечения для всех карманов (N = 116 для каждой группы (А) и для карманов глубиной ‡7мм (N = 31 для каждой группы (В). Представлены статистически значимые различия между обеими группами в каждой точке времени: †P <0.001.
Применение метода многофакторного дисперсионного анализа выявило статистически значимые различия по времени и результатам лечения (F2;111 = 5,23, P < 0.0,1 и F4;109 = 106,58, P < 0,001, соответственно). В противоположность этому дисперсия по исследователю/месту проведения исследования не достигла статистически значимой величины (F6;224 = 1,02; P > 0,1).
Наконец, во взаимодействиях второго и третьего порядка то, которое было связано с лечением и временем, также оказалось статистически значимым (F4;109 = 14,33, P < 0,001).
При использовании одномерного анализа были выявлены статистически значимые различия в показателях ГДК и ОУП между обоими методами лечения (F1;112 = 10,49, P < 0,01 и F1;112 = 3.92, P = 0.05, соответственно) и между точками времени (F2;224 = 259,97, P < 0,001, и F2;224 = 189,38, P = 0,001, соответственно).
ГДК (рисунок 2А) и ОУП (данные не показаны) были значительно ниже 3 и 6 месяцев спустя после начала лечения по сравнению с исходным уровнем (P < 0,01). Более того, ГДК была ниже для метода СШПК+ХГЧ по сравнению с монотерапией СШПК 3 и 6 месяцев спустя после лечения (рис. 2А), в то время как показатели ОУП были сходными у обоих методов через 3 месяца, но значительно ниже в группе СШПК+ХГЧ через 6 месяцев (данные не приведены).
Средние данные уменьшения ГДК и улучшения ОУП показаны на рисунках 3 и 4 соответственно.
В случае оценки всех десневых карманов средние значения разницы в уменьшении ГДК между обоими методами лечения составили 0,30 и 0,55 мм через 3 месяца и 6 месяцев соответственно (рис. 3А).
Относительно улучшения показателей ОУП средняя разница между обоими методами лечения составила 0,28 и 0,64 мм соответственно (рис. 4А).
Такое улучшение показателей ГДК и ОУП в группе СШПК+ХГЧ было существенно выше, чем то, которое наблюдалось в группе СШПК, и 3, и 6 месяцев спустя после начала лечения (P <0,01, по меньшей мере).
Сходные данные были получены и в подгруппе с глубиной десневых карманов ‡7мм, хотя снижение показателя ГДК было более выраженным (P <0,05) при использовании метода СШПК+ХГЧ лишь через 6 месяцев (рис. 3В). Разница в улучшении показателей ОУП не достигла статистически значимого уровня (рис 4В). Все различия по каждому методу, обнаруженные с течением времени, были статистически значимыми.
Частота выявления каждого из вида пародонтопатогенных бактерий представлена в таблице 1.
Можно утверждать, что в общем наблюдалось снижении численности всех видов бактерий с течением времени по каждому из видов терапии (P <0,05, как минимум).
В группе СШПК только численность бактерий Tf не снижалась с течением времени, что наблюдалось также в отношении микроорганизмов Ec и Pg в группе СШПК+ХГЧ.
В ходе данного исследования было установлено, что количество точек, в которых обнаруживались известные пародонтопатогенные бактерии, значительно уменьшалось от исходного уровня до 6 месяца в обеих группах, хотя ни один из методов не обеспечивал эрадикации этих патогенов (Таблица 1).
| Время /метод лечения | Виды бактерий | |||||||
|---|---|---|---|---|---|---|---|---|
| Aa | Cr | Ec | Fn | Pg | Pi | Td | Tf | |
| Исх. уровень | ||||||||
| СШПК+ХГЧ | 24.1 | 62.1 | 55.2 | 64.7 | 20.7 | 44.8 | 18.1 | 58.6 |
| СШПК | 24.1 | 51.7 | 58.6 | 52.6 | 18.2 | 34.5 | 20.7 | 50.0 |
| Разница | незначимая | незначимая | незначимая | незначимая | незначимая | незначимая | незначимая | незначимая |
| 15 дней | СШПК+ХГЧ | 17.2 | 27.6* | 44.8 | 58.6 | 10.3* | 17.2* | 10.3 | 20.7* |
| СШПК | 24.1 | 55.2 | 44.8 | 50.9 | 6.9* | 24.1 | 13.8 | 41.4 |
| Разница | незначимая | † | незначимая | незначимая | незначимая | незначимая | незначимая | ‡ |
| 1 месяц | ||||||||
| СШПК+ХГЧ | 17.2 | 44.8* | 49.1 | 65.5 | 13.8 | 31.0 | 6.9* | 27.6* |
| СШПК | 13.8 | 55.2 | 42.3* | 55.2 | 6.9 | 37.9 | 13.8 | 41.4 |
| Разница | незначимая | незначимая | незначимая | незначимая | незначимая | незначимая | незначимая | § |
| 3 месяца | ||||||||
| СШПК+ХГЧ | 13.8* | 41.4* | 49.1 | 48.3* | 10.3 | 37.9 | 13.8 | 24.1* |
| СШПК | 13.8 | 31.0* | 37.9* | 48.3 | 13.8 | 34.5 | 14.3 | 48.3 |
| Разница | незначимая | § | незначимая | незначимая | незначимая | незначимая | незначимая | † |
| 6 месяцев | ||||||||
| СШПК+ХГЧ | 7.1* | 40.7* | 51.9 | 55.2 | 19.1 | 50.0 | 3.7* | 40.7 |
| СШПК | 11.5* | 4.2 | 72.4* | 72.4* | 10.3 | 40.7 | 3.7* | 35.4 |
| Разница | незначимая | незначимая | † | незначимая | незначимая | незначимая | незначимая | незначимая |
| Разница по точкам времени | СШПК+ХГ | ‡ | † | незначимая | § | незначимая | † | ‡ | † |
| СШПК | ‡ | † | † | § | § | § | ‡ | незначимая |
| Разница – значение различий между группами лечения. Незначимая – статистические незначимое различие. * значение со статистически значимой разницей с исходными показателями. † P <0.001. ‡ P <0.01. § P <0.05. | ||||||||
Выводы
Использование чипов с ХГ в качестве дополнения к СШПК обеспечивает клинически значимое улучшение по уменьшению глубины пародонтальных карманов и показателю относительного уровня прикрепления по сравнению с группой, в которой лечение проводилось только с помощью метода СШПК.
Такой эффект наблюдался параллельно тому, как СШПК+ХГЧ обеспечивал большее воздействие на поддесневую микробиоту по сравнению с СШПК. Подобные клинические и микробиологические эффекты наблюдались после однократного помещения биорастворимого чипа с хлоргексидином в пародонтальный карман.
Литература
- Haffajee AD, Socransky SS. Microbial etiological agents of destructive periodontal diseases. Periodontol 2000 1994;5:78-111.
- Badersten A, Nilveus R, Egelberg J. Effect of nonsurgical periodontal therapy. I. Moderately advanced peri- odontitis. J Clin Periodontol 1981;8:57-72.
- Haffajee AD, Cugini MA, Dibart S, Smith C, Kent RL Jr., Socransky SS. The effect of SRP on the clinical and microbiological parameters of periodontal diseases. J Clin Periodontol 1997;24:324-334.
- Takamatsu N, Yano K, He T, Umeda M, Ishikawa I. Effect of initial periodontal therapy on the frequency of detecting Bacteroides forsythus, Porphyromonas gin- givalis, and Actinobacillus actinomycetemcomitans. J Periodontol 1999;70:574-580.
- Cugini MA, Haffajee AD, Smith C, Kent RL Jr., Socransky SS. The effect of scaling and root planing on the clinical and microbiological parameters of peri- odontal diseases: 12-month results. J Clin Periodontol 2000;27:30-36.
- Brayer WK, Mellonig JT, Dunlap RM, Marinak KW, Carson RE. Scaling and root planing effectiveness: The effect of root surface access and operator expe- rience. J Periodontol 1989;60:67-72.
- Caffesse RG, Sweeney PL, Smith BA. Scaling and root planing with and without periodontal flap surgery. J Clin Periodontol 1986;13:205-210.
- Rabbani GM, Ash MM Jr., Caffesse RG. The effective- ness of subgingival scaling and root planing in calcu- lus removal. J Periodontol 1981;52:119-123.
- Petersilka GJ, Ehmke B, Flemmig TF. Antimicrobial effects of mechanical debridement. Periodontol 2000 2002;28:56-71.
- Rams TE, Slots J. Local delivery of antimicrobial agents in the periodontal pocket. Periodontol 2000 1996;10: 139-159.
- Palmer RM, Matthews JP, Wilson RF. Adjunctive sys- temic and locally delivered metronidazole in the treat- ment of periodontitis: A controlled clinical study. Br Dent J 1998;184:548-552.
- Griffiths GS, Smart GJ, Bulman JS, Weiss G, Shrowder J, Newman HN. Comparison of clinical outcomes fol- lowing treatment of chronic adult periodontitis with subgingival scaling or subgingival scaling plus metro- nidazole gel. J Clin Periodontol 2000;27:910-917.
- Perinetti G, Paolantonio M, Cordella C, D’Ercole S, Serra E, Piccolomini R. Clinical and microbiological effects of subgingival administration of two active gels on persistent pockets of chronic periodontitis patients. J Clin Periodontol 2004;31:273-281.
- Goodson JM, Tanner A. Antibiotic resistance of the subgingival microbiota following local tetracycline therapy. Oral Microbiol Immunol 1992;7:113-117.
- Walker CB. Selected antimicrobial agents: Mecha- nisms of action, side effects and drug interactions. Periodontol 2000 1996;10:12-28.
- Loesche WJ, Grossman N, Giordano J. Metronidazole in periodontitis (IV). The effect of patient compliance on treatment parameters. J Clin Periodontol 1993;20:96-104.
- Ciancio SG. Systemic medications: Clinical significance in periodontics. J Clin Periodontol 2002;29(Suppl. 2): 17-21.
- Walker CB, Karpinia K, Baehni P. Chemotherapeutics: Antibiotics and other antimicrobials. Periodontol 2000 2004;36:146-165.
- Larsen T. Occurrence of doxycycline resistant bacteria in the oral cavity after local administration of doxycycline in patients with periodontal disease. Scand J Infect Dis 1991;23:89-95.
- van Winkelhoff AJ, Herrera Gonzales D, Winkel EG, Dellemijn-Kippuw N, Vandenbroucke-Grauls CM, Sanz M. Antimicrobial resistance in the subgingival microflora in patients with adult periodontitis. A com- parison between the Netherlands and Spain. J Clin Periodontol 2000;27:79-86.
- Walker CB, Godowski KC, Borden L, et al. The effects of sustained release doxycycline on the anaerobic flora and antibiotic-resistant patterns in subgingival plaque and saliva. J Periodontol 2000;71:768-774.
- Herrera D, Sanz M, Jepsen S, Needleman I, Roldan S. A systematic review on the effect of systemic antimicro- bials as an adjunct to scaling and root planing in peri- odontitis patients. J Clin Periodontol 2002;29(Suppl. 3): 136-159.
- Hugo WB, Longworth AR. Effect of chlorhexidine diac- etate on ‘‘protoplasts’’ and spheroplasts of Escherichia coli, protoplasts of Bacillus megaterium and the gram staining reaction of Staphylococcus aureus. J Pharm Pharmacol 1964;16:751-758.
- Hugo WB, Longworth AR. Some aspects of the mode of action of chlorhexidine. J Pharm Pharmacol 1964;16: 655-662.
- Hugo WB, Longworth AR. Cytological aspects of the mode of action of chlorhexidine diacetate. J Pharm Pharmacol 1965;17:28-32.
- Löe H, Schiott CR. The effect of mouthrinses and topical application of chlorhexidine on the develop- ment of dental plaque and gingivitis in man. J Periodontal Res 1970;5:79-83.
- Braatz L, Garrett S, Claffey N, Egelberg J. Antimicro- bial irrigation of deep pockets to supplement non- surgical periodontal therapy. II. Daily irrigation. J Clin Periodontol 1985;12:630-638.
- Cosyn J, Sabzevar MM. A systematic review on the effects of subgingival chlorhexidine gel administration in the treatment of chronic periodontitis. J Periodontol 2005;76:1805-1813.
- MacAlpine R, Magnusson I, Kiger R, Crigger M, Garrett S, Egelberg J. Antimicrobial irrigation of deep pockets to supplement oral hygiene instruction and root de- bridement. I. Bi-weekly irrigation. J Clin Periodontol 1985;12:568-577.
- Soh LL, Newman HN, Strahan JD. Effects of subgin- gival chlorhexidine irrigation of periodontal inflamma- tion. J Clin Periodontol 1982;9:66-74.
- Wennstrom JL, Dahlen G, Grondahl K, Heijl L. Periodic subgingival antimicrobial irrigation of periodontal pockets. II. Microbiological and radiographical observations. J Clin Periodontol 1987;14:573-580.
- Wennstrom JL, Heijl L, Dahlen G, Grondahl K. Periodic sub- gingival antimicrobial irrigation of periodontal pockets (I). Clinical observations. J Clin Periodontol 1987;14:541-550.
- Langer R. New methods of drug delivery. Science 1990; 249:1527-1533.
- Steinberg D, Friedman M, Soskolne A, Sela MN. A new degradable controlled release device for treatment of periodontal disease: In vitro release study. J Periodon- tol 1990;61:393-398.
- Soskolne WA, Chajek T, Flashner M, et al. An in vivo study of the chlorhexidine release profile of the PerioChip in the gingival crevicular fluid, plasma and urine. J Clin Periodontol 1998;25:1017-1021.
- Oosterwaal PJ, Mikx FH, van den Brink ME, Renggli HH. Bactericidal concentrations of chlorhexidine- digluconate, amine fluoride gel and stannous fluoride gel for subgingival bacteria tested in serum at short contact times. J Periodontal Res 1989;24:155-160.
- Stanley A, Wilson M, Newman HN. The in vitro effects of chlorhexidine on subgingival plaque bacteria. J Clin Periodontol 1989;16:259-264.
- Jeffcoat MK, Bray KS, Ciancio SG, et al. Adjunctive use of a subgingival controlled-release chlorhexidine chip reduces probing depth and improves attachment level compared with scaling and root planing alone. J Periodontol 1998;69:989-997.
- Soskolne WA, Heasman PA, Stabholz A, et al. Sus tained local delivery of chlorhexidine in the treatment of periodontitis: A multi-center study. J Periodontol 1997;68:32-38.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
