Инфанрикс Гекса инструкция, аналоги и состав
| Показания: | Вакцина ІНФАНРИКС ГЕКСА™ показана для первинної та бустерної імунізації дітей з метою профілактики дифтерії, правця, кашлюку, гепатиту В, поліомієліту та захворювань, збудником яких є Haemophilus influenzae типу b. |
| Форма випуска: | Суспензія (DTPa-HBV-IPV) для ін’єкцій у попередньо наповненому одноразовому шприці у комплекті з двома голками та ліофілізат (Hib) у флаконі, що змішуються перед використанням, № 1 або № 10 |
| Производитель, страна: | ГлаксоСмітКляйн Біолоджікалз С.А., Бельгія |
| Действующее вещества: | 1 доза (0,5 мл) відновленої вакцини містить: – дифтерійний анатоксин, адсорбований (D), не менше 30 міжнародних одиниць (МО),– правцевий анатоксин, адсорбований (T), не менше 40 МО, – кашлюковий анатоксин, адсорбований (PT), 25 мкг, –філаментозний гемаглютинін, адсорбований (FHA), 25 мкг, –пертактин, адсорбований (PRN), 8 мкг, – р-ДНК поверхневий антиген вірусу гепатиту В, адсорбований (HBsAg), 10 мкг, –інактивований поліовірус типу 1 (Mahoney), 40 D-антигенних одиниць (DU), – інактивований поліовірус типу 2 (MEF-1), 8 DU, –інактивований поліовірус типу 3 (Saukett), 32 DU, – кон’югат капсульного полісахариду Haemophilus influenzae типу b (PRP), 10 мкг та правцевого анатоксину (ТT), адсорбований ~ 25 мкг |
| МНН: | Diphtheria-Hemophilus influenzae B-pertussis-poliomyelitis-tetanus-hepatitis B |
| Регистрация: | 333/12-300200000з 12.03.2015 по 08.08.2017. Приказ 65 від 04.02.2016 |
| Код АТХ: |
Загальна характеристика
міжнародна непатентована назва: сombined diphtheria, tetanus, acellular pertussis, hepatitis B, inactivated polio vaccine and Haemophilusinfluenzae type b vaccine
основні властивості лікарської форми: Вакцина ІНФАНРИКС ГЕКСА™ – комбінована вакцина для профілактики дифтерії, правця, кашлюку (ацелюлярний компонент), гепатиту В, поліомієліту та захворювань, збудником яких є Haemophilusinfluenzae типу b.
ІНФАНРИКС ГЕКСА™ відповідає вимогам Всесвітньої Організації Охорони здоров’я до виробництва біологічних речовин, дифтерійних, правцевих, кашлюкових та комбінованих вакцин, вакцин для профілактики гепатиту В, отриманих за допомогою технології рекомбінантних ДНК, інактивованих вакцин для профілактики поліомієліту та кон’югованих Hib вакцин.
ЯКІСНИЙ ТА КІЛЬКІСНИЙ СКЛАД:
діючі речовини:1 доза (0,5 мл) відновленої вакцини містить:
– дифтерійний анатоксин, адсорбований (D), не менше 30 міжнародних одиниць (МО),
– правцевий анатоксин, адсорбований (T), не менше 40 МО,
– кашлюковий анатоксин, адсорбований (PT), 25 мкг,
– філаментозний гемаглютинін, адсорбований (FHA), 25 мкг,
– пертактин, адсорбований (PRN), 8 мкг,
– р-ДНК поверхневий антиген вірусу гепатиту В, адсорбований (HBsAg), 10 мкг,
– інактивований поліовірус типу 1 (Mahoney), 40 D-антигенних одиниць (DU),
– інактивований поліовірус типу 2 (MEF-1), 8 DU,
–інактивований поліовірус типу 3 (Saukett), 32 DU,
– кон’югат капсульного полісахариду Haemophilusinfluenzae типу b (PRP), 10 мкг та правцевого анатоксину (ТT), адсорбований ~ 25 мкг
Допоміжні речовини: натрію хлорид – 4,5 мг, cередовище 199 (М199) (включаючи амінокислоти) – 1,15 мг, вода для ін‘єкцій – 0,5 мл, лактоза – 12,6 мг.
Ад’ювант: алюміній (у формі солей) – 0,82 мг:
– алюмінію гідроксид (Al(OH)3) – 0,5 мг,
– алюмінію фосфат (AlPO4) – 0,32 мг.
Калію хлорид, динатрію фосфат, калію фосфорнокислий однозаміщений, полісорбат 20 та 80, гліцин, формальдегід, неоміцину сульфат, поліміксину В сульфат присутні як залишки виробничого процесу.
ФОРМА ВИПУСКУ: суспензія (DTPa–HBV-IPV) для ін’єкцій та ліофілізат (Hib), що змішуються перед використанням.
ФАРМАКОТЕРАПЕВТИЧНА ГРУПА: Бактеріальні та вірусні вакцини комбіновані. КОД ATC: J07CA09..
ІМУНОЛОГІЧНІ ТА БІОЛОГІЧНІ ОСОБЛИВОСТІ:
Імуногенність
Результати, отримані в клінічних дослідженнях для кожного з компонентів, підсумовані у наведених нижче таблицях:
Число суб’єктів (у процентах) з титрами антитіл > рівня антитіл необхідного для захисту через один місяць після первинної вакцинації ІНФАНРИКС ГЕКСА™
|
Антитіла |
Дві дози |
Три дози |
|||
|
3-5 місяців N=530 (4 клінічні дослідження) |
2-3-4 місяця N=196 (2 клінічні дослідження) |
2-4-6 місяців N=1693 (6 клінічних досліджень) |
3-4-5 місяців N=1055 (6 клінічних досліджень) |
6-10-14 тижнів N=265 (1 клінічне дослідження) |
|
|
% |
% |
% |
% |
% |
|
|
Проти дифтерії (0,1 МО/мл)† |
98.0 |
100.0 |
99.8 |
99.7 |
99.2 |
|
Проти правця (0,1 МО/мл) † |
100.0 |
100.0 |
100.0 |
100.0 |
99.6 |
|
Проти кашлюку (5 El.О/мл) |
99.5 |
100.0 |
100.0 |
99.8 |
99.6 |
|
Анти-FHA (5 El.О/мл) |
99.7 |
100.0 |
100.0 |
100.0 |
100.0 |
|
Анти-PRN (5 El.О/мл) |
99.0 |
100.0 |
100.0 |
99.7 |
98.9 |
|
Анти-HBs (10 мМО/мл) † |
96.8 |
99.5 |
98.9 |
98.0 |
98.5* |
|
Анти-Поліо тип 1 (1/8 розвед.) † |
99.4 |
100.0 |
99.9 |
99.7 |
99.6 |
|
Анти-Поліо тип 2 (1/8 розвед.) † |
96.3 |
97.8 |
99.3 |
98.9 |
95.7 |
|
Анти-Поліо тип 3 (1/8 розвед.) † |
98.8 |
100.0 |
99.7 |
99.7 |
99.6 |
|
Анти-PRP (0.15 мкг/мл) † |
91.7 |
96.4 |
96.6 |
96.8 |
97.4 |
|
* - у підгрупі новонароджених, яким при народженні не вводили вакцину для профілактики гепатиту В, у 77,7 % суб'єктів титри проти антигену HBs були > 10 мМО/мл. † - прийнято як рівень, що забезпечує захист. |
|||||
Число суб’єктів (у процентах) з титрами антитіл > рівня антитіл необхідного для забезпечення захисту через один місяць після бустерної вакцинації
ІНФАНРИКС ГЕКСА™
|
Антитіла (захисний рівень) |
Бустерна вакцинація у 11 місячному віці після курсу первинної вакцинації у 3 – 5 місячному віці N=532 (3 клінічні дослідження) |
Бустерна вакцинація протягом другого року життя після введення трьох доз вакцини під час курсу первинної вакцинації N=2009 (12 клінічних досліджень) |
|
Проти дифтерії (0.1 МО/мл) † |
100.0 |
99.9 |
|
Проти правця (0.1 МО/мл) † |
100.0 |
99.9 |
|
Проти кашлюку (5 El.О/мл) |
100.0 |
99.9 |
|
Анти-FHA (5 El.О/мл) |
100.0 |
99.9 |
|
Анти-PRN (5 El.О/мл) |
99.2 |
99.5 |
|
Анти-HBs (10 мМО/мл) † |
98.9 |
98.4 |
|
Анти-Поліо тип 1 (1/8 розвед.) † |
99.8 |
99.9 |
|
Анти-Поліо тип 2 (1/8 розвед.) † |
99.4 |
99.9 |
|
Анти-Поліо тип 3 (1/8 розвед.) † |
99.2 |
99.9 |
|
Анти-PRP (0.15 мкг/мл) † |
99.6 |
99.7 |
† - прийнято як рівень, що забезпечує захист.
Зважаючи на те, що імунна відповідь на антигени проти компонентів збудника кашлюку після введення вакцини ІНФАНРИКС ГЕКСА™є еквівалентною до такої для вакцини ІНФАНРИКС™, очікується, що захистна ефективність цих двох вакцин також є еквівалентною.
Ефективність захисту проти кашлюку
Захисна ефективність кашлюкового компонентувакцини ІНФАНРИКС™для профілактики типового кашлюку, як його визначає ВООЗ (³21 дня пароксизмального кашлю) була продемонстрована після первинної імунізації трьома дозами в клінічних дослідженнях, перелічених в таблиці нижче:
|
Клінічне дослідження |
Країна |
Графік імунізації |
Ефективність вакцини |
Фактори |
|
Дослідження сімейних контактів (сліпе проспективне) |
Німеччина |
3, 4, 5 місяців |
88,7% |
Базуючись на даних, зібраних з вторинних контактів у сім’ях, в яких спостерігався індексний випадок типового кашлюку. |
|
Дослідження ефективності (спонсороване Національним інститутом охорони здоров'я) |
Італія |
2, 4, 6 місяців |
84% |
При подальшому спостереженні за цією ж групою пацієнтів ефективність вакцини була підтверджена протягом 60 місяців після завершення первинної вакцинації без введення бустерної дози протикашлюкової вакцини. |
Стійкість імунної відповіді
Було показано, що захисний імунітет проти гепатиту В зберігається протягом якнайменше 3,5 роки у більш ніж 90 % дітей, яким були введені чотири дози вакцини ІНФАНРИКС ГЕКСА™. Рівні антитіл не відрізнялися від таких, що спостерігали у контрольній групі пацієнтів, яким була введена моновалентна вакцина для профілактики гепатиту В.
Досвід після реєстраційного застосування
Результати довгострокового спостереження в Швеції показують, що ацелюлярна вакцина для профілактики кашлюку є ефективною у немовлят при виконанні первинної імунізації в 3 та 5 місяців і введенні бустерної дози у віці приблизно 12 місяців. Тим не менш, існують дані, що доводять слабшання протикашлюкового захисту в віці 7-8 років з графіком імунізації 3-5-12 місяців. Тому призначення другої бустерної дози вакцини може бути виправданим у дітей 5-7 років, яким щеплення раніше проводили за цим графіком.
Ефективність Hib
Ефективність Hib компоненту вакцини ІНФАНРИКС ГЕКСАTMбула встановлена та продовжує вивчатися у клінічному дослідженні у Німеччині під час періоду постмаркетингового фармаконагляду. Протягом 7 років періоду спостереження, було встановлено, що ефективність Hib компонентів двох гексавалентних вакцин, одною з яких була ІНФАНРИКС ГЕКСА™, складала 89.6% для щеплених, які отримали первинний вакцинальний комплекс та 100% для щеплених, які отримали первинний вакцинальний комплекс плюс бустерну дозу (незалежно від Hib вакцини, що використовувалася для первинної вакцинації).
ІНФАНРИКС ГЕКСАTM- єдина Hib вакцина в Італії, що доступна починаючи з 2006 року. Іммунізацію проводять у віці 3, 5 та 11 місяців, охоплення перевищує 95%. В країні продовжується належний контроль за Hib-інфекцією. За шість років пасивного спостереження, починаючи з 2006 року, повідомлялось про чотири підтверджені випадки виникнення хвороби серед дітей з Італії віком до 5 років.
Фармакокінетика
Оцінка фармакокінетичних властивостей не є обов'язковою для вакцин.
ПОКАЗАННЯ ДЛЯ ЗАСТОСУВАННЯ: вакцина ІНФАНРИКС ГЕКСА™ показана для первинної та бустерної імунізації дітей з метою профілактики дифтерії, правця, кашлюку, гепатиту В, поліомієліту та захворювань, збудником яких є Haemophilusinfluenzae типу b.
СПОСІБ ЗАСТОСУВАННЯ ТА ДОЗИ:
Первинна вакцинація
Режим первинної вакцинації складається з введення 3-х доз по 0,5 мл (наприклад, введення вакцини у віці 2-х, 3-х, 4-х місяців; або 3-х, 4-х, 5-ти місяців; або 2-х, 4-х, 6-ти місяців) або 2-х доз (наприклад, введення вакцини у віці 3-х, 5-ти місяців). Між дозами повинен бути інтервал щонайменше в 1 місяць. Введення вакцини ІНФАНРИКС ГЕКСА™, призначене відповідно до графіку РПІ (Розширеної програми імунізації; у віці 6-ти, 10-ти, 14-ти тижнів), може бути використане тільки, якщо вакцинований при народженні отримав дозу вакцини для профілактики гепатиту В.
Повинні дотримуватися встановлених уповноваженими органами країни заходів щодо імунопрофілактики гепатиту В. Якщо вакцинований при народженні отримав дозу вакцини для профілактики гепатиту В то, вакцина ІНФАНРИКС ГЕКСА™ може бути використана як заміна для додаткових доз вакцини для профілактики гепатиту В у віці від 6 тижнів. Якщо до цього віку необхідно введення другої дози вакцини для профілактики гепатиту В, в цьому випадку необхідно використовувати моновалентну вакцину для профілактики гепатиту В.
Бустерна вакцинація
Після вакцинації 2 дозами (наприклад, у віці 3-х, 5-ти місяців) вакцини ІНФАНРИКС ГЕКСА™, бустерна доза мусить бути введена, як мінімум, через 6 місяців після останньої первинної дози, найкраще у віці між 11 та 13 місяцями.
Після вакцинації 3 дозами (наприклад, у віці 2-х, 3-х, 4-х місяці; 3-х, 4-х, 5-ти місяців; 2-х, 4-х, 6-ти місяців) вакцини ІНФАНРИКС ГЕКСА™, бустерна доза мусить бути введена, як мінімум, через 6 місяців після останньої первинної дози, найкраще у віці до 18 місяців.
Бустерні дози необхідно вводити у відповідності до офіційних рекомендацій.
Вакцина ІНФАНРИКС ГЕКСА™може бути розглянута для введення бустерної дози, якщо її склад відповідає офіційним рекомендаціям.
Інші комбінації антигенів, що були вивчені у клінічних випробуваннях після первинної вакцинації, можуть бути використані для введення бустерної дози: комбінації антигенів дифтерії, правця, ацелюлярного кашлюку (DTPa); дифтерії, правця, ацелюлярного кашлюку, Haemophilus influenzae типу b (DTPa+Hib); дифтерії, правця, ацелюлярного кашлюку, інактивованого вірусу поліомієліту, Haemophilus influenzae типу b (DTPa-IPV+Hib) та дифтерії, правця, ацелюлярного кашлюку, гепатиту В, інактивованого вірусу поліомієліту, Haemophilus influenzae типу b (DTPa-HBV-IPV+Hib).
ІНФАНРИКС ГЕКСА™ призначена для глибокого внутрішньом‘язового введення.
Щеплення дітей на території України здійснюється згідно з вимогами діючих наказів МОЗ України.
Діти. Немає даних щодо безпеки та ефективності ІНФАНРИКС ГЕКСА™ у дітей старше 36 місяців. Додатково див. розділи «Показання», «Спосіб застосування та дози»).
ПОБІЧНА ДІЯ:
Дані клінічних досліджень
Профіль безпеки, наведений нижче, базується на даних, отриманих при імунізації більш ніж 16 000 пацієнтів.
Як і у випадку з вакциною DTPa та комбінованими вакцинами, що містять DTPa, повідомлялось про збільшення частоти місцевої реакції та лихоманки після бустерної вакцинації ІНФАНРИКС ГЕКСА™ порівняно з первинним курсом.
Реакції, які спостерігались, визначались з наступною частотою:
Дуже часто: > 1/10
Часто: > 1/100 та < 1/10
Нечасто: > 1/1000 та < 1/100
Рідко: > 1/10000 та < 1/1000
Дуже рідко: < 1/10000
Порушення метаболізму та живлення
Дуже часто: втрата апетиту
Порушення психіки
Дуже часто: дратівливість, безперервний крик, неспокій
Часто: нервозність
Порушення функції нервової системи
Нечастo: сонливість
Дуже рідко: судоми (з та без лихоманки)**
Порушення дихання, функції органів грудної порожнини та середостіння
Нечасто: кашель
Порушення з боку шлунково-кишкового тракту
Часто: блювання, діарея
Порушення функції шкіри та підшкірних тканин
Рідко: висипка
Дуже рідко: дерматит
Загальні порушення та патологічні реакції у місці ін’єкції
Дуже часто: біль, почервоніння, місцева припухлість у місці ін’єкції
(< 50 мм), лихоманка > 38 оС, втомлюваність.
Часто: місцева припухлість у місці ін’єкції (˃50 мм)*, лихоманка ˃39,5 оС, патологічні реакції у місці ін’єкції, включаючи ущільнення.
Нечасто: дифузна припухлість кінцівки, куди зроблена ін’єкція, іноді з залученням сусідніх суглобів *.
Даніпісляреєстраційного нагляду
Порушення кровоносної та лімфатичної системи
Лімфаденопатія, тромбоцитопенія
Порушення імунітету
Алергічні реакції (включаючи анафілактичні та анафілактоїдні реакції)
Порушення функції нервової системи
Колапс або шокоподібний стан (гіпотонічно-гіпореактивний епізод)**
Порушення дихальної системи
Апное (див. розділ «Особливості застосування» для апное у передчасно народжених немовлят (≤ 28 тижнів гестації))
Порушення з боку шкіри та підшкірних тканин
Ангіоневротичний набряк
Реакції у місці ін’єкції
Поширені реакції у вигляді набряку, набряку всієї кінцівки, куди зроблено щеплення*, везикули у місці ін’єкції.
* У дітей, яким були введені первинні дози ацелюлярної вакцини для профілактики кашлюку, ймовірність виникнення реакцій припухлості після введення бустерної дози, більша у порівнянні із такими, що отримали цільноклітинні вакцини для профілактики кашлюку. Ці реакції минають у середньому через 4 дні.
** Аналіз показників повідомлень про післяреєстраційне застосування вказує на потенційно збільшений ризик судом (з лихоманкою або без неї) та гіпотонічно-гіпореспонсивних епізодів, у порівнянні з групами, які застосовували ІНФАНРИКС ГЕКСА™ з пневмококовою полісахаридною кон'югованою адсорбованою 13-валентною вакциною (ПКВ13) та групами, які застосовували лише вакцину ІНФАНРИКС ГЕКСА™.
- Клінічний досвід використання вакцини ІНФАНРИКС ГЕКСАтмз вакциною для профілактики гепатиту В:
Повідомлялось, що протягом постмаркетингового фармаконагляду після введення вакцини для профілактики гепатиту В виробництва компанії GlaxoSmithKline Biologicals, у дітей віком < 2 років, спостерігалося виникнення таких побічних явищ, як параліч, нейропатія, синдром Гієна-Барре, енцефалопатія, енцефаліт, менінгіт, симптоми, схожі на сироваткову хворобу, неврит, гіпотензія, васкуліт, червоний плаский лишай, поліморфна еритема, артрит та м‘язова слабкість. Причинно-наслідковий зв’язок між цими побічними явищами та введенням вакцини встановлений не був. Повідомлялося про тромбоцитопенію при застосуванні з моноваленною вакциною проти гепатиту В.
• Клінічний досвід використання вакцини ІНФАНРИКС ГЕКСАтм з пневмококовою полісахаридною кон'югованою 7-валентною вакциною (ПКВ7):
У клінічних дослідженнях, в яких деякі з щеплених отриманих ІНФАНРИКС ГЕКСАтм одночасно з ПКВ 7 в якості ревакцинації (4-ї) дози обох вакцин, повідомлялося про лихоманку ³ 38,0 ° C у 43,4% дітей, які отримували ПКВ 7 з ІНФАНРИКС ГЕКСАтм в порівнянні з 30,5% дітей, які були щеплені тільки ІНФАНРИКС ГЕКСАтм. Лихоманка більше 39,5 ° С спостерігалась у 2,6% і 1,5% дітей, які отримували ІНФАНРИКС ГЕКСАтм з або без ПКВ 7 відповідно, (дивіться розділ «Особливості застосування»). Випадки лихоманки після одночасного введення двох вакцин під час введення первинного вакцинального комплексу були нижчими, ніж спостерігалося після проведення ревакцинації.
Звітування про побічні реакції.
Звітування про побічні реакції після реєстрації лікарського засобу має важливе значення.
Це дозволяє здійснювати безперервний моніторинг співвідношення між користю та ризиком пов'язаним із застосуванням лікарського засобу. Медичним працівникам необхідно повідомляти про будь-які про побічні реакції.
ПРОТИПОКАЗАННЯ: Вакцина ІНФАНРИКС ГЕКСА™ не призначається особам з підвищеною гіперчутливістю до основних компонентів або до будь-якої з допоміжних/ залишкових речовин в тому числі поліміксину, неоміцину та формальдегіду (див. розділ «Якісний та кількісний склад») та особам, що мали ознаки гіперчутливості після попереднього введення вакцин для профілактики дифтерії, правця, кашлюку, гепатиту В, поліомієліту або захворювань, збудником яких є Haemophilusinfluenzae типу b (Hib).
ІНФАНРИКС ГЕКСА™ протипоказана, якщо у дитини спостерігалася енцефалопатія невідомої етіології в межах 7 днів після попередньої вакцинації з кашлюкововмісною вакциною. За цих обставин вакцинацію проти кашлюку слід припинити і курс вакцинації слід продовжити вакцинами для профілактики дифтерії, правця, гепатиту В, інактивованою поліомієлітною вакциною та вакциною для профілактики захворювань, що викликаються збудником Haemophilusinfluenzae типу b.
Як і у випадку з іншими вакцинами, застосування ІНФАНРИКС ГЕКСАТМ у пацієнтів з гострим захворюванням, що супроводжується лихоманкою, слід відкласти. Наявність незначної інфекції не є протипоказанням.
ОСОБЛИВОСТІ ЗАСТОСУВАННЯ:
Вакцинації повинні передувати збір медичного анамнезу (особливо, що стосується попередньої вакцинації і можливих випадків побічної реакції) і клінічне обстеження.
Якщо відомо, що будь-яка з наступних подій трапилася у часовому зв’язку з отриманням кашлюкововмісної вакцини, рішення про призначення послідуючої дози вакцини, що містить кашлюковий компонент, повинно бути ретельно обмірковане:
- температура ³40,0 °С в межах 48 годин після вакцинації, не пов’язана з іншими причинами;
- колапс або шокоподібний стан (гіпотонічно-гіпореспонсивний епізод) в межах 48 годин після вакцинації;
- безперервний плач, що триває ³3 годин, спостерігається в межах 48 годин після вакцинації;
- судоми з лихоманкою або без неї, що спостерігаються в межах 3 днів після вакцинації.
При обставинах, коли висока захворюваність на кашлюк, потенційна користь переважає можливий ризик.
У дітей з прогресуючими неврологічними порушеннями, включаючи інфантильні спазми, неконтрольовану епілепсію або прогресуючу енцефалопатію, краще відкласти щеплення для профілактики кашлюку (вакциною з ацелюлярним або з цільноклітинним кашлюковим компонентом) до покращання або стабілізації стану. Однак, рішення про застосування кашлюкової вакцини слід приймати на індивідуальній основі після ретельного зваження можливих ризиків та переваг.
Як і для всіх ін‘єкційних вакцин, відповідна допомога та медичний нагляд завжди повинні бути легко доступними у випадку виникнення рідкісних анафілактичних реакцій після введення вакцини. Тому пацієнти повинні бути під наглядом не менше 30 хвилин після вакцинації.
Вакцину ІНФАНРИКС ГЕКСА™ слід призначати з обережністю особам з тромбоцитопенією або порушеннями зсідання крові, оскільки при внутрішньом’язовому введенні у таких осіб можуть мати місце кровотечі.
Ні за яких обставин вакцину ІНФАНРИКС ГЕКСА™ не слід вводити внутрішньовенно або внутрішьошкірно.
ІНФАНРИКС ГЕКСА™ не буде запобігати інфекціям, викликаним іншими збудниками, відмінними від Corynebacterium diphtheriae, Clostridium tetani, Bordetella pertussis, вірусу гепатиту В, вірусів поліомієліту або бактерії Haemophilus influenzae типу b. Однак, імунізація цією вакциною може бути профілактичною мірою для захворювання гепатитом D, тому що ця інфекція (збудником якої є агент дельта) не зустрічається при відсутності інфекції вірусом гепатиту В.
Захисна імунна відповідь може бути отримана не у всіх вакцинованих (див. розділ «Імунологічні та біологічні властивості»).
Наявність в анамнезі життя фебрильних судом та наявність в родині судом, синдрому раптової смерті немовля не є протипоказанням для вакцинації ІНФАНРИКС ГЕКСА™. Вакциновані з фебрильними судомами в анамнезі повинні знаходитись під наглядом, оскільки такі побічні прояви можуть виникати через 2-3 дні після вакцинації.
Інфекція, викликана вірусом імунодефіциту людини (ВІЛ), не розглядається як протипоказання. Після вакцинації пацієнтів з пригніченим імунітетом може не розвинутись достатня імунологічна відповідь.
Оскільки антиген капсульного полісахариду Hib екскретується з сечею, можна спостерігати позитивний тест сечі протягом 1-2 тижнів після вакцинації. Необхідно проводити інші тести, щоб підтвердити діагноз Hib-інфекції в цей період.
Обмежені дані по застосуванню ІНФАНРИКС ГЕКСА™ для імунізації 169 передчасно народжених немовлят показують, що ця вакцина може застосовуватись для імунізації таких дітей. Однак, імунна відповідь може бути нижчою і рівень клінічного захисту залишається невідомим.
При призначенні первинної імунізації дуже передчасно народженим немовлятам (≤ 28 тижнів гестації) слід мати на увазі потенційний ризик розвитку у них апное та необхідність контролю за дихальною функцією протягом 48-72 годин після вакцинації, особливо у випадку, якщо немовля має в анамнезі недорозвиток дихальної системи. Оскільки користь вакцинації у цієї групи немовлят є високою, від вакцинації не слід відмовлятись або її затримувати.
Синкопе (непритомність) може виникнути під час або раніше будь-якої ін’єкційної вакцинації, як психогенна реакція на ін’єкцію голкою. Вакцинацію необхідно проводити тільки в положенні вакцинованого сидячи або лежачи, та залишаючи його в тому ж положенні (сидячи або лежачи) протягом 15 хвилин після вакцинації для попередження ризику його травматизації.
Висока частота виникнення лихоманки (>39,5°C) спостерігалася у новонароджених, які були щеплені ІНФАНРИКС ГЕКСА™ та ПКВ7 у порівнянні з новонародженими, які були вакциновані лише гексавалентною вакциною.
Зросла кількість повідомлень про судоми (з лихоманкою або без неї) та гіпотонічно-гіпореспонсивний епізод (ГГЕ) при одночасному застосуванні вакцин ІНФАНРИКС ГЕКСА™ та ПКВ13 (див. розділ «Побічна дія»).
Жарознижуюча терапія має бути розпочата відповідно до місцевих програм лікування.
Цей лікарський засіб містить менше 1 ммоль (39 мг)/дозу калію, тобто практично вільний від калію.
Цей лікарський засіб містить менше 1 ммоль (23 мг)/дозу натрію, тобто практично вільний від натрію.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Не стосується даної групи.
Взаємодія з іншими лікарськими препаратами та інші форми взаємодії
Для надання відповідних рекомендацій, обсяг даних, що стосуються ефективності та безпеки вакцини, для введення вакцини ІНФАНРИКС ГЕКСА™одночасно з вакциною для профілактики кору-епідемічного паротиту-краснухи, є недостатнім.
Дані стосовно одночасного введення вакцини ІНФАНРИКС ГЕКСА™та ПКВ7 свідчать про відсутність відповідної клінічно значущої перехресної взаємодії імунної відповіді у вигляді виработки (продукції) антитіл до кожного з індивідуальних антигенів, за умов введення 3 доз первинної вакцинації.
Однак, є повідомлення про високу частоту виникнення лихоманки (при температурі вище 39,5оС) у новонароджених, які отримали вакцини ІНФАНРИКС ГЕКСА™ та ПКВ7, у порівнянні з такими, що були імунізовані тільки однією гексавалентною вакциною (див. розділ «Особливості застосування» та інструкції для ПКВ13 та ПКВ7).
Якщо ІНФАНРИКС ГЕКСА™ застосовується одночасно з іншими ін’єкційними вакцинами, ці препарати завжди потрібно вводити в різні ділянки тіла.
Як і для інших вакцин, можна очікувати, що у пацієнтів, які отримують імуносупресивну терапію, може не досягатися адекватна імунна відповідь.
Застосування у період вагітності або годування груддю.
Оскільки ІНФАНРИКС ГЕКСА™ не призначена для використання у дорослих, дані про безпеку застосування вакцини в період вагітності або лактації відсутні.
Інструкція стосовно приготування вакцини перед використанням:
Представлення у флаконах і попередньо наповнених шприцах
Суспензію DTPa-HBV-IPV слід струсити для одержання однорідної мутної білої суспензії. Суспензію DTPa-HBV-IPV та порошок Hib необхідно перевірити візуально на наявність будь-яких сторонніх часток і/або змін фізичних властивостей. Вакцину необхідно утилізувати, якщо вона містить сторонні частинки або змінила загальний вигляд.
Будь-який невикористаний продукт або відходні матеріали мають бути знищені згідно з місцевими вимогами.
Вакцину необхідно готувати шляхом додавання усього вмісту попередньо наповненого шприца до флакону, що містить порошок Hib.
Гарною клінічною практикою є введення вакцини лише тоді, коли вона досягне кімнатної температури. Щоб досягти цього, флакон необхідно залишити при кімнатній температурі (25 ± 3 °C) щонайменше на п’ять хвилин перед приєднанням попередньо заповненого шприца та розведенням вакцини.
Відновлена вакцина являє собою злегка більш мутну суспензію, ніж рідкий компонент окремо. Це є нормальним явищем.
Після відновлення вакцина має бути використана негайно. Однак, вакцина може зберігатись до 8 годин при кімнатній температурі (21 °С).
Набирають увесь вміст флакону.
Будь-який невикористаний продукт або відходні матеріали мають бути утилізовані згідно з місцевими вимогами.
Особливі інструкції стосовно використання попередньо наповненого шприца з адаптером з насадкою Люера (PRTC – пластиковий жорсткий гвинтовий ковпачок)
Захисний ковпачок голки
 Голка
Голка
 Шприц
Шприц

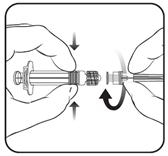
1. Тримаючи циліндр шприца в одній руці (не тримайтеся за поршень шприца), відкрутіть ковпачок шприца, обертаючи його проти годинникової стрілки.
2. Вставте голку в шприц, закрутіть її повністю до упору за годинниковою стрілкою (див. малюнок).
3. Зніміть захисний ковпачок голки, який може бути дещо щільно закріплений.
4. Введіть вакцину.
ПЕРЕДОЗУВАННЯ:
Даних недостатньо.
УМОВИ ЗБЕРІГАННЯ: Вакцину ІНФАНРИКС ГЕКСА™ необхідно зберігати при температурі від 2 до 8 °С. Зберігати в захищеному від світла та недоступному для дітей місці. При транспортуванні слід дотримуватися рекомендованих умов зберігання.
DTPa-HBV-IРV суспензію та приготовлену для введення вакцину не можна заморожувати.
Не використовувати, якщо вакцина була заморожена.
Дані стабільності показують, що компоненти вакцини залишаються сталими при температурі до 25°С протягом 72 годин. В кінці цього періоду вакцина ІНФАНРИКС ГЕКСА™ повинна бути використана або утилізована. Ці дані призначені для інформування медичних працівників на випадок тимчасових коливань температурних умов.
Після відновлення вакцина має бути використана негайно. Однак стабільність була продемонстрована протягом до 8 годин при кімнатній температурі (21 °С).
ТЕРМІН ПРИДАТНОСТІ: 36 місяців. Дата закінчення терміну придатності вакцини зазначена на упаковці. Дата останнього можливого використання відповідає останньому дню вказаного місяця.
НЕСУМІСНІСТЬ: через відсутність досліджень, вакцину не слід змішувати з іншими лікарськими засобами в одному шприці.
ПАКУВАННЯ: суспензія для ін’єкцій (DTPa-HBV-IPV) у попередньо наповненому одноразовому шприці, що містить монодозу препарату (0,5 мл), у комплекті з двома голками та флакон з ліофілізатом (Hib) для 1 дози, що змішуються перед використанням. Шприц з голками закриті гумовими ковпачками.
Дві голки (одного розміру), шприц та флакон герметично запаковані у пластиковий контейнер.
По 1 або по 10 пластикових контейнерів вкладають в картонну коробку разом з інструкцією про застосування.
Флакони і шприці виготовлені з нейтрального скла типу І, яке відповідає вимогам Європейської Фармакопеї.
КАТЕГОРІЯ ВІДПУСКУ. За рецептом.
ВИРОБНИК.
ГлаксоСмітКляйн Біолоджікалз С.А., Бельгія / GlaxoSmithKline Biologicals S.A., Belgium.
МІСЦЕЗНАХОДЖЕННЯ ВИРОБНИКА ТА ЙОГО АДРЕСА МІСЦЯ ПРОВАДЖЕННЯ ДІЯЛЬНОСТІ.
Рю де л’Інстітю, 89 1330 м. Ріксенсарт, Бельгія / Rue de l'Institut, 89 1330 Rixensart, Belgium.
Представництво в Україні:
ТОВ «ГлаксоСмітКляйн Фармасьютікалс Україна», 02152, м. Київ, проспект Павла Тичини, буд. 1-В, тел. (044) 585-51-85, факс (044) 585-51-92.
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Diphtheria-Hemophilus influenzae B-pertussis-poliomyelitis-tetanus-hepatitis B |
| Код АТХ | J07CA09 |
| Форма выпуска | суспензия |
- Гексаксим вакцина Санофі Пастер С.А. (повний цикл виробництва, випуск серії)/ЗАТ "Санофі-Авентіс" (вторинне пакування), Франція/Угорщина


