Иммунин 1200 Мо инструкция, аналоги и состав
| Показания: | Лікування і профілактика епізодів кровотеч у пацієнтів з гемофілією В (вроджений дефіцит фактора IX) віком від 6 років. |
| Форма випуска: | Порошок для розчину для інфузій/ін’єкцій по 1200 МО у флаконах у комплекті з розчинником (стерильна вода для ін’єкцій) по 10 мл у флаконах та набором для розчинення і введення |
| Производитель, страна: | БАКСТЕР АГ, Австрія |
| Действующее вещества: | вміст інгредієнта на флакон: фактор коагуляції крові людини ІХ - 1200* МО, специфічна активність не менше 50 МО/мг білка; білок плазми людини: 1200 МО - 6-29 мг;* МО (IU) - міжнародна одиниця на основі міжнародного стандарту ВООЗ для концентратів Фактора ІХ системи коагуляції крові людини |
| МНН: | Coagulation factor IX - Фактор коагуляции крови IX |
| Регистрация: | UA/13037/01/03з 21.08.2013 по 21.08.2018. Приказ 649 від 02.10.2015 |
| Код АТХ: |
Склад:
діюча речовина: Coagulation Factor IХ;
1 флакон з порошком містить:
Діюча речовина |
Вміст речовини на флакон |
||
|
200 MО |
600 MО |
1200 MО |
|
|
Фактор коагуляції крові людини IХ: |
|||
|
активність |
200 MО* |
600 MО* |
1200 MО* |
|
специфічна активність |
≥50 МО/мг білка |
≥50 МО/мг білка |
≥50 МО/мг білка |
|
білок плазми людини |
1–5 мг |
3–14 мг |
6–29 мг |
* MО (IU) - міжнародна одиниця на основі міжнародного стандарту ВООЗ для концентратів фактора IX системи коагуляції крові людини
допоміжні речовини: натрію цитрат, дигідрат, натрію хлорид;
флакон з розчинником містить воду для ін’єкцій.
Лікарська форма. Порошок для розчину для інфузій/ін’єкцій.
Основні фізико-хімічні властивості: порошок або крихка речовина білого або блідо-жовтого кольору.
Фармакотерапевтична група. Гемостатичні засоби. Фактори згортання крові. Фактор згортання IХ.
Код АТХ В02В D04.
Імунологічні і біологічні властивості.
Фактор IX являє собою одноланцюговий глікопротеїн з молекулярною масою близько 68 000 дальтон. Він синтезується в печінці і є вітамін-К-залежним фактором коагуляції. Фактор IX активується фактором ХIа внутрішнім шляхом коагуляції або комплексом фактор VII/тканинний фактор зовнішнім шляхом коагуляції. Активований фактор IX у комплексі з активованим фактором VIII активує фактор X. Активований фактор X перетворює протромбін у тромбін. Під дією тромбіну фібриноген перетворюється у фібрин, який утворює згусток. Гемофілія В є спадковим, пов’язаним зі статтю, порушенням коагуляції крові внаслідок зниженого рівня фактора IX і проявляється масивними крововиливами в суглоби, м’язи або внутрішні органи, які відбуваються або спонтанно, або в результаті випадкових травм чи операцій. Замісна терапія підвищує плазмовий рівень фактора IX і, таким чином, дає змогу тимчасово відкоригувати дефіцит фактора і знижує тенденцію до кровоточивості.
З урахуванням даних, отриманих у ході проведення фази 4 дослідження, середнє значення поступового відновлення (IR) фактора IX у раніше лікованих пацієнтів віком від 12 років (n=27) становило 1,1 (± 0,27) з діапазоном від 0,6 до 1,7 МО/дл на 1 МО/кг. У цьому ж дослідженні середнє значення IR у раніше лікованих пацієнтів віком до 11 років (n=4) становило 0,9 (± 0,12) з діапазоном від 0,8 до 1,1.
Результати дослідження фармакокінетичних параметрів у 26 пацієнтів.
Таблиця 1
|
Параметр |
Кількість пацієнтів |
Середня величина |
Стандартне відхилення |
95 % довірчий інтервал |
|
Кліренс (мл/год/кг) |
26 |
8,89 |
2,91 |
7,72-10,06 |
|
Середній час утримання (год) |
26 |
23,86 |
5,09 |
1,85-25,88 |
Біологічний час напіввиведення становить близько 17 годин.
Клінічні характеристики.
Показання.
Лікування і профілактика епізодів кровотеч у пацієнтів з гемофілією В (вроджений дефіцит фактора IX) віком від 6 років.
Протипоказання.
Підвищена чутливість до діючої речовини або будь-якої з допоміжних речовин препарату. Синдром дисемінованого внутрішньосудинного згортання (ДВЗ-синдром) і/або гіперфібриноліз. Встановлена алергія до гепарину або індукована гепарином тромбоцитопенія в анамнезі.
У разі виявлення цих станів під час відповідного лікування препарат ІМУНІН можна вводити лише у разі кровотеч, що загрожують життю.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Даних щодо взаємодії фактора коагуляції крові людини IХ з іншими медичними препаратами немає.
Особливості застосування.
Реакції підвищеної чутливості
Можливі алергічні реакції підвищеної чутливості. Препарат містить слідові кількості інших білків, окрім фактора ІХ. Пацієнтам або доглядачам за ними потрібно повідомити про ранні ознаки реакцій підвищеної чутливості, у тому числі шкірний висип, загальну кропив’янку, стиснення у грудях, свистяче дихання, гіпотонію та анафілаксію. При виявленні цих симптомів пацієнтам потрібно рекомендувати негайно припинити застосування препарату і звернутися до лікаря.
Інгібітори
Після повторного лікування препаратами фактора коагуляції крові IX пацієнтів потрібно контролювати щодо розвитку нейтралізуючих антитіл (інгібіторів), які кількісно визначаються в одиницях Бетезда (БО) за допомогою відповідних біологічних аналізів.
Якщо не вдається досягти очікуваного рівня активності фактора IX у плазмі крові або якщо кровотеча не контролюється при застосуванні відповідної дози препарату, слід провести аналіз, щоб визначити присутність інгібітору фактора IX. У пацієнтів з високим титром інгібіторів терапія фактором IX може виявитися неефективною, і слід розглянути інші можливості терапії. Ведення таких пацієнтів повинно проводитися лікарями, які мають досвід лікування хворих на гемофілію. У такому разі потрібно проконсультуватися з фахівцями спеціалізованого центру гемофілії.
Опубліковано повідомлення про взаємозв'язок між розвитком інгібіторів до фактора IX і виникненням алергічних реакцій. Тому пацієнтів з алергічними реакціями потрібно перевіряти на наявність інгібіторів. Необхідно відзначити, що пацієнти з інгібіторами фактора IX при повторному введенні фактора IX мають підвищений ризик розвитку анафілаксії.
Зважаючи на наявність ризику виникнення алергічних реакцій при застосуванні концентратів фактора IX, перші введення фактора IX слід проводити за призначенням лікаря під медичним спостереженням для надання належної медичної допомоги у разі розвитку алергічних реакцій.
Противірусна безпека
При застосуванні лікарських препаратів з крові або плазми крові людини вживають стандартних заходів, спрямованих на запобігання передачі пацієнтам збудників інфекції. До них належать відбір донорів, перевірка окремих порцій і пулів плазми за маркерами інфекцій, вжиття ефективних виробничих заходів для інактивації/знищення вірусів. Незважаючи на це, при введенні лікарських препаратів, виготовлених з крові або плазми людини, не можна цілком виключити можливість передачі збудників інфекції, у тому числі невідомих або нових на сьогодні вірусів та інших патогенів.
Заходи, що вживаються, вважаються ефективними для оболонкових вірусів, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В і вірус гепатиту С, а також для необолонкових вірусів, таких як вірус гепатиту А.
Заходи, що вживаються, можуть мати обмежену ефективність щодо необолонкових вірусів, таких як парвовірус В19. Інфікування парвовірусом В19 може бути серйозним для вагітних (інфікування плода) і пацієнтів з імунодефіцитом або підвищеним еритропоезом (наприклад з гемолітичною анемією).
Потрібно розглянути питання проведення вакцинації (від гепатиту A і B) пацієнтам, яким регулярно/повторно застосовують препарати отримуваного з плазми крові людини фактора IX.
Тромбоемболія, ДВЗ-синдром, фібриноліз
Оскільки застосування фактора IX було історично пов’язано з розвитком тромбоемболічних ускладнень, причому з більш високим ризиком для препаратів з низьким ступенем очищення, застосування препаратів, що містять фактор IX, для пацієнтів з ознаками фібринолізу і пацієнтів з ДВЗ-синдромом може становити потенційну небезпеку. У зв’язку з потенційним ризиком тромботичних ускладнень при введенні препарату ІМУНІН пацієнтам із захворюваннями печінки, тромбофілією, гіперкоагуляцією, стенокардією, ішемічною хворобою серця чи гострим інфарктом міокарда, пацієнтам у післяопераційному періоді, недоношеним і новонародженим, пацієнтам з ризиком тромботичних явищ або ДВЗ-синдромом слід проводити клінічне спостереження з метою виявлення ранніх ознак тромбозу і виснажливої коагулопатії споживання з проведенням відповідних лабораторних аналізів. У кожному з цих випадків очікувану користь від лікування препаратом ІМУНІН слід зіставити з ризиком розвитку таких ускладнень.
При підозрі на ДВЗ-синдром терапію препаратом ІМУНІН необхідно негайно припинити.
Застереження
Вміст натрію
ІМУНІН 200 МО та 600 МО містить розрахункову кількість 20 мг натрію на флакон, тоді як ІМУНІН 1200 МО містить 41 мг натрію на флакон. Це слід враховувати пацієнтам, які перебувають на низьконатрієвій дієті.
Настійно рекомендується записувати назву і номер серії препарату щоразу при введенні пацієнту препарату ІМУНІН з метою встановлення зв’язку між пацієнтом і серією препарату.
Застосування у період вагітності або годування груддю.
Дослідження впливу фактора IX на репродуктивну функцію тварин не проводилися. Частота захворювань жінок на гемофілію В низька; немає досвіду застосування фактора IX вагітним та жінкам, які годують груддю. Тому фактор IX слід застосовувати під час вагітності і годування груддю, лише якщо це чітко показано.
Вплив препарату ІМУНІН на фертильність не встановлений.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Немає даних стосовно впливу препарату ІМУНІН на здатність керувати автотранспортом або іншими механізмами.
Спосіб застосування та дози.
Лікування потрібно розпочинати під контролем лікаря, який має досвід лікування гемофілії.
Дозування
Дозування і тривалість замісної терапії залежать від ступеня недостатності фактора IХ, локалізації й інтенсивності кровотечі, а також клінічного стану хворого.
Кількість одиниць фактора IX, що вводиться, виражається в міжнародних одиницях (МО), які пов’язані з чинним стандартом ВООЗ для препаратів фактора IX. Активність фактора IX у плазмі виражається або у відсотках (відносно нормальної людської плазми), або в міжнародних одиницях (відносно міжнародного стандарту фактора IX в плазмі).
Одна міжнародна одиниця (МО) активності фактора IX еквівалентна кількості фактора IX в 1 мл нормальної людської плазми.
Розрахунок потрібної дози фактора IX здійснюється на основі емпірично виявленої залежності: 1 МО фактора IX на 1 кг маси тіла збільшує активність фактора IX в плазмі приблизно на 1,1 % нормальної активності у пацієнтів віком від 12 років.
Потрібна доза визначається за такою формулою:
Потрібна кількість одиниць = маса тіла (кг) х бажане збільшення фактора IX (%) (МО/дл) х 0,9
Кількість препарату, що має вводитися, і частота введення завжди повинні визначатися клінічною ефективністю у кожному конкретному випадку. Препарати фактора ІХ рідко потрібно вводити більше одного разу на день.
У разі появи наступних епізодів кровотечі активність фактора IX не повинна опускатися нижче заданого рівня активності в плазмі (у % від нормального рівня або МО/дл) у відповідному періоді.
Таблицю 2 можна використовувати як інструкцію з вибору дози при кровотечах і хірургічних операціях.
Таблиця 2
|
Ступінь кровотечі/ тип хірургічної операції |
Потрібний рівень фактора IX (у % від нормального рівня або МО/дл) |
Частота введення доз (години)/тривалість терапії (дні) |
|
Кровотеча |
||
|
Ранній гемартроз, м’язова кровотеча або кровотеча в ротовій порожнині. |
20-40 |
Повторюйте інфузії кожні 24 години протягом не менше 1 доби, поки не припиниться кровотеча (про що буде свідчити послаблення болю) або не буде досягнуто загоювання. |
|
Більший гемартроз, м’язова кровотеча або гематома. |
30-60 |
Повторюйте інфузії кожні 24 години протягом 3-4 днів або більше, поки не буде усунений біль чи гостра недієздатність. |
|
Загрозлива для життя кровотеча. |
60-100 |
Повторюйте інфузії кожні 8-24 години, поки не буде усунена загроза для життя. |
|
Хірургічна операція |
||
|
Мала операція (у тому числі видалення зуба) |
30-60 |
Кожні 24 години протягом не менше 1 доби, поки не буде досягнуто загоювання. |
|
Велика операція |
80-100 (перед операцією і після операції) |
Повторюйте ін’єкції кожні 8-24 години, поки не буде досягнуто адекватне загоювання рани, після чого потрібно продовжувати терапію не менше 7 днів для підтримання активності фактора IX на рівні 30-60 %. |
У ході лікування рекомендується визначити рівні фактора IX в плазмі і використовувати їх значення при визначенні потрібної дози і частоти повторних інфузій. Зокрема, у випадку великої хірургічної операції обов’язково потрібно точно контролювати замісну терапію за допомогою аналізу коагуляції (активності фактора ІХ у плазмі). Різні пацієнти можуть мати різну відповідь на фактор IX, досягаючи різних рівнів відновлення invivo і демонструючи різні рівні напіввиведення.
Для довготривалої профілактики кровотеч у пацієнтів з тяжкою формою гемофілії В зазвичай призначають дози від 20 до 40 МО/кг маси тіла з інтервалом введення від 3-х до 4-х діб.
Іноді, особливо молодим пацієнтам, можуть бути необхідні коротші інтервали між введеннями або більш високі дози.
Спосіб введення
Препарат потрібно вводити внутрішньовенно. Рекомендується, щоб швидкість інфузії не перевищувала 2 мл на хвилину.
Для розчинення використовувати лише набір для ін’єкції/інфузії, що входить у комплект.
ІМУНІН потрібно розчинити безпосередньо перед введенням. Розчин потрібно використати негайно (препарат не містить жодних консервантів). Розчин повинен бути прозорим або злегка опалесціюючим. Не використовувати розчини препарату, які є каламутними або містять осад. Після розчинення готовий розчин слід візуально перевірити на наявність частинок і знебарвлення, перш ніж розпочинати введення.
Рекомендується промити ізотонічним сольовим розчином пристрої венозного доступу перед інфузією препарату ІМУНІН і після цього.
Розчинення порошку для приготування розчину для ін’єкцій
Слід дотримуватися правил асептики.
1. Нагрійте невідкритий флакон з розчинником (стерильною водою для ін’єкцій) до кімнатної температури (не більше 37 °С).
2. Зніміть захисні ковпачки з флакона з порошком і флакона з розчинником (рис. А) і продезінфікуйте гумові пробки обох флаконів.
3. Зніміть захисне покриття з одного кінця голки-перехідника, що входить у комплект, повертаючи і потягуючи її. Вільний кінець голки введіть в гумову пробку флакона з розчинником (рис. Б і В).
4. Зніміть захисне покриття з іншого кінця голки-перехідника, не торкаючись відкритого кінця.
5. Переверніть флакон з розчинником над флаконом з порошком, введіть вільний кінець голки в цей флакон через гумову пробку флакона з порошком (рис. Г). Розчинник буде перетікати у флакон з порошком під дією вакууму.
6. Роз’єднаєте флакони, вийнявши голку-перехідник з флакона з порошком (рис. Ґ). Злегка струсіть або покрутіть флакон з порошком для прискорення розчинення.
7. Після повного розчинення порошку введіть у флакон повітровідвідну голку (рис. Д), що входить у комплект, для видалення піни. Вийміть повітровідвідну голку.
Ін’єкція/інфузія
Слід дотримуватися правил асептики.
1. Зніміть захисну упаковку з голки-фільтра, що входить у комплект, повертаючи і потягуючи її, і насадіть голку на стерильний одноразовий шприц. Наберіть розчин у шприц (рис. Е).
2. Від’єднайте голку-фільтр від шприца і повільно введіть розчин внутрішньовенно (максимальна швидкість ін’єкції 2 мл/хв) за допомогою голки-метелика, що входить у комплект (або одноразової голки, що входить у комплект).
При проведенні інфузії слід використовувати одноразовий набір для інфузії з відповідним фільтром.
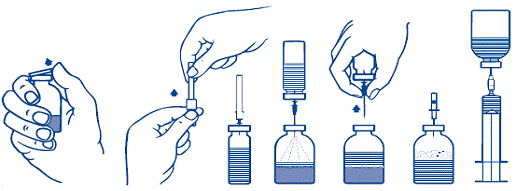
Рис. А Рис. Б Рис. В Рис. Г Рис. Ґ Рис. Д Рис. Е
Будь-який невикористаний препарат або залишки знищити відповідно до місцевих вимог.
Діти.
Відсутня достатня кількість даних, аби рекомендувати застосування препарату ІМУНІН дітям віком до 6 років.
Передозування.
Даних щодо симптомів передозування фактором коагуляції крові людини IХ немає.
Побічні реакції.
Резюме профілю безпеки
Підвищена чутливість або алергічні реакції, до яких можуть належати ангіоневротичний набряк, пекучий і гострий біль у місці інфузії, озноб, припливи, загальна кропив’янка, головний біль, висип, гіпотонія, летаргія, нудота, неспокій, тахікардія, стиснення у грудях, поколювання, блювання і свистяче дихання, нечасто спостерігалися у пацієнтів, які проходили лікування препаратами з вмістом фактора ІХ.
У деяких випадках ці реакції прогресували до тяжкої анафілаксії, і спостерігалися вони у тісному часовому зв’язку з розвитком інгібіторів фактора ІХ (див. також розділ «Особливості застосування»).
Повідомлялося про розвиток нефротичного синдрому при спробі проведення процедури індукції імунної толерантності у хворих на гемофілію В з інгібіторами фактора ІХ і алергічними реакціями в анамнезі.
У рідкісних випадках може підвищитися температура.
У хворих на гемофілію В можуть розвинутися нейтралізуючі антитіла (інгібітори) до фактора IX (див. також розділ «Особливості застосування»). У таких випадках рекомендується звернутися до спеціалізованого гемофілійного центру. У разі появи таких інгібіторів цей стан проявляється у недостатній клінічній відповіді.
Існує потенційний ризик розвитку тромбоемболічних епізодів у відповідь на введення препарату фактора IX, причому цей ризик вищий у препаратів з низьким ступенем очищення. При застосуванні препаратів фактора IX низького ступеня очищення відзначались випадки інфаркту міокарда, синдрому дисемінованого внутрішньосудинного згортання (ДВЗ-синдром), венозного тромбозу та легеневої емболії. Застосування препаратів високого ступеня очищення рідко призводить до таких побічних ефектів.
Інформація про противірусну безпеку наведена у розділі «Особливості застосування».
Небажані реакції
Наведені у таблиці 3 небажані реакції взяті зі звітів за результатами шести клінічних досліджень, проведених з використанням препарату ІМУНІН за участю 197 суб’єктів, а також за результатами післяреєстраційного контролю.
Частота небажаних ефектів оцінювалася з використанням таких критеріїв: дуже часті (>1/10); часті (>1/100 до <1/10); нечасті (>1/1000 дo <1/100); поодинокі (>1/10000 дo <1/1000); рідкісні (<1/10000); частота невідома (частоту не можна встановити з наявних даних).
Нижчезазначені небажані реакції подано за класами систем органів MedDRA.
Таблиця 3
|
Розлади нирок та сечовивідних шляхів |
Нефротичний синдром* |
Невідома |
|
Клас системи органів (КСО) |
Побічні реакції |
Частота |
|
Розлади кровоносної та лімфатичної систем |
Розвиток інгібіторів, |
Невідома |
|
дисеміноване внутрішньосудинне згортання |
||
|
Розлади імунної системи |
Алергічна реакція, |
Невідома |
|
анафілактична реакція, |
||
|
ангіоневротичний набряк, |
||
|
висип |
||
|
При наявності інгібіторів |
Невідома |
|
|
сироваткова хвороба, |
||
|
реакція підвищеної чутливості |
||
|
Розлади нервової системи |
Головний біль, |
Невідома |
|
неспокій, |
||
|
поколювання |
||
|
Порушення серцевої діяльності |
Інфаркт міокарда, |
Невідома |
|
тахікардія |
||
|
Судинні розлади |
Гіпотонія, |
Невідома |
|
тромбоемболічні епізоди (в т. ч. |
||
|
легенева емболія, |
||
|
венозний тромбоз, артеріальний тромбоз, тромбоз церебральних артерій), |
||
|
припливи |
||
|
Розлади дихання, органів грудної клітки та медіастинальні розлади |
Подразнення горла, |
Нечасті |
|
біль у роті і глотці, |
||
|
сухий кашель |
||
|
Свистяче дихання, |
Невідома |
|
|
задишка |
||
|
Шлунково-кишкові розлади |
Нудота, |
Невідома |
|
блювання |
||
|
Ураження шкіри та підшкірної тканини |
Висип, |
Нечасті |
|
свербіж |
||
|
Кропив’янка |
Невідома |
|
|
Загальні розлади та ураження в місці введення |
Гіпертермія |
Нечасті |
|
Застуда, |
Невідома |
|
|
печія і гострий біль в місці інфузії, |
||
|
летаргія, |
||
|
стиснення в грудях |
*Після спроб індукції імунної толерантності
Інгібітори фактора IX
У ході проведення клінічних досліджень препарату ІМУНІН інгібітори фактора IX виявлені не були. Раніше не ліковані пацієнти для участі у клінічних дослідженнях препарату ІМУНІН залучені не були.
Можлива побічна реакція при застосуванні з концентратами фактора коагуляції крові людини ІХ: парестезії.
Термін придатності.
Препарат – 2 роки.
Розчинник (вода для ін’єкцій) – 5 років.
В межах зазначеного терміну придатності препарат можна зберігати протягом 3 місяців при кімнатній температури (не вище 25 °С). Дату початку зберігання при кімнатній температурі необхідно відмітити на упаковці.
Хімічна і фізична стабільність розчиненого, готового до використання препарату становить
3 години при температурі від 20 до 25 °С.
Не застосовувати препарат після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання.
Зберігати при температурі від 2 до 8°С. Не заморожувати! Захищати від дії світла.
Зберігати в недоступному для дітей місці.
Несумісність.
Як і кожний з концентратів факторів, ІМУНІН не слід змішувати з іншими медичними препаратами перед введенням, тому що це може вплинути на ефективність і безпеку препарату. Рекомендується промивати загальну систему для внутрішньовенного введення ізотонічним сольовим розчином до і після введення препарату ІМУНІН.
Слід використовувати лише набори для ін’єкцій/інфузії, що входять до комплекту, інакше лікування може закінчитися невдало через адсорбцію фактора коагуляції крові людини IX на внутрішніх поверхнях іншого ін’єкційного/інфузійного обладнання.
Упаковка.
По 1 флакону з порошком (по 200 МО, 600 МО або 1200 МО) у комплекті з
1 флаконом розчинника (стерильна вода для ін'єкцій по 5 мл або 10 мл) разом з набором для розчинення і введення (голка для перенесення, аераційна голка, голка-фільтр, голка-метелик, одноразова голка для ін'єкцій, одноразовий шприц) у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Бакстер АГ/
Baxter AG.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Ланге Аллее 8, Ланге Аллее 24, Ланге Аллее 51, Індустріштрассе 20, Індустріштрассе 72, Індустріштрассе 131, Бенатцкігассе 2-6, Пасеттіштрассе 76, А-1221 Відень, Австрія/
Lange Alleе 8, Lange Alleе 24, Lange Alleе 51, Industriestrasse 20, Industriestrasse 72, Industriestrasse 131, Benatzkygasse 2-6, Pasettistrasse 76, А-1221 Vienna, Austria.
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Coagulation factor IX - Фактор коагуляции крови IX |
| Код АТХ | B02BD04 |
| Форма выпуска | порошок |
- РІКСУБІС Бакстер Хелскеа Корпорейшн (виробництво порошку ліофілізованого для розчину для інфузій, відповідальний за випуск серії)/Хамельн Фармацевтикалс ГмбХ (виробництво розчинника), США/Німеччина
- РІКСУБІС Бакстер Хелскеа Корпорейшн (виробництво порошку ліофілізованого для розчину для інфузій, відповідальний за випуск серії)/Хамельн Фармацевтикалс ГмбХ (виробництво розчинника), США/Німеччина
- РІКСУБІС Бакстер Хелскеа Корпорейшн (виробництво порошку ліофілізованого для розчину для інфузій, відповідальний за випуск серії)/Хамельн Фармацевтикалс ГмбХ (виробництво розчинника), США/Німеччина
- РІКСУБІС Бакстер Хелскеа Корпорейшн (виробництво порошку ліофілізованого для розчину для інфузій, відповідальний за випуск серії)/Хамельн Фармацевтикалс ГмбХ (виробництво розчинника), США/Німеччина
- РІКСУБІС Бакстер Хелскеа Корпорейшн (виробництво порошку ліофілізованого для розчину для інфузій, відповідальний за випуск серії)/Хамельн Фармацевтикалс ГмбХ (виробництво розчинника), США/Німеччина
- Иммунин 200 Мо БАКСТЕР АГ, Австрія
- Иммунин 600 Мо БАКСТЕР АГ, Австрія
- Октанин Ф 1000 Мо Октафарма Фармацевтика Продуктіонсгес м.б.Х (Виробник, відповідальний за виробництво за повним циклом)/Октафарма (Виробник, відповідальний за виробництво за повним циклом)/Октафарма ГмбХ, Дессау (Виробник (альтернативний), відповідальний за вторинне пакув
- Октанин Ф 250 Мо Октафарма Фармацевтика Продуктіонсгес м.б.Х (Виробник, відповідальний за виробництво за повним циклом)/Октафарма (Виробник, відповідальний за виробництво за повним циклом)/Октафарма ГмбХ, Дессау (Виробник (альтернативний), відповідальний за вторинне пакув
- Октанин Ф 500 Мо Октафарма Фармацевтика Продуктіонсгес м.б.Х (Виробник, відповідальний за виробництво за повним циклом)/Октафарма (Виробник, відповідальний за виробництво за повним циклом)/Октафарма ГмбХ, Дессау (Виробник (альтернативний), відповідальний за вторинне пакув



 Синдром кашлю в загальнолікарській практиці
Синдром кашлю в загальнолікарській практиці
 Коклюш
Коклюш
 Тромбоемболія легеневих артерій
Тромбоемболія легеневих артерій Роль інгібіторів ангіотензинперетворюючого ферменту в сучасному лікуванні серцево-судинних захворювань
Роль інгібіторів ангіотензинперетворюючого ферменту в сучасному лікуванні серцево-судинних захворювань