- Головна
- /
- Статті
- /
- Акушерство, гінекологія, репродуктивна медицина
- /
- Профілактика гнійно-септичних ускладнень після операції кесарів розтин
Профілактика гнійно-септичних ускладнень після операції кесарів розтин
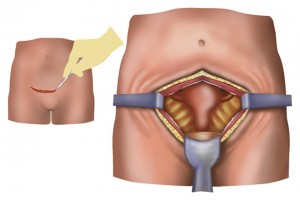
Профілактика післяопераційних гнійно-септичних ускладнень (ГСУ) – одна із найбільш актуальних проблем у сучасному акушерстві як у нашій країні, так і за кордоном. Це пояснюється тим, що протягом останніх десятиріч відмічається загрозлива тенденція до підвищення кількості оперативних пологів [1-7]. Особливо це стосується такого оперативного втручання як кесарів розтин (КР).
Тільки за останні 7 років частота КР в Україні зросла з 8 до 13%. Так, лише 2003 р. було виконано 52 131 операцію КР [1]. Водночас протягом останніх п’яти років, незважаючи на проведення начебто адекватної профілактики ГСУ у післяопераційному періоді, кількість їх залишається приблизно на одному і тому ж рівні і не має тенденції до зниження. Такий стан спостерігається і по відношенню до післяопераційної летальності в акушерстві [1, 7].
У даній ситуації особливого значення набуває проведення заходів профілактики виникнення післяопераційних ГСУ, оскільки останні негативно впливають на основні показники діяльності акушерсько-гінекологічної служби. Будь-яке післяопераційне гнійно-септичне захворювання потребує досить великих матеріальних затрат, що при нинішньому стані фінансування охорони здоров’я лягає важким тягарем на той лікувальний заклад, у якому виникло дане ускладнення. До того ж, на жаль, інколи післяопераційні ГСУ стають причиною материнської смертності або післяопераційної летальності [1, 4, 6].
Сьогодні у разі оперативних пологів проводиться та чи інша антибактеріальна профілактика ГСУ, однак її ефективність все ж залишається недостатньою [6-10, 17, 18]. У більшості випадків використовується довгостроковий протокол антибактеріальної профілактики [7, 8]. Окрім досить значних матеріальних затрат, це призводить до підвищеної кількості антибіотикостійких штамів мікроорганізмів [11, 12] і порушень стану мікробіоценозу кишечника та статевих шляхів жінки [13], що вкрай негативно позначається на репродуктивному здоров’ї та якості життя прооперованих пацієнток. Найчастіше використовують комбінацію одного з антибіотиків для впливу на аеробну мікрофлору і метронідазолу для внутрішньовенного введення для впливу на анаеробну мікрофлору.
Для проведення адекватних профілактичних заходів (у першу чергу мається на увазі антибактеріальна профілактика) необхідно дуже ретельно враховувати фактори ризику виникнення зазначених ускладнень та ступеня ризику тих чи інших післяопераційних ГСУ. Отже, антибактеріальна профілактика повинна бути диференційованою і максимально мінімізованою, з урахуванням негативного впливу антибактеріальних засобів на стан мікробіоценозу хворих.
Таким чином, основною метою дослідження стало вивчення особливостей перебігу післяопераційного періоду після КР, оцінка факторів ризику ГСУ та питомої ваги кожного з цих факторів ризику, визначення ступеня ризику виникнення післяопераційних ГСУ і на підставі цих даних – розробка й оцінка ефективності відповідних профілактичних заходів із застосуванням орнідазолу для внутрішньовенного введення.
На першому етапі роботи до обстеження було включено 40 пацієнток, у яких вивчали перебіг післяопераційного періоду після КР; з них віком від 20 до 25 років було 6 (15,0%) учасниць, від 26 до 30 років – 17 (42,5%) і понад 30 років – 17 (42,5%). Включення жінок у дослідження проводили сліпим методом. У плановому порядку було прооперовано 21 (52,5%) хвору, в ургентному – 19 (47,5%). Показання до абдомінального розродження наведені у таблиці 1.
При порівнянні зі структурою показань до операції КР у цілому в пологовому будинку суттєвих відмінностей зазначено не було, тобто включені у дослідження пацієнтки складали досить репрезентативну групу. Перебіг вагітності у 8 (20,0%) жінок був ускладнений загрозою переривання вагітності та передчасних пологів, у 3 (7,5%) – під час вагітності був висіяний St. aureus з носоглотки і проводилась відповідна санація, у 4 (10,0%) – виявлено антитіла до TORCH-інфекцій. Дородове вилиття навколоплідних вод мало місце у 4 (10,0%) жінок, а раннє – у 6 (15,0%) вагітних. Тривалість пологів до КР у 11 (27,5%) жінок перевищувала 12 год, тривалість безводного періоду перед операцією була в межах від 6 до 12 год – у 4 (10,0%) і понад 12 год – у 3 (7,5%). Піхвові дослідження до 3 разів проводились у 27 (67,5%) випадках, від 3 до 5 разів – в 11 (27,5%) і понад 5 – у 2 (5,0%). Усі вагітні були прооперовані шляхом КР у нижньому матковому сегменті. Ушивання матки проводили безперервним вікриловим швом у 25 (62,5%) пацієнток, окремими вікриловими швами – у 13 (32,5%) і окремими кетгутовими швами у 2 (5,0%). У однієї хворої, окрім КР, було проведено консервативну міомектомію. У 4 (10,0%) випадках мав місце виражений спайковий процес черевної порожнини. Проведення операції у межах 60 хв тривало у 32 (80,0%) жінок, від 60 до 90 хв – у 5 (12,5%) і понад 90 хв – у 3 (7,5%). Під час КР крововтрата до 600 мл відзначалась у 34 (85,0%) випадках, від 600 до 1000 мл – у 6 (15,0%); у двох (5,0%) випадках було проведено переливання еритроцитарної маси інтраопераційно, а у трьох (7,5%) хворих – протягом першої доби післяопераційного періоду. У переважної більшості пацієнток (95,0%) на момент оперативного втручання відмічена нормальна температура тіла, у двох (5,0%) – субфебрильна. З метою профілактики післяпологових ускладнень 15 (37,5%) породіль отримували цефазолін у дозі 1 г 3 рази на добу, а інші 25 (62,5%) – цефтриаксон по 1 г 3 рази на добу. Протягом першої доби 17 (42,5%) хворим призначали метронідазол (100 мл) внутрішньовенно крапельно. Усі пацієнтки протягом першої доби післяопераційного періоду отримували традиційну інфузійну терапію в об’ємі до 1 л.
Перебіг післяопераційного періоду ускладнився післяпологовим ендометритом у 2 (5,0%) жінок, тривалим субфебрилітетом у поєднанні із субінволюцією матки – у 3 (7,5%), тобто показник післяопераційних ГСУ становив 12,5%. Переважна більшість пацієнток (85,0%) були виписані на 5-6-у добу після операції КР, в інших 6 (15,0%) хворих середня тривалість післяопераційних ліжко-днів становила 10,5.
З огляду на аналіз факторів ризику і характер перебігу післяопераційного періоду включених у дослідження жінок та на аналіз, що базувався на вивченні 300 історій оперативних пологів КР [4], проведений раніше, було розроблено шкалу оцінки ризику виникнення післяпологових (післяопераційних) ГСУ (табл. 2).
Отже, ретельний аналіз дав можливість установити, що сумарна оцінка до 4 балів відповідає низькому ступеню ризику, від 5 до 10 балів – середньому і понад 10 балів – високому ступеню ризику виникнення ГСУ.
Таким чином, існують три ступені ризику виникнення ГСУ після операції КР:
- низький ступінь – характеризується відсутністю генітальних та екстрагенітальних вогнищ інфекції, цілим плідним міхурем, тривалістю безводного періоду не більше 6 год, пологів – до 12 год, кількістю вагінальних досліджень не більше двох, відсутністю підвищеної крововтрати, тривалістю операції до 60 хв;
- середній ступінь визначають як наявність генітальних та екстрагенітальних вогнищ інфекції, тривалість безводного періоду 6-12 год, пологів понад 12 год, кількість вагінальних досліджень не більше трьох-чотирьох, крововтрата 700-900 мл, тривалість операції до 60-90 хв;
- високий ступінь – наявність генітальних та екстрагенітальних вогнищ інфекції із загостренням на строках вагітності 26-28 тиж, тривалість безводного періоду понад 12 год, тривалість пологів понад 24 год, кількість вагінальних досліджень – п’ять і більше, крововтрата понад 1000 мл, тривалість операції понад 90 хв, наявність проявів хоріонамніоніту або ендометриту у пологах.
Відповідно до того чи іншого ступеня ризику були розроблені схеми проведення профілактичної антибактеріальної терапії. При цьому враховувалася можливість застосування нових методів антибактеріальної профілактики і використання нових антибіотиків. В останні роки опубліковано чимало праць, які переконливо свідчать про наявність великої кількості метронідазол-резистентних штамів мікроорганізмів, що значно зменшує ефективність антибактеріальної дії даного препарату [14-16]. Останнім часом на фармацевтичному ринку з’явився новий препарат для внутрішньовенного введення, діючою речовиною якого є орнідазол (Мератин), з високою чутливістю до анаеробної мікрофлори.
Цей препарат на сьогоднішній день практично не має резистентних до нього форм мікроорганізмів [16] й існує у формі для внутрішньовенного введення. Доцільним є також призначення антибіотика групи фторхінолонів останнього покоління – гатифлоксацину (Тебрісу), якому властивий дуже широкий спектр дії як на аеробні, так і на анаеробні мікроорганізми, і застосування їх буде цілком доречним у випадках високого інфекційного ризику. З іншого боку, для зменшення навантаження на організм хворої, ми виходили з того, що більш раціональними є короткочасні курси антибактеріальної терапії [17, 18].
Проведений нами аналіз перебігу післяопераційного періоду після КР, ретельне вивчення преморбідного фону та факторів ризику виникнення ГСУ дали можливість розробити чіткі критерії щодо застосування того чи іншого алгоритму проведення профілактики останніх.
Антимікробна профілактика післяопераційних ускладнень після КР
При низькому ступені ризику виникнення ГСУ вважається доцільним:
- інтраопераційне введення цефтриаксону 1 г внутрішньовенно крапельно, Мератину 100 мл у черевну порожнину;
- протягом першої доби післяопераційного періоду (через 24 год) – цефтриаксону 1 г внутрішньовенно і Мератину 100 мл внутрішньовенно крапельно;
- на другу добу – цефтриаксону 1 г внутрішньом’язово.
При середньому ступені ризику виникнення ГСУ рекомендується:
- інтраопераційне введення цефтриаксону 1 г внутрішньовенно крапельно, Мератину 100 мл у черевну порожнину і 100 мл внутрішньовенно крапельно;
- у першу добу післяопераційного періоду (через 12 год) – цефтриаксону 1 г внутрішньовенно, а через 24 год цефтриаксону 1 г внутрішньовенно і Мератину 100 мл внутрішньовенно крапельно;
- на другу добу – цефтриаксону 1 г внутрішньом’язово кожні 12 год;
- на третю добу – цефтриаксону 1 г внутрішньом’язово.
При високому ступені ризику виникнення ГСУ вводять:
- інтраопераційно Тебріс 200 мл (400 мг) внутрішньовенно крапельно і Мератин 100 мл у черевну порожнину;
- у першу добу післяопераційного періоду (через 12 год) – Тебріс 200 мл (400 мг) внутрішньовенно крапельно, а через 24 год внутрішньовенно крапельно Тебріс 200 мл (400 мг) і Мератин 100 мл;
- на другу добу – Тебріс 200 мл (400 мг) внутрішньовенно крапельно;
- на третю-п’яту добу – Тебріс 400 мг/доб per os.
Як свідчать перші результати, запропонований алгоритм визначення ступеня ризику і проведення відповідної профілактичної терапії є досить ефективним і цілком відповідає сучасним вимогам акушерства.
Література
- Жилка Н.Я. Стан надання хірургічної акушерсько-гінекологічної допомоги в Україні. Шляхи вирішення проблеми // Збірник наукових праць Асоціації акушерів-гінекологів України. – К.: Інтермед, 2004. – С. 167-174.
- Жилка Н., Іркіна Т., Стешенко В. Стан репродуктивного здоров’я в Україні /медико-демографічний огляд. – К., 2001.
- Степанківська Г.К. Гнійно-запальні захворювання в акушерстві і гінекології за сучасних умов // ПАГ. – 1996. – № 1. – С. 36-39.
- Степанковская Г.К., Сольский С.Я. Послеродовая инфекция. – К.: Здоров’я, 1989. – 128 с.
- Jennicer L., Bailit M.D., Sharon L. Risk adjustment for interhospital comparison for primary cesarean rates // J. Obstet. Gynecol. – 1999. – V. 93. – № 6. – Р. 1025-1030.
- Артамонов В.С., Сольський С.Я., Жесткова І.В., Марущенко Ю.Л., Манащук С.І. Профілактика і лікування ускладнень гнійно-септичного характеру після операції кесарського розтину // ПАГ. – 1999. – № 4. – С. 211-214.
- Венцківський Б.М., Гойда Н.Г., Іркіна Т.К. Діагностика та лікування гнійно-септичних ускладнень в акушерській практиці і профілактика материнської смертності // ПАГ. – 1996. – № 1. – С. 39-42.
- Миров И.М. Прогнозирование, раннее выявление, лечение и комплексная профилактика гнойно-воспалительных заболеваний после родов и кесарева сечения. Автореф.дисс. ... докт. мед. наук. – М. – 1996. – 49 с.
- Березняков И.Г. Антибиотикопрофилактика амоксициллин/клавуланатом при оперативных вмешательствах // Материалы симпозиума /Антибактериальная профилактика в хирургии. – Харьков, 2003. – С. 1-17.
- Ball P. Amoxicillin clavulanate: an assessment after 15years of clinical application. // Journal of Chemotherapy. – 1997. – 9 (3). – P. 167-198.
- Лебедюк В.В., Захарченко Л.Г., Боровкова Л.Г. Комплексная программа профилактики гнойно-септических осложнений после операции кесарева сечения // Збірник наукових праць Асоціації акушерів-гінекологів України. – К.: Інтермед, 2004. – С. 236-239.
- Руководство по инфекионному контролю в стационаре. Пер. с англ. / Под ред. Р. Венцеля, Т. Бревера, Ж-П. Бутцлера. – Смоленск: МАКМАХ, 2003. – 272 с.
- Нізова Н.М., Павловська О.М. Корекція мікробіоценозу кишечника пребіотиками після кесарського розтину // Збірник наукових праць Асоціації акушерів-гінекологів України. – К.: Інтермед, 2004. – С. 273-276.
- Rasoloson D., Tomkov E., Cammack R. et al. Metronidazolresistant strains of Trichomonas vaginalis display increased susceptibility to oxygen // Parasitology. – 2001. – V. 123. – P. 45-56.
- Rasoloson D., Vanacova S., Tomkov E. et al. Mechanisms of in vitro development resistance to metronidazole in Trichomonas vaginalis // Microbiology. – 2002. – V. 148. – P. 2467-2477.
- Берестовой О.А. Проблемы резистентности к антибактериальным препаратам: в списке препаратов к которым развилась резистентность тиберал (орнидазол) не значится // Здоровье женщины. – 2003. – № 4 (16). – С. 63-66.
- Кесарево сечение: в 3 т. // А.А. Зелинский, Б.М. Венцковский, Н.В.Шаповал и др. / Под ред. проф. Зелинского А.А. – Одесса: ОКФА, 1999. – Т. 2. – 272 с.
- Белоусов О.Г., Левченко И.И. Операция кесарево сечение и профилактика возможных осложнений // Збірник наукових праць Асоціації акушерів-гінекологів України. – К.: Інтермед, 2004. – С. 26-29.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Кесарево сечение
Кесарево сечение
 Методики проведения кесарева сечения
Методики проведения кесарева сечения
 Миф об идеальной частоте кесарева сечения: комментарий и историческая перспектива*
Миф об идеальной частоте кесарева сечения: комментарий и историческая перспектива*
 Кесарю – кесарево. История кесарева сечения
Кесарю – кесарево. История кесарева сечения