- Головна
- /
- Статті
- /
- Акушерство, гінекологія, репродуктивна медицина
- /
- Этиология, патогенез и новые возможности неоперативного лечения миомы матки
Этиология, патогенез и новые возможности неоперативного лечения миомы матки
Проблема миомы матки у женщин всех возрастов продолжает оставаться в центре внимания отечественных и зарубежных исследователей, так как это новообразование и его осложнения являются одной из основных причин радикальных операций в гинекологической практике.
На протяжении XX века миома матки считалась наиболее часто встречающейся доброкачественной опухолью. Частота ее возникновения у женщин в возрасте после 35 лет достигает 35-45% [1, 5, 6].
По данным исследователей, выделяют следующие факторы риска, способствующие возникновению миомы матки: позднее менархе, обильные менструации, высокая частота медицинских абортов, наличие экстрагенитальной патологии (особенно сердечно-сосудистой) и гинекологических заболеваний [8].
Cовершенствование диагностики, а именно широкое примененияе эхоскопии, которая стала рутинным методом обследования женщин, обратившихся к врачу (не обязательно к гинекологу), позволяет выявить узлы очень малых размеров (3-4 мм в диаметре). Узлы таких размеров не способствуют значительному увеличению матки и, соответственно, не определяются при бимануальном исследовании. Еще более точная диагностика миомы возможна при использовании компьютерной и магниторезонансной томографии.
В последние годы при лечении миом активно разрабатывается техника операций, выполняемых эндоскопическим доступом. В то же время возможны и такие клинические ситуации, при которых оперативное вмешательство не может быть выполнено из-за тяжести экстрагенитальной патологии или категорического отказа пациентки от операции.
Данный обзор посвящен вопросам этиологии, патоморфогенеза и неоперативного лечения миомы матки.
Изучение патогенетических механизмов развития миомы матки позволяет значительно уменьшить количество хирургических вмешательств, повысив объем консервативного лечения больных. Несмотря на многочисленные исследования, посвященные проблеме инициации и роста миоматозных узлов, патогенез заболевания до конца не известен.
Миома матки является заболеванием организма в целом, с вовлечением в патологический процесс системы гипоталамус-гипофиз-яичники-кора надпочечников-местная регуляция. Нарушения в системе местной регуляции определяются чувствительностью клеток миометрия к гормонам; особенностями их иннервации, трофики, кровоснабжения; содержанием гормонов в локальном кровотоке [8]. Участие в патологическом процессе гипоталамо-гипофизарной системы подтверждается частым сочетанием лейомиомы с дисгормональными заболеваниями молочных желез и нарушением функции щитовидной железы. Определенную роль играют изменения функции печени, железодефицитная анемия и другие факторы [3].
Предполагается, что соматотропин (гормон роста) также может играть роль инициатора развития лейомиомы. Это подтверждается тем, что у женщин с акромегалией чаще возникает миома матки [3].
В последние годы появляется все больше исследований, посвященных пролактину. При изучении особенностей выделения пролактина при миоме матки было установлено, что у больных моложе 40 лет содержание пролактина в плазме находится в пределах доверительного интервала нормы для здоровых женщин, а у больных старше 40 лет – в значительной мере превышает ее. Установлено, что клетки миомы матки также секретируют пролактин. По данным E.A. Stewart et al. (1996), блокатор прогестероновых рецепторов RU 486 подавляет синтез пролактина в миоматозных узлах и в нормальном миометрии. Авторы полагают, что поскольку RU 486 вызывает торможение роста миоматозных узлов у определенной группы больных, пролактин, наряду с прогестероном, может быть одним из факторов роста миоматозных узлов. Однако роль этого гормона в патогенезе миомы матки и его влияние на рост опухоли еще уточняются [3, 4].
Учитывая то, что существование и рост миомы матки у женщин, имеющих овуляторный цикл, никак не зависит от первичных гипоталамо-гипофизарных нарушений, патогенез миомы матки в большей степени связан с нарушениями процесса гиперплазии и гипертрофии миоцитов (специализированных гормон-зависимых тканевых структур миометрия). Не наблюдается принципиальных морфологических и биохимических отличий в патогенезе возникновения и роста миомы [7].
В результате проведенного в 1998 г. исследования установлено, что миома матки может формироваться в ответ на повреждение миометрия воспалительными, эксплантными, механическими и другими факторами. При этом промежуток времени от момента воздействия возможного этиологического фактора до первого обнаружения опухоли составляет в среднем 6-10 лет [1].
Согласно классическим работам по морфологии женской репродуктивной системы, проведенным еще в 30-е годы К.П. Улезко-Строгановой, образование зачатков миоматозных узлов происходит на эмбриональном этапе, что подтверждается последними исследованиями. Предполагают, что при миоме первично трансформированная мутантная клетка передает свои свойства только своим потомкам (своему «клону»); у других клеток, не принадлежащих к этому «клону», процесс дифференцировки не нарушен [8].
В соответствии с особенностями структурных компонентов и характеристиками тканевого обмена выделяют три последовательные стадии морфогенеза миомы матки [8]:
• образование активной зоны роста (зачатка) в миометрии с активированным клеточным метаболизмом;
• рост опухоли без признаков дифференцировки;
• рост опухоли с дифференцировкой и созреванием.
Развитие миом происходит из зон роста, расположенных обычно вокруг тонкостенного сосуда (активные зоны роста). Изначальные клетки миомы трансформируются в миофибробласты, которые затем дифференцируются в миобласты и фибробласты. Активные зоны роста обладают высоким уровнем обмена и повышенной сосудисто-тканевой проницаемостью, что, по-видимому, способствует дальнейшему росту опухоли. Опухолевый узел повторяет в своем развитии паренхиматозно-стромальные особенности того слоя миометрия, из которого он развивается. Клинически это проявляется тем, что множественные миоматозные узлы в одной матке развиваются независимо друг от друга (их различный темп роста обусловлен делением клеток, клонально не связанных между собой). Таким образом, миома матки является доброкачественной опухолью моноклонального происхождения [4, 6, 7].
Также эти данные подтверждают и ряд авторов, которые рассматривают в настоящее время развитие миомы матки с позиций апоптоза (генетически запрограммированного процесса гибели клеток). Незавершенность апоптоза объясняет различные размеры и разную степень зрелости узлов в пределах одной матки, возможность регресса узлов, доброкачественный характер опухоли, неинвазивный и медленный рост (если не возникает отек за счет сдавления или воспаления), а также вероятность рецидивов [4].
Возможно, что определенную роль в развитии заболевания играет нарушение нервно-мышечной регуляции миоматозных узлов. Проведя исследования узлов миомы матки путем выявления активности холинэстераз, контактно-микроскопическим и флюоресцентным методами, ученые установили, что в миоматозных узлах не обнаруживаются холин- и адренергические нервные структуры. Это дало им основание утверждать, что узел миомы матки является абсолютно денервированным образованием [7].
Несмотря на то что миоматозные клетки проявляют сходство с клетками миометрия, современные исследования выявили отличия в структуре и метаболизме этих тканей. На основе исследования ультраструктуры миомы матки Г.И. Брехманом, А.А. Мироновым (1986) была предложена следующая трактовка процессов, происходящих в миоматозной матке. Сначала расстройства микроциркуляции и нарастание тканевой гипоксии обусловливают компенсаторные изменения в гладкомышечных клетках (ГМК) (увеличение гладкой цитоплазматической сети, возрастание числа митохондрий, их набухание и др.), затем наступает декомпенсация (ишемические зоны в митохондриях, липидное перерождение, слипание миофибрилл, вакуолизация ядра, диффузный отек); в дальнейшем развивается отек и начинается разрушение клеток. Дистрофические изменения в опухоли рассматриваются авторами не как осложнения в ходе развития последней, а как звенья единого процесса. Помимо этого, имеются данные, что дистрофические изменения в ткани опухоли нарастают из-за денервации миоматозных узлов, в которых не обнаруживаются холин- и адренергические нервные структуры [4, 7].
Рост частоты встречаемости лейомиомы после менархе, увеличение ее размеров во время беременности, а также регрессия после менопаузы свидетельствуют о наличии зависимости роста опухоли от уровня половых гормонов [4, 6, 7].
Одно из центральных мест в проблеме патогенеза миомы матки занимает вопрос об особенностях гормонального статуса и функциональном состоянии репродуктивной системы по мере развития заболевания. Проведенные исследования показали, что у 2/3 больных гормональные параметры менструального цикла (МЦ) не отличаются от соответствующих нормативных показателей. У больных с недостаточностью лютеиновой фазы (НФЛ) и с ановуляторными циклами отмечаются изменения содержания фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов в крови, зависящие больше от функционального состояния репродуктивной системы, чем от наличия опухоли матки. У других больных отмечается гиперсекреция ФСГ на 5-7-й день МЦ и ЛГ на 14-й день с одновременным снижением экскреции ЛГ на 21-22-й день, эстрогенов и прегнандиола – на протяжении МЦ [7, 8].
Традиционное мнение о ведущей роли эстрогенов в патогенезе миомы матки подтверждается данными исследователей. Эстрогены рассматриваются как главные стимуляторы роста лейомиомы. В миометрии и эндометрии, окружающих лейомиоматозный узел, существует локальная продукция эстрогенов за счет превращения эстрон-сульфата в эстрон с помощью сульфатазы, а также за счет конверсии андростендиона в эстрадиол ароматазой. Таким образом, можно предполагать, что локальный синтез эстрогенов в миоматозном узле может поддерживать его рост независимо от яичниковых гормонов, т.е. обеспечивать своего рода автономность роста миоматозного узла [4, 7].
По мнению ряда исследователей, значение имеет не только количество выделяемых эстрогенов и нарушение их экскреции и метаболизма, а также нарушение качественного соотношения между фракциями эстрогенов. Считают, что преобладание эстриола (Е3) приводит к более выраженным изменениям миометрия, о чем свидетельствует появление быстрорастущих лейомиом без нарушения МЦ. При повышенном содержании эстрадиола (Е2) повреждается эндометрий, и клиническая картина характеризируется небольшими размерами опухоли и кровотечениями [3].
Эстрогены и прогестерон принимают участие в патогенезе миом, используя противоположные пути. За последние годы накоплены данные, свидетельствующие, что прогестерон наряду с эстрогенами стимулирует рост миомы матки. Согласно данной концепции, прогестерон играет ключевую роль в инициировании каскада молекулярно-генетических нарушений, возникающих в процессе развития опухоли, и вместе с Е2 является физиологическим регулятором данного процесса. В течение фолликулярной фазы эстрогены усиливают экспрессию генов, которые в норме активны в миометрии при развитии беременности. Увеличение массы миометрия может происходить как за счет гиперплазии ГМК, которая инициируется эстрогенами, так и за счет гипертрофии этих клеток. Однако процесс гипертрофии ГМК, аналогичный процессу их гипертрофии во время беременности, может возникать при сочетанном воздействии сравнительно высоких концентраций эстрадиола и прогестерона. В течение лютеиновой фазы прогестерон повышает митотическую активность миомы, особенно у молодых женщин [4, 6, 7].
Прогестерон оказывает двойное действие на рост миомы:
• блокирует влияние эстрогенов посредством угнетения экспрессии их рецепторов;
• действует непосредственно через прогестероновые рецепторы.
Содержание эстрогеновых рецепторов в миоме и нормальном миометрии не имеет существенных различий, но содержание прогестероновых рецепторов в миоме выше, чем в обычном миометрии. В миометрии в равных количествах экспрессируются А- и В-типы рецепторов прогестерона. Прогестерон связывается преимущественно с В-типом рецептора. А-тип в свою очередь ингибирует экспрессию В-типа. Раздельный анализ уровня А- и В-рецепторов к прогестерону показал, что уровень обоих типов рецепторов значительно выше в миоматозных узлах, чем в миометрии. В 40% случаев на поверхности миоматозных узлов избыточно экспрессируется В-тип рецептора [4].
По особенностям концентрации рецепторов эстрадиола и прогестерона и их реакции на изменение гормональной стимуляции в течение МЦ миома значительно ближе к эндометрию, чем к миометрию. Это, возможно, обусловливает большую потенцию роста миомы матки, чем миометрия, при одинаковом уровне гормонемии [1, 4].
Изучение новых механизмов развития миомы позволяет по-другому подойти к вопросу ее профилактики и лечения. Так, воздействие на регуляцию уровня прогестерона и его рецепторов может служить одним из необходимых компонентов для консервативной терапии миомы [5].
При миоме матки действие эстрогенов и прогестерона (как и в неизмененном миометрии) опосредовано факторами роста и цитокинами – биологически активными соединениями, которые за счет аутокринно-паракринного влияния изменяют пролиферативную активность ГМК. Факторы роста, цитокины обеспечивают основные межклеточные взаимодействия, что проявляется изменением деления и дифференцировки клеток [5].
Ключевую роль играют следующие факторы роста: ЭФР (эпидермальный), ИФР-I (инсулиноподобный фактор роста и связывающие его протеины, осуществляющие регуляторную роль), ТФР-β (трансформирующий), ОФРФ (основной фактор роста фибробластов), ТФР (тромбоцитарный), сосудисто-эндотелиальный (СЭФР). Вместе с гормонами они составляют молекулярную основу многих процессов, однако на определенном этапе развития миомы степень гормонального воздействия снижается, так как контроль за пролиферацией клеток регулируется межклеточными взаимодействиями [10].
В патогенезе миомы важную роль играет неоангиогенез, который, как правило, активизируется при опухолевом росте. Наиболее изученными активаторами данного процесса в органах репродуктивной системы женщины являются СЭФР, ТФР-β, ОФРФ, адреномедуллин. Все эти факторы роста оказывают митогенное действие на эндотелиоциты и ГМК, способствуя росту опухоли двояко: увеличивая пролиферативную способность ГМК и стимулируя ангиогенез [4, 6, 7, 10].
По уровню пролиферативной активности в миоматозных узлах миомы разделяют на простые и пролиферирующие (без атипии) [9, 10].
Пролиферирующие миомы встречаются у каждой четвертой больной с миомой матки. Наиболее часто в репродуктивном возрасте быстрый рост миомы матки является ложным (62,1%) и характеризуется не преобладанием пролиферативных процессов, а наличием воспалительных изменений, отека и нарушения кровообращения [9].
Отмечено, что в пролиферирующих миомах митотическая активность и продукция факторов роста повышена, а в простых миомах митозы отсутствуют. В связи с этим отмечают, что пролиферирующие миомы в два раза чаще встречаются у больных с быстрорастущими опухолями, чем при умеренном или медленном темпе роста опухоли. Для пролиферирующей миомы матки типичны наличие множественных узлов преимущественно субмукозной и интрамуральной локализации, нарушение МЦ по типу гиперполименореи, а также метроррагии, сочетание миомы с гиперпластическими процессами эндометрия и эндометриозом [9, 10].
Для простой миомы матки характерны наличие единичных миоматозных узлов преимущественно субсерозной локализации, воспалительные заболевания гениталий и различная патология шейки матки [9, 10].
Выделение двух форм миомы матки по особенностям гистогенеза имеет важное практическое значение, особенно при выборе врачебной тактики. Во многих странах миома матки стала основой коммерциализации гинекологических учреждений именно вследствие необычайной либерализации показаний для удаления детородного органа [7].
Именно поэтому весьма важно четко определить показания к оперативному лечению, которое может быть как консервативным (миомэктомия), так и радикальным (гистерэктомия, синоним – экстирпация матки).
Согласно приказу МЗ Украины № 620 от 29.12.2003 г., показаниями к оперативному лечению миомы матки являются:
• размер миомы больше 12 нед беременности;
• быстрый рост;
• симптомная миома матки.
Объем оперативного вмешательства зависит от клинической ситуации. В соответствии с вышеуказанным приказом МЗУ, основными методами оперативного лечения миомы матки являются:
• гистероскопическое удаление миоматозного узла или гистерорезектоскопия с резекцией миоматозного узла;
• консервативная миомэктомия узла на матке;
• тотальная и субтотальная гистерэктомия с/без придатков.
Следует согласиться с мнением большинства авторов, что при наличии безусловных показаний к оперативному лечению миомы его следует осуществлять, не тратя времени и средств на консервативное лечение, которое не будет достаточно эффективным или даст временное улучшение. При отсутствии показаний к хирургическому вмешательству или при отказе больной от операции основное значение приобретает консервативная терапия, целью которой является торможение роста опухоли.
Консервативное лечение приемлемо и достаточно эффективно в любом возрасте до наступления менопаузы, но особенно в репродуктивном периоде. Оно должно быть комплексным и направленным на различные звенья патологического процесса с учетом выявленных нарушений. Принципы консервативного лечения заболевания базируются на концепции гормонально-зависимого характера возникновения миомы матки и использования средств, сдерживающих ее рост, влияющих на уменьшение ее размеров и предотвращающих развитие в ней вторичных изменений.
Традиционно консервативное лечение основывалось на временном угнетении функции яичников, т.е. воспроизведении медикаментозной менопаузы и/или индукции гипоэстрогении. На протяжении довольно длительного времени использовались гестагены: норколут, премолют-нор, дуфастон и др. Однако результаты такой терапии были малоэффективны. Исходя из прогестероновой теории развития миомы матки (прогестерон наряду с эстрогенами стимулирует рост миомы матки), недостаточно эффективные результаты лечения производными прогестерона вполне объяснимы, хотя в конкретных клинических ситуациях подобный метод в качестве одного из вариантов гормонального воздействия может быть использован в комбинации с другими методами или в случае, когда другие группы препаратов противопоказаны. Производные прогестерона можно назначать в циклическом режиме прерывистыми 6-месячными курсами женщинам репродуктивного возраста с размерами миомы до 8 нед беременности при сочетании с гиперпластическими процессами эндометрия. В пременопаузальном возрасте целесообразнее принимать гестагены в непрерывном режиме.
Базовыми препаратами, применяемыми в качестве консервативной терапии миомы матки, являются антигонадотропины и агонисты гонадотропных рилизинг-гормонов (а-ГнРГ).
В последние годы для лечения миомы матки чаще использовались производные андрогенов: даназол и гестринон.
Даназол высокоэффективен по отношению к рецепторам тестостерона и действует как агонист. К рецепторам прогестерона препарат имеет умеренное сродство и характеризуется как агонистическим, так и антагонистическим действием. Гестринон (неместран) – антигестаген, производное 19-нортестостерона – обладает не только антипрогестагенными, но и проандрогенными, антигонадотропными, а значит, и антиэстрогенными свойствами. Препарат подавляет преовуляторные пики ЛГ и ФСГ, в результате чего уровень Е2 снижается на 50%, а прогестерона – примерно на 70% от исходного. Гестринон оказывает прямое антипрогестероновое действие за счет связывания прогестероновых рецепторов и тем самым подавляет пролиферацию эндометрия и, очевидно, миоматозных узлов [6].
Особое место в терапии миомы матки на протяжении двух последних десятилетий занимает применение аналогов ГнРГ. При непрерывном применении этих препаратов развивается гипоэстрогения, коррелирующая с уменьшением (в среднем на 52,6%) размеров матки и узлов опухоли. Подавление гонадотропной функции гипофиза, помимо снижения уровня Е2, вызывает блокаду продукции прогестерона, что играет важную роль в механизме действия а-ГнРГ [6].
Существует три способа введения а-ГнГР: интраназальный (бусерелина ацетат 0,2-процентный раствор, 300 мг/сут), подкожный (декапептил 0,1 мг ежедневно) и внутримышечный (депо-декапептил, диферелин, золадекс). Именно депонированные формы обладают способностью выделять а-ГнРГ в течение 6-7 нед. Терапия начинается со 2-4 дня МЦ.
Базовые препараты используют в качестве консервативной терапии миомы матки в течение 6 мес. Дальнейший их прием нецелесообразен в связи с появлением значительных побочных эффектов. Доказано, что у женщин репродуктивного возраста через 3-12 мес после окончания терапии этими препаратами рост миомы матки возобновляется. Следовательно, возникает необходимость стабилизации достигнутого лечебного эффекта и профилактики рецедивов ее роста.
Стабилизирующим эффектом на небольшие миоматозные узлы обладает внутриматочная гормональная рилизинг-система с левоноргестрелом, которая эффективно стабилизирует размер маленьких миоматозных узлов (до 2-2,5 см) в течение 4 лет [4].
Перспективным считается применение антипрогестагена – мифепристона [6]. В 1993 г. впервые был опубликован обзор, посвященный применению новой группы препаратов – антагонистов ГнРГ (ант-ГнРГ). К препаратам ант-ГнРГ относится цетрореликс. Фармакологическое действие данной лекарственной группы отличается от действия а-ГнРГ тем, что на клеточной мембране гонадотропных клеток гипофиза происходит классическая конкурентная блокада за рецепторы эндогенных гонадотропинов – без фазы непродолжительной стимуляции [6].
Возможно, достаточно эффективными окажутся препараты, которые ингибируют факторы роста, влияющие на апоптоз и продукцию межклеточного вещества ГМК, а также на пролиферацию и миграцию эндотелиоцитов [11]. Перспективное направление в лечении миомы – использование антифибротической терапии. Основанием для этого является тот факт, что миомы содержат большое количество экстрацеллюлярного матрикса, состоящего из коллагена, протеогликана и фибронектина, и имеют повышенный уровень экспрессии матричной РНК коллагена типов I и III [15].
Новым методом лечения лейомиомы матки является эмболизация маточных артерий, впервые примененная во Франции в 1991 г. Процедура включает прокол, катетеризацию бедренной артерии и последующую эмболизацию под рентгенологическим контролем с использованием поливинилового спирта и/или пены Gelfoam. Эмболизация приводит к уменьшению кровоснабжения и частичному некрозу миоматозных узлов [16].
Выраженным стабилизирующим эффектом на рост небольших миоматозных узлов обладают комбинированные оральные контрацептивы (КОК). Cовременные КОК в отличие от прогестерона блокируют основные звенья патогенеза развития лейомиомы матки, а именно: восстанавливают нарушения в гипоталамо-гипофизарной системе, нормализуют функцию яичников, улучшают состояние миометрия. Консервативное лечение пациенток приемлемо и достаточно эффективно в любом возрасте до наступления менопаузы, но особенно в репродуктивном периоде [3].
Принципиальный механизм терапевтического эффекта КОК на миому матки и профилактику этого заболевания основывается на этиопатогенетических теориях возникновения миомы матки.
Под воздействием прогестерона, вырабатываемого желтым телом, во второй фазе овуляторного МЦ в миометрии активизируются пролиферативные процессы. Во время приема КОК происходит подавление овуляторной функции яичников, т.е. выключается механизм образования желтого тела. Таким образом, при длительном приеме КОК на весь срок отсутствия желтого тела в организме женщины не наблюдаются высокие концентрации прогестерона, а присутствует только незначительное количество этого гормона, синтезирующегося надпочечниками. Так как существование эндометрия крайне опасно без достаточного влияния прогестерона, в состав КОК включают прогестин, который по своим рецепторным характеристикам схож с прогестероном, но не выполняет все его функции. Прогестины, связавшись с рецептором, не вызывают в полной мере весь спектр эффектов прогестерона. Это важно, поскольку воздействие осуществляется на «прогестероновый механизм» развития миом [1, 4, 7].
Однако не только выключение циклических процессов обусловливает представленные эффекты КОК. Немаловажное значение имеет также вид прогестина, входящего в состав применяющихся препаратов. Известно, что все прогестины способны в той или иной степени связываться с рецепторами прогестерона, и между ними существует целый ряд различий, например аффинитет к рецепторам прогестерона и величина антипролиферативного индекса (непосредственное влияние прогестинов на эндометрий). Безусловно, вызывают интерес препараты, которые в минимальных дозах способны оказывать благоприятный эффект на эндометрий, обладая выраженными антипролиферативными действиями [4].
Как видно из таблицы, самые минимальные дозы, необходимые для подавления трансформации эндометрия, характерны для дезогестрела, Новинета и Регулона, что подтверждено многочисленными клиническими исследованиями. Этими свойствами объясняется эффективность назначения препаратов (при отсутствии противопоказаний) при нарушениях МЦ по типу полименореи, а также при гиперпластических процессах. Иммуногистохимическими исследованиями подтверждено, что препараты Новинет, Регулон способны регулировать процессы в гипоталамо-гипофизарной системе и органах-мишенях (матке, яичниках), нормализируя соотношение ФСГ/ЛГ, эстрадиола и прогестерона (центральный механизм действия), и непосредственно блокировать рецепторы прогестерона в миоматозном узле. Именно поэтому эффективность этих препаратов при лечении миомы матки (антипролиферативный эффект) выше, чем производных прогестерона, применение которых в данной ситуации является не совсем патогенетическим (см. таблицу) [4, 7].
Однако не во всех случаях рост миоматозных узлов эффективно стабилизируется приемом КОК. Такой эффект КОК распространяется на миоматозные узлы размером до 1,5 см в диаметре. Назначение КОК при крупных узлах дает неоднозначный эффект: иногда размер узла стабилизируется, а в ряде случаев наблюдается рост миомы. Судя по всему, это связано с тем, что в небольших миоматозных узлах до конца не сформированы основные патологические порочные круги (локальные ферментные системы, автономная продукция соединительной ткани), в связи с чем рост такого узла осуществляется под экзогенным воздействием гестагена (дезогестрела, содержащегося в Новинете и Регулоне). В случаях, если размеры узлов большие, следует провести медикаментозное уменьшение их размеров до максимально возможных с применением а-ГнРГ.
Назначение Новинета и Регулона оправдано с лечебной (воздействие на основные звенья патогенеза) и профилактической целью.
Дифференцированное статистическое исследование, включавшее 843 пациентки с миомой матки и 1557 женщин контрольной группы, выявило, что с увеличением продолжительности непрерывного приема КОК снижается риск развития миомы матки [20].
Учитывая, что миома матки может формироваться в ответ на повреждение миометрия воспалительными, эксплантными, механическими и другими факторами, которые вызывают усиленное функционирование клеток специализированной ткани вокруг участков повреждения с последующей фенотипической трансформацией ГМК, применение КОК (Новинет, Регулон) является важным фактором профилактики воспалительных заболеваний органов малого таза и аденомиоза [1, 4].
Важное преимущество КОК, в частности Новинета и Регулона, состоит не только в решении медицинских (лечебных) вопросов, а и в предоставлении женщине надежного метода контрацепции. По рекомендациям ВОЗ (2004), пациенткам с миомой матки при отсутствии противопоказаний показано использование КОК. При правильном применении КОК женщина защищена от нежелательной беременности и от необходимости делать аборт, который является одним из патогенетических факторов развития миомы.
На фоне длительного использования КОК отмечается снижение частоты развития рака эндометрия (риск снижается на 20% в год после двух лет приема) [14]. Исследование, проведенное центром по контролю за заболеваемостью и Национальным институтом здоровья США, показало снижение риска развития рака эндометрия на 50%, что связывали с применением оральных контрацептивов в течение как минимум 12 мес. Защитный эффект при этом сохраняется до 15 лет после прекращения их приема [19].
У женщин, принимающих КОК, отмечается снижение частоты развития ретенционных образований яичников (при применении Новинета и Регулона – до 90%) [14].
Применение КОК около года на 40% снижает риск развития рака яичников по сравнению с теми, кто не использует КОК. У принимавших КОК более 10 лет этот показатель снижается до 80%. Предполагаемый протекторный эффект, связанный с использованием КОК, длится более 10 лет после прекращения их приема [20].
Кроме этого, КОК оказывают положительный эффект и на общесоматические заболевания. Так, на 78% отмечается снижение риска развития ревматоидного артрита, положительное влияние на течение идиопатической тромбоцитопенической пурпуры; на 40% снижение риска развития колоректального рака. Современные КОК оказывают терапевтическое воздействие на кожу при акне, гирсутизме и себорее (при приеме препаратов третьего поколения).
Таким образом, применение КОК, в частности Новинета и Регулона, способствует профилактике гиперпластических процессов в эндометрии (возникновение или появление рецидивов), оказывает стабилизируещее влияние на рост простых миом и начальных размеров узлов не более 2 см, а также на рост миом после терапии базисными препаратами, повышая эффективность и снижая экономичность лечения; проявляет значительное профилактическое действие на рецидив роста миомы матки.
В заключение следует отметить, что медикаментозная терапия тормозит рост и уменьшает размеры миомы, но, к сожалению, после прекращения лечения, как правило, наблюдается рецидив роста опухоли. Большой оптимизм внушает проведение неоперативного лечения у женщин в перименопаузальном периоде, в результате которого наступает естественная менопауза. Очевидной является необходимость сугубо индивидуального подхода к выбору метода лечения каждой пациентки, при этом совершенно недопустимо противопоставление консервативного и хирургического методов.
Литература
1. Алгоритм комплексного консервативного лечения больных с миомой матки / А.Л. Тихомиров, Ч.Г. Олейник // Медицина. – Минск, 2003. – № 4. – С. 84-86
2. Генетика и молекулярная биология миомы матки / В.И. Ланчинский, А.И. Ищенко, С.Н. Иллариошкин // Акушерство и гинекология. – М, 2004. – № 2. – С. 14-17.
3. Лейомиома матки (в помощь начинающему врачу) / А.Ю. Шиляев // Гинекология. – 2005. – Т. 7. – № 1. – С. 65-70.
4. Миома матки / А. Л. Тихомиров, Д. М. Лубнин. – М.: МИА, 2006. – 174 с.
5. Миома матки: алгоритм комплексного консервативного лечения в амбулаторных условиях / Н.В. Кулагина // Стационарозамещающие технологии. Амбулаторная хирургия. – СПб., 2005. – № 1. – С. 83-86.
6. Миома матки. Обоснование неоперативного лечения (обзор литературы) / Т.Е. Самойлова // Проблемы репродукции. – М, 2003. – Т. 9. – № 4. – С. 32-36.
7. Миома матки. Проблемы патогенеза и патогенетической терапии / Г.А. Савицкий, А.Г. Савицкий. – 3-е изд. – СПб.: Элби-СПб, 2003. – 236 с.
8. Патогенез, клиника и лечение миомы матки / Е.М. Вихляева, Г.А. Паллади – Кишинев: Штинница, 1982. – 300 с.
9. Простая и пролиферирующая миома матки: морфологические особенности / И. Сидорова, О. Зайратьянц, С. Леваков, М. Баракова-Безуглая // Врач. – М., 2004. – № 4. – С. 30-31.
10. Роль факторов роста и экстрацеллюлярного матрикса в патогенезе простой и пролиферирующей миомы матки / И. Сидорова , О. Зайратьянц , С. Леваков, М. Баракова-Безуглая // Врач. – М, 2004. – № 1. – С. 32-34.
11. Ali A.F., Fateen D., Ezzet E. et al. Obstet. Gynecol. – 2000. – 95 (SI). – S. – 6.
12. Felderbaum R.E., Reissman T. et al. Assist. Reprod. Genet. – 1996. – 13: 216-222.
13. Hisoaka V., Sheng W.Q. et al. Cancer Genet. Cytogenet. – 2002. – 138 (1). – Р. 50-55.
14. Kaunitz A.M. Rev. Endocr. Metab. Disord. – 2002. – V. 3 (3). – P. 277-283.
15. Nowak R.A. Clin. Obstet. Gynecol. – 2001. – 44( 2). – Р. 327- 334.
16. Ravina G.H. et al. Bull. Acad. Natl. Med. – 1997. – 181. – Р. 233-246.
17. Stergachis A. Am. J. Obstet. Gynecol. – 1992. – V. 167. – № 4 (Pt.2). – P. 1165-1170.
18. Tiltman A.J. Curr. Opin. Obstet Gynecol. – 1997. – 9(1). – Р. 48-51.
19. Williams J.K. Int. J. Fertil. Womens. Med. — 2000. — V. 45 (3). – P. 241-247.
20. Yang C.P., Daling J.R., Band P.R., Gallagher R.P., White E., Weiss N.S. Cancer Causes Control. – 1992. – V. 3 (5). – P. 475-479.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Перспективы органосохраняющего лечения миомы матки
Перспективы органосохраняющего лечения миомы матки
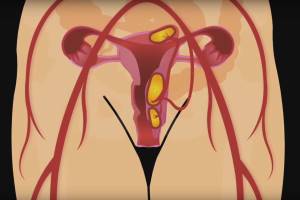 Лейомиома матки
Лейомиома матки
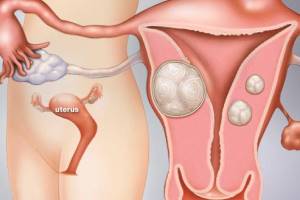 Лейомиома матки
Лейомиома матки
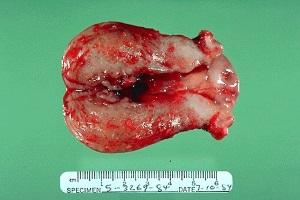 Злокачественное новообразование эндометрия
Злокачественное новообразование эндометрия