- Головна
- /
- Статті
- /
- Ендокринологія. Цукровий діабет
- /
- Передчасний статевий розвиток. Неповні форми передчасного статевого розвитку
Передчасний статевий розвиток. Неповні форми передчасного статевого розвитку
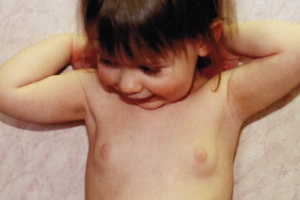
Передчасний статевий розвиток (pubertas praecox) – симптомокомплекс, що характеризується появою вторинних статевих ознак до 9 років у хлопчиків та до 8 років у дівчат.
МКХ10: Е30.1, МКХ10: Е30.8
Общая информация
Істинний передчасний статевий розвиток (ПСР) зумовлений передчасною активацією імпульсної секреції гіпоталамічного пульсового генератору гонадотропінРГ, що збільшує секрецію гонадотропних гормонів – ЛГ та ФСГ.
Істинна (церебральна) форма ПСР спостерігається у 90% дівчаток і 47% хлопчиків.
Етіологія
Істинний ПСР зумовлений ураженням ЦНС та гіпоталамогіпофізарної системи (черепномозкові травми під час пологів, менінгоенцефаліт, токсикоінфекція, пухлинний процес (пухлина заднього відділу діенцефальної ділянки), пухлина епіфізу, гідроцефалія. В 5075% випадків у хворих з істиним ПСР виявляються пухлини або доброякісні вроджені об’ємні утворення ЦНС. Найбільш характерні пухлини, що локалізуються в області заднього гіпофізу, дна третього шлуночку, сірого горба. В дітей у віці до трьох років причиною ПСР найчастіше є гіпоталамічні гамартоми (варіант вродженої вади порушення формування мозку – ектопія гіпоталамічної тканини, яка містить нейрони, що секретують рилізинггормон гонадотропних гормонів).
У 8090% дітей, навіть при повному клінічному обстеженні, не вдається знайти чинник захворювання та якогонебудь ураження гіпоталамусу або гіпофізу. В таких випадках говорять про ідіопатичну форму передчасного статевого розвитку. У дівчат така форма захворювання зустрічається в 78 разів частіше, аніж у хлопців.
Патогенез
Основну роль в патогенезі церебрального передчасного статевого розвитку відіграє передчасна зупинка гальмуючого впливу гіпоталамусу на аденогіпофіз, що веде до посилення секреції гонадотропінів та подальшої активації статевих залоз.
В разі гамартоми гіпоталамусу має місце патологія міграції в ранньому ембріогенезі нейронів, які секретують гонадотропінРГ. Ці нейрони знаходяться поза межами гіпоталамусу, не підпадають під вплив фізіологічних факторів, інгібуючих секрецію гонадотропінРГ в допубертатний період, тому функціонують як ектопічний генератор імпульсної секреції гонадотропінРГ. В наслідок цього виникає передчасна активація секреції гонадотропних та статевих гормонів та розвивається клінічна картина істинного ПСР. Характерним для гамартоми є відсутність швидкого росту та стиснення прилеглих тканин.
Оптичні гліоми невеликих розмірів маніфестують тільки симптомами ПСР, великі пухлини супроводжуються явищами нецукрового діабету, дефіциту гормону росту, зоровими порушеннями, загальномозковими симптомами, пов’язаними із підвищенням внутрішньочерепного тиску. Гліоми оптичного тракту також є одним із проявів нейрофіброматозу 1 типу (хвороба Ренклінгаузена) – захворювання, зумовленого мутацією гену, який кодує синтез нейрофіброміну (білок, який супресує проліферацію клітин). Можливий регрес пухлини в хворих у віці до 6 років.
Треба підкреслити, що гліоми та арахноїдальні кісти супроводжуються симптомами істиного ПСР тільки в разі однотипової локалізації в ділянці третього шлуночку та хіазмальнооптичній області. Патогенетичні механізми ПСР можуть бути реалізовані через механічне подразнення ядер заднього гіпоталамусу цими утвореннями, а також через вплив на гіпоталамічні ядра внутрішньочерепної гіпертензії. На сьогодні існує теорія про первинну роль астрогліальних клітин в розвитку ПСР – стимуляція або подразнення клітин астроглії здатне значно підвищити секрецію проліферативного пептиду – трансформуючого ростового фактору α (ТРФ α). ТРФ α, в свою чергу, має властивість стимулювати гонадотропінРГнейрони преоптичних ядер гіпоталамусу. Однак, патогенетичні механізми центральних форм ПСР до кінця не вивчені.
Клиническая картина
Першим клінічним симптомом захворювання є прискорений ріст дитини – за фізичним розвитком пацієнт випереджає однолітків. Однак, зазвичай до лікаря звертаються тільки при появі ознак раннього статевого дозрівання – статевого оволосіння, акне, менструацій, частих ерекцій та збільшення статевих органів у хлопчиків.
Істинний ПСР маніфестує у віці 35 років, у разі гамартоми гіпоталамусу – до трирічного віку. У дітей обох статей прискорюється швидкість росту (1015 см на рік), за 612 місяців з’являється вторинне оволосіння. Значно прискорюється диференціація кісткової тканини (рентгенвік випереджає хронологічний), відбувається передчасне закриття «зон» росту, тому кінцевий ріст пацієнта низький (у дівчат – 146150 см, у хлопчиків – 150156 см). У багатьох пацієнтів порушена послідовність виникнення ознак статевого дозрівання, пубертатний період прискорений.
У хлопчиків збільшуються статеві органи, виникають ерекції, відзначається специфічне потовиділення, збільшуються м’язова маса, грубіє голос, швидко прогресують вторинні статеві ознаки, збільшується об’єм яєчок. У дівчат з’являються надмірні слизові або геморагічні виділення з вагіни, збільшуються молочні залози. Менструації можуть мати регулярний характер. За наявності гамартоми характерним є ранній початок менструацій. Андрогенозалежні симптоми (акне, себорея, пітливість та ін.) у дівчат з ПСР зазвичай з’являються після 67 років (під час фізіологічної активації андрогенової функції наднирників).
Психологічний стан дитини порушений, спостерігається органічний психосиндром (рухлива та емоційна розгальмованість, ейфоричність поведінки, агресивність, афективна поведінка). Загальний рівень інтелекту зазвичай не страждає.
Психоневрологічні порушення спостерігаються за умов органічного ураження ЦНС: характерні зміни на ЕЕГ, підвищення внутрішньочерепного тиску, порушення з боку зорових нервів, рефлекторної та моторної сфери, невротичні реакції, зміни поведінки та психіки дитини, різні неврологічні реакції. Спостерігаються пароксизмальні стани так званого вимушеного сміху, приступи якого фіксуються від 23 разів на тиждень до кількох разів на добу. Пухлина гіпоталамусу, що росте, супроводжується неврологічною симптоматикою, поліурією, полідипсією, порушенням терморегуляції, булімією та ін.
Неповні форми ПСР можуть проявлятися як ізольоване телархе (збільшення молочних залоз у дівчаток раніше за 7 років без інших ознак ПСР), ізольоване адренархе/пубархе (рання поява лише вторинного статевого оволосіння у дівчаток до 8 років, у хлопчиків – до 9 років, без інших ознак ПСР). Н. Лавін (1999) пропонує виділяти ще дві форми неповного ПСР: передчасне ізольоване менархе та пубертатна гінекомастія.
Диагностика
Основні напрями діагностики:
Оцінка клінічних та анамнестичних даних
Обов’язкова оцінка статевого розвитку (за Tanner). У дівчат оцінюють ступінь розвитку молочних залоз та аксилярного і лобкового оволосіння, тип тілобудови, стан зовнішніх геніталій, менструальну функцію. У хлопчиків визначають об’єм яєчок, їх консистенцію, розмір статевого члена, наявність та частоту ерекцій, ступінь розвитку м’язів, зміни голосу, наявність acne vulgaris, ступінь розвитку аксилярного та лобкового оволосіння.
Визначення показників росту та маси тіла, SDS росту, динаміки швидкості росту.
Рентгенологічне обстеження
Визначення кісткового віку є важливим критерієм оцінки стану хворого з ПСР, оскільки воно відбиває ступінь впливу статевих стероїдів на кісткову тканину.
Гормональна діагностика
Таблиця 2. Лабораторні та інструментальні методи діагностики ПСР
Визначення рівнів ЛГ та ФСГ в крові (базальні значення та на тлі стимуляційних тестів). Найінформативнішим є проведення тесту з ЛГРГ – при введенні ЛГРГ відзначається чітке підвищення рівнів ЛГ та ФСГ до пубертатних значень. Головним гормональним маркером ПСР є характер відповіді ЛГ на стимуляцію ЛГРГ. У випадку істиного ПСР стимульований рівень ЛГ перевищує 10 мОД/мл.
Для проведення тесту використовують препарат природнього люліберину (ЛГРГ) у вигляді одноразового в/в введення в дозі 50100 мкг або недовгоживучі аналоги люліберину. (Диферелін 0,1 мг п/ш ). Зразки крові при п/ш беруть до та через 306090120 хв після введення препарату. Максимальний підйом ЛГ фіксується на 30 хв, ФСГ – на 6090 хв тесту. Якщо використовується аналог ЛГРГ, зразки крові беруть до та через 1 та 4 години після введення препарату. У більшості пацієнтів підйом ЛГ та ФСГ відбувається через 1 годину.
Визначення рівня тестостерону, естрадіолу в крові (підвищені відносно хронологічного віку).
Визначення ДГЕА та ДГЕАС (при істинному ПСР до 78річного віку відповідає хронологічному віку, в старшому віці – відповідність рівнів адреналових гормонів кістковому віку).
При підозрі на ХГЧсекретуючу пухлину – визначення рівня ХГЧ (підвищується в десятки разів) та визначення рівня ЛГ, що не змінюється на тлі стимуляційного тесту.
- Ультразвукове дослідження дозволяє оцінити ступінь збільшення матки та яєчників, виявити великі фолікулярні кісти та пухлини яєчників у дівчат; у хлопців – пухлини яєчка, аденоматоз.
КТ та МРТдослідження
Обов’язкове для виключення об’ємних утворень ЦНС. Гіпоталамічні гамартоми візуалізуються тільки при застосуванні МРТ. Для ХГЧсекретуючих герміном є характерним високе накопичення контрастуючих речовин.
Всі хворі потребують консультації невролога, гінеколога, нейрохірурга, офтальмолога, а в разі потреби – генетика (з визначенням статевого хроматину, каріотипу), психолога.
Диференційна діагностика
Загальні принципи диференційної діагностики ПСР:
- визначення форми захворювання (повна, неповна);
- визначення характеру активації гонадної функції (гонадотропінозалежне або гонадотропінонезалежне);
- визначення джерела підвищеної секреції гонадотропних та статевих гормонів.
Таблиця 3. Диференційна діагностика різних форм ПСР у дівчаток
Таблиця 4. Диференційна діагностика різних форм ПСР у хлопчиків
Вірогідні причини виникнення кров’янистих виділень з піхви
- Кров’янисті виділення з піхви притаманні всім формам передчасного статевого розвитку та з’являються зазвичай на тлі пубертатного прискорення росту, розвитку молочних залоз та лобкового оволосіння.
- Інфекційний вагініт (стрептококи, гонококи, Shigella spp., Candida spp.).
- Гельмінтози.
- Травма (стороннє тіло, згвалтування та ін.).
- Випадіння сечовивідного каналу, піхви).
- Пухлини (аденокарцинома піхви, шийки матки; рабдоміосаркома).
- Ендокринні порушення: синдром МакК’юнаОлбрайта, ідіопатичний ПСР, ураження ЦНС, ВГКН, естрогеносекретуючі пухлини яєчників або наднирників, екзогенні естрогени.
Лечение
Найоптимальнішим для лікування гонадотропінозалежного ПСР є застосування депонованих аналогів ЛГРГ (декапептилу, дифереліну, активною молекулою яких є трипторелін (синтетичний аналог, в якому в позиції 6 амінокислота Lгліцин замінена на Dтриптофан)). Отримана молекула в 100 разів активніша, ніж натуральний пептид, та діє триваліший час. Активний компонент трипторелін, введений до мікросфер, які містять лактидгліколідполімер. Це забезпечує повільний вихід триптореліну та підтримку його постійної концентрації протягом 4 тижнів. Трипторелін вводять в/м 1 раз на 28 днів в середній дозі 100 мкг/ кг маси тіла. Дітям з масою тіла до 30 кг застосовують Трипторелін 1,8 мг; при масі тіла більше 30 кг вводять Трипторелін 3,75 мг.
Критерії призначення агоністів ЛГРГ:
- підтвердження гонадотропінозалежної форми ПСР (викид ЛГ на тлі стимуляційного тесту з ЛГРГ > 10 ОД/л);
- швидке прогресування клінічних симптомів захворювання (прискорення кісткового віку, який випереджає паспортний на 2 роки і більше; прискорення швидкості росту > 2SD за попередній рік);
- наявність повторних менструацій у дівчат до 7 років та збільшення об’єму яєчок > 8 мл до 8 років у хлопчиків.
Вірогідне зниження рівнів ЛГ та ФСГ підтверджується результатами тесту з недовгоживучими аналогами ЛГРГ (зниження рівнів ЛГ та ФСГ в крові у порівнянні з вихідними). Дуже важливою є швидка зворотність гонадотропної супресії та відновлення процесів статевого дозрівання через 312 місяців після зупинки терапії.
Препарат переноситься добре, але інколи спостерігаються вегетативні прояви («припливи»), які проходять через 23 місяці лікування, збільшення маси тіла, зниження щільності кісткової тканини (в таких випадках призначаються препарати кальцію та вітаміну Д3).
З метою гальмування симптомів ПСР для всіх типів гліом показане призначення Дифереліну.
При виражених неврологічних симптомах, судомах та інтрагіпоталамічній локалізації новоутворення застосовують високотехнологічні методи (радіохірургічний метод, метод стереотоксичної радіочастотної термокоагуляції).
Хірургічне та променеве лікування гліом хіазмальнооптичної ділянки та дна третього шлуночку проводять за нейрохірургічними показаннями.
При гермінативноклітинних пухлинах будьякої локалізації ефективним є застосування променевої терапії. Опромінення інтракраніальної пухлини деколи призводить до розвитку гіпофізарної недостатності, яка потребує відповідної медикаментозної корекції.
Повільно прогресуючі форми істинного ПСР в дівчат у віці після 56 років не потребують медикаментозного лікування.
Критерії ефективності лікування
Стабілізація та регрес статевого розвитку; стабілізація або мінімальний прогрес диференціювання кісток скелету; зниження швидкості росту (до відповідних фізіологічних норм), нормалізація рівнів гонадотропних та статевих гормонів у крові, нормалізація неврологічного та психологічного стану хворого.
Рекомендації щодо подальшого надання медичної допомоги хворому
Дитина потребує регулярного нагляду ендокринолога та гінеколога (1 раз на 612 місяців), в разі пухлинного процесу – контроль з боку нейрохірурга, окуліста, невролога за показаннями. Гормональне та інструментальне дослідження: рівні ЛГ, ФСГ, пролактину, естрадіолу/тестостерону, 17ОПГ – на тлі лікування 1 раз на 36 місяців, при стабілізації процесу – 1 раз на рік; МРТ/КТ головного мозку, ЕЕГ, ЕхоЕЕГ, рентген кисті (кістковий вік), УЗД органів малого тазу та надниркових залоз, клінічний аналіз крові, сечі, печінкові проби – 1 раз на рік.
Пацієнти з ідіопатичними формами ПСР та гліомами гіпоталамусу в переважній більшості випадків при адекватній терапії не мають гормональних та репродуктивних порушень, добре адаптовані в суспільстві. При своєчасній (рентгенвік не перевищує 12 років) та адекватній терапії прогноз для росту також сприятливий.
Хірургічне видалення гліальної пухлини третьго шлуночка та променева терапія в багатьох випадках призводить до випадіння низки гіпофізарних функцій, що потребує призначення відповідної замісної терапії.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Киста яичника, или «у страха глаза велики»
Киста яичника, или «у страха глаза велики»
 Эндометриоз
Эндометриоз
 Синдром раздраженного кишечника
Синдром раздраженного кишечника
 Диагностика и лечение заболеваний органов пищеварения. Синдром раздраженного кишечника МКБ-10: K58. Алкогольная болезнь печени МКБ-10: К70
Диагностика и лечение заболеваний органов пищеварения. Синдром раздраженного кишечника МКБ-10: K58. Алкогольная болезнь печени МКБ-10: К70