- Головна
- /
- Статті
- /
- Гастроентерологія
- /
- Власний досвід малоінвазивної діагностики атрофічного гастриту
Власний досвід малоінвазивної діагностики атрофічного гастриту
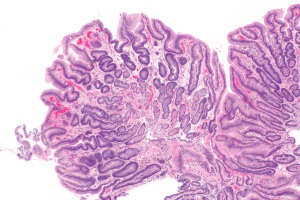
На сьогодні існує широке коло нерозв’язаних проблем, пов’язаних із діагностикою критичних етапів шлункового канцерогенезу – шлункової епітеліальної атрофії, кишкової метаплазії та дисплазії. З огляду на це, вкрай актуальною є ідентифікація хворих із диспепсією, які потребують динамічного спостереження з метою раннього виявлення пренеопластичних змін у слизовій оболонці шлунка.
Нині доведено, що економічно ефективними методами профілактики раку шлунка є скринінг і ерадикація H.pylori. У повсякденній практиці лікарів-гастроентерологів єдиним методом діагностики атрофічного гастриту та його важких наслідків є ендоскопічне дослідження із прицільною біопсією. Проте це дослідження є інвазивною процедурою, що вимагає значних витрат людських і матеріальних ресурсів. Крім того, для H. pylori-інфекції та її наслідків у вигляді хронічного атрофічного гастриту досить характерні виражені ділянкові зміни, тому для отримання правильного морфологічного висновку про характер патологічного процесу надзвичайно важливим є адекватне взяття біоптатів під час ендоскопії, що далеко не завжди досягається в амбулаторних умовах. З огляду на цю обставину морфологічне дослідження слизової оболонки шлунка не може бути скринінговим методом діагностики й профілактики раку шлунка. Разом із тим раннє виявлення в слизовій оболонці шлунка атрофії та подальших передракових морфологічних змін – кишкової метаплазії та дисплазії – є неодмінною умовою профілактики раку шлунка. Одним зі шляхів розв’язання цієї проблеми є біохімічна верифікація морфологічних змін слизової оболонки шлунка шляхом визначення діагностичних біомаркерів ушкоджень фундального й антрального його відділів. На сьогодні на основі імуноферментного аналізу розроблено методи серологічного скринінгу атрофії шлунка, за допомогою яких виявляють функціональну недостатність його слизової оболонки.
Наше дослідження ґрунтується на взаємозв’язку морфологічного стану й функціональної активності слизової оболонки тіла та антрального відділу шлунка і секреції, відповідно, пепсиногену-1 (PG-1) і гастрину-17 (G-17). Вивчивши досвід закордонних учених у цій галузі, ми використали новий спосіб малоінвазивної діагностики ступеня гастриту за допомогою тестової панелі. Зауважимо, що комплексне вивчення проблеми діагностики передракових змін слизової оболонки шлунка при хронічному H. pylori-асоційованому гастриті, у тому числі за допомогою малоінвазивного методу діагностики, в Україні здійснено вперше.
Мета дослідження
Провести морфофункціональні зіставлення в пацієнтів із H. pylori-асоційованим хронічним атрофічним гастритом із різними ступенями виразності атрофії та розвитку кишкової метаплазії і дисплазії в слизовій оболонці шлунка шляхом морфологічних і серологічних методів діагностики.
Методи дослідження
Обстежено 130 хворих віком від 18 до 80 років, у яких під час ендоскопічного дослідження з проведенням швидкого уреазного тесту діагностовано H. рylori-асоційований (Нр+) хронічний гастрит. До групи контролю увійшли 30 H. pylori-негативних (Нр-) осіб віком від 17 до 45 років, у яких в анамнезі відсутні хвороби шлунково-кишкового тракту і під час відеогастродуоденоскопії (ВГДС) змін слизової оболонки шлунка та дванадцятипалої кишки не виявлено.
Обстеження хворих проводилося під час першого огляду. Крім загальноклінічних досліджень, традиційних для цієї категорії хворих, проводили ВГДС із множинними біопсіями (по 2 біоптати з тіла й антрального відділу шлунка й 1 біоптат із ділянки кута шлунка з урахуванням вимог модифікованої Сіднейської системи) з подальшим гістологічним вивченням біоптатів. Крім цього, в усіх досліджуваних пацієнтів брали зразки сироватки крові для імуноферментного аналізу.
У гістологічних препаратах фіксували наявність і поширеність пілоричної і кишкової метаплазії та дисплазії епітелію, а також лімфатичних фолікулів у власній пластинці слизової оболонки шлунка.
Уреазний тест в осіб контрольної групи був негативним у 100% випадків.
Для виявлення концентрацій PG-1 та антитіл класу IgG до H.pylori брали зразки сироватки крові натще. Постпрандіальну концентрацію G-17 визначали в зразках сироватки крові, взятих через 20 хвилин після використання протеїнового коктейлю (порція містить 10 г протеїну). Зразки центрифугували при 1500 g протягом 10 хвилин і зберігали при температурі -20°С до проведення аналізу.
Серологічне дослідження проводилося за допомогою імуноферментного аналізу з визначенням концентрацій G-17 і PG-1, а також титрів H. pylori.
Результати
Зі 130 досліджених нами пацієнтів із ендоскопічними ознаками Н. pylori-асоційованого гастриту гістологічне дослідження біоптатів підтвердило наявність запальних змін різного ступеня важкості в слизовій оболонці шлунка в усіх випадках (100%).
Залежно від наявності й виразності атрофії слизової оболонки тіла шлунка неатрофічний гастрит було виявлено в 72 пацієнтів (55,0%), слабку атрофію слизової оболонки шлунка – в 14 (10,56%), помірну – в 26 (20,0%), виражену – в 19 (14,44%).
Неатрофічний гастрит тіла шлунка характеризувався збереженням архітектоніки слизової оболонки шлунка, при цьому в структурі основних залоз під час фарбування гематоксилін-еозином, альціановим синім при рH 2,5 у сполученні з ШИК-реакцією головні, парієтальні й додаткові клітини було виявлено у звичайних співвідношеннях: близько 30, 50 і 20% відповідно від загальної кількості клітин у залозі.
Сироваткові концентрації PG-1 у пацієнтів із неатрофічним хронічним Н. pylori-асоційованим гастритом становили в середньому 105,2±5,7 мкг/л, що свідчило про збереження функціональної активності слизової оболонки шлунка відносно продукції PG-1. У випадку гістологічного виявлення слабкого ступеня атрофії тіла шлунка реєструвалося зниження сироваткових концентрацій PG-1, що становили в середньому 18,71±0,95 мкг/л і були вірогідно (р<0,0001) нижчими порівняно з аналогічними показниками при неатрофічному гастриті у хворих групи контролю.
У разі виявлення в досліджуваних пацієнтів H. pylori-асоційованого хронічного атрофічного гастриту з помірним ступенем атрофії у фундальному відділі фіксувалося подальше зниження показників сироваткових концентрацій PG-1, що становили у середньому 11,91±0,49мкг/л і були вірогідно (р<0,0001) нижчими порівняно з аналогічними показниками при неатрофічному гастриті й гастриті зі слабким ступенем атрофії.
Розвиток вираженої атрофії слизової оболонки тіла шлунка при Н. pylori-асоційованому хронічному гастриті супроводжувався різким зниженням сироваткових концентрацій PG-1, що становили в середньому 6,92±0,45 мкг/л і були вірогідно (р<0,0001) нижчими порівняно з аналогічними показниками при неатрофічному гастриті й гастриті зі слабким і помірним ступенями атрофії.
Отже, зіставлення даних гістологічного вивчення біоптатів і результатів імуноферментного аналізу сироватки крові пацієнтів із Н. pylori-асоційованим хронічним гастритом показало достовірне зниження функціональної активності головних залоз шлунка при розвитку й прогресуванні атрофічних змін.
Сироваткові концентрації G-17 у пацієнтів із неатрофічним хронічним H. pylori-асоційованим антральним гастритом становили в середньому 14,57±1,29 пмоль/л, що свідчило про збереження функціональної активності слизової оболонки шлунка відносно продукції G-17.
У випадку гістологічного виявлення слабкого ступеня атрофії в антральному відділі шлунка реєструвалося зниження сироваткових концентрацій G-17, що становили в середньому 8,91±0,47 пмоль/л і були вірогідно (р<0,0001) нижчими порівняно з аналогічними показниками при неатрофічному гастриті.
Розвиток вираженої атрофії слизової оболонки антрального відділу шлунка при H. pylori-асоційованому хронічному гастриті супроводжувався різким зниженням сироваткових концентрацій G-17, що становили в середньому 1,82±0,26 пмоль/л і були вірогідно (р<0,0001) нижчими порівняно з аналогічними показниками при неатрофічному гастриті й гастриті зі слабким і помірним ступенями атрофії.
Зіставлення результатів гістологічного вивчення біоптатів антрального відділу шлунка й імуноферментного аналізу сироватки крові у відповідних пацієнтів показало вірогідне зниження функціональної активності гастрин-продукуючих клітин антрального відділу шлунка при розвитку й прогресуванні атрофічних змін.
Стосовно наявності й ступеня виразності мультифокальної атрофії слизової оболонки шлунка (одночасна наявність атрофічних змін у фундальному й антральному відділах), відсутність мультифокальної атрофії виявлено у 28 (21,7%) хворих, слабкий ступінь – у 33 (25,5%), помірний – у 46 (35,6%), виражений – у 22 (17,2%) пацієнтів.
Морфофункціональні зіставлення залежно від наявності й ступеня виразності мультифокальної атрофії наведено на рисунку.
Сироваткові концентрації G-17 у пацієнтів без мультифокального атрофічного хронічного H. pylori-асоційованого гастриту становили в середньому 10,85±2,03 пмоль/л, що свідчило про збереження функціональної активності слизової оболонки шлунка відносно продукції G-17.
Розвиток вираженої мультифокальної атрофії при H.pylori-асоційованому хронічному гастриті супроводжувався суттєвим зниженням сироваткових концентрацій G-17, що становили в середньому 5,26±2,36 пмоль/л і були вірогідно (р<0,001) нижчими порівняно з аналогічними показниками за відсутності мультифокальної атрофії та її слабкого і помірного (р<0,05) ступенів.
Сироваткові концентрації PG-1 у пацієнтів без мультифокального атрофічного хронічного H. pylori-асоційованого гастриту становили в середньому 27,86±3,25 мкг/л, що свідчило про збереження функціональної активності відносно продукції PG-1.
Розвиток вираженої мультифокальної атрофії супроводжувався значним зниженням сироваткових концентрацій PG-1, що становили в середньому 6,90±2,38 мкг/л і були вірогідно (р<0,001) нижчими порівняно з аналогічними показниками за відсутності мультифокальної атрофії та її слабкого і помірного ступенів.
Отже, зіставлення даних гістологічного й серологічного досліджень у пацієнтів із H. pylori-асоційованим мультифокальним хронічним гастритом показало вірогідне зниження функціональної активності слизової оболонки шлунка, що залежало від прогресування у ній атрофічних змін.
У всіх випадках кишкові метаплазії супроводжувалися тією чи іншою мірою вираженими атрофічними змінами слизової оболонки шлунка.
Розвиток кишкової метаплазії при хронічному мультифокальному H. pylori-асоційованому гастриті супроводжувався зниженням продукції PG-1 при нормальній продукції G-17.
Дисплазія виявлялася в зонах проліферативного компартменту шлункових залоз, що містять шийкові мукоцити. Під час зіставлення наявності дисплазії і сироваткових концентрацій G-17 і PG-1 були отримані такі дані. Середня концентрація G-17 у сироватці крові становила 6,9±2,17 пмоль/л, що відбивало збереження функції гастрин-продукуючих клітин слизової оболонки шлунка. Середня сироваткова концентрація PG-1 становила 14,25±8,9 мкг/л, що свідчило про функціональну недостатність парієтальних клітин слизової оболонки.
Розвиток дисплазії епітелію при хронічному мультифокальному H. pylori-асоційованому гастриті супроводжувався порушенням продукції PG-1 при збереженій продукції G-17.
Аналіз змін продукції G-17 і PG-1 при кишковій метаплазії та дисплазії шлункового епітелію дає змогу припустити наявність більш важкого ушкодження фундального відділу, що відповідає більшій поширеності саме цієї локалізації раку шлунка.
Висновки
Таким чином, проведене дослідження показало, що серологічні маркери функціональної активності слизової оболонки шлунка – PG-1 і G-17 – можуть слугувати об’єктами достовірного скринінгу атрофії відповідних відділів цього органу. У той же час відсутність вираженої кореляції між наявністю й ступенем виразності атрофії, з одного боку, і кишкової метаплазії/дисплазії – з іншого, не дає змоги використовувати зазначені серологічні маркери для діагностики цих патологічних процесів. Отже, в разі отримання результатів серологічного скринінгу, що свідчать про наявність атрофії слизової оболонки шлунка, показано проведення ендоскопії з узяттям біоптатів з тіла й антрального відділу шлунка для гістологічного виявлення можливого прогресування атрофії з розвитком кишкової метаплазії, дисплазії або раку шлунка.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Рак полового члена: возможно ли исцеление?
Рак полового члена: возможно ли исцеление?
 Рак яичников: причины, симптомы, методы лечения
Рак яичников: причины, симптомы, методы лечения
 Как уберечь себя от рака молочной железы
Как уберечь себя от рака молочной железы
 Таргетная терапия: продление и улучшение качества жизни у больных раком молочной железы
Таргетная терапия: продление и улучшение качества жизни у больных раком молочной железы