- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Особенности течения и лечения герпетической инфекции у детей
Особенности течения и лечения герпетической инфекции у детей
Инфекции, вызываемые герпетическими вирусами, привлекают внимание большой распространенностью в человеческой популяции. В настоящее время известно восемь герпетических вирусов, патогенных для человека. Общим для них является то, что, однажды попав в организм человека, вирусы персистируют в латентном состоянии в течение всей жизни.
Инфицирование герпетическими вирусами происходит обычно в детском возрасте, если оно не произошло внутриутробно. У взрослых обнаруживают герпетические вирусы с частотой от 70% (вирусы простого герпеса первого типа – HSV-1, цитомегаловирус – CMV) до 95% и более (вирус ветряной оспы – VZV, человеческий герпетический вирус-6 – HHV-6). Реже, хотя тоже достаточно часто, после начала сексуальной активности определяют вирус простого герпеса второго типа. Герпетические вирусы часто вызывают тяжелые заболевания у пациентов со скомпрометированным иммунитетом, поэтому герпетические инфекции называют еще оппортунистическими, иммунодефицит-ассоциированными инфекциями. С увеличением числа иммунокомпрометированных пациентов (трансплантация органов и тканей, применение гормонов и цитостатиков), особенно с возрастанием больных с ВИЧ-инфекцией и СПИДом, проблема оппортунистических инфекций становится высоко актуальной. Герпетические инфекции привлекают внимание еще и в связи с тем, что они входят в так называемый TORCH – комплекс, который вызывает внутриутробные инфекции.Вирус простого герпеса (HSV) относится к ДНК-содержащим вирусам, он чувствителен к высушиванию и тепловому воздействию, легко разрушается под действием эфира, спирта и других органических растворителей, культивируется на культурах ткани и курином эмбрионе. В инфицированных клетках образует внутриядерные включения, что считается патогномоничным признаком инфекции простого герпеса.
Источник герпетической инфекции только человек. Основной путь передачи HSV-1 в постнатальном периоде оральный – при поцелуях, со слюной. Поражение кожи возникает при контакте с оральным секретом, реже бывает прямое заражение кожи (так называемый герпес гладиаторов).
Патогенез. Воротами инфекции является кожа и слизистые. В месте первичной инокуляции начинается репликация вируса. Вирус может попадать в кровь, но у иммунокомпетентного хозяина виремия быстро прекращается в результате активации гуморального иммунитета. Виремия характерна для новорожденных и иммунокомпрометированных пациентов.
Так как вирус простого герпеса относится к нейротропным вирусам, из места первичной инокуляции по дендритам и аксону он мигрирует в ближайший ганглий. Для HSV-1 – это тригеминальный ганглий. Предполагается, что именно здесь происходит основная репродукция HSV-1. Отсюда новое потомство вируса возвращается по эффекторным путям в место первичной инокуляции, где реплицируется, вызывая повреждения.
Пожизненная персистенция HSV-1 происходит в тригеминальном ганглии. В период реактивации возможна виремия и распространение вируса в удаленные от локализации первичных высыпаний органы (например, ЦНС). Однако не исключается распространение вируса по нервным путям.
Клиника. Инфицированность HSV происходит чаще до 5-летнего возраста, при этом только у 10-30% инфицированных детей бывают клинические проявления (табл. 1).
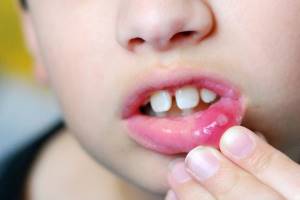
У трети детей после первичной инфекции возникают рецидивы [7]. Наиболее частая форма рецидивирующей герпетической инфекции – HSL. Герпетические высыпания обычно локализуются на наружном крае красной каймы губ, типично появление на умеренно инфильтрированной коже сгруппированных пузырьков вследствие баллонирующей дегенерации эпителия. Пузырьки окружены венчиком гиперемии, в дальнейшем они вскрываются с появлением поверхностных эрозий, затем корочек, после отпадения которых дефектов кожи и рубцов не остается. У иммунокомпетентного пациента процесс обычно завершается в течение 5-12 дней, при распространенных формах может затягиваться до 2-3 недель. В случае локализованных форм общее состояние ребенка, как правило, не нарушается, при распространенных формах отмечаются лихорадка, недомогание, головная боль, миалгия, возможно увеличение регионарных лимфоузлов. У некоторых больных в продромальном периоде возникают ощущение жжения, напряжение или зуд кожи в месте будущих высыпаний. При возникновении рецидивов герпес поражает, как правило, одни и те же участки кожи.
Рецидивирующая герпетическая инфекция может локализоваться на крыльях носа – назальный герпес (HSN), реже в области век, на руках, туловище, ягодицах. Инфекцию, поражающую пальцы, иногда ошибочно принимают за пиогенный паронихий и в последующем проводят ненужное оперативное вмешательство. Возникает интенсивный зуд или боль, затем появляются один или несколько пузырьков, которые могут сливаться. Часто эти проявления сопровождаются общими симптомами: сильной местной болезненностью, невралгией, подмышечной аденопатией. При благоприятном течении пораженные участки покрываются коркой, которая через 10 дней отпадает, и кожа возвращается к нормальному состоянию. У детей раннего возраста паронихий развивается как результат аутоинокуляции из первичного очага HSV-инфекции в периоральной области, может возникать после откусывания ногтей.
Офтальмогерпес также имеет склонность к рецидивированию у 36% больных детей старше трех лет. Развивается односторонний фолликулярный конъюнктивит с региональной лимфаденопатией. Может присоединяться или самостоятельно возникать блефарит с везикулами по краям век. Имеет место фотофобия, хемоз, слезотечение, отечность век. Если заболевание ограничено конъюнктивой, выздоровление наступает в течение 2-3 недель. При прогрессировании поражения в процесс вовлекается роговица в виде диффузной пункции с последующим образованием отросчатых фигур или извилистой язвы. Отросчатые поражения являются патогномоничными для герпетического кератита и сочетаются со снижением зрения. В процесс могут захватываться и глублежащие стромальные структуры, особенно после местного применения стероидов. Выздоровление длится свыше месяца. Чаще поражаются передние отделы глаза (поверхностный и глубокий кератит, кератоиридоциклит, иридоциклит), реже – задние (хориоретинит, увеит и т.д.). Офтальмогерпес – одна из наиболее частых причин роговичной слепоты.
К наиболее тяжелым проявлениям HSV-инфекции следует отнести герпетический энцефалит. HSV – одна из ведущих причин спорадических фокальных энцефалитов. В США частота герпетического энцефалита составляет 1 на 250-500 тысяч человек, пик заболеваемости приходится на две возрастные группы: 5-30 лет и старше 50 лет. Вирус может проникать в мозг во время первичной инфекции, но более часто в результате реактивации агента в любой из рецидивов ранее латентной персистирующей герпетической инфекции. Клинические симптомы развиваются внезапно или после короткого гриппоподобного продрома. Головная боль, лихорадка, нарушение сознания, затруднение речи, очаговые судороги являются главными симптомами, могут иметь место обонятельные галлюцинации. Височные доли – главная мишень для вируса. У половины больных в ликворе повышено количество эритроцитов. Типичен плеоцитоз, преобладают лимфоидные клетки (75-100%), но иногда, в начале заболевания, и нейтрофилы. Около 10-20% образцов спинномозговой жидкости не содержат клеток, если они получены в самом начале болезни, содержание белка в ликворе у половины больных в пределах нормы. Образование HSV-специфических антител в ЦНС происходит на второй неделе болезни. Определить вовлеченные области мозга в патологический процесс помогает ЭЭГ. ЯМР является более чувствительным методом ранней диагностики, чем компьютерная томография. Вирус редко выделяется из спинномозговой жидкости, поэтому для окончательного диагноза требуется исследование биоптатов мозга, однако необходимость применения биопсии мозга во всех случаях HSV-энцефалита противоречива. У нелеченных пациентов в течение нескольких дней быстро ухудшается состояние, вплоть до комы и смертельного исхода. Летальность среди пациентов, не получавших лечения, составляет 60-80%, среди выздоровевших – только 10% не имеют выраженных неврологических остаточных явлений. Описаны также необычные проявления со стороны ЦНС, вызываемые HSV-инфекцией: энцефалит ствола мозга, восходящий миелит, постинфекционный энцефаломиелит, нарушения движения, менингит.Диагностика кожных проявлений герпетической инфекции несложна из-за характерных везикулярных высыпаний и их типичного развития: вскрытие с образованием эрозий, впоследствии корочек; их отпадение без образования рубца и пигментации. Диагноз офтальмогерпеса также часто не вызывает трудностей. В настоящее время общепринято определять любой острый энцефалит как герпетический до подтверждения диагноза с помощью дополнительных методов обследования. Наиболее специфическим методом диагностики является идентификация вируса с помощью посева на культурах тканей. Экспериментальные животные, куриные эмбрионы, клеточные культуры чувствительны к инфицированию HSV. Материалом для исследования служат содержимое везикул, смывы с пораженных поверхностей, цереброспинальная жидкость, биоптаты, однако проведение посевов вируса требует специальных условий – это длительный и трудоемкий процесс.
Как альтернатива выделению вируса используют метод цепной полимеразной реакции для обнаружения ДНК-вируса. В диагностике герпетической инфекции может помочь и определение специфических антител против вируса простого герпеса. Во время активной фазы инфекции отмечается четырехкратное и более нарастание титра IgG-антител против вируса простого герпеса в сыворотке, взятой с интервалом в 10 дней (в острой фазе и фазе выздоровления). При рецидивах инфекции подобное нарастание может выявляться, а может и не быть. В случае реактивации инфекции также может отмечаться продукция IgM-антител.
Лечение. Создание ацикловира (ациклического нуклеозида) – главное достижение противогерпетической терапии. Разработчику препарата Gertrude Elion в 1988 году (после 17 лет успешного клинического применения) присуждена Нобелевская премия. И сегодня препаратом выбора для лечения герпетической инфекции остается ацикловир (герпевир). Он избирательно ингибирует репликацию вируса простого герпеса первого и второго типов и VZV, имеет низкую системную активность в отношении нормальных клеток. Такая селективность проявляется благодаря способности вирусной тимидинкиназы фосфорилировать ацикловир в монофосфат, но отсутствует в неинфицированных клетках. Ацикловир выпускается в трех лекарственных формах: мазь для местного применения (герпевир 2,5%, по 5 и 15 г), для внутривенного и перорального применения (герпевир 0,2 и 0,4 г). Парентеральное введение ацикловира показано при поражении ЦНС HSV-инфекцией. Рекомендуется доза 10 мг/кг каждые 8 часов в течение 14-21 дня. При остром энцефалите ацикловир нужно применять как можно скорее, эффективность лечения повышается при раннем его назначении, поэтому назначение препарата оправдано при подозрении на герпетическое поражение ЦНС. Промедление в проведении специфической терапии, в буквальном смысле, смерти подобно. При офтальмогерпесе показан ацикловир орально по 80 мг/кг массы тела в сутки, разделенный на 4 приема в течение 5 дней. Подобная схема способствует уменьшению проявлений кератита. При поражении кожи HSV в виде лабиальной или назальной формы применяют местно мазь ацикловира. При поражении кожи также рекомендуется провести 5-10-дневный курс ацикловира (40 мг/кг в сутки) per os. Использование оральных форм ацикловира позволяет уменьшить длительность рецидивов при реактивации инфекции, однако не всегда снижает их частоту.
Для повышения эффективности лечения предлагаются новые препараты семейства ацикловира, обладающие большей биодоступностью при применении per os. Фамцикловир – оральной формы пенцикловира (трифосфатный ингибитор вирусной ДНК-полимеразы), в виде мази, можно назначать 2-3 раза в сутки; валоцикловир – валиновый эфир ацикловира (расщепляется в организме на L-валин и ацикловир) – 2 раза в сутки. Меньшая кратность применения упрощает схему лечения и повышает комплайенс. При появлении штаммов, резистентных к ацикловиру, рекомендуется назначать аналог пирофосфата – фоскарнет, однако он имеет больше побочных эффектов и эффективен только при внутривенном применении.
Для уменьшения рецидивов герпетической инфекции предлагают удлинять курсы назначения ацикловира. Это так называемая супрессивная терапия, которая в основном используется для профилактики рецидивов генитального герпеса. Препараты ацикловира назначают ежедневно в течение 6-12 месяцев и более, при этом только у 30% пациентов на фоне приема препаратов не возникают рецидивы. У других больных они возобновлялись после отмены препаратов.
Наиболее экономически доступный препарат ацикловира – его отечественный аналог герпевир. Эффективность лечения повышается при назначении препаратов ацикловира в первые 24 часа от начала рецидива, еще лучше эффект при использовании препаратов в продромальном периоде, поэтому мы рекомендуем нашим пациентам иметь дома герпевир, чтобы при первых проявлениях лабиального или назального герпеса, начать лечение им. Детям с частыми рецидивами (более 4-5 раз в год) лабиального герпеса герпевир назначали в дозе 0,2 г 5 раз в сутки в течение 8 дней, одновременно использовали местно мазь герпевир 4 раза в сутки. Для усиления действия герпевира назначали гропринозин, обладающий частичным противовирусным действием, в дозе 50 мг/кг в сутки в 3-4 приема в течение 8 дней. Такая терапия не только сокращала длительность рецидива герпетической инфекции, но и существенно уменьшала число рецидивов [1].
Известно, что интерферон подавляет пролиферацию вируса простого герпеса 1 и 2 типов in vitro. Относительную эффективность отмечали при местном применении геля интерферона a-2а для лечения генитального герпеса [6]. Глазные капли интерферона a-2b включали в комплексную противовирусную терапию взрослых больных офтальмогерпесом, однако контролируемых исследований по их эффективности не проводилось. Парентеральное введение препаратов интерферона сопровождается большим числом побочных эффектов, поэтому для лечения герпетической инфекции интерфероны не используются. Существует правило: там, где есть специфическая терапия вирусных инфекций, нет места интерферонам! Синтетические индукторы интерферона известны давно, однако в мировой практике широкого применения они не нашли [4]. Последнее время в странах СНГ предложено ряд индукторов интерферона, изучение их эффективности продолжается. В Украине начали выпускать специфические антигерпетические иммуноглобулины для внутримышечного применения, их место в лечении и профилактике простого герпеса еще предстоит уточнить.
Иммунопрофилактика. Цель вакцинации против HSV-инфекции – предотвращение инфицирования, реактивации, рецидивов, трансмиссии, однако до настоящего времени не получено ни одной эффективной профилактической вакцины против HSV. Трудности создания таких вакцин связаны с особенностью HSV находиться в латентном состоянии вне системной вирусемии, поэтому даже успешная выработка специфических антител не предохраняет от последующего рецидива [5]. HSV имеет механизмы защиты от иммунной системы. В отличие, например, от полиовирусной вакцинации, где для защиты достаточно формирования только гуморального иммунитета. Для профилактики герпетической инфекции необходима также стимуляция Т-клеточного иммунитета – CD4+, CD8+ лимфоцитов. Несмотря на сложности разработки противогерпетических вакцин, исследования в этом направлении активно проводятся.
Предложены субъединичные вакцины (гликопротеид + адъювант). В ответ на введение этой вакцины возникал сильный ответ нейтрализующими антителами, но отсутствовал клеточно-опосредованный иммунный ответ. Вакцина не предотвращала сероконверсию у серонегативных индивидуумов. Живые аттенуированные HSV-вакцины вызывали более широкий иммунный ответ, но были недостаточно безвредны, так как не исключалась реверсия вирулентности. Вакцина оказывала протекцию у животных, однако первая фаза клинических испытаний показала ограниченную иммуногенность. Рекомбинантная субъединичная вакцина gD2 в сочетании с новым адъювантом (MF 59) оказывала протекцию клинического заболевания у серонегативных женщин, но не защищала мужчин и сероположительных женщин. Компромиссом между живой и субъединичной вакциной стала вакцина с дефектом в гликопротеине, в результате чего невозможна репликация HSV. На вакцину происходит более широкий ответ, она безопасна. Отмечена эффективность вакцины у животных, но вторая фаза клинических испытаний не показала клинической эффективности. Принципиально новые вакцины – так называемые ДНКовые вакцины (используются бактериальные плазмиды, которые вырабатывают HSV-протеины). Эти вакцины не только повышают клеточно-опосредованный иммунитет, но и врожденный (натуральные киллеры – NK, интерфероны). В настоящее время ДНКовые вакцины доведены до этапа клинических испытаний.
Есть надежда, что вакцины помогут уменьшить трансмиссию HSV, ослабить или сделать полностью невозможными клинические проявления заболевания, однако считается, что обеспечить протекцию в месте внедрения инфекции никогда не удастся.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Генитальный герпес
Генитальный герпес
 Кагоцел в лечении генитального герпеса
Кагоцел в лечении генитального герпеса
 Порівняльний аналіз ефективності застосування Вальтрексу та ацикловіру в лікуванні генітального герпесу
Порівняльний аналіз ефективності застосування Вальтрексу та ацикловіру в лікуванні генітального герпесу
 Опыт применения Кситроцина для лечения рецидивирующих инфекций мочевыводящих путей у детей и взрослых
Опыт применения Кситроцина для лечения рецидивирующих инфекций мочевыводящих путей у детей и взрослых