- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Современные аспекты клиники, диагностики и лечения герпесвирусной инфекции
Современные аспекты клиники, диагностики и лечения герпесвирусной инфекции

Герпесвирусную инфекцию (ГВИ) чаще всего вызывают вирусы простого герпеса (ВПГ) – ВПГ-1 и ВПГ-2, антитела к которым выявляются у 90-99% взрослого населения планеты. Инфицирование ВПГ-1 обычно происходит в течение первых трех лет жизни ребенка, а ВПГ-2 – в период полового созревания.
По данным ВОЗ, заболевания, обусловленные ВПГ, занимают второе место в мире (15,8%) после гриппа (35,8%) по частоте смертельных исходов вследствие вирусных инфекций, а герпетические энцефалиты составляют 20% всех вирусных инфекций центральной нервной системы (ЦНС). Литературные данные свидетельствуют о том, что около 80% населения инфицировано ВПГ-1, а 10% женщин и 15% мужчин – ВПГ-2. Офтальмологи регистрируют 60% герпетических кератитов и иридоциклитов от общего количества поражений роговицы у пациентов [1, 2].
Основная особенность ГВИ – склонность к хроническому течению. Больные, страдающие герпесвирусными заболеваниями, как правило, наблюдаются у врачей разных специальностей (терапевтов, дерматовенерологов, урологов, стоматологов, невропатологов, офтальмологов, иммунологов, инфекционистов и др.). Этим обусловлены различия в методологических подходах к обследованию, диагностике и лечению таких пациентов, что существенно влияет на учет, эпидемиологию и другие качественно-количественные показатели заболеваний.
Для ГВИ характерны горизонтальный (от больного к здоровому) и вертикальный (от матери к плоду) пути передачи. Первый осуществляется воздушно-капельным, половым и парентеральным путями, второй – в результате внутриутробного трансплацентарного инфицирования плода. Внутриутробная герпетическая инфекция может быть причиной перинатальной летальности, самопроизвольных выкидышей, преждевременных родов или ранней инвалидизации детей (глухота, слепота, эпилепсия, микроцефалия, пороки сердца, гепатоспленомегалия и др.) [2-4].
Вирусы, являясь облигатными внутриклеточными паразитами, имеют ультрамикроскопические размеры, содержат только один тип нуклеиновых кислот, не способны к росту и бинарному делению, не имеют собственных систем мобилизации энергии и размножаются путем репликации собственной геномной нуклеиновой кислоты в живых клетках. Все эти особенности влияют на формирование клинических проявлений и развитие инфекционного процесса.
Попав в организм человека, ВПГ пожизненно персистирует в нем, периодически вызывая рецидивы заболевания различной степени тяжести. Вирусы герпеса находятся в латентном состоянии в виде L-PREP-частиц в паравертебральных сенсорных ганглиях. В период обострения они активируются и по периферическим нервам достигают мишени поражения. Многочисленные клинические вирусологические исследования указывают на основную роль иммунной системы макроорганизма в активности ГВИ. Персистенция герпесвируса в организме человека связана с его способностью к иммунной мимикрии. Длительная персистенция вирусов приводит к вторичному иммунодефициту, который обусловливает активацию вирусов и частые рецидивы заболевания [3-5].
Отличительными особенностями вирусной инфекции являются:
- выраженная контагиозность и эпидемичность;
- передача инфекции посредством специфического механизма;
- специфичность и топизм паразитирования в органах и тканях, в которых возникают характерные для болезни патологические изменения;
- высокая специфичность формирования иммунного ответа.
Характерной особенностью течения вирусных инфекций является цикличность, когда один период последовательно сменяется другим. Инкубационный этап начинается с момента заражения и продолжается до появления первых симптомов заболевания. Продромальный период сопровождается повышением температуры тела, головной и мышечной болью, слабостью, общим недомоганием. Этап развития основных симптомов характеризуется специфической картиной для каждого вирусного заболевания. При благоприятном течении болезнь заканчивается выздоровлением (реконвалесценцией). При слабовыраженном иммунитете возможны рецидивы [6-8].
Независимо от пути попадания вируса в организм человека, начальное размножение возбудителя происходит у входных ворот, после чего он проникает в регионарные лимфатические узлы, затем в кровь и лимфогематогенным путем заносится во внутренние органы и нервную систему. В ЦНС ВПГ может проникать и по нервным стволам. При ГВИ поражаются слизистые оболочки, кожа, структурные элементы центральной и периферической нервной систем, печень, эндотелий сосудов, клетки крови (Т-лимфоциты, эритроциты, тромбоциты). ВПГ может интегрироваться в генетический аппарат клетки хозяина и вызывать злокачественную трансформацию клеток. Доказана этиопатогенетическая роль представителей семейства герпесвирусов в развитии рака шейки матки, карциномы простаты. Указывается возможность влияния ВПГ на развитие язвенной болезни двенадцатиперстной кишки, острого илеоколита, а также внезапной глухоты и вестибулярных расстройств. Продолжает обсуждаться вопрос об отягощающем влиянии ГВИ на течение психических заболеваний (сенильной деменции, ядерной шизофрении), а также гломерулонефрита и нефротического синдрома у детей. Вирусемия во время беременности может стать причиной гибели плода, мертворождения. Герпесвирусы вызывают до 30% спонтанных абортов на ранних сроках беременности и более 50% поздних выкидышей, занимая второе место после вируса краснухи по степени тератогенности [7-9].
Классические проявления ГВИ наблюдаются у 20-40% больных. После инкубационного периода (2-14 дней) появляются высыпания в виде сгруппированных пузырьков полусферической формы, расположенных на гиперемированных отечных участках кожи и слизистых. За 1-2 сут до появления сыпи пациенты ощущают жжение, покалывание, зуд в местах будущей сыпи. Указанные субъективные ощущения в дальнейшем могут сопровождаться высыпаниями, а иногда сохраняться даже после их разрешения. Содержимое пузырьков изначально прозрачное, затем мутнеет. За счет тесного расположения пузырьки могут сливаться в многокамерный сплошной пузырь. После их вскрытия образуются эрозии и корочки. Кожные проявления разрешаются в течение 10-14 дней, а в случае присоединения вторичной инфекции длительность рецидива увеличивается до 3-4 нед. Среди редко встречающихся атипичных проявлений поражения кожи при ВПГ следует выделить зостериформную, абортивную, отечную, элефантиазоподобную, язвенную, мигрирующую, геморрагическую, геморрагически-некротическую и диссеминированную формы, которые часто являются причиной диагностических врачебных ошибок, влияющих на качество лечебных и эпидемиологических мероприятий [2, 3, 5].
Целью нашего исследования являлось определение адекватных методов диагностики и комплексного этиопатогенетически обоснованного эффективного лечения больных с различными проявлениями ГВИ.
Материалы и методы исследования
Под наблюдением находились 76 больных (24 женщины и 52 мужчины) с наличием ГВИ в возрасте от 18 до 57 лет. У 46 (60,5%) пациентов выявлен ВПГ-1, у 30 (39,5%) – ВПГ-2. Диагностика инфицированных ГВИ основывалась на их жалобах, анамнезе болезни, клинических и лабораторных данных. Комплексное обследование включало несколько методов, в частности один из наиболее доступных – микроскопическое изучение изменений в клетках, инфицированных ВПГ (мазки, приготовленные из содержимого герпетических пузырьков, и мазки-отпечатки, полученные со дна эрозий, фиксируют в абсолютном спирте, затем окрашивают по Романовскому-Гимзе). Для дифференциальной диагностики ГВИ применяли методы иммунофлюоресценции (прямой и непрямой иммуноферментный анализ) и современные молекулярно-биологические методы исследования. Серологическая диагностика основывалась на выявлении специфических антител с учетом вида иммуноглобулинов и их титра.
Правильное понимание механизмов возникновения и развития ГВИ, сложностей взаимодействия различных звеньев иммунитета и особенностей их реагирования позволяет планировать дифференцированный подход к комплексной терапии заболевания. С позиций фундаментальной клинической иммунологии любое из существующих направлений терапии должно иметь четко очерченные и обозначенные патогенетические критерии.
Используемый нами метод выбора оптимальной комплексной терапии имеет математическое выражение и построен на определении клинического индекса терапевтической тактики (КИТТ) и клинико-иммунологического индекса этиопатогенетической терапии (КИИЭПТ) ВПГ, предложенного М.А. Смагиным и А.А. Халдиным (2002). Теоретически он базируется на выявлении иммунологических особенностей при различном течении заболевания. В основе подхода к планированию и назначению лечения лежит оценка неоднородности количественной и качественной иммунной недостаточности, ведущей к обострению вирусной инфекции [7].
Определение КИТТ позволяет оценить клиническое течение заболевания и выбрать подход к ведению больного ВПГ. При этом возможны два варианта лечения ВПГ: первый – купирование каждого конкретного рецидива заболевания; второй – системная терапия с целью профилактики последующих обострений.
Расчет КИТТ основан на введении в формулу числовых значений показателей, характеризующих клинические особенности течения ВПГ:
КИТТ ВПГ = (a-1)(3a+2d+e+2b-9,14)/3,66а-3,62, где а – частота рецидивов; b – склонность к нарастанию частоты рецидивов; d – длительность течения рецидивов; е – продолжительность заболевания.
Показатели оценивали в баллах по следующим параметрам:
- частота рецидивов 1-2 раза в год – 2 балла, 3-4 раза – 3, более 6 раз – 4 балла;
- наличие склонности к увеличению количества рецидивов – 2, а ее отсутствие – 1 балл;
- длительность заболевания до 5 лет – 1, более 5 лет – 2 балла;
- продолжительность рецидива ВПГ до 14 дней – 1, более 14 дней – 2 балла.
При значении КИТТ ВПГ 0,5-1,5 выполняли только купирование каждого конкретного рецидива; 1,6-1,9 – проводили дополнительную оценку иммунного статуса и определяли КИИЭПТ; от 2 и более – лечение назначали в зависимости от значения КИИЭПТ (пролонгированная этиотропная или системная иммунотерапия).
Оцениваемые клинические показатели напрямую связаны с полноценностью функционирования иммунной системы. Так, если КИТТ ВПГ указывает на транзиторный характер нарушений (значения 0,5-1,3), любое вторжение в иммунную систему противопоказано, т.к. может привести к непрогнозируемым результатам, которые будут проявляться различной дискоординацией иммунной системы.
КИИЭПТ ВПГ учитывает основные количественные и качественные нарушения противовирусной защиты и позволяет определить направления этиопатогенетической терапии. Он рассчитывается по следующей формуле:
КИИЭПТ ВПГ = [(КИТТ ВПГ+√2с+2d)(1-k)+1]:2, где с – значение интерлейкина (ИЛ)-4; d – значение ИЛ-6; k – значение соотношения функциональной активности CD-4+/CD-8+ лимфоцитов.
Иммунологические показатели соответственно оценивали в баллах.
Шкала значений ИЛ-6, ИЛ-4, индекса соотношения функциональной активности CD-4/CD-8 приведена в таблице.
При значениях КИИЭПТ ВПГ 1-2 назначали иммуномодулирующую терапию (индукторы интерферона [ИФН]); 4,4 – иммуностимулирующую (герпетическую вакцину); 5,1-7,8 – длительное этиотропное лечение; 8,9 – иммунозаместительную терапию ИФН-содержащими препаратами.
После анализа КИТТ и КИИЭПТ ВПГ пациенты были разделены на три группы. Первая группа включала 30 больных, которым назначали только этиотропное лечение для купирования конкретного рецидива заболевания. Вторую группу составили 28 пациентов, которым в качестве патогенетического лечения был назначен индуктор эндогенного ИФН – Кагоцел. Третью группу составили 18 больных, лечение которых заключалось в назначении длительной этиотропной терапии. В качестве этиотропного препарата был назначен валацикловир.
Механизм этиотропного действия валацикловира базируется на следующих моментах. Валацикловир, как и другие ациклические нуклеозиды, обладает высокой комплементарностью исключительно к ферментам герпесвирусов, что обусловливает его высокую избирательность по отношению к ВПГ и отсутствие влияния на незараженные вирусом клетки макроорганизма. Тимидинкиназа (гуанилаткиназа) герпесвирусов с валацикловиром связывается в тысячу раз быстрее, чем клеточная тимидинкиназа. Это обеспечивает накопление действующего вещества исключительно в инфицированных клетках и объясняет отсутствие мутагенных, тератогенных или цитотоксических свойств даже при длительном приеме ациклических нуклеозидов. Нарушение репликации вирусов обусловлено тем, что ДНК-полимераза герпесвирусов ошибочно включает фосфорилированные ациклические нуклеозиды в концевые участки синтезируемых новых вирусных ДНК вместо стандартного клеточного дезоксигуанозинтрифосфата. Высокая биодоступность действующего начала валацикловира, в свою очередь, позволяет снизить кратность приема препаратов до 2 раз в сутки в связи с увеличением периода их полувыведения, что обеспечивает очень удобный режим применения.
В ходе исследования валацикловир назначали больным с показаниями для проведения длительной этиотропной терапии по 500 мг/сут однократно в течение 6 мес. Пациентам с первым манифестом ВПГ валацикловир назначали по 2000 мг 2 раза в сутки однократно, а при последующих рецидивах – по 500 мг 2 раза в сутки в течение 5-7 дней.
Накопленный опыт применения индукторов эндогенного ИФН позволяет рассматривать их в качестве эффективных противовирусных препаратов. Это связано с тем, что механизм противовирусного действия ИФН более универсален и не конкурирует с таковым других известных противовирусных препаратов, специфически ингибирующих вирусные ферменты. Индукторы ИФН оказывают целый ряд неспецифических и специфических эффектов, связанных с дифференциацией клеток иммунной системы, синтезом мембранных рецепторов, а также с действием на различные звенья иммунитета в комплексе с другими цитокинами.
Кагоцел – гетероцепный полимер, получаемый путем химического синтеза из растительного сырья – водорастворимой карбоксиметилцеллюлозы и полифенола семян хлопчатника. Он обладает свойствами индуктора эндогенного ИФН, а также иммуностимулятора, что клинически может проявляться в виде противовирусного, противомикробного, противоопухолевого и радиопротекторного действия. Кагоцел как индуктор ИФН способен к формированию стойкой резистентности организма к вирусам в течение длительного времени после его применения. Препарат вызывает продукцию так называемых «поздних» ИФН (смесь α-, β- и γ-ИФН) практически во всех популяциях клеток, которые принимают участие в иммунном ответе организма на внутриклеточные агенты: Т- и В-лимфоцитах, макрофагах, гранулоцитах, фибробластах, эндотелиальных клетках. Кроме ИФН-индуцирующей активности, препарат стимулирует выработку разными клетками других цитокинов – ИЛ-1, ИЛ-2 и ИЛ-6.
В нашем исследовании Кагоцел назначали по 2 таблетки 3 раза в сутки в течение 10 сут.
Следует отметить, что в стадии ремиссии заболевания проводят отдельный этап лечения больных ВПГ, включающий общеукрепляющую терапию, санацию очагов хронической инфекции, лечение хронических соматических и других заболеваний. Назначают также адекватное симптоматическое и физиотерапевтическое лечение.
Результаты исследования и их обсуждение
Анализ наблюдений за больными с ВПГ в процессе проводимого комплексного лечения позволил констатировать хорошую переносимость применяемых препаратов, отсутствие токсико-аллергических реакций и других побочных эффектов, отсутствие необходимости в коррекции схемы лечения или в отмене применяемых препаратов, связанной с их побочным действием или непереносимостью.
Основными клиническими критериями оценки эффективности терапии являлись время достижения полного разрешения клинических проявлений заболевания, длительность и тяжесть течения рецидива, частота возникновения рецидивов после проведенного лечения в сравнении с предыдущим периодом.
Так, у 8 пациентов первой группы, которым этиотропное лечение было назначено в продромальный период, купирования рецидива заболевания удалось достичь в эритематозной стадии, без появления везикул и других клинических проявлений ВПГ. У всех других больных первой группы период разрешения клинических проявлений сокращался в два раза.
У пациентов второй группы, получавших Кагоцел в качестве монотерапии, длительность течения рецидивов сократилась в среднем с 5,3 до 3 дней, у 21 (75%) – отмечалось снижение тяжести течения и частоты рецидивов. Шестимесячное наблюдение за больными ВПГ после лечения позволило констатировать уменьшение рецидивов почти в 2 раза по сравнению с предыдущими периодами.
Среди пациентов третьей группы, получавших длительное этиотропное лечение, отмечено значительное снижение частоты рецидивов, выраженности клинических проявлений заболевания, уменьшение площади пораженного участка. У 4 (22,2%) больных данной группы рецидив заболевания проявлялся в абортивной (легкой) форме.
Показатели общего анализа крови и мочи в динамике наблюдения за больными до и после лечения свидетельствовали о том, что назначаемые препараты не оказывали отрицательного влияния на органы кроветворения и функцию почек. В ходе исследования также не выявлено негативного влияния проводимого лечения на гепатобилиарную систему, что подтверждалось результатами биохимического анализа крови, которые находились в пределах параметрических показателей физиологически здоровых лиц.
Выводы
Таким образом, анализ проведенного нами наблюдения позволяет рекомендовать врачам дифференцированно подходить к планированию комплексной терапии больных ВПГ на основании правильного понимания всех механизмов возникновения и развития заболевания, сложных звеньев иммунитета, а также вариантов особенностей их взаимодействия между собой. Оценку неоднородности количественной и качественной иммунной недостаточности и назначение комплексного лечения проводят на основании расчета КИТТ и КИИЭПТ ВПГ.
Клиническое наблюдение за эффективностью этиологического и патогенетического лечения больных ВПГ с применением валацикловира и Кагоцела позволяет сделать следующие заключения:
- Валацикловир – новый этиотропный препарат, характеризующийся мощным противовирусным действием, высокой биодоступностью (в 3-5 раз выше, чем у ацикловира), быстрым достижением клинического эффекта, хорошим профилем безопасности и удобством применения (1-2 раза в сутки).
- Кагоцел – новый индуктор эндогенных ИФН, высокоэффективный и безопасный препарат для лечения больных с ГВИ.
- Кагоцел может быть рекомендован для широкого применения в лечении больных и в профилактике рецидивов ВПГ 1- и 2-го типов.
- Валацикловир может быть рекомендован для лечения ВПГ 1- и 2-го типов как для купирования каждого конкретного рецидива заболевания, так и для длительной этиотропной терапии.
Литература
- Masucci M.G., Ernberg I. Epstein-Barr virus: adaptation to a life within the immune system. Trends Microbiol 1994; 2 (4): 125-30.
- Хахалин Л.Н. Вирусы простого герпеса у человека. Consilium medicum 1999; 1 (1): 5-17.
- Львов Н.Д., Андронова В.Л., Леонтьева Н.А., Галегов Г.А. // Вопросы вирусологии. – 1999. – Т. 44. – С. 247-249.
- Сухих Г.Т., Ванько Л.В., Кулаков В.И. Иммунитет и генитальный герпес. Нижний Новгород. – М., 1997.
- Reyburn H.T., Mandelboim O. et al. Nature 1997; 386 (3, Apr.): 514-7.
- Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. – М., 1995. – 314 c.
- Ершов Ф.И. Антивирусные препараты. – М.: Медицина, 1998.
- Самгин М.А., Халдин А.А. Простой герпес. – М., 2002. – С. 122-127.
- Rosen F.S., Geha R.S. Case Studies in immunology: a clinical companion. CB/GP. 1998; 1-134.
- Scott L.L. Prevention of perinatal herpes: prophylactic antiviral therapy? Clin Obstet Gynecol 1999; 42 (1): 134-48.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

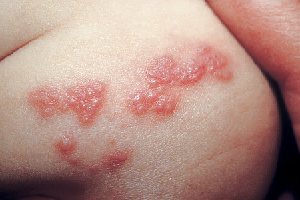 Новый препарат для лечения герпетических кератитов
Новый препарат для лечения герпетических кератитов
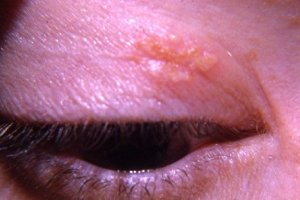 Комплексная терапия больных офтальмогерпесом
Комплексная терапия больных офтальмогерпесом
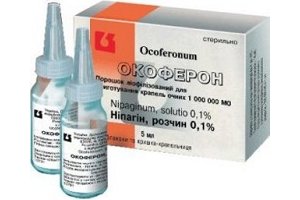 Глазные капли Окоферон в лечении различных форм офтальмогерпеса
Глазные капли Окоферон в лечении различных форм офтальмогерпеса
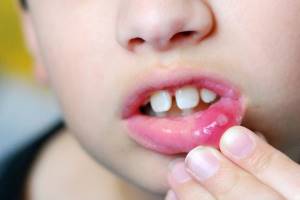 Особенности течения и лечения герпетической инфекции у детей
Особенности течения и лечения герпетической инфекции у детей