- Головна
- /
- Статті
- /
- Пульмонологія, фтизіатрія
- /
- Негоспитальная пневмония у взрослых: этиология, патогенез, классификация, диагностика, анибактериальная терапия (укр)
Негоспитальная пневмония у взрослых: этиология, патогенез, классификация, диагностика, анибактериальная терапия (укр)

Проект нових Рекомендацій з питань діагностики та лікування негоспітальних пневмоній у дорослих Пневмонія і в XXI столітті залишається важливою медико-соціальною проблемою. Це зумовлено, насамперед, її значною поширеністю, досить високими
Проект нових Рекомендацій з питань діагностики та лікування негоспітальних пневмоній у дорослих
Пневмонія і в XXI столітті залишається важливою медико-соціальною проблемою. Це зумовлено, насамперед, її значною поширеністю, досить високими показниками інвалідизації та смертності, а також суттєвими економічними втратами внаслідок цього захворювання.
В Україні в 1998-2001 pp. захворюваність на пневмонію серед дорослих становила 4,3-4,7 на 1 тис. населення, а смертність — 10-13,3 на 100 тис. населення, тобто померли 2-3% захворілих на пневмонію. За даними офіційної статистики в 1999 p. у Росії серед осіб віком 18 років та старших було зареєстровано 440 049 випадків пневмонії (3,9 на 1 тис.). Однак ці величини показників не відображають справжньої захворюваності. Так, за даними зарубіжних епідеміологічних досліджень захворюваність негоспітальною пневмонією (НП) у дорослих (18 років та старші) коливається в широкому діапазоні від 1-11,6 випадків на 1 тис. осіб молодого та середнього віку до 25-44 на 1 тис. осіб старших вікових груп (65 років та старші). У США щорічно виявляють 3-4 млн. випадків НП, із яких більше ніж 900 тис. госпіталізують. Із числа останніх безпосередньо від НП щорічно помирають більше ніж 60 тис. осіб. Протягом року кількість дорослих хворих (18 років та більше) на НП у 5 країнах Європи (Великобританія, Франція, Італія, Німеччина, Іспанія) перевищує 3 млн. осіб. При НП найменша летальність (1-3%) в осіб молодого та середнього віку без супутніх захворювань. Навпаки, в осіб старших вікових груп, за наявності супутніх захворювань (хронічні обструктивні захворювання легень, злоякісні новоутворення, алкоголізм, цукровий діабет, захворювання нирок та печінки, серцево-судинні захворювання та ін.), а також у випадку тяжкого перебігу НП (мультичасткова інфільтрація, вторинна бактеріємія, тахіпное 30/хв та більше, артеріальна гіпотензія, гостра ниркова недостатність) цей показник сягає 15-30 випадків на 1 тис. осіб. В Україні термін непрацездатності, зумовлений пневмонією, становив у 2000 p. 13,1 дня на 100 працюючих, у середньому на 1 працюючого — 19,5 дня. У США пневмонія призводить до щорічної втрати більше ніж 150 млн. робочих днів, а загальні витрати на лікування хворих — понад 10 млрд. доларів.
Одними із основних та найбільш авторитетних джерел інформації для лікарів з питань діагностики та лікування хворих на НП є клінічні рекомендації (консенсуси), підготовлені провідними спеціалістами за результатами проспективних рандомізованих порівняльних контрольованих досліджень з урахуванням позицій доказової медицини. На жаль, проведення досліджень такого рівня в Україні поки що утруднене через наявну економічну ситуацію. Тому доводиться орієнтуватися, у першу чергу, на дані, отримані в сусідніх країнах з близькою до нашої системою охорони здоров’я.
Розроблені клінічні рекомендації підлягають уточненню кожні 3-5 років. Це повною мірою стосується і рекомендацій з діагностики та лікування НП, прийнятих в Україні в 1998 p. (наказ МОЗ України № 311 від 30.12.1999 p., Інструкція про діагностику, клінічну класифікацію та лікування пневмонії). За минулі 5 років відбулися деякі зміни уявлень про це захворювання та його лікування, а саме:
- поглибилися знання з питань епідеміології респіраторних інфекцій, розроблено нові методи діагностики, переосмислено значення та місце традиційних методів дослідження хворих на НП;
- отримано численні докази зростання резистентності до антибіотиків основних респіраторних патогенів;
- розроблено та широко застосовуються критерії оцінки факторів ризику несприятливого перебігу НП у дорослих;
- стали доступними нові антибіотики, насамперед респіраторні (нові) фторхінолони.
Визначення та класифікація
Пневмонія — гостре інфекційне захворювання, переважно бактеріальної етіології, яке характеризується вогнищевим ураженням респіраторних відділів легень та наявністю внутрішньоальвеолярної ексудації.
Оскільки пневмонія, за визначенням, є гострим інфекційним захворюванням, тому вживання означення «гостра» в діагнозі є зайвим, тим більше що термін «хронічна пневмонія» практично не використовується.
У Міжнародній класифікації хвороб, травм та причин смерті 9-го (1975) та 10-го (1992) переглядів пневмонія чітко відокремлена від інших вогнищевих запальних захворювань легень неінфекційного походження. Так, із рубрики «Пневмонія» вилучені захворювання, зумовлені фізичними (променевий пневмоніт) чи хімічними («бензинова пневмонія») факторами, або мають алергічне (гіперсенситивний пневмоніт, «еозинофільна пневмонія») чи судинне (інфаркт легені внаслідок тромбоемболії гілок легеневої артерії) походження. З цієї рубрики вилучено також запальні процеси в легенях, спричинені облігатними патогенами бактеріальної або вірусної природи — їх розглядають в межах відповідних нозологічних форм (Курикетсіоз, чума, черевний тиф, кір та інші).
Класифікація пневмонії, яка найбільш повно відображає особливості її перебігу та дозволяє обгрунтувати етіотропну терапію, безумовно повинна базуватися на етіологічному принципі. Однак на практиці своєчасна етіологічна діагностика пневмонії ускладнена через недостатню інформативність та значну тривалість традиційних мікробіологічних досліджень. У багатьох країнах світу, у тому числі в Україні, використовують класифікацію, що враховує умови виникнення захворювання, особливості інфікування тканини легень, а також стан імунологічної реактивності організму хворого. Це дозволяє з досить високим ступенем імовірності передбачити можливого збудника захворювання.
За цією класифікацією виділяють такі види пневмонії:
- НП (позалікарняна, поширена, амбулаторна) — пневмонія, що виникла поза лікувальним закладом;
- нозокоміальна (госпітальна) пневмонія — пневмонія, що виникла через 48 годин і пізніше після госпіталізації хворого до стаціонару за відсутності будь-якого інфекційного захворювання в інкубаційному періоді на момент госпіталізації хворого;
- аспіраційна пневмонія;
- пневмонія в осіб з тяжкими дефектами імунітету (природжений імунодефіцит, ВІЛ-інфекція, ятрогенна імуносупресія).
Найбільше практичне значення має поділ пневмонії на негоспітальну (набуту поза лікувальним закладом) та нозокоміальну (набуту в лікувальному закладі). Такий поділ не пов’язаний із тяжкістю перебігу захворювання, а основним та єдиним критерієм розподілу є те оточення, в якому розвинулася пневмонія. Крім того, залежно від тяжкості перебігу, розрізняють пневмонії легкого, середньотяжкого та тяжкого ступенів. Однак досі не розроблено чітких критеріїв розподілу легкого та середньотяжкого перебігу. Оскільки обсяг діагностичних та лікувальних заходів з приводу пневмонії таких ступенів тяжкості майже однаковий, доцільно об’єднати їх в одну групу — пневмонію з нетяжким перебігом. Ознаки тяжкого перебігу НП, які мають вирішальне значення у виборі обсягу діагностичних досліджень і тактики антимікробної терапії, наведено в розділі Лікування.
Патогенез
Антиінфекційний захист нижніх дихальних шляхів здійснюють механічні фактори (аеродинамічна фільтрація, розгалуження бронхів, надгортанник, кашель та чихання, коливальний рух війок миготливого епітелію слизової оболонки бронхів), а також механізми неспецифічного та специфічного клітинного та гуморального імунітету.
Причинами розвитку запальної реакції в респіраторних відділах легень можуть бути як зниження ефективності захисних механізмів макроорганізму, так і масивність дози мікроорганізмів та/або їх підвищена вірулентність.
Виділяють чотири шляхи інфікування, які з різною частотою зумовлюють розвиток пневмонії:
- аспірація вмісту ротоглотки;
- вдихання аерозолю, що містить мікроорганізми;
- гематогенне поширення мікроорганізмів із позалегеневого вогнища інфекції (ендокардит з ураженням трикуспідального клапана, септичний тромбофлебіт вен таза);
- безпосереднє поширення інфекції із сусідніх уражених тканин (наприклад, абсцес печінки) або внаслідок інфікування при проникних пораненнях грудної клітки.
Аспірація вмісту ротоглотки — основний шлях інфікування респіраторних відділів легень при НП. У нормальних умовах ряд мікроорганізмів, наприклад Streptococcus pneumoniae, можуть колонізувати ротоглотку, але нижні дихальні шляхи при цьому залишаються стерильними. Мікроаспірація вмісту ротоглотки — фізіологічний феномен, який відбувається у 40-70% здорових осіб під час сну. Однак кашльовий рефлекс, відрегульований механізм мукоциліарного кліренсу, антибактеріальна активність альвеолярних макрофагів та секреторних імуноглобулінів забезпечують елімінацію інфікованого секрету із нижніх дихальних шляхів та їх стерильність. У разі порушення цих механізмів «самоочищення» трахеобронхіального дерева, наприклад при респіраторній вірусній інфекції, коли порушується функція війок епітелію бронхів та знижується фагоцитарна активність альвеолярних макрофагів, створюються сприятливі умови для розвитку пневмонії. В окремих випадках самостійним патогенетичним фактором можуть бути масивність дози мікроорганізмів або проникнення до респіраторних відділів легень навіть поодиноких високовірулентних мікроорганізмів, стійких до дії захисних механізмів макроорганізму, що також призводить до розвитку пневмонії.
Інгаляція аерозолю, який містить мікроорганізми, — менш поширений механізм розвитку пневмонії. Він має основне значення при інфікуванні облігатними патогенами, наприклад Legionella spp.
Ще менше значення (за частотою виявлення) мають гематогенне (наприклад, Staphylococcus spp.) та безпосереднє поширення збудника із вогнища інфекції.
Етіологія
У сучасних рекомендаціях щодо лікування хворих на НП підкреслюється необхідність встановлення етіологічного діагнозу для обґрунтування етіотропної терапії, що суттєво підвищує вимоги до рівня мікробіологічного дослідження клінічного матеріалу, отриманого від хворих. Однак іноді навіть під час ретельних дослідженнь не вдається встановити етіологію НП у 50% пацієнтів. Це зумовлено як відсутністю доступного тесту, який дозволив би ідентифікувати всі потенційні збудники захворювання, так і наявністю обмежень у кожного із тестів, які використовуються. Наприклад, для виявлення більшості мікроорганізмів використовують методи бактеріоскопії пофарбованого за Грамом мазка мокротиння та посів мокротиння на відповідні живильні середовища. Проте ці тести не придатні для виявлення Mycoplasma pneumoniae, Chlamydophyla (Chlamidya) pneumoniae, Legionella spp. та деяких інших збудників. Крім того, необхідно враховувати ймовірність змішаної інфекції, а саме поєднання типових бактеріальних (наприклад, Streptococcus pneumoniae) та «атипових» збудників (Mycoplasma pneumoniae, Chlamydophyla pneumoniae, Legionella spp.), що спостерігається в 10-40% випадків.
З урахуванням наведених особливостей патогенезу пневмонії очевидно, що її етіологія пов’язана з мікрофлорою верхніх дихальних шляхів. Серед численних видів мікроорганізмів, які колонізують верхні дихальні шляхи, тільки деякі (а саме з підвищеною вірулентністю) здатні в разі проникнення до респіраторних відділів легень спричинювати запальну реакцію навіть при мінімальних порушеннях захисних механізмів.
Залежність видового складу мікрофлори верхніх дихальних шляхів від характеру навколишнього середовища, в якому перебуває індивід, його віку та загального стану здоров’я дає можливість прогнозувати етіологію НП. Склад збудників НП має деякі відмінності в пацієнтів залежно від тяжкості перебігу захворювання та місця проведення лікування — амбулаторне чи в умовах стаціонару (терапевтичне відділення або відділення реанімації та інтенсивної терапії — ВРІТ).
У пацієнтів з НП нетяжкого перебігу, які не потребують госпіталізації, етіологія захворювання вивчена недостатньо через незначну кількість відповідних досліджень. У цієї категорії хворих частота етіологічно неверифікованої пневмонії становить 40-50%. Під час бактеріологічного дослідження мокротиння найчастіше (у 9-36% випадків) виявляють Streptococcus pneumoniae. Однак результати серологічних досліджень свідчать про домінуюче значення Mycoplasma pneumoniae (у 13-37% випадків) та Chlamydophyla pneumoniae (до 17%). У 5-10% випадків збудником НП є Haemophilus influenzae, у 0,4-2,8% — Legionella spp., у 0,2-1,3% — грамнегативні ентеробактерії, у 10-13% — віруси.
У хворих на НП, які потребують госпіталізації до відділення терапевтичного профілю, збудників захворювання не вдається встановити в 20-70% випадків. За даними позитивних результатів мікробіологічного дослідження, домінуючим патогеном є Streptococcus pneumoniae (у 11-39% випадків). Не часто визначають Haemophilus influenzae (у 4-9,5%), Legionella spp. (у 3,6-7,5%), Moraxella (Branhamella) catarrhalis (y 1,2-3,1%), Staphylococcus aureus (y 0,8-3,8%), грамнегативні ентеробактерії (у 1-5,3%), Mycoplasma pneumoniae (у 4,1-14,6%), Chlamydophyla pneumoniae (у 3,1-13,1% та віруси у 8,9-12,8%).
Основними збудниками НП тяжкого перебігу, яка загрожує життю пацієнта та є показанням для госпіталізації до ВРІТ, є Streptococcus pneumoniae (у 21-22% випадків), Legionella spp. (у 5,5-17,8%), Haemophilus influenzae (у 3,8-5,3%), Staphylococcus aureus (у 7-8,7%), грамнегативні ентеробактерії (у 1,6-8,6%), Mycoplasma pneumoniae (у 2-2,7%) та віруси (у 4-9,7%). За наявності в пацієнтів з НП з тяжким перебігом специфічних факторів ризику, наприклад бронхоектазів, до складу потенційних збудників може входити Pseudomonas aeruginosa. Однак у 50-60% випадків НП з тяжким перебігом захворювання етіологія залишається невстановленою.
Антибіотикорезистентність основних збудників НП
В останні роки в усіх країнах світу відмічають зростання резистентності Streptococcus pneumoniae, Haemophilus influenzae та Moraxella catarrhalis до антибактеріальних препаратів, причому досить часто вони є мультирезистентними, тобто стійкими до антибіотиків трьох класів і більше. Встановлено як загальні, так і регіональні тенденції розвитку антибіотикорезистентності, які слід враховувати при розробленні стратегії і тактики лікування хворих на НП. На жаль, в Україні сьогодні відсутні достовірні дані щодо антибактеріальної стійкості цих патогенів, тому доцільно враховувати результати досліджень, проведених в інших країнах, насамперед у Росії, Чехії, Словаччині та Польщі.
Особливе занепокоєння спеціалістів викликає підвищення резистентності Streptococcus pneumoniae до пеніциліну, оскільки такі штами досить часто можуть бути стійкими і до багатьох інших антибактеріальних препаратів, у тому числі і до макролідів. Поширеність резистентних до антибактеріальних препаратів пневмококів суттєво відрізняється в різних країнах і навіть у межах однієї країни. За сукупними даними, які отримані в Alexander Project у 1999 p., найбільш високі показники стійкості Streptococcus pneumoniae до пеніциліну отримано в Гонконгу. При цьому 6% штамів мали проміжний (МПК від 0,1 до 1 мг/л) та 73,8% — високий рівень резистентності (МПКі 2 мг/л). В інших регіонах Азії також визначено досить високі показники стійкості пневмокока до пеніциліну: в Японії 23,6% та 39,9% штамів були відповідно помірно резистентними та резистентними, у Сінгапурі — відповідно 6,5% та 36,1%, у Саудівській Аравії — 44% та 17,9% штамів. У Таїланді протягом 1999-2000 pp. помірно стійкими та стійкими до пеніциліну були відповідно 27,2% та 39,3% штамів Streptococcus pneumoniae.
У Канаді при дослідженні 374 ізолятів Streptococcus pneumoniae за допомогою Е-тесту було встановлено, що 20,1% із них були помірно стійкими та 22,2% — резистентними до пеніциліну.
У 1999-2000 pp. у 33 медичних центрах США виділили 1531 клінічних ізолятів Streptococcus pneumoniae, з яких 34,2% були нечутливими до пеніциліну.
В Європі найбільш високі рівні резистентності пневмокока до пеніциліну були зареєстровані у Франції (17,2% помірно стійких та 45,3% резистентних штамів), Іспанії (9,9% та 37,4% відповідно), Словаччині (15,5% та 15,5% відповідно) та Польщі (5% та 17,2% відповідно). Однак у Чехії стійкість пневмокока до пеніциліну була невисокою (відповідно 1% та 2%). У Росії резистентність Streptococcus pneumoniae до b-лактамних антибіотиків також не є значною проблемою. Лише 7,5% штамів збудника, які виділено із носоглотки здорових дітей дошкільного віку, що перебували в організованих колективах (Москва, Смоленськ, Ярцево), були помірно стійкими до пеніциліну. Резистентність Streptococcus pneumoniae до макролідів, за даними Alexander Project (1999), коливалася від 0,5% у Кенії до 82,2% у Гонконгу. В Європі такі штами виявлено в Чехії в 2%, у Польщі — в 6,7%, у Словаччині — в 11,3%, в Іспанії — в 57,1% і у Франції — в 58,1% випадків. За даними дослідження ПеГАС-І (2000), у Росії резистентність цього збудника до макролідних антибіотиків становила 4,4-4,6%, при цьому від 39,1 до 43,5% штамів пневмокока з проміжним рівнем стійкості до пеніциліну були резистентними до макролідів. У Канаді серед штамів Streptococcus pneumoniae, чутливих до пеніциліну, резистентність до макролідів становила 4,7%, а серед стійких до пеніциліну — 14,7%, у США — 6,1% та 78,1% відповідно.
У 1999-2000 pp. у США в 22,4% випадків визначали мультирезистентні штами Streptococcus pneumoniae, при цьому частіше — до пеніциліну, еритроміцину і котримоксазолу. У Таїланді мультирезистентні штами пневмокока виявлено в 25,2% випадків. Серед них стійкими до азитроміцину, пеніциліну і ко-тримоксазолу були 77% ізолятів, до азитроміцину, цефтриаксону, пеніциліну і ко-тримоксазолу — 19,2% і до цефтриаксону, пеніциліну і ко-тримоксазолу — 3,8% ізолятів.
Основний механізм резистентності Haemophilus influenzae до b-лактамних антибіотиків полягає в продукуванні b-лактамаз, які гідролізують амінопеніциліни та цефалоспорини І покоління. Решта b-лактамних антибіотиків, як правило, зберігають високу активність щодо цього збудника. За даними дослідження PROTEKT, проведеного в 20 країнах світу в 1999-2000 pp., у середньому 10-15% штамів Haemophilus influenzae продукують b-лактамази. Найбільш високі рівні b-лактамазопозитивних штамів цього збудника були виявлені в Північній Америці (28,7%), Мексиці (23,7%), Саудівській Аравії (24,7%), Сінгапурі (24%), Гонконгу (20%). У той самий час у Бразилії висівали 18,6% b-лактамазопозитивних штамів Н. influenzae, у Кенії — 13,5%, у Південній Африці — 7%, в Японії — 8%, а в Європі — 12,3%. На європейському континенті поширеність b-лактамазопродукуючих штамів Haemophilus influenzae коливається в широких межах: від 41,6% у Франції до 0,3% в Росії.
У Таїланді в 1999-2000 pp. було протестовано 305 клінічних ізолятів Haemophilus influenzae і всі вони виявилися чутливими до макролідів. У Канаді серед b-лактамазопозитивних штамів Haemophilus influenzae виявлено 4,8% ізолятів, стійких до макролідів, за допомогою Е-тесту і всього 0,8% ізолятів — за даними тесту Kirby-Bauer. Серед b-лактамазонегативних штамів Haemophilus influenzae резистентними до цього антибіотика відповідно були 15,8% і 0,2% ізолятів. У Росії в 44% здорових дітей, які відвідували організовані колективи, виділили Haemophilus influenzae. При цьому резистентність даного збудника до ампіциліну становила 0,9%, до амоксицилін/клавуланату — 0,6%, до цефаклору — 0,6%. Резистентних до кларитроміцину штамів не виявлено.
На сьогодні встановлено, що 90-100% штамів Moraxella catarrhalis продукують b-лактамази, що зумовлюють гідроліз природних і незахищених напівсинтетичних пеніцилінів, а також цефалоспоринів І покоління. Резистентність до макролідів зустрічається вкрай рідко.
Чутливість до антибактеріальних препаратів найбільш значущих збудників НП наведено в таблиці 1.
Діагностика
У загальному вигляді найбільш вагомі клінічні та рентгенологічні ознаки НП можуть бути сформульовані таким чином.
- У незначної частини хворих клінічний перебіг НП може залежати від її етіології. Так, для пневмококової пневмонії характерні гострий початок, висока лихоманка, біль у грудній клітці; для легіонельозної — діарея, неврологічна симптоматика, нерідко тяжкий перебіг захворювання, порушення функції печінки; для мікоплазмової — м’язовий та головний біль, симптоми інфекції верхніх дихальних шляхів. Однак здебільшого за даними аналізу клініко-рентгенологічної картини захворювання не можливо передбачити ймовірну етіологію НП. При цьому конкретні клінічні прояви захворювання часто пов’язані не з властивостями збудника, а з такими факторами макроорганізму, як вік, наявність або відсутність супутніх захворювань. Зокрема, поділ НП на «типову» (зумовлену Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, грамнегативними ентеробактеріями) та «атипову» (зумовлену Mycoplasma pneumoniae, Chlamydophyla pneumoniae, Legionella spp.) не має особливого клінічного значення.
- Такі ознаки пневмонії, як гострий початок, лихоманка, біль у грудній клітці тощо можуть бути відсутніми — особливо в ослаблених хворих та в осіб похилого віку.
- Приблизно в 25% хворих на НП у віці понад 65 років відсутня лихоманка, а лейкоцитоз відмічають лише в 50-70% хворих. При цьому клінічна симптоматика нерідко може бути представлена втомлюваністю, слабкістю, нудотою, анорексією, болем у животі, порушенням свідомості.
- Пізня діагностика та затримка із початком проведення антибактеріальної терапії (більше ніж 8 год) зумовлюють погіршення прогнозу захворювання.
- Плевральний випіт, як правило, обмежений, ускладнює перебіг НП у 10-25% випадків та не має особливого значення в передбаченні етіології захворювання.
- Утворення порожнин розпаду в легенях не є характерним для пневмококової, мікоплазмової та хламідійної пневмонії, а здебільшого свідчить на користь стафілококової інфекції, аеробних грамнегативних збудників кишкової групи та анаеробів.
- Ретикулонодулярна інфільтрація в базальних відділах легень характерна для мікоплазмової пневмонії (однак у 20% випадків мікоплазмова пневмонія може супроводжуватися вогнищево-зливною інфільтрацією в проекції декількох сегментів або навіть частки легені).
Діагностика НП базується на виявленні загальних (слабкість, адинамія, зниження апетиту, лихоманка) та локальних (кашель, виділення мокротиння, задишка, біль у грудях) симптомів, а також фізикальних даних (фокус гучних дрібнопухирцевих хрипів або інспіраторної крепітації, посилення бронхофонії та голосового дрижання, укорочення (тупість) перкуторного звуку). Вираженість цих ознак залежить від стану пацієнта на початку захворювання, тяжкості перебігу захворювання, об’єму та локалізації ураження легеневої паренхіми, віку, наявності супутніх захворювань. Увесь цей симптомокомплекс неспецифічний для пневмонії, але достатній для встановлення попереднього клінічного діагнозу. Проте у частини хворих об’єктивні ознаки НП можуть відрізнятися від типових або ж бути відсутніми (приблизно у 20% хворих). В осіб старших вікових груп та/або при неадекватній «імунній» відповіді в картині захворювання на передній план можуть вийти сплутаність свідомості, загострення/декомпенсація супутніх захворювань, відсутність лихоманки.
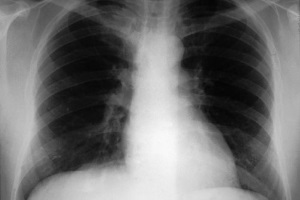
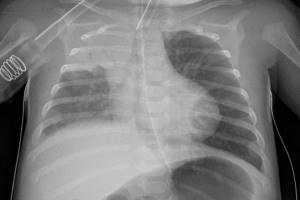
Найбільш важливим діагностичним дослідженням хворих на НП є рентгенографія органів грудної порожнини, яку необхідно виконувати в двох проекціях (задньопередня та бічна) з метою підвищення інформативності цього методу обстеження. Діагностика пневмонії практично завжди передбачає виявлення вогнищево-інфільтративних змін у легенях у поєднанні з відповідною клінікою інфекцій нижніх дихальних шляхів. Цінність цього дослідження полягає не тільки в самому факті візуалізації пневмонічної інфільтрації, тобто у верифікації діагнозу пневмонії (як правило, за наявності відповідних клінічних ознак), оцінці динаміки патологічного процесу та повноти одужання. Ступінь вираженості рентгенологічних змін (поширеність інфільтрації, наявність або ж відсутність плеврального випоту, порожнини розпаду) відповідає ступеню тяжкості перебігу захворювання і може бути критерієм при виборі антибактеріальної терапії. Проведення додаткових рентгенологічних досліджень (рентгенотомографії, комп’ютерної томографії) доцільне для диференціальної діагностики ураження верхніх часток легень, лімфатичних вузлів, середостіння, при зменшенні об’єму частки легені, у разі припущення абсцедування, а також за неефективності попередньої антибактеріальної терапії.
Мікробіологічне дослідження при пневмонії спрямоване на виявлення збудника захворювання в матеріалі, отриманому із вогнища інфекції. Матеріал для дослідження необхідно забирати до початку антибактеріальної терапії. Однак труднощі проведення повноцінного мікробіологічного дослідження не повинні затримувати призначення антибіотика.
Стандартними методами дослідження є бактеріоскопія пофарбованих за Грамом мазків мокротиння та засів мокротиння, отриманого при глибокому відкашлюванні. Проведення цих досліджень є обов’язковим при лікуванні хворого в стаціонарі і необов’язковим при амбулаторному лікуванні.
Високу діагностичну цінність має також матеріал, отриманий під час проведення бронхоальвеолярного лаважу (БАЛ) та бронхоскопії з використанням «захищених» щіток.
Матеріал транстрахеального аспірату, мазки з інтубаційних трубок, зіва і трахеостоми мають низьку діагностичну цінність.
Під час збору та дослідження мокротиння слід дотримуватися таких правил:
- мокротиння необхідно збирати до початку антибактеріальної терапії, краще вранці натще, після ретельного полоскання порожнини рота кип’яченою водою;
- пацієнт повинен бути проінструктований щодо необхідності отримання для дослідження вмісту нижніх дихальних шляхів, а не рото- або носоглотки;
- збір мокротиння необхідно проводити в стерильні контейнери, термін зберігання яких не повинен перевищувати 1-2 годин при кімнатній температурі.
Виявлення в мазках значної кількості грамнегативних або грампозитивних мікроорганізмів з типовою морфологією (грампозитивні ланцетоподібні диплококи — Streptococcus pneumoniae; скупчення грампозитивних коків у вигляді грон — Staphylococcus aureus, грамнегативні кокобацили — Haemophilus influenzae) може бути орієнтиром у виборі антибіотика(ів) для призначення емпіричної терапії.
Діагностичну цінність результатів мікробіологічного дослідження мокротиння оцінюють як високу, якщо кількість виявленого в ньому потенційного збудника захворювання становить 106 колонієутворювальних одиниць (КУО)/мл або більше. Інтерпретацію результатів бактеріоскопії та засіву мокроти слід проводити з урахуванням клінічних даних.
У пацієнтів з тяжким перебігом НП обов’язковим є проведення також мікробіологічного дослідження крові (необхідно взяти 2 зразки венозної крові з різних вен з інтервалом 10 хв та більше).
У разі тяжкого перебігу захворювання у пацієнта та неможливості отримати придатні для дослідження зразки мокротиння, за підозри на туберкульоз легень при відсутності продуктивного кашлю, за наявності «обструктивної пневмонії» на тлі бронхогенної карциноми, при аспірації чужорідного тіла в бронхи тощо слід застосувати інвазивні методи діагностики: фібробронхоскопію з МІНІ-БАЛ або «захищену» браш-біопсію слизової оболонки бронха, транстрахеальну аспірацію, трансторакальну біопсію та ін. Застосування інвазивних методів дослідження є доцільним у хворих, що знаходяться на штучній вентиляції легень.
Вимоги до транспортування та зберігання матеріалу, отриманого інвазивними методами, такі самі, як і для мокротиння. Первинна оцінка матеріалу проводиться за даними аналізу мазка, пофарбованого за Грамом, однак мікробіологічне дослідження отриманого інвазивними методами матеріалу слід проводити незалежно від його клітинного складу.
Результати дослідження визнають діагностично значущими, якщо в матеріалі, який отриманий під час БАЛ, концентрація потенційного збудника захворювання становить 104 КУО/мл і вище, а отриманого за допомогою «захищених» щіток — 103 КУО/мл і вище.
Слід відмітити, що, на думку більшості експертів, фібробронхоскопія не є рутинним діагностичним дослідженням у хворих на НП і необхідність її проведення зумовлюється клінічною доцільністю — для виключення локальної бронхіальної обструкції, для отримання матеріалу із нижніх дихальних шляхів.
Дані клінічного аналізу крові не дозволяють визначити потенційного збудника пневмонії. Однак лейкоцитоз більше ніж 10-12x109/л вказує на високу ймовірність бактеріальної інфекції, а лейкопенія нижче ніж 3x109/л або лейкоцитоз вище ніж 25x109/л є несприятливими прогностичними ознаками.
Біохімічні аналізи крові (функціональні печінкові і ниркові тести, рівень глікемії та ін.) не надають якої-небудь специфічної інформації, однак за наявності відхилень від нормальних значень вказують на ураження деяких органів/систем, що має певне клінічне та прогностичне значення. У хворих з ознаками дихальної недостатності, що зумовлена поширеною пневмонічною інфільтрацією, масивним плевральним випотом, розвитком пневмонії на фоні хронічних обструктивних захворювань легень необхідно визначати гази артеріальної крові. При цьому гіпоксемія із зниженням рівня PaО2 нижче ніж 60 мм рт. ст. (при диханні кімнатним повітрям) є прогностично несприятливою ознакою та вказує на необхідність госпіталізації хворого у відділення інтенсивної терапії. Поширена в нашій країні практика дослідження газів у капілярній крові має відносну діагностичну цінність, незадовільну відтворюваність і часто не відповідає змінам газів артеріальної крові.
Серологічна діагностика НП, спричиненої Mycoplasma pneumoniae, Chlamydophila pneumoniae і бактеріями роду Legionella, не розглядається як обов’язковий основний метод дослідження, оскільки з урахуванням повторного взяття сироватки крові в гострий період захворювання та в період реконвалесценції (через декілька тижнів від початку захворювання), це переважно епідеміологічний, а не клінічний рівень діагностики.
Пропонують використовувати імуноферментний тест з визначенням у сечі специфічного розчинного антигену Legionella pneumophila (1-й серотип) при тяжкому перебігу НП. Як перспективний додатковий метод розглядають також імунохроматографічний тест для визначення в сечі хворого антигену Streptococcus pneumoniae. Однак наявних даних недостатньо, щоб дати однозначні рекомендації щодо їх застосування. В останні роки швидко розвивається новий метод діагностики інфекційних захворювань — полімеразна ланцюгова реакція (ПЛР). Цей метод може бути перспективним для виявлення таких збудників, як Mycoplasma pneumoniae і Chlamydophila pneumoniae. Однак остаточне місце ПЛР у діагностиці НП ще не визначено, тому вона не може бути рекомендована для впровадження в широку клінічну практику.
За наявності у хворого плеврального випоту та умов для безпечного проведення плевральної пункції (візуалізація на латерограмі рідини, яка вільно переміщується, із товщиною шару більше ніж 1 см) слід проводити дослідження плеврального випоту із визначенням кількості лейкоцитів та лейкоцитарної формули, рН активності лактатдегідрогенази, кількості білка, пофарбувати мазки за Грамом для визначення кислотостійких бактерій, провести посів на аероби, анаероби та мікобактерії.
 Інструкція про негоспітальну пневмонію у дорослих: етіологія, патогенез, класифікація, діагностика,
антибактеріальна терапія
Інструкція про негоспітальну пневмонію у дорослих: етіологія, патогенез, класифікація, діагностика,
антибактеріальна терапія
 Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія
Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія
 Інструкція про негоспітальну пневмонію у дорослих: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія
Інструкція про негоспітальну пневмонію у дорослих: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія
 Інструкція про негоспітальну пневмонію у дорослих: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія
Інструкція про негоспітальну пневмонію у дорослих: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
