- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Простий герпес: патогенез, клініка та лікування
Простий герпес: патогенез, клініка та лікування
Проблема рецидивуючого простого герпесу (РПГ) привертає до себе особливу увагу насамперед великою питомою вагою цієї патології у дерматологічній та венерологічній практиці. За деякими узагальненими даними, захворюваність на герпетичну інфекцію сягає
Проблема рецидивуючого простого герпесу (РПГ) привертає до себе особливу увагу насамперед великою питомою вагою цієї патології у дерматологічній та венерологічній практиці. За деякими узагальненими даними, захворюваність на герпетичну інфекцію сягає 83-480 на 100 тисяч населення і в даний час не має тенденції до зниження. Широке розповсюдження вірусу простого герпесу, значний клінічний поліморфізм захворювання, складний патогенез інфекції ставлять проблему лікування герпесу в ряд актуальних завдань клінічної медицини.
Давно відомо, що для герпесу характерна пожиттєва персистенція вірусу в клітинах нервових гангліїв, що зумовлює перебіг з періодичними рецидивами та ремісіями. Проте в останні роки з’явилися літературні повідомлення, що герпесвіруси персистують не тільки у нервових клітинах, а й у клітинах імунної системи. Це призводить до загибелі або зниження функціональної активності імуноцитів та сприяє розвитку вторинних імунодефіцитних станів, що підтримує тривалу персистенцію вірусу. Таким чином, виникає своєрідне «хибне коло», коли, виникаючи на тлі імунодефіцитного стану, герпетична інфекція цей стан підтримує за рахунок ураження лімфоцитів та порушення їхньої функції. Тому хронічний рецидивуючий простий герпес все частіше відносять до імунопатологічних захворювань. У статті розглядаються питання етіології, патогенезу, клініки та лікування простого герпесу.
Роль герпеcвірусів у патології людини
Вивчення ролі герпесвірусів у патології людини почалось у першій чверті нашого сторіччя, коли W. Grutter (1912) вперше знайшов вірусні включення у рідині герпетичних везикул та довів цим герпесвірусну природу герпетичного кератиту. Перша культура in vitro вірусу простого герпесу (ВПГ) була отримана у 1920 році. З того часу відкрито вісім антигенних серотипів вірусу герпесу та доведено їхню роль в етіології понад 40 хвороб людини. На сьогодні відомі декілька вірусів з родини Herpesviridae: два серотипи вірусу простого герпесу (ВПГ-1 та ВПГ-2), вірус вітряної віспи — оперізуючого лишаю, цитомегаловірус, вірус Епштейна-Барр, віруси герпесу людини 6-го, 7-го, та 8-го типів. Герпесвірусні інфекції відрізняються різноманітним, складним та тяжким перебігом з ураженням багатьох органів та тканин, що дозволяє визначати їх як загальні системні захворювання організму [1].
Серед усіх герпесвірусів особлива роль належить ВПГ, який викликає значну частку інфекційної патології людини взагалі. ВПГ вважають найбільш широко розповсюдженим паразитом з родини Herpesviridae. Єдиним природним резервуаром для ВПГ є людина. Ступінь інфікованості ним сягає ендемічного майже у всіх людських популяціях земної кулі, а рівень трансмісії вірусу є досить високим протягом усього року [2].
Розподіл ВПГ на два антигенних серотипи (ВПГ-1 та ВПГ-2) був зроблений наприкінці 60-х років на основі вивчення особливостей патогенності, шляхів передачі, динаміки накопичення на курячих ембріонах, з урахуванням різниці в будові деталей віріону та антигенної структури. ВПГ-1 та ВПГ-2 належать до підродини Alphaherpesvirinae, виду Simplexvirus та характеризуються відносно швидким циклом реплікації, стрімким розповсюдженням у культурі клітин, здатністю до деструкції інфікованих клітин, можливістю встановлення латентної інфекції та персистенції у сенсорних гангліях [3].
Віруси простого герпесу відіграють вирішальну роль в етіопатогенезі цілої низки різноманітних патологічних процесів. Найбільш клінічно розповсюдженими є прояви, що спостерігаються на шкірі та слизових оболонках. Більш тяжкі форми пов’язані з ураженням очей, геніталій, внутрішніх органів та центральної нервової системи. Тривалий час існувала думка, що ВПГ-1 викликає ураження переважно верхньої половини тулубу, а ВПГ-2 — нижньої, спричинюючи генітальний герпес та герпес новонароджених унаслідок внутрішньочеревної інфекції. У даний час встановлено, що приблизно 18% генітального герпесу викликано ВПГ-1 [4], а при вивченні герпетичного ураження ЦНС виявлено зв’язок менінгоенцефаліту з ВПГ-2 [5].
Найважливішим елементом патогенезу простого герпесу є розвиток інфекції в чутливих сенсорних гангліях, тому виникають повторні ураження в місцях фіксованої локалізації.
Епідеміологія простого герпесу
За висновками експертів Всесвітньої організації охорони здоров’я, простий герпес є однією з найбільш розповсюджених неконтрольованих інфекцій людини [6]. За даними різних авторів від 90% до 100% населення земної кулі є серопозитивними на вірус простого герпесу. Генітальний герпес став справжнім лихом сучасної медицини у всьому світі: у Сполучених Штатах щорічно реєструється понад 600 000 нових випадків генітального герпесу, не враховуючи 6-10 мільйонів випадків рецидивуючого герпесу. Між 1978 та 1991 роками, розповсюдженість генітального герпесу в Північній Америці зросла на 30%. За деякими оцінками, одна п’ята населення США інфіковані ВПГ-2, який є найбільш частою причиною генітального герпесу [7]. У результаті широкого серологічного скринінгу було виявлено, що від 45 до 60 мільйонів населення цієї країни мають генітальний герпес та 80% з них не підозрюють, що вони інфіковані. Результати цих досліджень дозволили зробити висновки щодо пандемічності характеру розповсюдженості генітального герпесу. Таке катастрофічне зростання інфікованості на простий герпес спостерігається і в інших країнах світу. Вчені багатьох країн спостерігали закономірність, коли швидке розповсюдження ВПГ-2-інфекції передувало різкому зростанню ВІЛ-інфікування статевим шляхом.
Стрімке зростання числа захворювань, обумовлених вірусом простого герпесу, що чітко спостерігається у Північній Америці та Європі, менше ніж в інших частинах світу, оскільки в багатьох країнах діагностичні можливості та дані епідемічного нагляду недостатні. Що стосується епідеміології ВПГ-1, то за оцінками деяких авторів приблизно половина населення є інфікованими ВПГ-1. Крім того, чим нижче рівень життя суспільства, тим більше в ньому серопозитивних на ВПГ-1 осіб. Так, у країнах, що розвиваються, майже 100% населення хворіють на ВПГ-1-інфекцію. Цікаво, що серед соціально-благополучних верств населення інфікованість цим штамом вірусу не досягає й 50% [8].
Традиційно вважали, що передача генітального герпесу можлива лише під час симптоматичного епізоду (за умов наявності висипу) та під час короткого продромального періоду перед симптоматичним рецидивом. Як тепер відомо, трансмісія ВПГ відбувається не лише за умов наявності клінічних проявів у партнера, а й під час так званих асимптоматичних рецидивів (або асимптоматичного виділення вірусу) [9]. За допомогою вірусологічних методів було показано, що у всіх серопозитивних на ВПГ-2 осіб має місце явище асимптоматичної реактивації інфекції, вільне виділення вірусних інфекційних часток триває від 1 до 10% часу життя від моменту інфікування. Більш того, найновіші дослідження, що були проведені за допомогою чутливого методу полімеразної ланцюгової реакції, довели, що екскреція індивідуумом вірусу простого герпесу відбувається протягом 28% днів його життя. Серед чоловіків та жінок, які зверталися до венерологічних клінік, ВПГ-2 був ізольований вірусологічним методом зі статевих шляхів у 5,4 та 8% відповідно (при відсутності будь-яких клінічних проявів). За оцінками американських експертів, понад 80% інфікування генітальним герпесом відбувається під час асимптоматичних рецидивних епізодів у статевих партнерів [10].
Підсумовуючи вище викладене, зазначимо, що джерелом інфекції є хвора людина або вірусоносії. Епідемічно небезпечними є як хворі під час рецидиву, так і вірусоносії (або хворі) під час асимптоматичної реактивації герпетичної інфекції. Існують різноманітні механізми передачі вірусу простого герпесу — статевий, повітряно-крапляний, кишково-оральний, через шкірний покрив та слизові оболонки, можливе й внутрішньочеревне інфікування.
Клінічні форми герпетичної інфекції
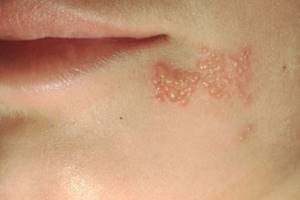
Існують різноманітні клінічні форми герпетичної інфекції: ушкодження шкіри, порожнини рота, очей, центральної нервової системи, герпетичні гострі респіраторні хвороби, генітальний герпес, герпес новонароджених, а також вісцеральні форми (пневмонія, гепатит та ін.). Найбільш розповсюдженим проявом інфекції є герпес шкіри — від невеликого за площею везикульозу, переважно в області межі шкіри та червоної окрайки губ, до розповсюджених уражень з вираженим регіонарним лімфаденітом та інтоксикацією.
У типових випадках простий герпес проявляється висипкою, яка складається з напівсферичних згрупованих везикул розміром 1,5-2,0 мм на тлі еритеми та набряку шкіри. Продромальні явища характеризуються печією, поколюванням, свербінням та іншими суб’єктивними розладами. Вони виникають за один-два дні до клінічних проявів. Висип виникає поодинокими вогнищами, які складаються з 3-6 згрупованих везикул. Вміст везикул, як правило, прозорий, але може бути й геморагічним. Через 3-6 днів везикули розриваються, виникають ерозії з фестончастими контурами, дно їх м’яке, гладке, поверхня волога. На місці ерозій утворюються буро-жовті кірки. Останні поступово відходять, залишаючи еритему, яка повільно зникає. У середньому процес триває 10-14 днів та обмежується утворенням одного вогнища. Іноді через 2-3 дні формується новий везикульозний висип.
У розвитку герпетичних везикул виділяють чотири стадії: еритемну, везикульозну, кіркову та клінічного одужання.
Загальноприйнятої класифікації герпетичної інфекції не існує, але в залежності від локалізації патологічного процесу виділяють такі форми герпетичної інфекції:
- герпетичні ураження очей (кон’юнктивіт, кератит, іридоцикліт та інші);
- герпетичні ураження шкіри та слизових оболонок (герпес губ, крилів носу, обличчя, рук, сідниць);
- герпетичні ураження нервової системи (менінгіт, енцефаліт, неврит, менінгоенцефаліт і таке інше);
- генералізований та вісцеральний герпес (пневмонії, гепатит, езофагіт і т. д.).
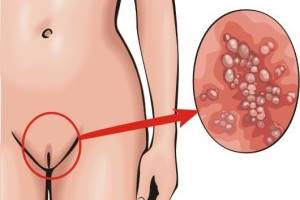
Серед герпесу шкіри та слизових оболонок відрізняють: генітальний герпес (ураження слизових оболонок та шкіри статевого члена, вульви, піхви, каналу шийки матки), герпетичний стоматит, гінгівіт, фарингіт, герпес сідниць, рук, носу, щік та інші. Крім того, в останні роки виділяють так звану багатоформну ексудативну еритему, асоційовану з простим герпесом [11].
Крім типової везикульозної форми деякі автори виділяють абортивну, набрякову, зостероподібну форми простого герпесу.
Клінічні симптоми, що викликаються ВПГ-1 та ВПГ-2 є однаковими, тому важливим є ідентифікація причинного агенту (K. R. Beutner et al., 1997). Це пов’язане з тим, що прогноз є більш позитивним та благопріємним при ураженні ВПГ-1.
Класифікація герпетичних уражень шкіри та слизових оболонок
Клінічна класифікація герпетичної інфекції шкіри та слизових оболонок грунтується на анамнестичних та серологічних даних. Простий герпес поділяють на первинний та рецидивуючий. Перший з них уявляє первинне інфікування пацієнта, який не має антитіл ані до ВПГ-1, ані до ВПГ-2. Рецидивуючий тип являє собою реактивацію латентної інфекції, що була набута раніше. Про рецидивний характер прояву свідчать: схожі клінічні прояви в минулому; виявлення під час теперішнього прояву антитіл до ВПГ; ідентифікація антигену вірусу з вогнища клінічного прояву. Причому, умовою для виставлення діагнозу рецидивуючого герпесу є співпадання типу ідентифікованого з вогнища ВПГ та типу ВПГ, до якого знайдені антитіла у сироватці хворого. Наприклад, якщо з вогнища виділений ВПГ-2, а у сироватці крові ідентифіковані антитіла до ВПГ-2, то такий прояв трактується як рецидивний. Якщо з вогнища виділений ВПГ-1 та у сироватці крові виявлені антитіла до ВПГ-1, то такий епізод також вважається рецидивним. Деякі автори крім первинного та рецидивуючого виділяють так званий непервинний герпес (nonprimary herpes) [12], коли з вогнища ураження виділяють один з двох серотипів ВПГ, а антитіла у сироватці крові ідентифікують до іншого серотипу.
Пацієнти як з первинним, так і з рецидивуючим типом простого герпесу можуть бути джерелом вірусу. Первинне інфікування відбувається при першому контакті людини з ВПГ. Первинний герпес спостерігається частіше в дітей у віці від 6 місяців до 5 років (як правило це ВПГ-1-інфікування), коли з крові дитини починають зникати протигерпетичні антитіла, що були передані трансплацентарно від матері. Первинне інфікування у 80% дітей має безсимптомний характер, проте в окремих випадках може проявлятися клінічними симптомами.
Генітальний герпес є одним з різновидів простого герпесу та відноситься до захворювань, що передаються статевим шляхом [6]. Він відноситься до найбільш розповсюджених форм герпетичної інфекції. Первинне інфікування генітальним герпесом відбувається в період активного статевого життя. Частіше всього на первинний генітальний герпес хворіють люди у віці від 15 до 35 років. У переважній більшості випадків генітального герпесу інфікуючим агентом виступає ВПГ-2, проте у 10-26% випадків генітальний герпес спричинений ВПГ-1, що пояснюють побутовим та орогенітальним шляхами зараження.
Первинний генітальний герпес виникає через 1-10 днів після інфікування та відрізняється від наступних рецидивів більш важким та тривалим перебігом. Нові везикули можуть утворюватися протягом двох тижнів від появи перших альтерацій. Ерозії утворюються протягом першого тижня захворювання та зберігаються протягом наступного другого тижня клінічної маніфестації, наприкінці якого починають утворюватися кірки. Процес інкрустації завершується відпадінням корок на 20-25-й день. Клінічний перебіг первинного прояву генітального герпесу дуже часто супроводжується системною симптоматикою, включаючи підвищення температури тіла, лихоманку, головний біль, нездужання та біль у м’язах. Середня тривалість екскреції вірусу з вогнища при розташуванні висипу на шкірі становить у жінок 11,8 днів, у чоловіків — 10,5 днів та корелює з тривалістю періоду від появи перших везикул до утворення перших корок (такий період дорівнює в середньому 10,5 днів). При розташуванні висипу на слизових оболонках реепітелізація закінчується в середньому до 20 доби. Упродовж цього періоду відбувається виділення вірусу з вогнища уражень, при цьому хворі є стовідсотковим джерелом ВПГ. Ці обставини треба враховувати при проведенні терапії первинного герпесу. Слід відзначити, що після розрішення висипу первинного епізоду, вірус пожиттєво зберігається в організмі людини.
Рецидивуючий тип перебігу герпетичної інфекції являє собою реактивацію латентної інфекції, що була набута раніше. Явище латенції забезпечує зберігання вірусу в організмі при несприятливому для розповсюдження імунологічному фоні. Рецидиви захворювання як правило мають більш легкий перебіг, висип менш рясний, слабко виражений, його тривалість значно менша. У більшості хворих загостренню передують продромальні явища, такі як біль, парестезії в області сідниць, промежини, внутрішньої поверхні стегон (при локалізації на геніталіях та сідницях), в області щік, верхньої губи (при локалізації висипу на обличчі). Цілком можливо, що ці явища пов’язані з подразненням периферійних нервів під час «пересування» вірусу по них до епітелію. За даними L. Corey et al. (1983), продромальні явища перед появою висипу відчувають близько 50% хворих на генітальний герпес, продром триває від декількох годин до 1-2 днів [13]. Деякі пацієнти відчувають «хибні» продромальні симптоми без клінічних епізодів. Проте S.L. Sacks (1984) вважає, що під час такого продрому відбувається екскреція вірусу і хворі є джерелом інфекції.
Як для чоловіків, так і для жінок, період між виникненням везикул та початком інкрустації триває в середньому 4-5 днів, а період між початком везикуляції до реепітелізації дорівнює в середньому 10 днів.
Доведено, що у хворих на генітальний герпес час від часу відбуваються рецидиви негенітальної локалізації. Дослідження показало, що у 21% пацієнтів, які мали первинні прояви герпесу на геніталіях, у подальшому спостерігалися рецидиви й на інших ділянках шкіри та слизових. Так, у пацієнтів з генітальним герпесом, що був спричинений ВПГ-2, крім клінічних проявів на геніталіях, час від часу спостерігали герпетичний висип на шкірі сідниць, а у пацієнтів з генітальним герпесом, спричиненим ВПГ-1, спостерігали герпетичні ураження на обличчі та верхніх кінцівках.
Одним з показників важкості перебігу рецидивуючого простого герпесу будь-якої локалізації є частота рецидивів. Давно відомо, що частота рецидивів залежить від типу ВПГ, що викликав захворювання. Пацієнти, у яких причиною первинного прояву генітального герпесу був ВПГ-1, мають менше рецидивів протягом першого року захворювання, ніж ті хворі, у яких перший епізод спричинив ВПГ-2. W.C. Reeves et al. (1981), спостерігаючи 137 хворих після первинного епізоду генітального герпесу, виявили, що тільки 14% пацієнтів з ВПГ-1-генітальною інфекцією мали рецидиви. Проте серед хворих з ВПГ-2-генітальною інфекцією 60% мали рецидиви протягом наступного (після первинного прояву) року. Така різниця може залежати від неоднакової здатності двох серотипів вірусу до встановлення латенції. Припускають також, що фактори, які впливають на реактивацію інфекції, можуть розрізнятися для двох серотипів цього вірусу.
Тривалі спостереження деяких авторів [14] дозволили визначити деякі загальні закономірності щодо частоти рецидивів. Частота може залежати від статі, тривалості первинного епізоду або давності захворювання. Доведено, що частота рецидивів у жінок вище, ніж у чоловіків. Є також позитивна залежність між тривалістю первинного епізоду герпесу та частотою наступних рецидивів. Чим триваліше первинний прояв герпесу (35 днів і більше), тим коротше проміжок до появи першого рецидиву, тим удвічі більша частота наступних рецидивів. Також з’ясовано, що чим молодше був вік людини, коли трапився перший прояв герпесу, тим вище частота рецидивів у майбутньому. І, зрештою, показано, що частота рецидивів з часом поступово зменшується.
Як уже зазначалося, асимптоматичний перебіг відіграє важливу роль у трансмісії генітальної ВПГ-інфекції. Вважається, що до 80% зараження генітальним герпесом відбувається під час асимптоматичних епізодів, а широке розповсюдження генітального герпесу відбувається як раз завдяки передачі вірусу партнеру під час подібних асимптоматичних рецидивів (зрозуміло, що більшість хворих утримуються від статевих контактів під час рецидиву з клінічними проявами). Відомо, що частота асимптоматичних рецидивів значно більша протягом першого року захворювання після первинного клінічного епізоду, зокрема протягом перших шести місяців.
Визначення ролі асимптоматичної герпетичної інфекції у розповсюдженні герпесу спонукало до деяких змін у підходах до лікування герпетичної інфекції. Так, вважається, що хронічна супресивна протигерпетична терапія, яка розпочата негайно після первинного епізоду, значно зменшує частоту рецидивів у майбутньому (як симптоматичних, так і асимптоматичних). Результати плацебо контрольованого дослідження довели, що під впливом тривалої терапії ацикловіром суттєво пригнічується асимптоматичне виділення вірусу з урогенітального тракту, у результаті чого антивірусне лікування редукує кількість асимптоматичних рецидивів.
Таким чином, проблема простого герпесу набуває нового забарвлення: передача ВПГ відбувається не лише в період клінічних проявів, але й під час так званих асимптоматичних рецидивів, тобто протягом вільного виділення вірусу з поверхні слизових оболонок, що і спричинює пандемічне розповсюдження ВПГ. Крім того, добре відомо, що чим частіше у хворого на рецидивуючий герпес з’являються ерозивні ушкодження на слизових оболонках та шкірі статевих органів, тим вище вірогідність ВІЛ-інфікування при статевих контактах.
Тому подальше удосконалення лікувальних заходів, а також перегляд існуючої практики призначення специфічної протигерпетичної терапії лише під час явних клінічних проявів є важливою проблемою контролю над герпетичним процесом з позицій попередження розповсюдження ВПГ-інфекції.
Патогенез персистенції, реактивації та асимптомного перебігу інфекції
Хоча ВПГ-інфекція є однією з найбільш вивчених вірусних інфекцій, патогенез персистенції, реактивації та асимптоматичного перебігу все ще залишається недостатньо з’ясованим. Розглянемо існуючи теорії потрапляння ВПГ до організму людини та можливі механізми його персистенції, латенції та реактивації.
Згідно з розповсюдженою теорією, вірус, що потрапив зовні до шкіри або на слизову оболонку при первинній інфекції, сягає нервових закінчень та через ретроградний аксон піднімається до нервових гангліїв. У гангліях виникає гостре інфікування, при якому вірус реплікується у нервових клітинах або в інших клітинах ганглію. Ця активна інфекція триває протягом двох-трьох тижнів. Потім вірус переходить у стан персистенції, яка є причиною латентного перебігу герпесу. Геном ВПГ був ідентифікований у гангліях людей з рецидивуючим герпесом у періоді ремісії. За певних умов відбувається активація вірусу, унаслідок чого виникає черговий рецидив.
Нині найбільш відомі дві альтернативні гіпотези, які пояснюють виникнення рецидивів герпесу: теорія статичного стану вірусу та теорія динамічного стану вірусу [3].
Згідно з теорією статичного стану, вірус знаходиться в клітинах паравертебрального сенсорного ганглію в інтегрованому або вільному непродуктивному стані. Репродукція не відбувається за умов недостатності транскрипції або внаслідок імунологічного контролю репродукції. Під впливом «пускового фактора» активований вірус з ганглію центробіжно мігрує аксоном периферійного нерва та викликає репродукцію ВПГ в епітеліальних клітинах на тлі зміненої біохімічної та імунологічної рівноваги. Умовою виникнення репродукції вірусу, крім послаблення загального імунологічного контролю, є порушення місцевого імунітету в ділянці епідермісу. Це призводить до підвищення сприймання епітеліоцитів до вірусу. Але ця теорія не пояснює швидкого розвитку рецидиву (через 13 днів) після впливу провокуючого фактора, а термін пересування вірусу по аксону становить щонайменше 4 дні.
Гіпотеза динамічного стану припускає, що репродукція та виділення з ганглію невеликої кількості вірусу відбувається постійно кожні декілька днів. Неврально, досягаючи шкіри, вірус викликає мікрофокуси інфекції, які швидко усуваються механізмами захисту. Це або попереджує клінічний розвиток інфекції, або призводить до асимптоматичного виділення вірусу. Доказом цієї гіпотези є екскреція інфекційного ВПГ з урогенітального тракту, носового секрету, сльозової рідини людей з персистуючим герпесом, які не мають ознак клінічних уражень. Часта ідентифікація ВПГ у секреті слизових оболонок переконливо доводить, що в міжрецидивні проміжки ВПГ знаходиться не тільки в ганглії. Ця гіпотеза пояснює можливість появи висипу через 1-2 дні після дії провокуючого фактора. Крім того, тривала латентна інфекція підтримується повторними надходженнями вірусу у ганглії зі шкірних вогнищ ураження.
На основі аналізу наведених даних можна припустити можливість існування обох механізмів виникнення рецидивів. Важливе місце в розвитку рецидивуючих герпетичних уражень відводять стану місцевого імунітету, при пригніченні якого виникають умови для репродукції вірусу, що знаходиться у шкірі.
Жодна теорія не пояснює, чому при багатофакторній активації інфекції відбувається затримка репродукції вірусу та обмеження його розповсюдження.
Факторами, які провокують рецидив та послаблюють напруженість інфекційного імунітету, можуть бути гострі респіраторні захворювання, грип, пневмонія, малярія, менінгіт, фокальна інфекція, підвищена інсоляція, опромінення, імунодепресія, високі дози стероїдів, посилене вироблення адреналіну, менструація, механічне подразнення (статевий акт).
Особливості імунного статусу при ВПГ-інфекції
Аналіз даних багаторічного вивчення ВПГ-інфекції та багаточисельних клініко-морфологічних описів герпетичних уражень, які традиційно розглядалися як локальні форми прояву інфекції, переконливо довів, що герпес являє собою хворобу всього організму, а не вибіркове ураження тієї чи іншої системи.
Використання в клінічній практиці методів оцінки імунного статусу хворих з різноманітними проявами герпетичної патології виявило у них імунологічні порушення. Головною особливістю імунного статусу при герпетичній інфекції є формування вторинного імунного дефіциту. Слід підкреслити, що порушення в імунній системі відіграють суттєву роль у персистенції вірусу та в патогенезі рецидивуючого простого герпесу. Це захворювання все частіше відносять до хвороб, що мають імунопатологічну природу. Відомо, що при порушеннях імунного статусу герпетична інфекція набуває більш тяжкого перебігу з частими та тривалими рецидивами, що пов’язано з недостатністю імунітету або з надлишковою імунною реакцією. Так, добре відомо, що часте рецидивування та більш злоякісний характер перебігу герпетичних уражень відмічається в осіб з імуносупресією різного ступеня вираженості (наприклад, при онкологічних захворюваннях та лейкозах, при синдромі набутого імунного дефіциту, після трансплантації органів і таке інше).
З іншого боку, сама герпетична персистуюча інфекція може спричинювати пригнічення імунітету. Факт персистенції та реплікації ВПГ у нервових клітинах відомий давно. Але останні літературні повідомлення доводять, що ці ж процеси відбуваються і в клітинах імунної системи. Це призводить до загибелі або до зниження функціональної активності імуноцитів. Останнє сприяє розвитку вторинних імунодефіцитних станів, підтримуючи тривалу вірусну персистенцію. Таким чином виникає своєрідне «хибне коло», коли на тлі існуючого імунодефіциту герпес набуває рецидивуючого характеру, а потім вірус сам по собі підтримує цей стан шляхом персистенції та реплікації в імуноцитах, зокрема в лімфоцитах та макрофагах, які відповідають за утворення ендогенного інтерферону. Слід відмітити, що ураження клітин імунної системи починається майже біля «воріт» інфекції — із зараження клітин Лангергансу, лімфоцитів та макрофагів, які відіграють важливу роль у забезпеченні бар’єрної функції шкіри.
Дослідниками доведено, що при рецидивуючому герпесі суттєві зсуви в різних ланках імунітету зберігаються не тільки в періоді рецидиву, але й під час ремісії. Ця обставина повинна враховуватися лікарями, тому що хворі на рецидивуючий простий герпес потребують уваги та розумної терапії не тільки під час загострення, але й при зникненні основних клінічних симптомів. Іншими словами, повинно бути забезпечено етапне лікування хворих на РПГ із врахуванням стадії хвороби.
Імунна відповідь макроорганізму при герпетичній інфекції обумовлена гуморальними та клітинними факторами. Особливості специфічного імунітету при герпесі пов’язані зі зміною мембран інфікованих клітин, з виникненням на їх поверхні рецепторів для імуноглобулінів, мембранного вірус-специфічного антигену та комплексу мембранного вірусного антигену з антигеном гістосумісності.
Велике захисне значення має синтез антитіл проти оболонкових антигенів вірусу та мембранних антигенів інфікованих клітин. Як при первинному, так і при рецидивуючому герпесі послідовно синтезуються IgM, IgG та IgA. Протягом перших трьох тижнів захворювання з’являються антитіла, представлені спочатку IgM. Пізніше з’являються антитіла, що представлені IgG. Перемикання синтезу IgM та IgG при первинній інфекції відбувається через декілька днів. При вторинній відповіді (при рецидиві) одразу ж синтезуються антитіла класу G. Антитіла класу А утворюються пізніше та реєструються недовго. Антитіла, що нейтралізують вірус (IgM, IgG), мають більш важливе значення при герпесі та зберігаються більш тривалий час, ніж антитіла, що зв’язують комплемент (IgA).
Антитіла сприяють пригніченню виходу вірусу з інфікованих клітин до оточуючого середовища. Феномен імунного пригнічення та вивільнення вірусу сприяє обмеженню розповсюдження ВПГ до інших чутливих клітин. Протигерпетичні антитіла пожиттєво зберігаються у крові людини. Але, незважаючи на наявність специфічних антитіл, гуморальні імунні механізми не здатні попередити процес активації латентного ВПГ та виникнення рецидивів. Проте антитіла поряд з факторами клітинного імунітету послаблюють інтенсивність проявів інфекції, попереджують дисемінацію вірусу, сприяють активації сенсибілізованих лімфоцитів. Негативна роль протигерпетичних антитіл у підтримці персистенції ВПГ полягає в тому, що, зв’язуючись з Fc-рецепторами інфікованих клітин, антитіла самостійно або в комплексі з антигеном порушують розпізнавання цих клітин та їх лізис ефекторними клітинами та сенсибілізованими лімфоцитами. Отже, протигерпетичні антитіла сприяють не тільки обмеженню інфекції та нейтралізації вірусу, але й підтримують інфекцію у латентному стані.
Поряд з гуморальним імунітетом, велике значення при герпетичній інфекції мають реакції клітинного імунітету, що здійснюються Т-кілерами, Т-ефекторами, макрофагами, поліморфноядерними лейкоцитами без участі специфічних протигерпетичних антитіл. Реакції клітинного імунітету спрямовані проти вірусів та інфікованих клітин задля пригнічення репродукції вірусу та пов’язані з міграцією та утриманням макрофагів і лімфоцитів у вогнищі запалення. Велику роль у патогенезі герпетичної інфекції відіграють макрофаги, які захоплюють вірусні частки та сприяють дисемінації інфекції. Фактори клітинного імунітету сприяють лізису інфікованих клітин та вивільненню внутрішньоклітинних часток ВПГ для подальшої нейтралізації їх антитілами. Крім того, ці фактори попереджають інфікування оточуючих незаражених клітин. Цей процес здійснюється за рахунок активації інтерфероноутворення у стимульованих лімфоцитах [16].
Глибокий аналіз стану клітинного імунітету у хворих на рецидивуючий герпес дозволив зробити висновок про неповноцінність цієї ланки імунітету як у період рецидиву, так і в період ремісії. Це є віддзеркаленням вторинного імунного дефіциту. Таким чином, при рецидивуючому герпесі в першу чергу страждає клітинний імунітет. Проте, чи впливає глибина порушень у клітинному імунітеті на частоту рецидивів, ще остаточно не з’ясовано.
Терапія герпетичної інфекції
Лікування рецидивуючого герпесу залишається важким та не завжди ефективним. Тактика лікування полягає у використанні на різних етапах хвороби комплексного етіологічного та патогенетичного лікування, спрямованого як на пригнічення репродукції ВПГ, так і на підвищення імунологічної резистентності організму.
Терапія герпесвірусних інфекцій поділяється на лікування клінічних проявів (тобто або первинного прояву, або прояву клінічного рецидиву) та на протирецидивне лікування. Питання терапії клінічних проявів є, на нашу думку, практично вирішеним. Воно полягає у топічному або системному призначенні протигерпетичних хіміопрепаратів (ацикловіру, валaцикловіру, фамцикловіру та ін.) або препаратів лейкоцитарного та рекомбінантного інтерферону. Метою лікування первинного чи рецидивного клінічного прояву є скорочення терміну наявності об’єктивних та суб’єктивних симптомів. Як довів клінічний досвід, ацикловір та його похідні швидко та ефективно купують гострі прояви герпетичної інфекції. Проте вони не попереджують повторного рецидивування герпесу та не знижують частоту рецидивів при короткостроковому їх вживанні.
Щодо протирецидивного лікування, існує декілька підходів протирецидивного лікування РПГ:
- тривалі, протягом місяців та майже років, безперервні курси ацикловіру (супресивна протигерпетична терапія) [17];
- імунотерапія протигерпетичними вакцинами;
- терапія імуномодулюючими препаратами та індукторами інтерферону.
Супресивна тривала терапія ацикловіром та його похідними є майже не єдиним загальноприйнятим методом попередження рецидивів герпесу в західній медицині. Ацикловір призначається тривалими (місяці і роки) безперервними курсами у підтримуючих дозах (800 мг на добу). Під час вживання цього препарату рецидиви не виникають, але після його відміни поновлюються з попередньою частотою. Це змушує поновляти або подовжувати лікування.
Незважаючи на це, майже єдиним сучасним підходом попередження клінічних та субклінічних рецидивів є призначення тривалих курсів ацикловіру та його похідних (гальмувачі тімідинкінази).
У заключенні слід підкреслити, що позитивним критерієм будь-якого методу лікування герпесу є не тільки скорочення тривалості рецидивів, що зменшує ризик інфікування здорових людей, але й подовження періоду ремісії. Слід відзначити, що найголовніша проблема герпесу — рецидивування та існування прихованих субклінічних форм — все ще залишається відкритою, що і буде обумовлювати подальше неухильне зростання захворюваності на простий герпес, зокрема з генітальною локалізацією. Тому подальше удосконалення лікування герпетичної інфекції є важливою проблемою з позицій профілактики розповсюдження захворювань, обумовлених ВПГ.
Література
- Liesegang T. Herpes simplex // Cornea. -1999. — V. 18, No. 6. — P.739.
- Schneede P., Hofstetter A.G. Viral sexually transmitted urogenital infections. Increased importance of viral STD in industrial countries // Fortschritte der Medizin. — 1999. — V.117, No.11. — P.22-26, 28.
- Баринский И.Ф., Шубладзе А.К., Каспаров А.А., Гребенюк В.Н. Герпес (этиология, диагностика, лечение). М.:Медицина, 1986. — 272 с.
- Janier M., Lassau F., Sprindler E., Morel P., Gerard P., Aufrere A. Seroprevalence of herpes simplex virus type 2 antibodes in an STD clinic in Paris // International Journal of STD and AIDS. — 1999. — V.10, No.8. — P.522-526.
- Dennet C., Cleator G.M., Klapper P.E. HSV-1 and HSV-2 in herpes simplex encephalitis: a study of sixty-for cases in the United Kingdom // Journal of Medical Virology. — 1997. — V.53, No.1. — P.1-3.
- WHO Regional Office for Europe. Epidemiology of herpes simplex virus infections and surveillance of other STDs in Europe. Report on a Workshop: Copenhagen, 19-20 June 1995. Copenhagen: WHO EURO, 1996. — 47 pp.
- Wald A., Corey L., Cone R., Hobson A., Davis G., Zeh J. Frequent genital herpes simplex virus 2 shedding in immunocompetent women. Effect of acyclovir treatment // Journal of Clinical Investigation.-1997.-V.99, No.5.-P.1092-1097.
- Beutner K.R., Brown Z.A., Cates W. et al. Genital Herpes: A Clinician’s Guide to Diagnosis and Treatment. Part II / American Medical Association.-1997.-p.40.
- Woolley P. Genital Herpes: Recognizing the Problem // Medscape Womens Health. — 1997. — V.2, No.5. -P.2.
- Barton S.E., Munday P.E., Patel R.J. Asymptomatic shedding of herpes simplex virus from the genital tract: uncertainty and its consequences for patient management. The Herpes Simplex Virus Advisory Panel // International Journal of STD and AIDS. — 1996. — V.7, No.4. — P.229-232.
- Kokuba H., Imafuku S., Burnett J.W., Aurelian L. Longitudinal study of a patient with herpes-simplex-virus-associated erythema multiforme: viral gene expression and T cell repertoire usage // Dermatology. — 1999. — V.198, No.3. — P.233-242.
- Corey L. Transmission and viral shedding // Holmes K.K., Cates W.Jr., Lemon S.M., Stamm W.E. (eds). Sexually Transmitted dideases. — New Yourk, NY: McGraw-Hill Information Services Co, 1990. — P391-413.
- Corey L., Adams H.G., Brown Z.A., Holmes K.K. Genital herpes simplex infections: clinical manifestations, course and complications // Annals of Internal Medicine.- 1983.-V.54.-P.262-265.
- Benedetti J., Corey L., Ashley R. Recurrence rate in genital herpes after symptomatic first-episode infection // Annals of Internal Medicine.-1994.-V.121.-P.847-854.
- Mikloska Z., Danis V.A., Adams S., Lloyd A.R., Adrian D.L., Cunningham A.L. In vivo production of cytokines and beta (C-C) chemokines in human recurrent herpes simplex lesions—do herpes simplex virus-infected keratinocytes contribute to their production? // Journal of Infection Diseases. — 1998. — V.177, No.4. -P. 827-838.
- Gosselin J., TomoIu A., Gallo R.C., Flamand L. Interleukin-15 as an activator of natural killer cell-mediated antiviral response // Blood. — 1999. — V.94, No.12. — P.4210-4219.
- Goldberg L.H., Kaufman R., Kurtz T.O., Conant M.A., Eron L.J., Batenhorst R.L., Boone G.S. Long-term suppression of recurrent genital herpes with acyclovir. A 5-year benchmark. Acyclovir Study Group // Archives of Dermatology. — 1993. -V.129, No.5. — P.582-587.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Генітальний герпес: клінічні рекомендації CDC 2006 р.
Генітальний герпес: клінічні рекомендації CDC 2006 р.
 Порівняльний аналіз ефективності застосування Вальтрексу та ацикловіру в лікуванні генітального герпесу
Порівняльний аналіз ефективності застосування Вальтрексу та ацикловіру в лікуванні генітального герпесу
 Генитальный герпес
Генитальный герпес
 Кагоцел в лечении генитального герпеса
Кагоцел в лечении генитального герпеса