Теваграстим инструкция, аналоги и состав
| Показания: | • Скорочення тривалості нейтропенії і зменшення частоти фебрильної нейтропенії у хворих, які отримують цитотоксичну хіміотерапію з приводу злоякісних захворювань (за винятком хронічного мієлолейкозу і мієлодиспластичного синдрому). • Скорочення тривалості нейтропенії у хворих, які отримують мієлоаблативну терапію з наступною трансплантацією кісткового мозку, з високим ризиком пролонгованої тяжкої нейтропенії.• Мобілізація периферичних стовбурових клітин крові (ПСКК).• Довготривала терапія для збільшення кількості нейтрофілів і зменшення частоти і тривалості інфекційних ускладнень у дітей та дорослих з тяжкою уродженою, періодичною або ідіопатичною нейтропенією (абсолютна кількість нейтрофільних гранулоцитів 0,5109/л) та тяжкими або рецидивуючими інфекціями в анамнезі.• Зменшення ризику бактеріальних інфекцій при стійкій нейтропенії (абсолютна кількість нейтрофілів не більше 1,0109/л) у пацієнтів з розгорнутою стадією ВІЛ-інфекції у разі неефективності інших засобів контролю нейтропенії. |
| Форма випуска: | Розчин для ін'єкцій або інфузій по 30 млн МО/0,5 мл або 48 млн МО/0,8 мл у шприці № 1 |
| Производитель, страна: | ТЕВА Фармацевтікал Індастріз Лтд./Тева Фарма Б.В., Ізраїль/Нідерланди |
| Действующее вещества: | 1 шприц містить: філграстиму 300 мкг (30 млн. МО)/0,5 мл або 480 мкг (48 млн. МО)/0,8 мл |
| МНН: | Filgrastim - Филграстим |
| Регистрация: | 848/11-300200000з 11.01.2016 по 21.06.2016. Приказ 6 від 11.01.2016 |
| Код АТХ: |
Склад:
діюча речовина:філграстим;
1 шприц містить: філграстиму 300 мкг (30 млн. МО)/0,5 мл або 480 мкг (48 млн. МО)/0,8 мл;
допоміжні речовини:
для 30 млн. МО/0,5 мл: 0,30 мг кислоти оцтової льодяної,25,0 мг сорбіту (Е 420), 0,0275 мг полісорбату 80, до рН 4,20 натрію гідроксиду, до необх. кільк. 0,50 мл води для ін'єкцій;
для 48 млн. МО/0,8 мл: 0,48 мг кислоти оцтової льодяної,40,0 мг сорбіту (Е 420), 0,044 мг полісорбату 80, до рН 4,20 натрію гідроксиду, до необх. кільк. 0,80 мл води для ін'єкцій.
Не містить консервантів.
Лікарська форма. Розчин для ін'єкцій або інфузій.
Основні фізико-хімічні властивості: розчин безбарвний та прозорий.
Фармакотерапевтична група. Колонієстимулюючі фактори.
Код АТХ L03A A02Філграстим.
Імунологічні і біологічні властивості.
Фармакодинаміка. Людський гранулоцитарний колонiєстимулюючий фактор (Г-КСФ) − це глiкопротеїн, що регулює утворення функцiонально активних нейтрофiлiв i їх вихід у кров iз кiсткового мозку.
ТеваГрастим, що мiстить рекомбiнантний Г-КСФ (філграстим), значно збiльшує число нейтрофiлiв у периферичнiй кровi вже в першi 24 години пiсля введення, iз невеликим збiльшенням числа моноцитiв. Фiлграстим виробляється за технологією рекомбiнантної ДНК за допомогою Е.соli (К802). У деяких хворих з тяжкою хронічною нейтропенiєю ТеваГрастим може викликати незначне збiльшення циркулюючих еозинофiлiв і базофiлiв порівняно з вихідним рівнем; у деяких з цих хворих спостерігалася еозинофілія або базофілія до початку лікування. ТеваГрастим дозозалежно збільшує число нейтрофiлiв при використанні рекомендованих доз. Нейтрофіли, що виробляються у відповідь на вживання філграстиму, демонструють нормальну або пiдвищену функціональну активність, що підтверджується аналізами хемотаксичної та фагоцитарної функцій. Після закiнчення лiкування філграстимом число нейтрофiлiв в периферичнiй крові знижується на 50 % протягом 1-2 днiв i повертається до нормального рівня протягом 1-7 днiв.
Філграстим значно зменшує частоту, тяжкість i тривалiсть нейтропенiї та фебрильної нейтропенiї у хворих, якi проходять хiмiотерапiю цитостатиками. Лiкування філграстимом значно зменшує тривалість фебрильної нейтропенiї, потребу в антибiотикотерапiї та госпiталiзацiї після iндукцiйної хiмiотерапiї при гострому мiєлолейкозi або мієлоаблативній терапії з наступним пересадженням кісткового мозку. Впливу препарату на частоту лихоманки та iнфекцiйних ускладнень виявлено не було. Препарат не зменшує тривалість лихоманки у хворих, якi проходять мієлоаблативну терапію з наступним пересадженням кісткового мозку.
Застосування філграстиму як самостiйно, так i пiсля хіміотерапії, мобiлiзує вихiд гемопоетичних стовбурових клiтин в периферичний кровообiг. Аутологiчну трансплантацiю периферичних стовбурових клiтин кровi (ПСКК) проводять пiсля високодозової цитотоксичної терапiї або замiсть трансплантацiї кiсткового мозку, або як доповнення до неї. Інфузія ПСКК прискорює відновлення кровотворення, зменшуючи тривалість ризику геморагічних ускладнень та потребу в переливанні тромбоцитарної маси.
У порівнянні з алогенною трансплантацією кісткового мозку, застосування алогенних ПСКК, мобілізованих за допомогою філграстиму, виявило у реципієнтів значно прискорене відновлення кровотворення, що призвело до значного скорочення часу відновлення кількості тромбоцитів.
Ретроспективне європейське дослідження, яке оцінювало використання Г-КСФ після алогенної трансплантації кісткового мозку у пацієнтів з гострими формами лейкозу, виявило підвищений ризик реакцій «трансплантат проти хазяїна», а також підвищений ризик пов'язаної з лікуванням смертності та загальної смертності у хворих, які приймали Г-КСФ. Інше ретроспективне міжнародне дослідження пацієнтів з гострою та хронічною формами мієлоїдного лейкозу не виявило підвищеного ризику реакцій «трансплантат проти хазяїна», а також пов'язаної з лікуванням смертності та загальної смертності у хворих. Мета-аналіз досліджень алогенних трансплантатів, включаючи результати 9 проспективних рандомізованих досліджень, 8 ретроспективних досліджень та одне дослідження «випадок-контроль», не виявив впливу препарату на ризик гострої чи хронічної реакції «трансплантат проти хазяїна» або пов'язаних з лікуванням випадків ранньої смертності.
Призначення здоровим донорам ТеваГрастиму по 10 мкг/кг маси тіла/добу підшкірно щоденно протягом 4-5 днів зазвичай дозволяє при проведенні 2-х лейкаферезів одержати кількість ПСКК, яка дорівнює 4×106 CD34+-клітин/кг маси тіла реципієнта.
У дітей та дорослих з тяжкою хронічною нейтропенією (уродженою, періодичною або ідіопатичною) ТеваГрастим стабільно збільшує кількість нейтрофілів у периферичній крові, зменшує частоту інфекцій і пов'язаних з ними ускладнень.
Призначення ТеваГрастиму пацієнтам з ВІЛ-інфекцією дозволяє підтримувати нормальний рівень нейтрофілів, що сприяє планомірному проведенню противірусної та/або мієлосупресивної терапії. Не відмічено ознак збільшення реплікації ВІЛ при лікуванні філграстимом.
Як і інші гемопоетичні фактори росту, ТеваГрастим стимулює in vitro проліферацію ендотеліальних клітин людини.
Ефективність та безпека ТеваГрастиму була оцінена в рандомізованих, контрольованих клінічних дослідженнях фази ІІІ раку грудей, легенів та неходжкінської лімфоми. Не було значущої різниці між ТеваГрастимом та референтним препаратом щодо тривалості тяжкої нейтропенії та частотності фебрильної нейтропенії.
Фармакокінетика. Рандомізовані, сліпі, однодозові, перехресні клінічні дослідження на
196 здорових волонтерах продемонстрували зпівставність фармакокінетичного профілю ТеваГрастиму та референтого препарату при підшкірному або внутрішньовенному застосуванні.
Як при підшкірному, так і при внутрішньовенному введенні препарату елімінація ТеваГрастиму відбувається за правилами кінетики 1-го порядку.
Середнє значення періоду напіввиведення ТеваГрастиму з сироватки крові становить близько 3,5 години, кліренс дорівнює 0,6 мл/хв/кг. При тривалому застосуванні ТеваГрастиму (до 28 днів) після аутологічної трансплантації кісткового мозку не спостерігалося ознак кумуляції і збільшення періоду напіввиведення.
При внутрішньовенному і підшкірному введенні ТеваГрастиму спостерігається позитивна лінійна залежність між дозою та концентрацією в сироватці крові. Після підшкірного введення терапевтичних доз ТеваГрастиму його концентрація в сироватці крові перевищує 10 нг/мл протягом 8-16 годин. Об'єм розподілу становить близько 150 мл/кг.
В онкохворих фармакокінетичний профіль ТеваГрастиму був зпівставний з референтним препаратом при одноразовому та повторному підшкірному застосуванні.
Клінічні характеристики.
Показання.
· Скорочення тривалості нейтропенії і зменшення частоти фебрильної нейтропенії у хворих, які отримують цитотоксичну хіміотерапію з приводу злоякісних захворювань (за винятком хронічного мієлолейкозу і мієлодиспластичного синдрому).
· Скорочення тривалості нейтропенії у хворих, які отримують мієлоаблативну терапію з наступною трансплантацією кісткового мозку, з високим ризиком пролонгованої тяжкої нейтропенії.
· Мобілізація периферичних стовбурових клітин крові (ПСКК).
· Довготривала терапія для збільшення кількості нейтрофілів і зменшення частоти і тривалості інфекційних ускладнень у дітей та дорослих з тяжкою уродженою, періодичною або ідіопатичною нейтропенією (абсолютна кількість нейтрофільних гранулоцитів ≤ 0,5×109/л) та тяжкими або рецидивуючими інфекціями в анамнезі.
· Зменшення ризику бактеріальних інфекцій при стійкій нейтропенії (абсолютна кількість нейтрофілів не більше 1,0×109/л) у пацієнтів з розгорнутою стадією ВІЛ-інфекції у разі неефективності інших засобів контролю нейтропенії.
Протипоказання.
ТеваГрастим протипоказаний особам з відомою гіперчутливістю до гранулоцитарного колонієстимулюючого фактора людини або інших компонентів ТеваГрастиму.
Особливі заходи безпеки.
Знищення залишків невикористаного препарату необхідно проводити згідно з національними вимогами. На шприци без пристрою для безпечного введення не потрібно одягати ковпачок на вже використану голку. Використані шприци складають в контейнер з міцними стінками та тримають його в недоступному для дітей місці. Заповнений контейнер знищують згідно з національними вимогами. Забороняється викидати використані шприци у відро для сміття.
Шприци з пристроєм для безпечного введення: захисний пристрійпопереджує можливість нанесення поранень після використання, тому не потребує жодних особливих заходів утилізації. Шприци з пристроєм для безпечного введення знищують згідно з національними вимогами.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Безпечність та ефективність введення філграстиму в один і той же день з мієлосупресивними цитотоксичними препаратами не встановлені. Через чутливість мієлоїдних клітин, що діляться швидко, до мієлосупресивної цитотоксичної хіміотерапії призначати філграстим в інтервалі за 24 години до або після введення цих препаратів не рекомендується. При одночасному призначенні філграстиму і 5-фторурацилу тяжкість нейропенії може збільшитись.
Можлива взаємодія з іншими гемопоетичними факторами росту і цитокінами не вивчалась в клінічних дослідженнях.
Враховуючи той факт, що літій стимулює вихід нейтрофілів, можливе посилення дії філграстиму при комбінованому призначенні. Хоча дослідження такої взаємодії не проводились, не існує доказів шкідливого впливу цієї взаємодії.
Особливості застосування.
Не слід призначати ТеваГрастим для збільшення дозування цитотоксичної хіміотерапії понад встановлені межі.
Не слід призначати ТеваГрастим пацієнтам з тяжкою формою вродженої нейтропенії (синдром Koстмана) з цитогенетичними порушеннями.
Хворі на злоякісні мієлоїдні пухлини
Ріст злоякісних клітин
Філграстим може спричиняти ріст мієлоїдних клітин in vitro. Аналогічні ефекти можуть спостерігатися і для деяких немієлоїдних клітин in vitro.
Безпека та ефективність застосування філграстиму у хворих з мієлодиспластичним синдромом і хронічним мієлолейкозом не встановлені. ТеваГрастим не рекомендується до застосування при цих захворюваннях. Особлива увага повинна звертатися на диференційну діагностику між бластним кризом хронічного мієлолейкозу та гострим мієлолейкозом.
Безпека та ефективність застосування філграстиму у хворих із вторинним гострим мієлолейкозом досліджені недостатньо, тому призначати їм лікарський засіб ТеваГрастим слід з обережністю.
Не встановлені безпека та ефективність застосування філграстиму при de novo гострому мієлолейкозі у хворих, молодше 55 років, у разі прогностично сприятливих цитогенетичних факторів (t (8;21), t (15;17) та inv (16)).
Інші заходи безпеки
Хворим із супутніми кістковою патологією та остеопорозом, які одержують безперервне лікування препаратом ТеваГрастим протягом більше 6 місяців, показаний контроль щільності кісткової речовини.
Повідомлялося про рідкісні небажані реакції з боку легень, зокрема інтерстиціальну пневмонію, при застосуванні Г-КСФ. Ризик може бути вищим у пацієнтів, які нещодавно мали легеневі інфільтрати або пневмонію. При лікуванні філграстимом можливий розвиток респіраторного дистрес-синдрому дорослих (РДСД), першими ознаками якого можуть бути кашель, гарячка та задишка, у поєднанні з легеневими інфільтратами, які виявляються рентгенологічно, і розлад функції дихання. У цьому випадку слід відмінити ТеваГрастим і призначити необхідне лікування.
Синдром підвищеної проникності капілярів
Повідомлялось про випадки синдрому підвищеної проникності капілярів після вживання гранулоцитарного колонієстимулюючого фактора людини, цей стан супроводжувався гіпотонією, гіпоальбумінемією, набряком та загустінням крові. Стан пацієнтів, у яких виявлено ознаки синдрому підвищеної проникності капілярів, необхідно ретельно контролювати та забезпечити їм стандартне симптоматичне лікування, що може включати інтенсивну терапію.
Онкологічні хворі
Лейкоцитоз
У менш ніж 5 % хворих, що одержували ТеваГрастим у дозах понад 0,3 МО (3 мкг/кг на добу), число лейкоцитів збільшувалося до 100×109/л і більше. Будь-яких побічних явищ, що безпосередньо були пов'язані з таким лейкоцитозом, не описано. Враховуючи можливий ризик, пов'язаний з високим лейкоцитозом, під час лікування препаратом ТеваГрастим потрібно регулярно контролювати кількість лейкоцитів.Якщо кількість лейкоцитів після проходження лікування перевищить очікуваний мінімум 50×109/л, препарат ТеваГрастим слід негайно відмінити. Однак, якщо філграстим застосовується для мобілізації ПСКК, препарат відміняють або знижують дозу при перевищенні кількості лейкоцитів 70×109/л.
Ризик, пов'язаний з високодозовою хіміотерапією
Особливу обережність слід виявляти при лікуванні хворих, які одержують високодозову хіміотерапію, оскільки в цих випадках результативність лікування не встановлена, в той час як підвищені дози хіміопрепаратів виявляли більш виражену токсичність, призводячи до розвитку серцевих, легеневих, неврологічних і дерматологічних реакцій.
Монотерапія філграстимом не запобігає тромбоцитопенії та анемії, зумовленим мієлосупресивною хіміотерапією. Внаслідок можливості застосування більш високих доз хіміопрепаратів (наприклад, повні дози відповідно до схем) хворий може піддаватися більш високому ризику розвитку тромбоцитопенії та анемії, тому рекомендується регулярно визначати кількість тромбоцитів та гематокрит. З особливою обережністю слід застосовувати однокомпонентні або комбіновані хіміотерапевтичні схеми, які можуть викликати тяжку тромбоцитопенію.
Застосування ПСКК, мобілізованих за допомогою філграстиму, зменшує вираженість і тривалість тромбоцитопенії після мієлосупресивної або мієлоаблативної хіміотерапії.
Інші заходи безпеки
Дія філграстиму у хворих зі значно зниженою кількістю мієлоїдних клітин-попередників не вивчалася. Препарат збільшує кількість нейтрофілів шляхом впливу, перш за все, на клітини-попередники нейтрофілів. Тому у хворих з незначною кількістю клітин-попередників (наприклад, які піддавалися інтенсивній променевій терапії або хіміотерапії, а також при пухлинній інфільтрації кісткового мозку) ступінь збільшення кількості нейтрофілів може бути знижений.
Повідомлялося про розвиток реакції «трансплантат проти хазяїна» (ТПХ) з летальними наслідками у хворих, що застосовували гранулоцитарний колонієстимулюючий фактор після алогенної трансплантації кіскового мозку.
Повідомлялося про підвищену гемопоетичну активність кісткового мозку у відповідь на лікування гранулоцитарним колонієстимулюючим фактором, що проявлялась у тимчасово позитивних результатах сканування кісток. Це слід враховувати при інтерпретації результатів сканування кісток.
Хворі, які проходять мобілізацію периферичних стовбурових клітин крові (ПСКК)
Мобілізація
Проспективне рандомізоване порівняння двох рекомендованих методів мобілізації (лише філграстим або в комбінації з мієлосупресивною терапією) на одній і тій же популяції хворих не проводилось. Індивідуальні особливості хворих у різних дослідженнях і ступінь розходження результатів лабораторного визначення кількості CD34+-клітин утруднюють безпосереднє порівняння результатів цих досліджень. Тому оптимальний метод рекомендувати важко. Вибір методу мобілізації слід проводити залежно від мети лікування цього хворого.
До призначення цитотоксичних засобів
У хворих, яким в минулому проводилася активна мієлосупресивна терапія, може не відбуватися достатньої активації ПСКК до рекомендованого мінімального рівня (2,0×106 CD34+-клітин/кг) або прискорення нормалізації кількості тромбоцитів.
Деякі цитостатики мають особливу токсичність відносно клітин-попередників гемопоезу і можуть негативно впливати на їх мобілізацію. Такі препарати, як мелфалан, кармустин і карбоплатин, якщо вони призначалися протягом тривалого часу до спроб мобілізації стовбурових клітин, можуть знижувати її ефективність. Однак застосування мелфалану, карбоплатину або кармустину сумісно з філграстимом виявилося ефективним при активації стовбурових клітин. Якщо планується трансплантація ПСКК, рекомендується запланувати мобілізацію стовбурових клітин на ранній стадії курсу лікування. Особливу увагу слід звернути на кількість стовбурових клітин, активованих у таких хворих до високодозової хіміотерапії. Якщо результати мобілізації відповідно до вищенаведених критеріїв є недостатніми, слід розглянути альтернативні види лікування, які не вимагають застосування клітин-попередників.
Оцінка кількості мобілізованих периферичних стовбурових клітин крові
Оцінюючи кількість ПСКК, мобілізованих у хворих за допомогою філграстиму, слід приділити особливу увагу методу кількісного визначення. Результати протокового цитометричного аналізу кількості CD34+-клітин відрізняються залежно від конкретної методики, тому слід з обережністю ставитися до рекомендацій з їх кількості, заснованих на дослідженнях, проведених в інших лабораторіях.
Швидкість нормалізації кількості тромбоцитів після високодозової хіміотерапії залежить від кількості введених в реінфузію CD34+-клітин. Рекомендована мінімальна кількість ПСКК становить 2,0×106 CD34+-клітин/кг. Кількість клітин-попередників, більша за це значення, судячи з усього, супроводжується більш швидкою нормалізацією, тоді як кількість, менша за вказану – більш повільною нормалізацією складу крові.
Здорові донори, які проходять мобілізацію ПСКК
Мобілізація ПСКК не забезпечує прямої клінічної користі для здорових донорів і повинна розглядатись лише у якості алогенної трансплантації стовбурових клітин.
Мобілізація ПСКК може проводитися у донорів лише у разі відповідності звичайним клінічним та лабораторним критеріям донорства клітин-попередників гемопоезу, особливо слід звертати увагу на гематологічні показники і наявність інфекційних хвороб.
Безпека та ефективність застосування філграстиму у здорових донорів віком до 16 років або старше 60 років не оцінювалася.
Транзиторна тромбоцитопенія (кількість тромбоцитів менше 100×109/л) після застосування філграстиму і проведення лейкаферезу спостерігається у 35 % донорів. Крім того, було зареєстровано 2 випадки тромбоцитопенії менше 50×109/л після проведення процедури лейкаферезу.
За необхідності проведення більш ніж одного лейкаферезу особлива увага повинна звертатися на донорів, у яких кількість тромбоцитів до лейкаферезу становить менше 100×109/л.
Проведення лейкаферезу не рекомендується, якщо кількість тромбоцитів менше 75×109/л при призначенні антикоагулянтів та відомих порушеннях гемостазу.
Препарат слід відмінити або дозу препарату зменшити, якщо кількість лейкоцитів більше 70×109/л.
За донорами, які приймали філграстим для мобілізації ПСКК, потрібно спостерігати до нормалізації гематологічних показників.
У донорів, які отримують Г-КСФ, спостерігались тимчасові цитогенетичні порушення. Значущість цих змін в плані розвитку злоякісних гематологічних пухлин невідома. Довгостроковий нагляд за станом здоров'я таких донорів триває. Крім того, не виключений ризик стимуляції злоякісного мієлоїдного клону. Центрам аферезу рекомендується реєструвати і проводити спостереження за донорами ПСКК протягом принаймні 10 років для забезпечення подальшого збору даних щодо безпеки застосування препарату.
Поширені, але зазвичай асимптоматичні випадки спленомегалії та поодинокі випадки розриву селезінки було зафіксовано у здорових донорів та пацієнтів, які застосовували Г-КСФ. Декілька випадків розриву селезінки були смертельними. У зв'язку з цим у таких пацієнтів рекомендується контролювати розміри селезінки (пальпація, УЗД). Слід мати на увазі можливість розриву селезінки при скаргах на біль у верхній лівій частині живота або в лівому плечі.
У постмаркетинговий період повідомлялося про рідкісні легеневі побічні реакції (кровохаркання, легенева кровотеча, інфільтрати в легенях, диспное та гіпоксія) у здорових донорів. У разі підозри на легеневі побічні реакції або їх підтвердженні лікування філграстимом необхідно припинити та призначити відповідне лікування.
Реципієнти алогенних ПСКК, мобілізованих філграстимом
Наявні дані свідчать про те, що імунологічній взаємодії алогенних ПСКК і реципієнта властивий більший ступінь ризику розвитку гострої реакції трансплантата проти господаря порівняно з трансплантацією кісткового мозку.
Пацієнти з ТХН
Дослідження складу крові
Необхідно ретельно контролювати кількість тромбоцитів, особливо протягом перших кількох тижнів лікування філграстимом. Якщо у хворого виявляється тромбоцитопенія (кількість тромбоцитів стабільно нижча за 100000/мм3), слід розглянути питання про тимчасову відміну препарату або зменшення дози. Можуть спостерігатися й інші зміни формули крові, в тому числі анемія і тимчасове збільшення кількості мієлоїдних клітин-попередників, які вимагають її ретельного контролю.
Трансформація у лейкоз або мієлодиспластичний синдром
Особливу обережність слід виявляти у разі діагностики тяжких хронічних нейтропеній. Необхідно диференціювати їх від інших гематологічних захворювань, таких як апластична анемія, мієлодисплазія та мієлолейкоз. До початку лікування слід провести повний клінічний аналіз крові з визначенням лейкоцитарної формули та кількості тромбоцитів, а також дослідити морфологічну картину кісткового мозку і каріотип.
У клінічних дослідженнях лише у невеликої кількості (3 %) хворих з тяжкою хронічною нейтропенією, що отримували філграстим, спостерігались мієлодиспластичний синдром (МДС) або лейкоз. Мієлодиспластичний синдром і лейкоз є звичайними ускладненнями даного захворювання; їхній зв'язок із лікуванням філграстимом не визначений. Близько у 12 % хворих з вихідною нормальною цитогенетикою при повторних дослідженнях виявились аномалії, у тому числі моносомія 7. Якщо у хворих з ТХН з'являються цитогенетичні порушення, необхідно ретельно оцінити переваги і ризик продовження терапії. При розвитку мієлодиспластичного синдрому (МДС) або лейкозу препарат ТеваГрастим слід відмінити. На сьогодні не встановлено, чи сприяє тривале лікування філграстимом хворих з тяжкою хронічною нейтропенією розвитку цитогенетичних аномалій, МДС та лейкозу. Таким хворим рекомендується регулярно (приблизно кожні 12 місяців) проводити морфологічні та цитогенетичні дослідження кісткового мозку.
Інші випадки
Слід виключити такі причини тимчасової нейтропенії, як вірусні інфекції.
Збільшення селезінки є прямим наслідком лікування філграстимом. Під час клінічних досліджень у 31 % хворих з тяжкою нейтропенією при пальпації виявлялась спленомегалія. При рентгенографії збільшення об'єму виявляється незабаром після початку лікування і має тенденцію до стабілізації. Зменшення дози сповільнює або зупиняє збільшення селезінки; трьом відсоткам хворих була потрібна спленектомія. Розміри селезінки необхідно контролювати регулярно, для виявлення аномального збільшення об'єму селезінки достатньо здійснити пальпацію живота.
У незначної кількості хворих виявлялися гематурія та/або протеїнурія, для контролю за ними слід регулярно проводити лабораторне дослідження сечі.
Безпека та ефективність застосування препарату у новонароджених та хворих з аутоімунною нейтропенією не встановлені.
ВІЛ-інфекція
Дослідження клітин крові
Слід ретельно контролювати кількість нейтрофілів, особливо протягом перших кількох тижнів лікування філграстимом. У деяких пацієнтів вже після першої ін'єкції дуже швидко виявляється лікувальний ефект і кількість нейтрофілів значно збільшується. Рекомендується проводити контроль кількості нейтрофілів у перші 2-3 дні лікування філграстимом щоденно, потім – в перші два тижні після лікування не рідше 2 разів на тиждень, і під час підтримуючого лікування – щонайменше один раз на тиждень або на 2 тижні.
Якщо доза 30 млн. МО (300 мкг) на добу вводиться пацієнту не щоденно, через деякий час починаються сильні коливання кількості нейтрофілів. Для визначення зменшення кількості нейтрофілів або дійсного мінімального їх рівня рекомендується брати для аналізу зразки крові пацієнта безпосередньо перед введенням чергової дози препарату.
Ризик у зв'язку з високодозовою мієлосупресивною терапією
Монотерапія філграстимом не запобігає тромбоцитопенії та анемії, зумовленим мієлосупресивною хіміотерапією. Внаслідок можливості застосування разом із філграстимом більшої кількості хіміопрепаратів або їхніх високих доз, хворий може піддаватися більшому ризику розвитку тромбоцитопенії та анемії, у зв'язку з чим рекомендується регулярно визначати кількість клітин крові (див. вище).
Інфекції та злоякісні захворювання, які спричиняють мієлосупресію
Нейтропенія може бути обумовлена інфільтрацією кісткового мозку збудниками опортуністичних інфекцій (такими як бактерії групи Mycobacterium avium) або пухлинами (лімфома). Таким хворим окрім призначення філграстиму слід застосовувати специфічне лікуваня.Вплив філграстиму на нейтропенію, спричинену інфекційними збудниками або злоякіснии пухлинами кісткового мозку, досліджений недостатньо.
Хворі з серпоподібно-клітинною анемією
Є дані про кризи серповидних клітин при використанні філграстиму для лікування хворих із серпоподібноклітинною анемією, іноді навіть смертельні. Тому хворим із серпоподібноклітинною анемією філграстим слід призначати з обережністю і лише після ретельного порівняння переваг і ризиків від його використання.
Інше
1 мл розчину ТеваГрастим містить 50 мг сорбіту. Хворим із рідкісною спадковою непереносимістю фруктози не рекомендовано застосовувати препарат.
1 попередньо заповнений шприц ТеваГрастиму містить менш ніж 1 ммоль (23 мг) натрію, тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю.
Вагітність. Немає адекватних даних щодо застосування філграстиму у вагітних. Існують повідомлення про проходження філграстиму через плацентарний бар'єр. Дослідження на тваринах продемонстрували репродуктивну токсичність. Потенційний ризик для людини невідомий. Філграстим не слід застосовувати у період вагітності окрім життєво необхідних випадків.
Годування груддю. Невідомо, чи проникає ТеваГрастим в молоко людини. Тому не рекомендується застосування препарату в період годування груддю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Філграстим має мінімальний або середній вплив на здатність керувати автотранспортом або працювати з іншими механізмами. Якщо пацієнт відчуває втому, рекомендується бути пильним під час керування автотранспортом або роботи з іншими механізмами.
Спосіб застосування та дози.
Лікування повинно проходити у співпраці з онкологічним центром, що має необхідне діагностичне обладнання і достатній досвід роботи в області гематології та лікуванні із застосуванням гранулоцитарного колонієстимулюючого фактору людини. Процедури мобілізації та аферезу клітин повинні проводитися спеціалістами з достатнім досвідом роботи в цій галузі і можливості адекватного моніторингу клітин-попередників гемопоезу.
Препарат ТеваГрастим за потреби розводять 5 % (50 мг/мл) розчином глюкози для інфузій.
Розведення до фінальної концентрації менше, ніж 0,2 млн. МО (2 мкг)/мл не рекомендується ні за яких умов.
Розчин повинен бути візуально перевірений перед застосуванням. Тільки прозорий розчин без видимих часточок може бути використаний.
Якщо ТеваГрастим розводиться до концентрації менше 1,5 млн. МО (15 мкг)/мл, для запобігання адсорбції необхідно додавати сироватковий альбумін людини в такій кількості, щоб кінцева концентрація становила 2 мг/мл. Наприклад, при розведенні загальної дози ТеваГрастиму менше 30 млн. МО (300 мкг) до кінцевого об'єму розчину 20 мл слід додати 0,2 мл 20 % розчину альбуміну людини.
ТеваГрастим не містить консервантів. Тому через можливий ризик мікробного зараження, шприци з препаратом призначені тільки для одноразового застосування.
Розведений 5 % розчином глюкози, ТеваГрастим сумісний зі склом та рядом пластмас, у тому числі з полівінілхлоридом (ПВХ), поліолефіном (співполімер поліпропілену та поліетилену) і поліпропіленом.
Хімічна та фізична стабільність розведеного розчину для інфузій – 24 години при температурі від 2 до 8 °С. З мікробіологічної точки зору, препарат треба застосовувати негайно. В іншому випадку, час та умови зберігання до використання є відповідальністю користувача, та, зазвичай, становлять не більше 24 годин при температурі від 2 до 8 °С, якщо тільки розведення не було проведене в контрольованих та валідованих асептичних умовах.
Випадкове одноразове замороження шприців не впливає на стабільність ТеваГрастиму.
Звичайна цитотоксична хіміотерапія
Рекомендована доза ТеваГрастиму складає 0,5 млн. МО (5 мкг)/кг маси тіла один раз на добу. Першу дозу слід вводити не раніше ніж через 24 години після закінчення курсу цитотоксичної хіміотерапії. Препарат ТеваГрастим можна вводити шляхом щоденних підшкірних ін'єкцій або щоденних коротких (30-хвилинних) внутрішньовенних інфузій на 5 % розчині глюкози. Більш бажаним є підшкірний шлях введення, оскільки є дані з клінічних випробувань однодозового застосування про те, що при внутрішньовенному введенні дія філграстиму може скорочуватися. Клінічна релевантність цих даних по відношенню до багатодозового застосування нез'яcована. Шлях введення повинен залежати від індивідуальних клінічних даних пацієнта. В рандомізованих клінічних дослідженнях використовувалась доза 23 млн. МО (230 мкг)/м2/добу (4,0-8,4 мкг/кг маси тіла на добу) підшкірним введенням.
Профіль безпечності та ефективності філграстиму однаковий для дорослих і дітей, що проходять курс цитотоксичної хіміотерапії.
Відкриття шприца та переважні ділянки тіла для підшкірного введення ТеваГрастиму:
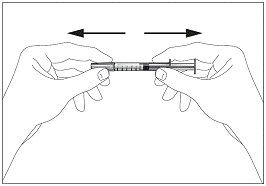 1a
1a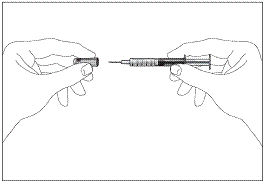 1b
1b
Шприц без пристрою для безпечного введення та запобігання поранень
голкою чи повторного використання (рис. 1а, 1b)
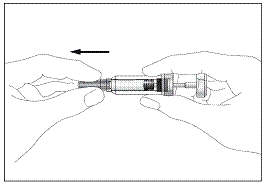 2a
2a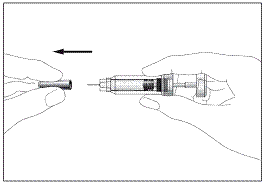 2b
2b
Шприц з пристроєм для безпечного введення та запобігання
поранень голкою чи повторного використання(рис. 2а, 2b)
 3
3 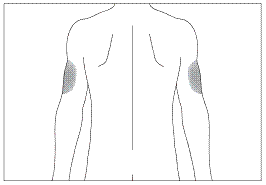 4
4
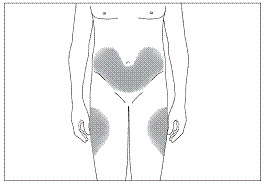
Переважні ділянки тіла для підшкірного введення (рис. 3, 4)
 5
5
 6
6 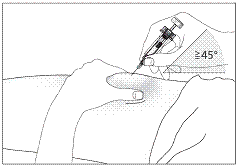 7
7
Підшкірне введення препарату:
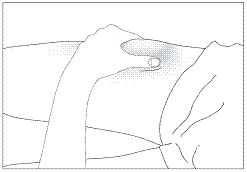
1. Продезінфікуйте місце введення серветкою, змоченою в спиртовому розчині.
Затисніть ділянку шкіри між великим та вказівним пальцями, не стискаючи її (рис. 5).
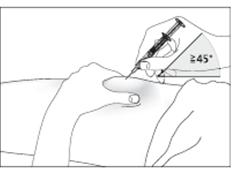
2. Введіть голку на всю довжину в шкіру (рис. 6 для введення шприца без захисного пристрою; рис. 7 для введення шприца з захисним пристроєм).
3. Злегка потягніть на себе поршень шприца, щоб перевірити, чи при введенні не проколено кровоносну судину. У випадку, якщо ви помітили кров у шприці, витягніть голку та введіть її повторно в іншу ділянку шкіри.
Слід вводити препарат щоденно в один і той же час.
Для уникнення болю краще за все щоденно міняти місце введення.
Шприци без пристрою для безпечного введення
Вводити препарат необхідно повільно та рівномірно, затиснувши шкіру між пальцями.
· Після введення препарату, спочатку витягують голку, а потім відпускають шкіру.
Для кожної наступної ін'єкції використовують окремий шприц. Забороняється повторне введення ТеваГрастиму, що залишився у шприці.
 8
8
Шприци з пристроєм для безпечного введення
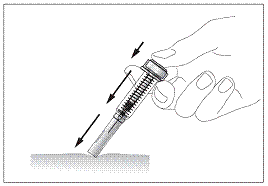
Вводити препарат необхідно повільно та рівномірно, затиснувши шкіру між пальцями, до повного введення дози та зупинки руху поршня шприца.
Забороняється прикладати надмірну силу при натисканні на поршень.
· Після введення препарату, витягують голку, продовжуючи натискати пальцем на поршень, а потім відпускають шкіру (рис. 8).
· Знімають палець з поршня. Захисний пристрій шприца швидко опуститься на голку, щоб закрити її.
Для кожної наступної ін'єкції використовують окремий шприц. Забороняється повторне введення ТеваГрастиму, що залишився у шприці.
Препарат ТеваГрастим вводять щоденно доти, доки кількість нейтрофілів після очікуваного зниження не перевищить очікуваний мінімум і не досягне діапазону нормальних значень. У хворих, які одержують цитотоксичну хіміотерапію з приводу солідних пухлин, лімфом і лімфолейкозу, тривалість терапії становить до 14 днів. Після індукційної та консолідаційної терапії гострого мієлолейкозу тривалість застосування ТеваГрастим може збільшитися до 38 днів. Тривалість лікування препаратом ТеваГрастим залежить від типу, доз і схеми цитотоксичної хіміотерапії, яку застосовують.
Звичайно тимчасове збільшення кількості нейтрофілів спостерігається через 1-2 дні після початку лікування філграстимом. Для досягнення стабільного терапевтичного ефекту необхідно продовжувати терапію лікарським засобом ТеваГрастим доти, доки кількість нейтрофілів не перевищить очікуваний мінімум і не досягне нормального рівня. Не рекомендується відміняти лікування передчасно, до зміни кількості нейтрофілів.
Хворі, які одержують мієлоаблативну терапію з наступною трансплантацією кісткового мозку
Рекомендована початкова доза складає 1,0 млн. МО (10 мкг)/ кг маси тіла на добу шляхом 30-хвилинної або безперервної 24-годинної внутрішньовенної інфузії або безперервної 24-годинної підшкірної інфузії.
Для внутрішньовенної та підшкірної інфузії препарату ТеваГрастим розводять 20 мл 5 % розчину глюкози.
Першу дозу ТеваГрастиму слід вводити не раніше, ніж через 24 години після проведення цитотоксичної хіміотерапії і не пізніше, ніж через 24 години після трансплантації кісткового мозку.
Після максимального зниження кількості нейтрофілів добова доза коригується залежно від зміни кількості нейтрофілів таким чином:
|
Кількість нейтрофілів |
Доза ТеваГрастиму |
|
> 1,0×109/л протягом 3-х днів поспіль |
Зменшують до 0,5 млн МО (5 мкг)/кг/добу |
|
Потім, якщо АКН залишається > 1,0×109/л протягом наступних 3-х днів поспіль |
Філграстим відміняють |
|
Якщо під час лікування абсолютна кількість нейтрофілів знижується до рівня |
|
Мобілізація периферичних стовбурових клітин крові (ПСКК)
Мобілізація периферичних стовбурових клітин крові (ПСКК) у пацієнтів, які одержують мієлосупресивну або мієлоаблативну терапію з наступною аутологічною трансплантацією ПСКК
Для мобілізації периферичних стовбурових клітин крові (ПСКК) рекомендована доза становить 1,0 млн. МО (10 мкг)/кг на добу у вигляді безперервної 24-годинної підшкірної інфузії або шляхом підшкірної ін'єкції 1 раз на добу протягом 5-7 днів поспіль.Для інфузії лікарський засіб ТеваГрастим розводять 20 мл 5 % розчину глюкози. Зазвичай досить одного або двох лейкаферезів на 5-й або 6-й день. У разі додаткового лейкаферезу призначення препарату ТеваГрастим в тій же дозі необхідно продовжувати до завершуючого лейкаферезу.
Для мобілізації ПСКК після мієлосупресивної хіміотерапії рекомендована доза становить 0,5 млн. МО (5 мкг)/кг на добу шляхом щоденних підшкірних ін'єкцій, починаючи з першого дня після завершення хіміотерапії і доти, доки кількість нейтрофілів не зміниться і не досягне нормальних значень. Лейкаферез слід проводити протягом періоду зростання кількості нейтрофілів з менше 0,5×109/л до більше 5,0×109/л. Хворим, які не одержували інтенсивної хіміотерапії, іноді достатньо лише одного лейкаферезу. В окремих випадках рекомендується проводити додаткові лейкаферези.
Мобілізація периферичних стовбурових клітин крові (ПСКК) у здорових донорів для алогенної трансплантації ПСКК
Рекомендована доза – 1,0 млн. МО (10 мкг)/кг на добу підшкірно протягом 4-5 днів поспіль. Лейкаферез проводять з 5-го дня до 6-го дня з метою одержання 4×106 CD34+-клітин/кг маси тіла реципієнта.
Хворі з тяжкою хронічною нейтропенією (ТХН)
Уроджена нейтропенія
ТеваГрастим призначається в початковій дозі 1,2 млн. МО (12 мкг)/кг на добу шляхом підшкірної ін'єкції одноразово або за кілька введень.
Ідіопатична або періодична нейтропенія
ТеваГрастим призначається в початковій дозі 0,5 млн. МО (5 мкг)/кг на добу підшкірно одноразово або за кілька введень.
Корекція дози
Препарат ТеваГрастим вводять щоденно шляхом підшкірної ін'єкції до досягнення стабільного перевищення кількості нейтрофілів 1,5×109/л. Після досягнення терапевтичного ефекту визначають мінімальну ефективну дозу для підтримання цього рівня. Для підтримання необхідної кількості нейтрофілів потрібне тривале щоденне введення препарату. Через 1 чи 2 тижні лікування початкову дозу можна подвоїти або зменшити вдвічі, залежно від ефекту терапії. Далі кожні 1-2 тижні проводять індивідуальну корекцію дози для підтримання середньої кількості нейтрофілів в діапазоні від 1,5×109/л до 10×109/л. У хворих з тяжкими інфекціями можна застосувати схему з більш швидким збільшенням дози. В клінічних дослідженнях 97 % пацієнтів дали повну відповідь після введення дози
≤ 2,4 млн. МО (24 мкг)/кг на добу. Безпека застосування філграстиму при тривалому лікуванні хворих з ТХН дозами, вищими ніж 2,4 млн. МО (24 мкг)/кг на добу, не встановлена.
Пацієнти з ВІЛ-інфекцією
Для відновлення кількості нейтрофілів
Рекомендована початкова доза становить 0,1 млн. МО (1 мкг)/кг на добу щоденно шляхом одноразової підшкірної ін'єкції, зі збільшенням дози максимально до 0,4 млн. МО (4 мкг)/кг на добу до нормалізації кількості нейтрофілів (більше 2,0×109/л). В клінічних дослідженнях більше 90 % пацієнтів відповіли на це дозування, досягнувши відновлення кількості нейтрофілів в середньому за 2 доби.
У незначної кількості пацієнтів (менше 10 %), вистачило дози до 0,1 млн. МО (1 мкг)/кг на добу для досягнення відновлення кількості нейтрофілів.
Для підтримання нормальної кількості нейтрофілів
По закінченні нейтропенії визначають мінімальну ефективну дозу препарату для підтримання нормальної кількості нейтрофілів. Рекомендується починати з введення 30 млн. МО (300 мкг) на добу підшкірно через день. В подальшому може бути потрібна індивідуальна корекція дози залежно від рівня нейтрофілів у пацієнта для необхідності підтримувати кількість нейтрофілів більше 2,0×109/л. В клінічних дослідженнях доза в 30 млн. МО (300 мкг) на добу з 1 по 7 день була достатньою для підтримки кількості нейтрофілів більше 2,0×109/л, з середньою частотністю введення 3 рази на тиждень. Іноді для підтримання кількості нейтрофілів більше 2,0×109/л потрібне тривале призначення препарату.
Застосування у дітей з тяжкою хронічною нейтропенією (ТХН) та онкологічними захворюваннями
65 % пацієнтів, що брали участь у программі клінічних досліджень лікування ТХН, були віком молодше 18 років. Ефективність лікування була очевидна для цієї вікової групи, яка включала більшість пацієнтів з уродженою нейтропенією. Не було різниці в профілях безпеки для дітей, що лікувались від тяжкої хронічної нейтропенії.
Клінічні дослідження продемонстрували однакову ефективність та безпечність філграстиму у дорослих та дітей, що отримують цитотоксичну хіміотерапію.
Рекомендації по дозуванню для дітей такі ж, як і для дорослих, що отримують мієлосупресивну цитотоксичну хіміотерапію.
Застосування у хворих літнього віку
Клінічні дослідження ТеваГрастиму включали невелику кількість пацієнтів літнього віку, але спеціальних досліджень застосування в цій групі хворих не проводилось, таким чином специфічних рекомендацій щодо дозування зробити неможливо.
Застосування у хворих з порушенням функції нирок або печінки
Хворі з тяжким порушеннями функції нирок або печінки не потребують корекції дози, оскільки дослідження продемонструвли, що їхні фармакокінетичні та фармакодинамічні показники подібні до таких у здорових пацієнтів.
Діти.
Дані клінічних випробувань свідчать про те, що безпека та ефективність лікування ТеваГрастимом ідентичні як для дорослих, так і для дітей, які отримують цитотоксичну хіміотерапію.
Рекомендована доза для дітей та дорослих, що отримують мієлосупресивну цитотоксичну хіміотерапію, однакова.
Передозування.
Про випадки передозування ТеваГрастимом не повідомлялося, тому дію препарату при передозуванні не встановлено. Після відміни препарату кількість циркулюючих нейтрофілів зазвичай знижується на 50 % протягом 1-2 днів і потім повертається до норми протягом
1-7 днів.
Побічні реакції.
У клінічних дослідженнях брали участь 541 онкологічних хворих та 188 здорових добровольців, яким застосовували ТеваГрастим. Профіль безпеки ТеваГрастиму у цих клінічних дослідженнях відповідав референтному препарату.
Після застосування гранулоцитарного колонієстимулюючого фактора у онкохворих, які проходили хіміотерапію та здорових донорів, які проходили мобілізацію ПСКК, спостерігалися непоширені випадки (від ≥ 1/1000 до < 1/100) синдрому підвищеної проникності капілярів, які можуть становити загрозу життю у разі відсутності своєчасного лікування.
На основі опублікованої інформації повідомлялося про наступні побічні реакції з частотою:
Дуже поширені: > 1/10
Поширені: > 1/100, < 1/10
Непоширені: > 1/1000, < 1/100
Рідкісні: > 1/10000, < 1/1000
Дуже рідкісні: < 1/10000;
Невідомі не можуть бути оцінені з наявних даних
В кожній підгрупі, розподіленій за частотою, побічні реакції розміщені в порядку зменшення серйозності.
В онкологічних хворих
У клінічних дослідженнях найчастішою побічною реакцією, що спостерігалась при застосуванні філграстиму в рекомендованих дозах, був від легкого або помірного (у 10 % пацієнтів) до тяжкого (у 3 % пацієнтів) кістково-м'язовий біль, який в більшості випадків усувається звичайними аналгетиками. Рідше побічні явища включають розлади сечовипускання (головним чином, слабку або помірну дизурію).
За даними рандомізованих плацебо-контрольованих клінічних досліджень, філграстим не збільшував частоти побічних реакцій на цитотоксичну хіміотерапію. Небажані явища, що з однаковою частотою відмічалися у хворих, які одержували філграстим/хіміотерапію та плацебо/хіміотерапію, включали нудоту, блювання, алопецію, діарею, втомлюваність, анорексію, запалення слизових оболонок, головний біль, кашель, шкірні висипи, біль у грудині, загальну слабкість, біль у горлі, запори та невизначений біль.
При лікуванні філграстимом в рекомендованих дозах спостерігалося оборотне, дозозалежне і зазвичай слабке або помірне підвищення концентрацій лактатдегідрогенази, лужної фосфатази, сечової кислоти та g-глутамілтрансферази в сироватці відповідно у 50 %, 35 %, 25 % і 10 % хворих.
Зрідка можливе тимчасове зниження артеріального тиску, яке не потребує лікування.
Повідомлялося про розвиток реакції «трансплантат проти хазяїна» (ТПХ) з летальними наслідками у хворих, що застосовували гранулоцитарний колонієстимулюючий фактор після
алогенної трансплантації кіскового мозку.
Іноді у хворих, які одержують високодозову хіміотерапію з наступною аутологічною трансплантацією кісткового мозку, відзначалися судинні порушення, включаючи вено-оклюзійну хворобу і порушення водного обміну. Їхній зв'язок із застосуванням філграстиму встановлено не було.
В поодиноких випадках у хворих, які одержували філграстим, спостерігався шкірний васкуліт, механізм якого не з'ясовано.
Відмічалися випадки синдрому Світа (гострий фебрильний нейтрофільний дерматоз). У цих випадках зв'язок із застосуванням філграстиму невідомий, оскільки значна їх частина відносилася до хворих на лейкоз, а синдром Світа спостерігається при цьому захворюванні.
В окремих випадках спостерігалося загострення ревматоїдного артриту.
Повідомлялося про псевдоподагру у онкохворих, які одержували філграстим.
Повідомлялося про рідкісні побічні реакції з боку легень, включаючи інтерстиціальну пневмонію, набряк легень, легеневі інфільтрати, що іноді призводили до дихальної недостатності або дистрес синдрому дорослих, які можуть закінчуватися летальними випадками.
Алергічні реакції: реакції алергічного типу, включаючи анафілаксію, шкірний висип, кропив'янку, ангіоедему, диспное та артеріальну гіпотензію, – на початку або при подальшому застосуванні препарату. Таких реакцій було більше після внутрішньовенного застосування препарату. Іноді відновлення лікування супроводжувалося рецидивом симптомів, що свідчить про причинно-наслідковий зв'язок. Необхідно відмінити застосування препарату у пацієнтів, у котрих проявилися серйозні алергічні реакції.
Повідомлялося про поодинокі випадки кризи серпоподібних еритроцитів у пацієнтів з захворюванням серпоподібних еритроцитів.
|
Система органів |
Частота |
Побічний ефект |
|
Розлади метаболізму та харчування |
Дуже поширені |
Збільшення концентрацій лужної фосфатази, лактатдегідрогенази, сечової кислоти |
|
З боку нервової системи |
Поширені |
Головний біль |
|
З боку судин |
Рідкісні |
Васкулярні розлади |
|
Непоширені |
Синдром підвищеної проникності капілярів |
|
|
З боку дихальної, торакальної та медіастинальної систем |
Поширені |
Кашель, біль у горлі |
|
Дуже рідкісні |
Інфільтрати в легенях |
|
|
З боку шлунково-кишкового тракту |
Дуже поширені |
Нудота/блювання |
|
Поширені |
Запор, анорексія, діарея, мукозит |
|
|
Гепатобіліарні розлади |
Дуже поширені |
Збільшення концентрацій g-глутамілтрансферази |
|
З боку шкіри та підшкірних тканин |
Поширені |
Алопеція, шкірний висип |
|
Дуже рідкісні |
Синдром Світа, шкірний васкуліт |
|
|
З боку кістково-м'язової системи та системи сполучних тканин |
Дуже поширені |
Біль у грудях, біль в кістках і м'язах |
|
Дуже рідкісні |
Загострення ревматоїдного артриту |
|
|
З боку нирок та сечовидільної системи |
Дуже рідкісні |
Розлади сечовипускання |
|
Загальні реакції та реакції в місці введення |
Поширені |
Втома, загальна слабкість |
|
Непоширені |
Невизначений біль |
|
|
Дуже рідкісні |
Алергічна реакція |
У здорових донорів при мобілізації периферичних стовбурових клітин крові (ПСКК)
У здорових донорів ПСКК небажані реакції на філграстим найчастіше виявлялися слабким або помірно вираженим болем у кістках і м'язах. У 41 % донорів спостерігався лейкоцитоз (більше 50×109/л), а у 35 % – після введення філграстиму та проведення лейкаферезу виявлялася минуща тромбоцитопенія (кількість тромбоцитів менше 100×109/л).
В окремих здорових донорів, які отримували філграстим, спостерігалося клінічно безсимптомне транзиторне невелике збільшення концентрацій лужної фосфатази, лактатдегідрогенази, аспартат-амінотрансферази та сечової кислоти.
Дуже рідко спостерігались симптоми загострення артриту та тяжкі алергічні реакції. Повідомлялося про головний біль у здорових донорів ПСКК, ймовірно пов'язаний із застосуванням філграстиму.
В дуже рідкісних випадках у здорових донорів ПСКК та пацієнтів, які одержували гранулоцитарний колонієстимулюючий фактор, відбувався розрив селезінки. Було зафіксоване поширене, але загалом безсимптомне виникнення спленомегалії.
В постмаркетингових дослідженнях повідомлялося про побічні реакції з боку дихальної системи у здорових донорів (кровохаркання, легенева кровотеча, інфільтрація легень, диспное, гіпоксія).
|
Система органів |
Частота |
Побічний ефект |
|
З боку кровотворної та лімфатичної системи |
Дуже поширені |
Лейкоцитоз, тромбоцитопенія |
|
Непоширені |
Порушення функціонування селезінки |
|
|
Розлади метаболізму та харчування |
Поширені |
Збільшення концентрацій лужної фосфатази, лактатдегідрогенази |
|
Непоширені |
Збільшення концентрацій аспартат-амінотрансферази, гіперурикемія |
|
|
З боку нервової системи |
Дуже поширені |
Головний біль |
|
З боку судин |
Непоширені |
Синдром підвищеної проникності капілярів |
|
З боку кістково-м'язової системи та системи сполучних тканин |
Дуже поширені |
Біль в кістках і м'язах |
|
Непоширені |
Загострення ревматоїдного артриту |
|
|
Загальні реакції та реакції в місці введення |
Непоширені |
Тяжка алергічна реакція |
У хворих з ТХН
Побічні ефекти, пов'язані з лікуванням філграстимом тяжкої хронічної нейтропенії, мають тенденцію до зменшення їх частоти з часом.Найчастішою побічною реакцією, яку приписують філграстиму, є біль у кістках, та загальний скелетно-м'язовий біль.
Інші побічні явища включають збільшення селезінки, яке у невеликої кількості хворих може прогресувати, а також тромбоцитопенію.
Описані головний біль та діарея незабаром після початку лікування філграстимом менше, ніж у 10 % хворих. Також були відмічені анемія та носові кровотечі.
Спостерігалося минуще і клінічно безсимптомне збільшення сироваткових концентрацій сечової кислоти, лактатдегідрогенази і лужної фосфатази, а також минуще помірне зниження концентрації глюкози в крові після їжі.
Побічні явища, можливо пов'язані з лікуванням філграстимом, які відмічалися менше, ніж у 2 % хворих з ТХН, включали реакції в місці ін'єкції, головний біль, збільшення печінки, біль в суглобах, алопецію, остеопороз і висипи.
При тривалій терапії у 2 % хворих на ТХН спостерігали шкірний васкуліт, а дуже рідко – протеїнурію/гематурію.
|
Система органів |
Частота |
Побічний ефект |
|
З боку кровотворної та лімфатичної системи |
Дуже поширені |
Анемія, спленомегалія |
|
Поширені |
Тромбоцитопенія |
|
|
Непоширені |
Порушення функціонування селезінки |
|
|
З боку метаболізму та харчування |
Дуже поширені |
Зменшення рівня глюкози, збільшення концентрацій лужної фосфатази, лактатдегідрогенази, гіперурикемія |
|
З боку нервової системи |
Поширені |
Головний біль |
|
З боку дихальної, торакальної та медіастинальної систем |
Дуже поширені |
Носова кровотеча |
|
З боку шлунково-кишкового тракту |
Поширені |
Діарея |
|
Гепатобіліарні розлади |
Поширені |
Збільшення печінки |
|
З боку шкіри та підшкірних тканин |
Поширені |
Алопеція, шкірний васкуліт, біль в місці ін'єкції, висипи |
|
З боку кістково-м'язової системи та системи сполучних тканин |
Дуже поширені |
Біль в кістках і м'язах |
|
Поширені |
Остеопороз |
|
|
З боку нирок та сечовидільної системи |
Непоширені |
Гематурія, протеїнурія |
У ВІЛ-інфікованих
Клінічними дослідженнями встановлено, що єдиною небажаною реакцією, яку можна віднести на рахунок філграстиму, є біль в кістках і м'язах, як правило, слабкий або помірний.Частота симптомів приблизно така ж, як в онкологічних хворих.
Менше ніж у 3 % пацієнтів, які лікуються філграстимом, відмічалося невелике або середнє збільшення селезінки із сприятливим клінічним перебігом;гіперспленізму, як і спленектомії, не було ні у кого з хворих. Оскільки при ВІЛ-інфекції та СНІДі селезінка звичайно буває збільшена, зв'язок цього явища з прийомом філграстиму лишається нез'ясованим.
|
Система органів |
Частота |
Побічний ефект |
|
З боку кровотворної та лімфатичної системи |
Поширені |
Порушення функціонування селезінки |
|
З боку кістково-м'язової системи та системи сполучних тканин |
Дуже поширені |
Біль в кістках і м'язах |
У постмаркетинговий період повідомлялося про випадки синдрому підвищеної проникності капілярів, які спостерігалися переважно у онкохворих, хворих з сепсисом, які застосовували поліхіміотерапію чи аферез.
Термін придатності. 30 місяців.
Умови зберігання. Зберігати при температурі від 2 до 8 °С в оригінальній упаковці.
Несумісність.
ТеваГрастим не слід розводити розчинами хлориду натрію.
ТеваГрастим не слід змішувати з іншими препаратами, окрім зазначених у розділі«Спосіб застосування та дози».
Препарат після розведення може адсорбуватися склом і пластмасами.
Упаковка. По 0,5 мл (30 млн. МО) або по 0,8 мл (48 млн. МО) в скляному шприці одноразового використання з перманентно приєднаною голкою та захисним ковпачком, з або без пристрою для безпечного введення та запобігання поранень голкою чи повторного використання.
1 шприц у картонній коробці з інструкцією для медичного застосування.
Категорія відпуску. За рецептом.
Виробники.
Тева Фарма Б.В.
Тева Фармацевтікал Індастріз Лтд.
Місцезнаходження виробників та адреси місця провадження їхньої діяльності.
Вул. Свенсвег 5, 2031 GA Харлем, Нідерланди.
Вул. Елі Хурвіц 18, Інд. зона, Кфар-Саба, Ізраїль.
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Filgrastim - Филграстим |
| Код АТХ | L03AA02 |
| Форма выпуска | раствор |
- Грастим Д-р Редді'с Лабораторіс Лтд, Індія
- Зарсио 600 мкг Сандоз ГмбХ (відповідальний за випуск серії)/Ай Ді Ті Біологіка ГмбХ (відповідальний за виробництво, пакування, контроль серії)/ГП Гренцах Продакшнз ГмбХ (відповідальний за вторинне пакування), Австрія/Німеччина/Німеччина
- Зарсио 960 мкг Сандоз ГмбХ (відповідальний за випуск серії)/Ай Ді Ті Біологіка ГмбХ (відповідальний за виробництво, пакування, контроль серії)/ГП Гренцах Продакшнз ГмбХ (відповідальний за вторинне пакування), Австрія/Німеччина/Німеччина
- Нейпоген Ф. Хоффманн-Ля Рош Лтд, Швейцарія
- Нейтромакс Біо Сідус С.А., Аргентина
- Филграстим-Фармекс ТОВ "Фармекс Груп" (із "in bulk" виробництва "Center of Molecular Immunology", Куба), Україна
- Филстим ПрАТ "БІОФАРМА" (виробництво, первинне та вторинне пакування, контроль якості, випуск серій)/ТОВ "ФЗ "БІОФАРМА" (виробництво, первинне та вторинне пакування, випуск серій), Україна/Україна

 Боль при артритах. Решение сложной задачи
Боль при артритах. Решение сложной задачи
 Боль при артритах. Решение сложной задачи
Боль при артритах. Решение сложной задачи
 Цитостатики в дерматовенерологии
Цитостатики в дерматовенерологии
 Важные аспекты кардиоваскулярной безопасности современных противовоспалительных препаратов
Важные аспекты кардиоваскулярной безопасности современных противовоспалительных препаратов