Жетреа инструкция, аналоги и состав
| Показания: | Лікування вітреомакулярної тракції (ВМТ) у дорослих, включаючи випадки, пов’язані з макулярним отвором діаметром 400 мікрон або менше. |
| Форма випуска: | Концентрат для розчину для ін'єкцій, 0,5 мг/0,2 мл по 0,2 мл у флаконі № 1 |
| Производитель, страна: | Алкон-Куврьор (виробник, відповідальний за вторинну упаковку, випуск серії)/Патеон ЮК Лімітед (виробник, відповідальний за виробництво "in bulk", первинне та вторинне пакування), Бельгія/Велика Британія |
| Действующее вещества: | 1 флакон розчину (0,2 мл) містить 0,5 мг окриплазміну*.Після розведення 0,1 мл розчину містить 0,125 мг окриплазміну.*Окриплазмін – це модифікована форма людського плазміну, отримана за ДНК-рекомбінантною технологією у системі експресії Pichia pastoris. |
| МНН: | Ocriplasmin - Окриплазмин |
| Регистрация: | UA/13876/01/01з 18.09.2014 по 18.09.2019. Приказ 652 від 18.09.2014 |
| Код АТХ: |
Склад:
діюча речовина: 1 флакон розчину (0,2 мл) містить 0,5 мг окриплазміну*.
Після розведення 0,1 мл розчину містить 0,125 мг окриплазміну.
*Окриплазмін – це модифікована форма людського плазміну, отримана за ДНК-рекомбінантною технологією у системі експресії Pichia pastoris.
Допоміжні речовини: маніт (Е 421); кислота лимонна, моногідрат; натрію гідроксид (для регулювання рН); вода для ін’єкцій.
Лікарська форма. Концентрат для розчину для ін’єкцій.
Основні фізико-хімічні властивості: прозорий та безбарвний розчин.
Фармакотерапевтична група. Засоби, що застосовують в офтальмології. Інші офтальмологічні засоби. Окриплазмін.
Код АТХ S01ХА22.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Окриплазмін має протеолітичну активність щодо білкових компонентів скловидного тіла та вітреоретинальної поверхні (ВРП) (наприклад, ламініну, фібронектину та колагену), спрямовану на розчинення білкового матриксу, який сприяє надлишковій вітреомакулярній адгезії (ВМА). Міцний зв’язок компонентів білків у межах макулярної ділянки ВРП сприяє виникненню вітреомакулярної тракції (ВМТ), що призводить до погіршення зору та/або виникнення макулярного отвору.
Клінічна ефективність та безпека
Ефективність препарату ЖЕТРЕА® була продемонстрована у ході 2 багатоцентрових рандомізованих подвійних сліпих плацебо-контрольованих 6-місячних досліджень за участю пацієнтів з ВМТ. Загальну кількість пацієнтів, що становила 652 особи (препарат ЖЕТРЕА® – 464, плацебо – 188), було рандомізовано для двох досліджень: TG‑MV‑006 та TG‑MV‑007.
В обох базових дослідженнях частина пацієнтів, які досягли усунення ВМА на 28-й день дослідження (первинна кінцева точка), була значно більшою (p≤0,003) у групі із застосуванням препарату ЖЕТРЕА® у порівнянні з групою із застосуванням плацебо. І ця різниця продовжувала бути статистично значимою до 6-го місяця у кожному з досліджень (p≤0,024). В узагальнених даних у 26,5% пацієнтів групи із застосуванням препарату ЖЕТРЕА®, порівняно з 10,1% пацієнтів у групі із застосуванням плацебо, вітреомакулярна адгезія (ВМА) до 28-го дня дослідження зникла (p<0,001). Різниця зберігалася з 7-го дня до 6-го місяця дослідження (Малюнок 1).
Малюнок 1. Кількість пацієнтів, у яких ВМА зникла до 180-го дня дослідження (6 місяців) (TG‑MV‑006, TG‑MV‑007 та узагальнені дані)
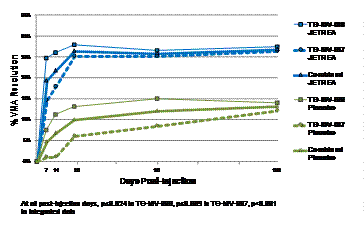
Пацієнти з відсутністю змін епіретинальної мембрани (ЕРМ) на початку дослідження мали більшу ймовірність досягти зникнення ВМА на 28-й день дослідження порівняно з пацієнтами з наявністю ЕРМ на початку дослідження. На основі узагальнених даних частота зникнення ВМА на 28-й день була вищою у пацієнтів, яким застосовували препарат ЖЕТРЕА®, порівняно з пацієнтами групи, де застосовували плацебо, в обох підгрупах пацієнтів: без ЕРМ (37,4% порівняно з 14,3%, p<0,001) та зі змінами ЕРМ (8,7% порівняно з 1,5%, p=0,046).
Пацієнти з меншим діаметром ВМА на початку дослідження (≤ 1500 мікрон) мали більшу ймовірність зникнення ВМА на 28-й день у порівнянні з тими пацієнтами, діаметр ВМА у яких становив > 1500 мікрон. На основі узагальнених даних частота зникнення ВМА на 28-й день була вищою у пацієнтів, яким застосовували препарат ЖЕТРЕА®, порівняно з групою, у якій застосовували плацебо, як з підгрупою з ВМА ≤ 1500 мікрон на початку дослідження (34,7% порівняно з 14,6%, p<0,001), так і з підгрупою з ВМА > 1500 мікрон на початку дослідження (5,9% порівняно з 0%, p=0,113).
106 (22,8%) та 47 (25%) пацієнтів групи із застосуванням препарату ЖЕТРЕА® та групи із застосуванням плацебо відповідно мали отвір всіх шарів макули (ОВШМ) на початку дослідження. З них кількість пацієнтів, які досягли закриття ОВШМ без проведення вітректомії на 28-й день, була вищою у групі із застосуванням препарату ЖЕТРЕА®, ніж у групі із застосуванням плацебо (40,6 % порівняно з 10,6 % відповідно; p<0,001). Така різниця зберігалася до завершення дослідження (6-й місяць).
Значно вищий відсоток пацієнтів, у яких застосовували препарат ЖЕТРЕА®, відмічали тотальне заднє відшарування скловидного тіла (ЗВСТ) на 28-й день, порівняно з пацієнтами групи плацебо (узагальнені дані: 13,4% порівняно з 3,7% відповідно; p<0,001).
Під час проведення дослідження вітректомію можна було здійснювати згідно з рішенням дослідника. Пацієнти, яким застосовували препарат ЖЕТРЕА®, мали меншу ймовірність проведення вітректомії до кінця дослідження (6-й місяць), порівняно з пацієнтами групи, у якій застосовували плацебо (узагальнені дані: 17,7% порівняно з 26,6% відповідно; p=0,016).
У більшої частини пацієнтів, яким застосовували препарат ЖЕТРЕА®, показник гостроти зору з максимальною корекцією (ГЗМК) збільшився на ≥ 2 або ≥ 3 рядки (незалежно від вітректомії) на 6-му місяці дослідження (28,0% та 12,3% відповідно) порівняно з пацієнтами групи плацебо (17,1% та 6,4%) (p=0,003 та p=0,024 відповідно). Також співвідношення пацієнтів, гострота зору яких покращилася на ≥ 2 або ≥ 3 рядки без процедури вітректомії на 6-му місяці дослідження, переважала у пацієнтів групи із застосуванням препарату ЖЕТРЕА® (23,7% порівняно з 11,2%, p<0,001 у пацієнтів, гострота зору яких покращилася на ≥ 2 рядки, та 9,7% порівняно з 3,7%, p=0,008 у пацієнтів, гострота зору яких покращилася на ≥ 3 рядки).
У комплексному аналізі анкети Національного інституту зору щодо функції зору (VFQ‑25) за результатами оцінок додаткових тестів, а також за загальною кількістю балів було продемонстровано кількісну перевагу пацієнтів групи із застосуванням препарату ЖЕТРЕА® у порівнянні з групою із застосуванням плацебо. Різниця покращення загальної функції зору за додатковими тестами була статистично значимою (6,1 –ЖЕТРЕА® порівняно з 2,1 – плацебо, p=0,024).
Діти
Європейське агентство з контролю лікарських засобів відтермінувало зобов’язання щодо надання результатів дослідження препарату ЖЕТРЕА® в усіх підгрупах дітей лікуванні вітреомакулярної тракції (ВМТ), включаючи випадки, коли ВМТ була пов’язана з макулярним отвором діаметром 400 мікрон або менше (для отримання інформації щодо застосування дітям див. розділ «Дози та спосіб застосування»).
У дослідженні TG-MV-009 оцінювалися безпека та ефективність окриплазміну при застосуванні дітям, яким була запланована вітректомія. Одну ін'єкцію 0,175 мг (вище рекомендованої дози) або плацебо вводили в середину скловидного тіла у 24 ока дітей віком від 0 до 16 років за 30-60 хвилин до запланованого початку вітректоміі. Основними причинами вітректоміі були відшарування сітківки та ретинопатія недоношених дітей. Застосування окриплазміну не демонструє вплив на швидкість заднього відшарування скловидного тіла, ступінь розрідження скловидного тіла, швидкість післяопераційного прикріплення сітківки, розвиток проліферативної вітреоретинопатіі або стадію ретинопатії недоношених дітей. Результати з безпеки, які були отримані у дослідженні TG-MV-009, були сумісні з відомим профілем безпеки для ЖЕТРЕА®. На підставі результатів цього дослідження не рекомендується застосовувати ЖЕТРЕА® як доповнення до вітректомії у дітей з метою полегшення відділення та видалення скловидного тіла.
Фармакокінетика.
Після інтравітреальної ін’єкції рівень окриплазміну у скловидному тілі швидко зменшується. У ході клінічного дослідження за участю пацієнтів, яким було призначено процедуру вітректомії і які отримували по 0,125 мг ЖЕТРЕА® (відповідає теоретичній початковій концентрації 29 мкг/мл у скловидному тілі), середня активність окриплазміну через 2-4 години після введення становила 9% від теоретичної початкової концентрації, через 7 днів знаходилась нижче нижньої межі кількісного визначення.
Через застосування малої дози препарату (0,125 мг) визначення окриплазміну у системному кровотоці при інтравітреальному введенні не очікується.
При внутрішньовенному введенні окриплазмін бере участь у процесі катаболізму ендогенних білків, внаслідок чого він швидко інактивується через свою взаємодію з інгібіторами протеази α2‑aнтиплазміном або α2‑макроглобуліном. Інактивований комплекс окриплазмін/α2‑aнтиплазмін виводиться з кровотоку з періодом напіввиведення (t1/2), що становить кілька годин.
Порушення функції нирок
Досліджень з вивчення фармакокінетики окриплазміну у пацієнтів з порушенням функції нирок не проводилося, оскільки очікуваний системний вплив препарату після інтравітреального застосування є дуже низьким.
Порушення функції печінки
Досліджень з вивчення фармакокінетики окриплазміну у пацієнтів з порушенням функції печінки не проводилося, оскільки очікуваний системний вплив препарату після інтравітреального застосування є дуже низьким.
Клінічні характеристики.
Показання.
Лікування вітреомакулярної тракції (ВМТ) у дорослих, включаючи випадки, пов’язані з макулярним отвором діаметром 400 мікрон або менше.
Протипоказання.
Підвищена чутливість до активного компонента або до будь-якого з допоміжних компонентів препарату.
Існуюча або підозрювана інфекція ока або його придатків.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Досліджень взаємодії з іншими лікарськими засобами не проводилось.
Окриплазмін – це протеолітичний фермент, що проявляє активність серин-протеази і може бути присутнім в оці протягом декількох днів після здійснення інтравітреальної ін’єкції (див. розділ «Фармакологічні властивості (Фармакокінетика)»). Одночасне застосування з іншими лікарськими засобами у те саме око може вплинути на активність обох лікарських засобів і, таким чином, не рекомендується.
Системної взаємодії не очікується.
Особливості застосування.
Постін’єкційний моніторинг
Препарат ЖЕТРЕА® застосовується тільки шляхом інтравітреальної ін’єкції. Інтравітреальні ін’єкції супроводжувались інтраокулярним запаленням/інфекцією, інтраокулярним крововиливом та підвищеним внутрішньоочним тиском (ВОТ). При здійсненні ін’єкції слід завжди використовувати належний асептичний метод. Після здійснення інтравітреальної ін’єкції слід наглядати за пацієнтами через можливе виникнення побічних реакцій, в тому числі інтарокулярного запалення/інфекції та підвищення ВОТ. Тимчасове підвищення ВОТ, включаючи тимчасову відсутність зору та порушення перфузії зорового нерва, спостерігалися впродовж 60 хвилин після здійснення ін’єкції препарату ЖЕТРЕА®. Моніторинг підвищення ВОТ може складатися з перевірки перфузії диска зорового нерва одразу ж після здійснення ін’єкції та тонометрії впродовж 30 хвилин після здійснення ін’єкції. Внутрішньоочне запалення/інфекцію можна оцінити, застосовуючи біомікроскопію у період між 2-м та 7-м днями після здійснення ін’єкції. Пацієнти повинні негайного сповіщати про симптоми можливого інтарокулярного запалення/інфекції або про виникнення будь-яких інших зорових або очних симптомів. У випадку виникнення будь-яких з вищенаведених подій лікування пацієнта слід здійснювати відповідно до стандартної медичної практики.
Інші застереження
Безпека та ефективність застосування препарату ЖЕТРЕА® в обидва ока одночасно не досліджувались. Таким чином, одночасне застосування препарату в обидва ока не рекомендується.
Повторне застосування препарату ЖЕТРЕА® у те саме око недостатньо досліджене і тому не рекомендується.
Немає клінічних даних щодо одночасного застосування окриплазміну з інгібіторами фактора росту ендотелію судин (VEGF).
Застосування препарату ЖЕТРЕА® не досліджували у пацієнтів з великим діаметром макулярного отвору (> 400 мікрон), міопією високого ступеня (сферичною корекцією > 8 діоптрій або довжиною осі > 28 мм), афакією, регматогенним відшаруванням сітківки в анамнезі, зі слабкістю цінових зв’язок, при нещодавньому офтальмологічному хірургічному втручанні або інтраокулярній ін’єкції (включаючи лазерну терапію), з проліферативною діабетичною ретинопатією, ішемічною ретинопатією, оклюзією вени сітківки, ексудативною віковою макулярною дегенерацією (ВМД) та крововиливом у скловидне тіло. Для цієї категорії пацієнтів лікування препаратом ЖЕТРЕА® не рекомендується.
Не слід виключати можливість виникнення підвивиху та факодонезу кришталика (див. розділ «Побічні реакції»).
Досвід застосування препарату пацієнтам з непроліферативною діабетичною ретинопатією, увеїтом в анамнезі (включаючи активне запалення тяжкого ступеня) або значним травмуванням ока є обмеженим. Слід бути обережними під час лікування цієї категорії пацієнтів.
Дія окриплазміну (особливо щодо стимулювання розсмоктування вітреомакулярної адгезії або повного заднього відшарування скловидного тіла (ЗВСТ) зменшується у пацієнтів з епіретинальною мембраною (ЕРМ) або з діаметром вітреомакулярної адгезії (ВМА)>1500 мікрон (див. розділ «Фармакологічні властивості (Фармакодинаміка)»).
Через можливість підвищення тракційної сили існує ризик утворення нового або збільшення вже існуючого макулярного отвору (див. розділ «Побічні реакції»).
Існує ризик виникнення значної, але тимчасової втрати гостроти зору протягом першого тижня після ін’єкції. У цей період слід здійснювати ретельний нагляд за пацієнтами (див. розділ «Побічні реакції»).
Застосування у період вагітності або годування груддю.
Вагітність
Немає даних щодо застосування препарату ЖЕТРЕА® вагітним жінкам. Дослідження репродуктивної токсичності не проводилися. Передбачається, що системний вплив препарату ЖЕТРЕА® після інтравітреальної ін’єкції є дуже низьким. Препарат ЖЕТРЕА® слід застосовувати під час вагітності тільки у випадку, якщо користь від застосування препарату переважатиме потенційні ризики.
Годування груддю
Невідомо, чи виділяється препарат ЖЕТРЕА® в грудне молоко. Препарат ЖЕТРЕА® слід застосовувати у період годування груддю тільки у випадку, якщо користь від застосування препарату переважатиме потенційні ризики.
Репродуктивна функція
Жодних даних щодо впливу препарату ЖЕТРЕА® на репродуктивну функцію немає.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Після інтравітреальної ін’єкції препарату ЖЕТРЕА® може спостерігатись тимчасове погіршення гостроти зору (див. розділ «Побічні реакції»). У цих випадках пацієнтам не слід керувати автотранспортом або механізмами, доки ці явища не зникнуть.
Спосіб застосування та дози.
Підготовка та введення препарату ЖЕТРЕА® повинна здійснюватися кваліфікованим офтальмологом, який має досвід у здійсненні інтравітреальних ін’єкцій. Діагноз вітреомакулярної тракції (ВМТ) повинен ставитись тільки за наявності повної клінічної картини, включаючи історію хвороби пацієнта, клінічне обстеження та лабораторні аналізи з використанням сучасних діагностичних пристроїв, таких як оптична когерентна томографія (OКT).
Дози
Рекомендована доза становить 0,125 мг (0,1 мл розведеного розчину), яку застосовують шляхом одноразової інтравітреальної ін’єкції в уражене око. Кожен флакон слід застосовувати одноразово і тільки для лікування одного ока. Не рекомендується застосовувати препарат ЖЕТРЕА® у друге око одночасно протягом 7 днів після першої ін’єкції враховуючи ймовірність зниження гостроти зору ока, в яке була здійснена ін’єкція. Не рекомендується повторне застосування в те саме око (див. розділ «Особливості застосування»).
Щодо постін’єкційного моніторингу див. розділ «Особливості застосування».
Особливі категорії пацієнтів
Порушення функції нирок
Досліджень застосування препарату ЖЕТРЕА® пацієнтам з порушенням функції нирок не проводилось. Потреби коригувати дози або спеціальних застережень при застосуванні пацієнтам з порушенням функції нирок немає (див. розділ «Фармакологічні властивості (Фармакокінетика)»).
Порушення функції печінки
Досліджень застосування препарату ЖЕТРЕА® пацієнтам з порушенням функції печінки не проводилось. Потреби коригувати дози або спеціальних застережень при застосуванні пацієнтам з порушенням функції печінки немає (див. розділ «Фармакологічні властивості (Фармакокінетика)»).
Пацієнти похилого віку
Застосування цього препарату пацієнтам похилого віку вивчалось у клінічних дослідженнях. Для цієї категорії пацієнтів потреби у коригуванні дози немає.
Застосування дітям
Відсутній належний досвід застосування препарату ЖЕТРЕА® дітям віком до 18 років з вітреомакулярною тракцією (ВМТ), включаючи випадки, коли макулярний отвір є меншим або дорівнює 400 мікронам. Наявні на даний час дані про застосування препарату дітям описані в розділі «Фармакодинаміка».
Етнічна приналежність
Досвід застосування в усіх етнічних групах, крім європеоїдної, є обмеженим.
Метод застосування
Флакон призначений тільки для одноразового інтравітреального використання.
Передопераційна терапія, яку призначає офтальмолог, може включати антибіотик у вигляді очних крапель.
Застереження перед початком застосування лікарського препарату
Інтравітреальну ін’єкцію слід здійснювати у контрольованих асептичних умовах, що включають використання дезінфекційних засобів для рук хірурга, стерильних рукавичок, стерильного простирадла, стерильного розширювача повік (або еквівалентного інструментарію) та здійснення парацентезу у стерильних умовах (якщо необхідно). Перед ін’єкцією слід продезінфікувати шкіру навколо ока, поверхню повік та ока, а також здійснити анестезію і застосувати місцевий бактерицидний засіб широкого спектра дії відповідно до стандартної медичної практики.
Розведення лікарського препарату перед застосуванням
Флакони призначено тільки для одноразового застосування.
Під час приготування препарату ЖЕТРЕА® для інтравітреальної ін’єкції дотримуйтесь таких інструкцій:
- Дістати флакон з холодильника та нагріти його до кімнатної температури (приблизно 2 хвилини).
- Зняти захисний поліпропіленовий ковпачок з флакона.
- Продезінфікувати верхню частину флакона серветкою, змоченою у спирті.
- Використовуючи асептичну методику, додати 0,2 мл 0,9% розчину натрію хлориду (9 мг/мл) для ін’єкцій (стерильного, який не містить консервантів та буферів) у флакон з препаратом ЖЕТРЕА® та обережно змішати. Слід набирати розчинник з герметичної упаковки і використовувати тільки одноразово. Залишок 0,9% розчину для ін’єкцій натрію хлориду (9 мг/мл) слід утилізувати. Розведений розчин слід одразу ж використати, оскільки він не містить консервантів.
- Візуально перевірте розчин на наявність часток. Слід використовувати тільки прозорий безбарвний розчин без видимих часток.
- Використовуючи асептичну методику, набрати у шприц весь розведений розчин, використовуючи відповідну асептичну голку (злегка нахиливши флакон для більш легкого забору розчину). Після цього голку слід утилізувати . Не використовуйте цю голку для інтравітреальної ін’єкції.
- Після заміни голки на стерильну обережно витисніть повітря зі шприца та відкоригуйте дозу до позначки на шприці 0,1 мл (що відповідає 0,125 мг окриплазміну).
- Оскільки розведений розчин не містить консервантів, одразу ж введіть 0,1 мл розчину в скловидне тіло.
- Утилізуйте флакон та невикористаний залишок розчину.
Невикористаний лікарський засіб необхідно утилізувати відповідно до вимог місцевого законодавства.
Ін’єкційну голку слід вводити на відстані 3,5‑4,0 мм позаду лімба, спрямовуючи її до центру порожнини скловидного тіла і уникаючи горизонтального меридіана. Потім у середню частину скловидного тіла здійснюється ін’єкція об’ємом 0,1 мл.
Діти.
Безпека та ефективність препарату ЖЕТРЕА® при застосуванні дітям з вітреомакулярною тракцією (ВМТ), включаючи випадки, коли макулярний отвір є меншим або дорівнює 400 мікронам, не встановлені. Дані відсутні.
Передозування.
Клінічні дані щодо передозування препаратом ЖЕТРЕА® є обмеженими. Повідомлялося про один випадок ненавмисного передозування окриплазміном у дозі, що становила 0,250 мг (вдвічі більше рекомендованої дози). У пацієнта відмічалося погіршення гостроти зору з максимальною корекцією на 21 літеру таблиці ETDRS у порівнянні з початковими показниками, які наприкінці дослідження покращились на 9 літер від початкових показників. У пацієнта також розвинулася помірна кон’юнктивальна гіперемія, запалення ока та міоз, які було усунено за допомогою кортикостероїдів у формі очних крапель.
У випадку передозування рекомендується ретельний нагляд. У разі виникнення побічних реакцій їх слід лікувати відповідно до стандартної медичної практики.
Побічні реакції.
Короткий виклад даних щодо безпеки
Понад 800 пацієнтів було проліковано із застосуванням інтравітреальної ін’єкції препарату ЖЕТРЕА®, з яких більше ніж 570 пацієнтів із застосуванням рекомендованої дози, яка становить 0,125 мг.
Усі побічні реакції були офтальмологічними. Найчастіше повідомлялося про рухомі частки в скловидному тілі, біль в оці та фотопсію, а також кон’юнктивальний крововилив внаслідок ін’єкції. Більшість побічних реакцій виникали протягом першого тижня після ін’єкції. Більшість цих реакцій були несерйозними, помірними та зникали впродовж 2-3 тижнів.
Частота виникнення серйозних побічних реакцій в усіх клінічних дослідженнях становила 2,2% у групі пацієнтів, де застосовували препарат ЖЕТРЕА®, та 2,4% у контрольній групі.
Перелік побічних реакцій, наведений у вигляді таблиці
У наступній таблиці наведено перелік побічних реакцій, які виникали під час клінічних дослідженнях і які ймовірніше пов’язані із процедурою введення або самим препаратом ЖЕТРЕА®.
Побічні реакції наведено відповідно до класифікації за системами органів згідно з MedDRA. Частоту визначено таким чином: дуже часті (≥1/10), часті (≥1/100 до <1/10), нечасті (≥1/1000 до <1/100), рідкі (≥1/10000 до <1/1000), поодинокі (<1/10000) або невідомо (неможливо оцінити з наявних даних). У межах кожної групи побічні реакції представлено у порядку зменшення їх клінічної важливості.
|
Порушення з боку очей |
Дуже часті Рухомі частки у скловидному тілі, біль в оці, кон’юнктивальний крововилив Часті Зменшення гостроти зору*, порушення зору, затуманення зору, ретинальний крововилив, крововилив у скловидне тіло,розрив сітківки*, відшарування сітківки*, збільшення внутрішньоочного тиску,макулярний отвір*, макулярна дегенерація, дегенерація сітківки, макулярний набряк, набряк сітківки, пігментна епітеліопатія сітківки, метаморфопсія, адгезія скловидного тіла*, набряк кон’юнктиви, набряк повік, вітреїт, клітини та опалесценція в передній камері, ірит, фотопсія, гіперемія кон’юнктиви, гіперемія ока, відшарування скловидного тіла, відхилення від норми даних ретинограми*, подразнення ока, синдром сухого ока, відчуття стороннього тіла в оці, свербіж ока, відчуття дискомфорту в оці, фотофобія, хроматопсія* Нечасті Тимчасова сліпота, підвивих кришталика*, скотома, порушення поля зору, диплопія, гіфема, міоз, різний розмір зіниць, ерозія рогівки, запалення передньої камери, запалення ока, подразнення кон’юнктиви |
* Див. розділ «Опис окремих побічних реакцій»
Опис окремих побічних реакцій
Зменшення гостроти зору.
У базових плацебо-контрольованих дослідженнях ІІІ фази у 7,7% пацієнтів, яким застосовували препарат ЖЕТРЕА®, та у 1,6% пацієнтів групи, у якій застосовували плацебо спостерігалося тимчасове гостре погіршення гостроти зору з максимальною корекцією (ГЗМК) на ≥ 2 рядки (≥ 10 літер таблиці ETDRS) впродовж першого тижня після здійснення ін’єкції без альтернативного пояснення такої зміни. Гострота зору, як правило, відновлювалася впродовж 2 тижнів без будь-якого втручання. Рекомендації щодо нагляду за пацієнтами наведено у розділі «Особливості застосування».
Хроматопсія
Дисхроматопсія (зазвичай описується як зір з відтінками жовтого кольору) була частою побічною реакцією у пацієнтів, яким здійснювали ін’єкції препарату ЖЕТРЕА®. Більшість випадків були несерйозними, з помірним ступенем тяжкості і симптоми зазвичай проходили самостійно. Середня тривалість відновлення становила 3 місяці.
Відхилення на ретинограмі
Зміни на електроретинограмі (ЕРГ) (зменшення амплітуди a‑ та b‑хвиль) були частою побічною реакцією у пацієнтів, яким здійснювали ін’єкції препарату ЖЕТРЕА®; у більшості випадків також повідомлялося про розвиток дисхроматопсії. Приблизно в половині випадків відхилення на ретинограмі зникали до моменту проведення останнього контрольного обстеження. Середній час зникнення відхилень становив 6 місяців. Відхилення на ЕРГ не являлися передвісниками негативних результатів щодо гостроти зору.
Пошкодження сітківки (розриви та відшарування)
У базових плацебо-контрольованих дослідженнях III фази повідомлялося про пошкодження сітківки (розриви та відшарування) у 1,9% пацієнтів, яким здійснювали ін’єкції препарату ЖЕТРЕА®, порівняно з 4,3% пацієнтів, яким здійснювали ін’єкції плацебо. Більшість цих випадків спостерігалися у пацієнтів обох груп під час або після процедури вітректомії. Частота випадків відшарування сітківки, що виникали до процедури вітректомії, становила 0,4% у групі пацієнтів із застосуванням препарату ЖЕТРЕА®, а у пацієнтів групи із застосуванням плацебо такі явища не спостерігалися, тоді як частота розривів сітківки (без відшарування), що виникли до процедури вітректомії, становила 0,2% у групі пацієнтів із застосуванням препарату ЖЕТРЕА® та 0,5% у пацієнтів групи із застосуванням плацебо.
Макулярний отвір
У базових плацебо-контрольованих дослідженнях III фази повідомлялось про випадки утворення та збільшення макулярного отвору, що становили 6,7% у пацієнтів, яким здійснювали ін’єкції препарату ЖЕТРЕА®, порівняно з 9,6% у пацієнтів групи плацебо. Хоча у ході базових плацебо-контрольованих досліджень III фази встановлено, що препарат ЖЕТРЕА® сприяв зменшенню макулярного отвору, виникнення якого було пов’язано з вітреомакулярною тракцією, в деяких випадках спостерігалося посилення тракції з наступним збільшенням існуючого або виникненням нового макулярного отвору. Розвиток таких явищ є частиною природного перебігу хвороби, однак внесок окриплазміну у деяких випадках виявляється досить переконливим з огляду на механізм його дії.
Адгезія скловидного тіла
У базових плацебо-контрольованих дослідженнях III фази повідомлялося про випадки погіршення вітреомакулярної адгезії/вітреомакулярної тракції у 1,5% пацієнтів, яким здійснювали ін’єкції препарату ЖЕТРЕА®, порівняно з 1,1% у пацієнтів групи плацебо. Розвиток таких явищ є частиною природного перебігу хвороби, однак у деяких випадках ефект окриплазміну виявляється досить переконливим з огляду на механізм його дії.
Підвивих/факодонез кришталика
У ході клінічних досліджень за участю дорослих добровольців повідомлялося про один випадок підвивиху/факодонезу кришталика, причина якого може бути пов’язана з ін’єкцією препарату ЖЕТРЕА®. Під час дослідження, в ході якого вивчалася доцільність застосування препарату ЖЕТРЕА® дітям, як додаткової процедури до вітректомії, повідомлялося про один випадок підвивиху у недоношеного новонародженого, якому було зроблено одноразову інтравітреальну ін’єкцію препарату ЖЕТРЕА® у дозі 0,175 мг. Підвивих кришталика спостерігався у 3 видів тварин при концентрації окриплазміну, вищій за передбачені клінічні концентрації.
На основі даних щодо протеолітичної активності окриплазміну, а також результатів доклінічних та клінічних досліджень, не слід виключати можливість виникнення підвивиху або факодонезу кришталика. Такі явища лікують відповідно до стандартної медичної практики.
Рекомендації щодо спостереження за пацієнтами наведено у розділі «Особливості застосування». У всіх вищенаведених ситуаціях рекомендовано здійснювати регулярні обстеження.
Повідомлення про підозрювані побічні реакції
Після реєстрації лікарського засобу важливо повідомляти про підозрювані побічні реакції. Це забезпечує постійний моніторинг співвідношення користь/ризик лікарського засобу. Медичних працівників просять повідомляти про будь-які підозрювані побічні реакції
Термін придатності.
18 місяців.
Після розведення
З мікробіологічної точки зору, препарат слід використати одразу ж після його розведення.
Флакон та невикористаний розчин, які призначено для одноразового застосування, необхідно утилізувати.
Умови зберігання.
Зберігати в морозильній камері при температурі – 20 ± 5 °C.
Якщо під час зберігання препарату порушувався температурний режим, флакон з препаратом слід утилізувати.
Зберігати в місцях, недоступних для дітей.
Несумісність.
У зв’язку з відсутністю досліджень на сумісність цей лікарський препарат не слід змішувати з іншими лікарськими засобами, крім стерильного 0,9% розчину для ін’єкцій натрію хлориду (9 мг/мл), який не містить консервантів та буферів.
Упаковка.
0,2 мл розчину у флаконі (скло I типу), закритому гумовою пробкою з хлорбутилу, що не містить латексу. По 1 флакону в упаковці.
Категорія відпуску.
За рецептом.
Виробник.
Алкон-Куврьор/Alcon-Couvreur.
Місцезнаходження виробника.
Рійксвег 14, B-2870 Пуурс, Бельгія/Rijksweg 14, B-2870 Puurs, Belgium.

 Невроотологія — нова, добре забута, давня наука
Невроотологія — нова, добре забута, давня наука
 Кір
Кір
 Гиперметропия
Гиперметропия
 Рваная травма глаза с выпадением или утратой внутриглазных тканей
Рваная травма глаза с выпадением или утратой внутриглазных тканей