Зоули инструкция, аналоги и состав
| Показания: | Пероральна контрацепція. |
| Форма випуска: | Таблетки, вкриті плівковою оболонкою, 2,5 мг/1,5 мг № 28 у блістері |
| Производитель, страна: | Органон (Ірландія) Лтд (виробництво за повним циклом)/Н.В. Органон (вторинна упаковка, дозвіл на випуск серії), Ірландія/Нідерланди |
| Действующее вещества: | 1 активна таблетка, вкрита плівковою оболонкою, містить 2,5 мг номегестролу ацетату та 1,5 мг естрадіолу (у формі естрадіолу гемігідрату) |
| МНН: | Nomegestrol and estradiol - Номегэстрол и эстроген |
| Регистрация: | UA/14120/01/01з 19.12.2014 по 19.12.2019. Приказ 197 від 16.03.2016 |
| Код АТХ: |
Склад:
діюча речовина: номегестрол ацетат, естрадіол;
1 активна таблетка, вкрита плівковою оболонкою, містить 2,5 мг номегестролу ацетату та 1,5 мг естрадіолу (у формі естрадіолу гемігідрату);
допоміжні речовини: целюлоза мікрокристалічна, кросповідон, тальк, магнію стеарат, кремнію діоксид колоїдний безводний, лактоза моногідрат;
оболонка: Oпадрай® ІІ білий: спирт полівініловий, титану діоксид (Е 171), макрогол, тальк.
1 плацебо таблетка, вкрита плівковою оболонкою, містить:
допоміжні речовини: целюлоза мікрокристалічна, кросповідон, тальк, магнію стеарат, кремнію діоксид колоїдний безводний, лактоза моногідрат;
оболонка: Oпадрай® ІІ жовтий: спирт полівініловий, титану діоксид (Е 171), макрогол, тальк, оксид заліза жовтий, оксид заліза чорний.
Лікарська форма. Таблетки, вкриті плівковою оболонкою.
Фармакотерапевтична група. Статеві гормони та модулятори статевої системи. Прогестерони та естрогени, фіксовані комбінації. Код ATХ G03A A14.
Клінічні характеристики.
Показання.
Пероральна контрацепція.
Протипоказання.
Не можна приймати комбіновані гормональні контрацептиви (КГК) у разі наявності хоча б одного з нижчеперерахованих станів. Через відсутність даних епідеміологічних досліджень застосування комбінованих пероральних контрацептивів (КПК), які містять 17β-естрадіол, нижчевикладені протипоказання щодо комбінованих гормональних контрацептивів, які містять етинілестрадіол, застосовуються для препарату Зоулі. Якщо при прийомі препарату Зоулі будь-які із зазначених нижче станів розвиваються вперше, прийом препарату слід негайно припинити.
- Підвищена чутливість до діючих речовин або до будь-якого компонента препарату.
- Наявна або присутня в анамнезі серцево-судинна патологія (в тому числі інфаркт міокарда, стенокардія, транзиторне порушення мозкового кровообігу, тромбоз глибоких вен, емболія легеневої артерії).
- Наявність тяжких або численних факторів розвитку венозних та артеріальних тромбозів (цукровий діабет з ураженням судин, тяжка гіпертензія, тяжка дисліпопротеїнемія).
- Гостре порушення мозкового кровообігу (в анамнезі).
- Велике оперативне втручання з тривалою іммобілізацією.
- Спадкова або набута схильність до венозних або артеріальних тромбозів, а саме: резистентність до активованого протеїну C (APC), дефіцит антитромбіну III, дефіцит протеїну C, дефіцит протеїну S, гіпергомоцистеїнемія та антифосфоліпідні антитіла (антикардіоліпінові антитіла, вовчаковий антикоагулянт).
- Мігрень із фокальними неврологічними симптомами в анамнезі.
- Панкреатит (у тому числі наявний в анамнезі), пов’язаний з тяжкою гіпертригліцеридемією.
- Тяжкі захворювання печінки (в анамнезі) – до відновлення показників функцій печінки.
- Захворювання печінки, в тому числі пухлини печінки (злоякісні або доброякісні), тромбози вен печінки.
- Злоякісні пухлини, залежні від статевих гормонів (наприклад, пухлини статевих органів або молочних залоз).
- Недіагностована вагінальна кровотеча.
- Вагітність або підозра на вагітність.
Спосіб застосування та дози.
Для перорального застосування.
Дозування
Препарат приймають щоденно по 1 таблетці на добу протягом 28 днів. Прийом таблеток з кожної упаковки повинен починатися з 24 білих активних таблеток з наступним прийомом 4 таблеток жовтого кольору. Прийом таблеток з кожної наступної упаковки слід розпочинати одразу після застосування останньої таблетки з попередньої упаковки без перерви в прийомі препарату та незважаючи на наявність чи відсутність менструальноподібної кровотечі (внаслідок відміни гормонів). Менструальноподібна кровотеча, як правило, починається на 2–3-й день після прийому останньої таблетки білого кольору і може не закінчитися до початку прийому таблеток з наступної упаковки (дивіться «Контроль циклу» в розділі «Особливості застосування»).
Таблетки слід приймати щодня приблизно в один і той самий час незалежно від прийому їжі, згідно з порядком, зазначеним на блістері. За потреби, таблетки можна запивати невеликою кількістю рідини. До таблеток додається 7 смужок-наклейок із назвами 7 днів тижня. Жінка має обрати смужку-наклейку, яка починається з того дня, коли вона почала приймати таблетки, та наклеїти її на блістер.
Як почати приймати препарат Зоулі
Коли жодний гормональний протизаплідний засіб не застосовувався (у попередньому місяці).
Жінка починає приймати таблетки препарату Зоулі у перший день циклу (тобто в перший день менструальної кровотечі). У цьому випадку немає потреби у застосуванні додаткового методу контрацепції. Жінка може також почати приймати препарат на 2–5-й день менструального циклу, але в цьому випадку необхідно застосовувати бар’єрний метод контрацепції протягом перших 7 днів безперервного прийому таблеток білого кольору (див. Малюнок 1).
Перехід з комбінованого гормонального контрацептиву (комбінованого перорального контрацептиву (КПК), вагінального кільця або трансдермального контрацептивного пластиру).
Жінка починає приймати препарат Зоулі переважно у перший день після застосування останньої активної таблетки (остання таблетка, яка містить діючі речовини) попереднього КПК, проте не пізніше ніж на наступний день після звичайного інтервалу без таблеток або після періоду таблеток плацебо попереднього КПК. У випадку застосування вагінального кільця або трансдермального пластиру жінці бажано почати приймати препарат Зоулі в день видалення засобу, у всякому випадку не пізніше вказаного дня його наступного застосування.
Перехід з пероральних контрацептивів, що містять тільки прогестоген («міні-пілі», імплантати, ін'єкційні контрацептиви), або з внутрішньоматкової гормональної системи (ВМС).
Жінка може припинити приймання “міні-пілі” будь-якого дня і почати прийом препарату Зоулі наступного дня. Імплантат або ВМС можна видалити у будь-який день, а прийом Зоулі слід почати в день їхнього видалення. При переході з ін'єкційних контрацептивів прийом Зоулі слід починати у той день, коли повинна бути зроблена наступна ін'єкція. В усіх випадках жінці необхідно також застосовувати бар’єрний метод контрацепції протягом 7 днів безперервного прийому активних таблеток білого кольору.
Після аборту в першому триместрі.
Жінка може одразу почати прийом препарату. У цьому випадку немає потреби у застосуванні додаткового методу контрацепції.
Після пологів або аборту в другому триместрі.
Жінкам необхідно рекомендувати розпочинати прийом препарату Зоулі з 21–28-го дня після пологів або аборту у другому триместрі вагітності. Якщо жінка розпочинає прийом таблеток пізніше, слід рекомендувати додатково використовувати бар'єрний метод контрацепції протягом перших 7 днів прийому активних таблеток білого кольору. Однак якщо статевий акт уже відбувся, то перед початком застосування КПК необхідно виключити вагітність або жінці слід дочекатися першої менструації. Перед відновленням прийому препарату Зоулі в післяпологовий період слід врахувати підвищений ризик виникнення венозної тромбоемболії (ВТЕ).
Пропуск прийому таблеток
Вказівки, що приводяться нижче, стосуються тільки пропуску активних таблеток білого кольору.
Якщо запізнення в прийомі активної таблетки не перевищує 24 години, протизаплідна дія препарату не знижується. Жінка має прийняти пропущену таблетку одразу, як тільки згадала про це. Наступну таблетку з цієї упаковки слід приймати у звичний час.
Якщо запізнення з прийомом активної таблетки перевищує 24 годин, контрацептивний захист може знизитися. В такому випадку необхідно керуватися двома основними правилами.
- Адекватне пригнічення системи гіпоталамус – гіпофіз – яєчники досягається при безперервному прийомі активних таблеток білого кольору протягом 7 днів.
- Чим більше активних таблеток білого кольору пропущено і чим ближче цей пропуск до фази 4 таблеток плацебо жовтого кольору, тим вище ризик вагітності.
Малюнок 1

Рекомендації на випадок пропуску прийому таблеток
Дні 1–7
Жінка має прийняти останню пропущену таблетку білого кольору якомога швидше, навіть якщо доведеться прийняти дві таблетки одночасно. Продовжити прийом таблеток у звичний час. Крім того, слід застосовувати бар'єрний метод контрацепції (наприклад, презерватив) протягом наступних 7 днів. Якщо у попередні 7 днів відбувся статевий акт, слід враховувати можливість настання вагітності.
Дні 8–17
Жінка повинна прийняти останню пропущену таблетку білого кольору якомога швидше, навіть якщо доведеться прийняти дві таблетки одночасно. Після цього продовжити прийом таблеток у звичний час. За умови, що жінка правильно приймала свої таблетки протягом 7 днів перед пропуском прийому таблетки, немає необхідності використовувати додаткові засоби контрацепції. Однак якщо пропущено прийом більше ніж однієї таблетки, слід рекомендувати використовувати додаткові засоби контрацепції протягом 7 днів.
Дні 18–24
Ризик зниження надійності неминучий з наближенням періоду застосування таблеток плацебо жовтого кольору. Однак при дотриманні схеми приймання таблеток можна уникнути зниження контрацептивного захисту.
У разі виконання будь-якої з нижчевикладених рекомендацій, немає необхідності використовувати додаткові засоби контрацепції, за умови, що протягом 7 днів, що передують пропуску прийому таблетки, жінка правильно приймала всі таблетки. Якщо це не так, необхідно діяти відповідно до першої рекомендації, а також використовувати додаткові засоби контрацепції протягом наступних 7 днів.
- Жінка повинна прийняти останню пропущену таблетку, як тільки згадає, навіть якщо це буде прийом двох таблеток одночасно. Продовжити прийом таблеток у звичний час, поки активні таблетки не будуть використані. 4 таблетки плацебо з останнього ряду приймати не слід. Натомість відразу розпочинають прийом таблеток з наступної упаковки. Малоймовірно, що у жінки з’явиться менструальноподібна кровотеча внаслідок відміни до закінчення приймання всіх таблеток жовтого кольору з другої упаковки, хоча під час приймання таблеток білого кольору можуть спостерігатися кровомазання або проривна кровотеча.
- Можна також припинити прийом активних таблеток з розпочатої упаковки, а приймати таблетки плацебо з останнього ряду до 4 днів, включаючи дні пропуску прийому, а потім розпочати прийом таблеток з наступної упаковки.
Якщо жінка пропустила прийом таблеток та у плацебо-фазі не з’явилась менструальноподібна кровотеча внаслідок відміни, необхідно розглянути можливість вагітності.
Якщо жінка не пам’ятає цифру або колір пропущених таблеток, протягом наступних 7 днів безперервного прийому таблеток білого кольору слід застосовувати бар'єрний метод контрацепції.
Пропущено прийом таблеток плацебо жовтого кольору
На пропуск прийому таблетки плацебо жовтого кольору із 4-го ряду блістера можна не зважати, бо контрацептивний захист не знизиться. Однак її треба викинути, щоб уникнути випадкового подовження плацебо-фази.
Рекомендації на випадок порушень з боку шлунково-кишкового тракту
У разі тяжких порушень з боку шлунково-кишкового тракту (наприклад, блювання чи діареї) можливе неповне всмоктування препарату. У такому випадку слід застосовувати додаткові засоби контрацепції.
Якщо протягом 3–4 годин після прийому таблетки білого кольору виникло блювання, таблетку слід вважати пропущеною та якнайшвидше прийняти ще одну таблетку. Наступну таблетку слід прийняти протягом 24 годин від встановленого часу прийому, якщо це можливо. Наступну таблетку слід прийняти в звичайний час. Якщо запізнення з прийомом перевищує 24 години, слід дотримуватися рекомендацій щодо пропуску прийому таблеток (дивіться розділ «Рекомендації на випадок пропуску прийому таблеток»). Якщо жінка не хоче змінювати свою звичну схему прийому препарату, їй необхідно прийняти додаткові таблетки білого кольору з іншої упаковки.
Як змістити або затримати початок менструації
Щоб затримати день початку менструації, жінці слід пропустити прийом таблеток плацебо жовтого кольору і почати прийом активних таблеток Зоулі з нової упаковки. При бажанні термін прийому можна подовжити аж до закінчення активних таблеток білого кольору з другої упаковки. Регулярне застосування препарату Зоулі відновлюється після прийому таблеток плацебо жовтого кольору з другої упаковки. При цьому можуть спостерігатися проривна кровотеча або кровомазання.
Щоб змістити настання менструації на інший день тижня, рекомендується скоротити інтервал прийому таблеток плацебо жовтого кольору максимум на 4 дні. Чим коротшою буде перерва, тим вища ймовірність відсутності менструальноподібної кровотечі внаслідок відміни та вищий ризик виникнення проривної кровотечі або кров'янистих виділень упродовж періоду прийому таблеток з наступної упаковки (як у випадку затримки настання менструації).
Особливі групи пацієнтів
Ниркова недостатність
Незважаючи на відсутність даних щодо пацієнтів з порушенням функції нирок, малоймовірно, що ниркова недостатність негативно впливає на виведення номегестролу ацетату та естрадіолу.
Печінкова недостатність
Клінічні дослідження за участю пацієнтів із печінковою недостатністю не проводилися. Оскільки метаболізм стероїдних гормонів може порушуватися у пацієнтів з тяжкою формою захворювання печінки, застосування Зоулі таким жінкам не рекомендується доти, доки показники функції печінки не повернуться до нормального рівня.
Побічні реакції.
Безпеку застосування препарату Зоулі оцінювали протягом семи дворічних багатоцентрових клінічних досліджень. Наведені нижче побічні реакції класифіковані за класами систем органів та за частотою: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), іноді (від ≥ 1/1000 до < 1/100) та рідко (від ≥ 1/10000 до < 1/1000).
За результатами двох рандомізованих, відкритих, порівняльних випробувань ефективності та безпеки, збільшення маси тіла відзначалося у 8,6 % жінок (порівняно з 5,7 % в групі препарату порівняння), порушена менструальноподібна кровотеча внаслідок відміни гормонів (особливо відсутність менструальноподібної кровотечі внаслідок відміни гормонів) відзначалася у 10,5 % жінок (порівняно з 0,5 % в групі препарату порівняння), а акне відзначалося у 15,4 % жінок (порівняно з 7,9 % в групі препарату порівняння). Оцінка проявів акне під час застосування препарату Зоулі показала, що більшість жінок (73,1 %) не відзначали змін у проявах акне порівняно з попереднім лікуванням, тоді як у 16,8 % відзначалося зменшення інтенсивності акне, а у 10,1 % відзначалися нові або посилення вже існуючих симптомів акне.
|
Клас систем органів |
Побічні реакції відповідно до термінології MedDRA1 |
|||
|
Дуже часто |
Часто |
Іноді |
Рідко |
|
|
З боку обміну речовин і харчування |
підвищений апетит, затримка рідини |
знижений апетит |
||
|
З боку психіки |
зниження лібідо, депресія/ пригнічений настрій, зміна настрою |
збільшення лібідо |
||
|
З боку нервової системи |
головний біль, мігрень |
зниження концентрації уваги |
||
|
З боку органів зору |
непереносимість контактних лінз/ |
|||
|
З боку серцево-судинної системи |
прилив крові до обличчя |
|||
|
З боку травної системи |
нудота |
здуття живота |
сухість у роті |
|
|
З боку шкіри та її похідних |
акне2 |
підвищене потовиділення, алопеція, свербіж, сухість шкіри, себорея |
хлоазма, гіпертрихоз |
|
|
З боку скелетно-м’язової системи та сполучної тканини |
відчуття важкості |
|||
|
З боку репродуктивної системи та молочних залоз |
порушення менструаль-ноподібної кровотечі внаслідок відміни гормонів |
метрорагія, менорагія, біль у грудях, тазовий біль |
гіпоменорея, набряк молочних залоз, галакторея, спазм матки, передменструальний синдром, збільшення молочних залоз, диспареунія, сухість вульви та піхви |
запах із піхви, вульвовагіналь- ний дискомфорт |
|
Порушення загального характеру |
подразнення, |
голод |
||
|
Обстеження |
збільшення маси тіла |
підвищення рівня печінкових ферментів |
||
1 Для опису конкретної побічної реакції надається найбільш прийнятна термінологія MedDRA (версія 13.1). Синоніми або пов’язані стани не наводяться, але мають враховуватися.
2 Акне є скоріш запропонованим, ніж спонтанно відміченим явищем, що реєструвалося щоразу під час кожного візиту протягом дослідження.
Крім вищеперерахованих побічних реакцій, також повідомлялось про випадки венозної тромбоемболії, артеріальної тромбоемболії та алергічних реакцій при застосуванні препарату Зоулі (частота невідома).
Більш детальну інформацію щодо інших виявлених побічних реакцій у жінок при застосуванні КПК, які містять етинілестрадіол, дивіться у розділі «Особливості застосування».
Передозування.
Дози, які у 5 разів перевищували добову дозу препарату Зоулі, а також разові дози, які у 40 разів перевищували добову дозу номегестролу ацетату, не чинили побічних ефектів у жінок.
На підставі загальних даних про застосування комбінованих пероральних контрацептивів виділяють такі симптоми: нудота, блювання, а у молодих дівчат - незначна кровотеча з піхви. Жодних антидотів не існує, лікування повинно бути симптоматичним.
Застосування у період вагітності або годування груддю.
Препарат не застосовують під час вагітності. У разі виникнення вагітності під час застосування препарату Зоулі приймання таблеток необхідно припинити. Більшість епідеміологічних досліджень не виявили підвищення ризику народження немовлят із вроджених вадами жінками, які до вагітності приймали КПК, що містять етинілестрадіол. Також не було виявлено тератогенного ефекту при застосуванні КПК, що містять етинілестрадіол, в ранній період вагітності. Клінічні дані, отримані у деяких дослідженнях вагітних, не виявили побічних реакцій у плода або новонародженого.
КПК можуть впливати на лактацію, оскільки під їх впливом може зменшуватись кількість грудного молока, а також змінюватись його склад. Тому КПК не рекомендуються при грудному вигодовуванні. Жінці, яка має намір продовжити годування, слід запропонувати альтернативний метод контрацепції. Невеликі кількості контрацептивних стероїдів та/або іхніх метаболітів можуть виводитись з грудним молоком, проте дані про їх негативний вплив на здоров’я немовлят відсутні.
Діти.
Дані про ефективність і безпеку застосування підлітками, які не досягли 18 років, відсутні.
Особливості застосування.
У разі появи зазначених нижче станів/ факторів ризику слід ретельно зважити переваги та ризики застосування Зоулі для кожної конкретної жінки, а також обговорити їх з жінкою перед початком прийому препарату. Якщо будь-які із зазначених нижче станів/ факторів ризику розвиваються вперше, повторюються або загострюються при застосуванні препарату, жінці необхідно звернутися до лікаря. Лікар має вирішити питання про подальше застосування Зоулі. Всі дані, представлені нижче, базуються на результатах епідеміологічних досліджень і стосуються комбінованих гормональних контрацептивів, які містять етинілестрадіол. Препарат Зоулі містить 17β-естрадіол. Через відсутність даних епідеміологічних досліджень застосування комбінованих пероральних контрацептивів, які містять 17β-естрадіол, нижчевикладені попередження застосовуються для препарату Зоулі.
Порушення кровообігу
- Застосування комбінованих гормональних контрацептивів асоціюється зі збільшенням ризику венозної тромбоемболії (ВТЕ). Ризик виникнення венозної тромбоемболії є найвищим протягом першого року застосування комбінованого гормонального контрацептиву. Також ризик виникнення венозної тромбоемболії підвищується після початку прийому комбінованого гормонального контрацептиву або після відновлення прийому того ж самого або іншого комбінованого гормонального контрацептиву після 4 тижневої або довшої перерви.
Епідеміологічні дослідження показали, що частота виникнення ВТЕ у жінок за відсутності факторів ризику розвитку ВТЕ, які приймали низькодозові комбіновані гормональні контрацептиви (<50 мкг етинілестрадіолу), становить від 3 до 12 випадків на 10000 жінок на рік у порівнянні з частотою 1–5 випадків на 10000 жінок на рік, які не застосовують комбіновані гормональні контрацептиви, та частотою 5–20 випадків серед 10000 жінок на рік для вагітних жінок. ВТЕ має летальні наслідки у 1–2% випадків.
- Нижче показано ризик розвитку ВТЕ у невагітних жінок, у жінок, які не приймають комбіновані гормональні контрацептиви, у жінок, які приймають комбіновані гормональні контрацептиви, у вагітних жінок та у жінок у післяпологовий період.
Ризик розвитку ВТЕ показано через перспективу: серед 10000 невагітних жінок та жінок, які не приймають комбіновані гормональні контрацептиви протягом року, у 1–5 з цих жінок розвинеться ВТЕ.
Імовірність розвитку ВТЕ
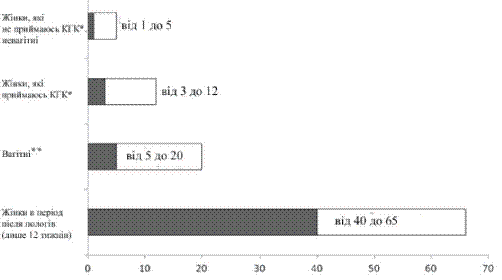
Кількість жінок, у яких утворився тромб, з 10000 на рік
* КГК – комплексний гормональний контрацептив.
** Дані вагітності грунтуються на фактичному періоді вагітності у порівняльних дослідженнях. Виходячи з моделі припущення, що вагітність триває дев’ять місяців, показник становить від 7 до 27 на 10 000 жінок на рік.
Невідомо, яким чином препарат Зоулі впливає на ризик ВТЕ порівняно з іншими комбінованими гормональними контрацептивами.
- На підставі результатів епідеміологічних досліджень припускається існування зв’язку між застосуванням комбінованих гормональних контрацептивів та підвищенням ризику виникнення артеріальної тромбоемболії (інфаркт міокарда, транзиторна ішемічна атака).
- Дуже рідко повідомлялося про тромбози, локалізовані в інших кровоносних судинах, наприклад печінкових, брижових, ниркових, церебральних або ретинальних венах та артеріях, які виникали у жінок, що приймали комбіновані гормональні контрацептиви.
- Ознаки тромбозу вен чи артерій або цереброваскулярних епізодів можуть включати: однобічний біль та/або набряк ноги, різкий сильний біль у грудях, який може віддавати у ліву руку, раптове апное, раптовий напад кашлю, будь-який незвичний серйозний або довготривалий головний біль, раптова повна або часткова втрата зору, диплопія, нечіткість мовлення або афазія, вертиго, колапс з фокальними симптомами або без них, слабкість або виражений параліч, що раптово уражає половину або частину тіла, моторні розлади, “гострий“ живіт.
- Ризик венозних тромболітичних епізодів підвищують:
- вік;
- сімейний анамнез (наприклад, венозна тромбоемболія у братів, сестер або батьків у відносно молодому віці). Якщо є підозра на спадкову схильність, обстеження спеціаліста слід провести до того, як буде прийнято рішення про прийом КПК;
- тривала іммобілізація, широке хірургічне втручання, будь-яке хірургічне втручання на ногах, серйозніші ураження. У таких випадках слід припинити прийом комбінованих пероральних контрацептивів (у разі планового хірургічного втручання – принаймні за чотири тижні) і почати прийом знову тільки через два тижні після повної ремобілізації. У разі несвоєчасного припинення застосування КПК слід перейти на лікування антитромботичними засобами;
- надмірна вага (індекс маси тіла понад 30 кг/м2).
- Немає єдиної думки щодо потенційної ролі варикозних вен та поверхневого тромбофлебіту у розвитку венозного тромбозу.
- Ризик артеріальних тромбоемболічних ускладнень або порушення мозкового кровообігу підвищують:
- вік;
- тютюнокуріння (активне куріння після 35 років ще більше підвищує ризики). Жінкам віком від 35 років слід рекомендувати не палити, якщо вони мають намір застосовувати КПК;
- дисліпопротеїнемія;
- надмірна вага (індекс маси тіла понад 30 кг/м2);
- артеріальна гіпертензія;
- мігрень;
- вади клапанів серця;
- фібриляція передсердь;
- сімейний анамнез (наприклад, тромбоз артерій у братів, сестер або батьків у відносно молодому віці). Якщо є підозра на спадкову схильність, жінку повинен обстежити спеціаліст до того, як буде прийнято рішення про прийом комбінованих пероральних контрацептивів.
- Інші захворювання, які пов’язані з небажаними циркуляторними ефектами, включають цукровий діабет, системний червоний вовчак, гемолітично-уремічний синдром, хронічні запальні захворювання кишечнику (хвороба Крона або виразковий коліт), а також серпоподібноклітинну анемію.
- Слід зважати на підвищений ризик тромбоемболії в післяпологовий період.
- Підвищена частота або серйозність мігрені протягом прийому комбінованих пероральних контрацептивів (це може стосуватись продромів церебрально-васкулярного епізоду) може бути причиною негайної відміни препарату Зоулі.
Жінки, які застосовують КПК, повинні негайно звертатися до лікаря при виникненні симптомів можливого тромбозу. У разі підозри на тромбоз або при підтвердженому тромбозі прийом комбінованого перорального контрацептиву необхідно припинити. Потрібно підібрати адекватний метод контрацепції у зв'язку з тератогенністю антикоагулянтної терапії (кумарини).
Пухлини
Всі дані, представлені нижче, базуються на результатах епідеміологічних досліджень і стосуються КПК, які містять етинілестрадіол. Препарат Зоулі містить 17β-естрадіол. Через відсутність даних епідеміологічних досліджень щодо комбінованих пероральних контрацептивів, які містять 17β-естрадіол, нижчевикладені попередження застосовуються для препарату Зоулі.
- Найбільш вагомим фактором ризику виникнення раку шийки матки є стійка інфекція, пов'язана з вірусом папіломи людини. Епідеміологічні дослідження показали, що тривале застосування комбінованих пероральних контрацептивів, які містять етинілестрадіол, сприяє підвищенню ризику, проте це твердження все ще суперечливе, оскільки остаточно не з'ясовано, наскільки результати досліджень враховують супутні фактори ризику, наприклад взяття мазка із шийки матки та статеву поведінку, включаючи використання бар'єрних методів контрацепції, або є випадковим збігом.
- Відомо, що застосування високодозованих КПК (50 мкг етинілестрадіолу) знижує ризик раку ендометрія і яєчників. Чи стосується це низькодозованих комбінованих пероральних контрацептивів, які містять 17β-естрадіол, остаточно не встановлено.
- Мета аналіз 54 епідеміологічних досліджень вказує на незначно підвищений відносний ризик (ВР = 1,24) раку молочних залоз у жінок, які приймали комбіновані пероральні контрацептиви, що містять етинілестрадіол. Цей ризик поступово знижується протягом 10 років після припинення прийому КПК. Через той факт, що рак молочної залози рідко трапляється у жінок до 40 років, збільшення кількості випадків раку молочної залози у жінок, які приймають або приймали раніше КПК, є незначним у зв’язку із загальним ризиком раку молочної залози. Рак молочної залози, що діагностується у таких жінок, звичайно клінічно менш виражений, аніж у тих, які ніколи не застосовували КПК. Частіше виявлення раку молочної залози, що спостерігається у жінок, які приймають КПК, може бути спричинене його ранньою діагностикою, біологічним ефектом КПК або цими обома факторами.
- У поодиноких випадках у жінок, що приймають КПК, діагностували доброякісні пухлини печінки, а злоякісні пухлини печінки були ще рідшими. Такі пухлини зрідка були причиною внутрішньочеревної кровотечі, що становила загрозу для життя. Тому якщо у жінки, яка приймає КПК, фіксують сильний біль в епігастральній зоні, збільшення печінки або ознаки внутрішньочеревної кровотечі, можлива наявність пухлини печінки.
Інші стани
Всі дані, представлені нижче, базуються на результатах епідеміологічних досліджень і стосуються КПК, які містять етинілестрадіол. Препарат Зоулі містить 17β-естрадіол. Через відсутність даних епідеміологічних досліджень щодо комбінованих пероральних контрацептивів, які містять 17β-естрадіол, нижчевикладені попередження застосовуються для препарату Зоулі.
- У жінок, що страждають на гіпертригліцеридемію або мають несприятливий сімейний анамнез, під час прийому комбінованих пероральних контрацептивів може з’явитися підвищений ризик панкреатиту.
- Незважаючи на той факт, що у багатьох жінок, що приймали КПК, фіксували незначне підвищення кров’яного тиску, клінічно значуще підвищення трапляється рідко. Зв’язок між застосуванням КПК та артеріальною гіпертензією не встановлений. Проте якщо протягом прийому КПК розвивається клінічно значуща артеріальна гіпертензія, слід тимчасово припинити застосування таблеток та лікувати артеріальну гіпертензію. Як тільки шляхом антигіпертензивної терапії буде досягнуто нормальних значень кров’яного тиску, при позитивному рішенні лікаря, терапію КПК можна поновити знову.
Протягом семи дворічних багатоцентрових клінічних досліджень не спостерігалося жодних клінічно значущих змін артеріального тиску при застосуванні Зоулі. - Повідомлялося про виникнення або посилення таких симптомів, пов’язаних і з вагітністю, і з застосуванням КПК, як жовтяниця та/або свербіж, пов’язаних з холестазом; утворення каменів у жовчному міхурі; порфірія; системний червоний вовчак; гемолітичний уремічний синдром; хорея Сиденгама; герпес вагітних; втрата слуху, пов’язана з отосклерозом, але переконливих доказів зв’язку із застосуванням КПК немає.
- У жінок зі спадковою формою ангіоневротичного набряку екзогенні естрогени можуть індукувати або посилювати симптоми ангіоневротичного набряку.
- При гострих або хронічних порушеннях функції печінки може виникнути необхідність припинити приймання КПК, доки показники функції печінки не повернуться до нормальних значень. При рецидиві холестатичної жовтяниці, що вперше виникла під час вагітності або попереднього застосування статевих гормонів, приймання КПК слід припинити.
- Хоча КПК можуть впливати на периферичну інсулінорезистентність та толерантність до глюкози, немає даних щодо потреби змінювати терапевтичний режим у жінок з діабетом, які приймають низькодозовані КПК (що містять < 0,05 мг етинілестрадіолу). Проте жінки, які страждають на цукровий діабет, повинні перебувати під пильним наглядом протягом періоду приймання КПК, особливо протягом перших місяців застосування. Доведено, що препарат Зоулі не чинить вплив на периферичну інсулінорезистентність та толерантність до глюкози у здорових жінок.
- Посилення депресивних станів, хвороба Крона та виразковий коліт можуть бути пов’язані із застосуванням КПК. Іноді може виникати хлоазма, особливо у жінок з хлоазмою вагітних в анамнезі. Жінки, схильні до виникнення хлоазми, повинні уникати дії прямих сонячних променів або ультрафіолетового опромінювання під час приймання КПК.
- Пацієнтам з такими рідкісними спадковими захворюваннями, як непереносимість галактози, недостатність лактази або синдром недостатності всмоктування глюкози-галактози, не слід приймати цей препарат.
Медичний огляд/консультація
Перед початком або відновленням приймання препарату Зоулі слід провести повне медичне обстеження (включаючи вивчення сімейного анамнезу), а також виключити вагітність. Слід вимірювати артеріальний тиск та, якщо призначено, слід проходити медичний огляд, беручи до уваги протипоказання і застереження. Жінці слід порадити уважно прочитати інструкцію для медичного застосування препарату, а також дотримуватися рекомендацій. Частота і характер подальших періодичних обстежень повинні ґрунтуватися на існуючих нормах медичної практики з урахуванням індивідуальних особливостей кожної жінки.
Необхідно попередити жінку, що пероральні контрацептиви не захищають від ВІЛ-інфекції (СНІДу) та інших захворювань, що передаються статевим шляхом.
Зниження ефективності
Ефективність КПК може знижуватись у випадку, наприклад, пропуску прийому таблеток, розладів з боку шлунково-кишкового тракту упродовж застосування активних таблеток або при використанні інших лікарських засобів.
Контроль циклу
При прийманні пероральних контрацептивів можуть спостерігатися проривна кровотеча або кровомазання, особливо протягом перших кількох місяців. Зважаючи на це, обстеження при появі проривної кровотечі або кровомазання слід проводити після періоду адаптації організму до препарату, що становить приблизно три цикли. Кількість жінок, які застосовують препарат Зоулі і у яких відзначають міжменструальні кров’янисті виділення періоду адаптації, становить від 15 до 20%.
Якщо порушення циклу продовжуються або поновлюються після кількох нормальних циклів, слід розглянути негормональні причини кровотеч і провести відповідні обстеження з метою виключення наявності пухлин та вагітності. До діагностичних заходів можна включити кюретаж.
Тривалість менструальноподібної кровотечі внаслідок відміни гормонів у жінок, які застосовують препарат Зоулі, становить, в середньому, 3–4 дні. У жінок, які застосовують препарат Зоулі, може не настати менструальноподібна кровотеча внаслідок відміни гормонів, вагітність малоймовірна. Під час клінічних досліджень випадки відсутності менструальноподібної кровотечі внаслідок відміни гормонів становили від 18% до 32% (протягом циклів 1–12). Ця відсутність не була пов’язана з підвищеною частотою виникнення проривної кровотечі/кровомазання у наступних менструальних циклах. У 4,6% жінок спостерігалася відсутність менструальноподібної кровотечі внаслідок відміни гормонів у кожному з перших трьох циклів застосування. У цій підгрупі частка жінок, які відмічали відсутність менструальноподібної кровотечі в більш пізніх циклах була високою, відсоток становив від 76% до 87%. З 28% жінок, у яких була відсутня кровотеча відміни принаймні протягом одного циклу (під час 2, 3 або 4 циклу), від 51% до 62% жінок також відмічали відсутність менструальноподібної кровотечі й у більш пізніх циклах. У разі відсутності менструальноподібної кровотечі внаслідок відміни гормонів, за умови, що препарат Зоулі застосовується відповідно до рекомендацій, вагітність малоймовірна. Якщо препарат Зоулі застосовувався нерегулярно або якщо дві поспіль менструальноподібні кровотечі внаслідок відміни гормонів відсутні, необхідно виключити вагітність перед продовженням приймання препарату Зоулі.
Фолієва кислота є важливим вітаміном на ранній стадії вагітності. Рівень фолієвої кислоти в сироватці крові залишаються незмінними під час та після застосування препарату Зоулі протягом 6 послідовних циклів порівняно з вихідним рівнем.
Під час дослідження жінки віком від 21 до 35 років приймали препарат Зоулі без клінічно значущого впливу на мінеральну щільність кісткової тканини.
Дослідження було проведено з метою оцінки впливу препарату Зоулі на показники згортання крові, показники вуглеводного метаболізму, метаболізму ліпідів, функції щитовидної залози, надниркових залоз, а також впливу на андрогени. Резистентність до інсуліну і толерантність до глюкози залишалися без змін, а також не відзначалося клінічно значущого впливу на метаболізм ліпідів та показники згортання крові. Препарат Зоулі підвищував концентрацію білків-носіїв ТБГ і КБГ, а також спричинював незначне підвищення рівня ГЗСГ. Андрогенні параметри, а саме рівень андростендіону, ДГЕА-С, загального та вільного тестостерону, суттєво знижувалися під час застосування препарату Зоулі.
Внутрішньоматкова гістологія досліджувалася у підгрупі жінок (n=32) в одному клінічному дослідженні після 13 циклів лікування. Аномальні результаті відсутні.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Дослідження впливу препарату на здатність керувати автотранспортом або іншими механізмами не проводилися. Однак не спостерігався вплив на здатність керувати автотранспортом або іншими механізмами у жінок, які приймали КПК.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Взаємодія пероральних контрацептивів та інших лікарських засобів, що індукують ферменти, може призводити до проривних кровотеч та навіть до втрати ефективності контрацептиву.
Діючі речовини, що індукують ферменти печінки, і, як наслідок, призводять до підвищення кліренсу статевих гормонів: фенітоїн, фенобарбітал, примідон, бозентан, карбамазепін, рифампіцин, лікарські засоби або рослинні препарати, що містять звіробій, а також, меншою мірою, окскарбазепін, топірамат, фельбамат та гризеофульвін. Інгібітори ВІЛ-протеази з індукуючим потенціалом (наприклад, ритонавір та нелфінавір) та ненуклеозидні інгібітори зворотної транскриптази (наприклад, невірапин та ефавіренз) можуть також негативно впливати на печінковий метаболізм.
При лікуванні препаратами, що індукують мікросомальні ферменти, бар’єрний метод слід застосовувати протягом всього терміну лікування відповідним препаратом і ще протягом 28 днів після припинення його використання. У разі тривалого лікування речовинами, що індукують мікросомальні ферменти, слід передбачити застосування іншого методу контрацепції.
Дослідження щодо вивчення взаємодії препарату Зоулі з іншими лікарськими засобами не проводилось, але були проведені два дослідження застосування рифампіцину та кетоконазолу, відповідно, з високодозованою комбінацією номегестролу ацетатестрадіол (3,75 мг номегестролу ацетату + 1,5 мг естрадіолу) жінкам в період постменопаузи. Супутнє застосування рифампіцину знижує AUC0-∞ номегестролу ацетату на 95 % та збільшує AUC0-tlast естрадіолу на 25 %. Одночасне застосування кетоконазолу (разова доза 200 мг) не змінює метаболізм естрадіолу, тоді як спостерігається підвищення максимальної концентрації (85 %) та AUC0-∞ (115 %) номегестролу ацетату, що не має клінічної значущості. Аналогічні спостереження можна зробити і щодо жінок з репродуктивним потенціалом.
Пероральні контрацептиви можуть негативно впливати на метаболізм інших лікарських засобів. Особливу увагу слід звернути на взаємодію з ламотриджином.
Лабораторні дослідження
Приймання КПК може вплинути на результати певних лабораторних аналізів, в тому числі на біохімічні параметри функції печінки, щитоподібної залози, надниркових залоз та нирок, показники вмісту в плазмі транспортних білків, таких як глобулін, що зв’язує кортикостероїди і фракції ліпідів/ліпопротеїнів, параметри вуглеводного обміну, а також параметри коагуляції і фібринолізу. Зазвичай такі зміни перебувають у межах норми.
Фармакологічні властивості.
Фармакодинаміка.
Номегестролу ацетат є високоселективним прогестагеном, який виробляється з природного стероїдного гормону прогестерону. Номегестролу ацетат має високу спорідненість з прогестероновими рецепторами людини, а також має антигонадотропну активність, опосередковану прогестероновими рецепторами антиестрогенну активність, помірну антиандрогенну активність та не має естрогенної, андрогенної, глюкокортикоїдної та мінералокортикоїдної активності.
Естроген, який міститься в препараті Зоулі, являє собою 17β-естрадіол, природний естроген, ідентичний ендогенному 17β-естрадіолу людини (E2). Цей естроген відрізняється від естрогену – етинілестрадіолу, який використовується у складі інших КПК, відсутністю метильної групи в 17-альфа положенні. Протягом періоду застосування препарату Зоулі середні рівні E2 порівнюються з рівнями E2 під час раннього періоду фолікулярної та пізнього періоду лютеїнової фази менструального циклу.
Протизаплідна дія препарату Зоулі базується на взаємодії різних чинників, найважливішими серед яких є пригнічення овуляції і зміна цервікальної секреції.
Після припинення застосування препарату Зоулі відновлення овуляції відбувається, в середньому, через 21 день після прийому останньої таблетки; більш рання овуляція спостерігається через 16 днів.
Фармакокінетика.
Номегестролу ацетат (NOMAC)
Всмоктування
Номегестролу ацетат швидко всмоктується після перорального застосування.
Максимальна концентрація номегестролу ацетату в плазмі (приблизно 7 нг/мл) досягається за 2 години після прийому разової дози. Абсолютна біодоступність номегестролу ацетату після застосування разової дози становить 63%. Немає даних про клінічно значущий вплив їжі на біодоступність номегестролу ацетату.
Розподіл
Номегестролу ацетат повністю зв'язується з альбуміном (97‑98%), але не зв’язується з глобуліном, що зв'язує статеві гормони (ГЗСГ), або кортикостероїд-зв'язувальним глобуліном (КЗГ). Явний об'єм розподілу номегестролу ацетату в рівноважному стані становить 1,645 ± 576 л.
Біотрансформація
Номегестролу ацетат метаболізується з утворенням декількох неактивних гідроксильованих метаболітів за участю ізоферментів системи цитохрому Р450, а саме CYP3A4 та CYP3A5, з можливою участю CYP2C19 та CYP2C8. Номегестролу ацетат та його гідроксильовані метаболіти проходять фазу 2 екстенсивного метаболізму з утворенням кон'югатів глюкуроніду та сульфату. Явний кліренс в рівноважному стані становить 26 л/г.
Виведення
Період напіввиведення (t1/2) становить 46 годин (від 28 до 83 годин) в рівноважному стані. Період напіввиведення метаболітів не визначений.
Номегестролу ацетат виводиться з організму з сечею та калом. Приблизно 80% дози виводиться з організму з сечею та калом протягом 4 днів. Номегестролу ацетат повністю виводиться через 10 днів, а кількості, що виводяться, вищі при виведенні з калом, аніж із сечею.
Лінійність
Спостерігалося лінійне дозування 0,625‑5 мг (оцінка проводилася серед жінок репродуктивного віку та у період постменопаузи).
Рівноважний стан
ГЗСГ не впливає на фармакокінетику номегестролу ацетату.
Рівноважна концентрація досягається через 5 днів. Максимальна концентрація номегестролу ацетату в плазмі крові (приблизно 12 нг/мл) досягається за 1,5 години після прийому разової дози. Середня концентрація в плазмі крові у стабільному стані становить 4 нг/мл.
Лікарська взаємодія
За даними досліджень in vitro номегестролу ацетат значною мірою не спричинює або не пригнічує жоден фермент цитохрому P450. Також відсутня клінічно значуща взаємодія з транспортером Pgp.
Естрадіол (E2)
Всмоктування
Ефект першого проходження через печінку естрадіолу досягається після перорального застосування. Абсолютна біодоступність становить приблизно 1 %. Немає даних про клінічно значущий вплив їжі на біодоступність естрадіолу.
Розподіл
Розподіл екзогенного естрадіолу подібний до розподілу ендогенного естрадіолу. Естрогени швидко розподіляються по організму, при цьому високі концентрації спостерігаються в органах-мішенях для статевих гормонів. Естрадіол циркулює у крові в основному зв’язаним з ГЗСГ (37 %) та з альбуміном (61 %), тоді як приблизно 1‑2 % залишається незв’язаним.
Біотрансформація
Після перорального застосування екзогенний естрадіол досить швидко метаболізується. Метаболізм екзогенного естрадіолу подібний до метаболізму ендогенного естрадіолу. Естрадіол швидко трансформується у печінці та кишечнику в декілька метаболітів, переважно в естрон, які в подальшому кон'югуються та проходять кишково-печінкову циркуляцію. Існує динамічна рівновага між естрадіолом, естроном та естрон-сульфатом внаслідок різної ферментної активності, включаючи естрадіол-дегідрогеназу, сульфотрансферазу та арилсульфатазу. В процесі окислення естрону та естрадіолу бере участь цитохром P450, переважно CYP1A2, CYP1A2 (високоактивні печінкові ферменти), CYP3A4, CYP3A5, CYP1B1 та CYP2C9.
Виведення
Естрадіол швидко виводиться з циркуляції. Внаслідок метаболізму та кишково-печінкової циркуляції спостерігається великий об'єм циркулюючих естроген-сульфатів та глюкуронідів. Це призводить до дуже мінливого періоду напіввиведення естрадіолу з відкоригованим нульовим рівнем, що становить 3,6±1,5 г після внутрішньовенного введення.
Рівноважний стан
Максимальна концентрація естрадіолу в сироватці крові становить приблизно 90 пг/мл та досягається через 6 годин після введення. Середня концентрація естрадіолу в сироватці крові становить 50 пг/мл, і ці рівні естрадіолу відповідають ранньому та пізньому періоду фази менструального циклу жінки.
Особливі групи пацієнтів
Вплив ниркової недостатності
Дослідження впливу ниркової недостатності на фармакокінетику препарату Зоулі не проводилися.
Вплив печінкової недостатності
Дослідження впливу печінкової недостатності на фармакокінетику препарату Зоулі не проводилися. Однак стероїдні гормони можуть незначним чином метаболізуватися у жінок з порушенням функції печінки.
Етнічні групи населення
Офіційні дослідження з метою оцінки фармакокінетики серед різних етнічних груп не проводилися.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості:
Активні таблетки: круглі таблетки, вкриті плівковою оболонкою, білого або майже білого кольору з гравіюванням «ne» з обох боків.
Таблетки плацебо: круглі таблетки, вкриті плівковою оболонкою, жовтого кольору з гравіюванням «p» з обох боків.
Термін придатності. 3 роки.
Умови зберігання. Зберігати при температурі не вище 30 °С в недоступному для дітей місці.
Упаковка. По 28 таблеток у блістері (24 (активні) таблетки білого кольору та 4 (плацебо) таблетки жовтого кольору), по 1 блістеру в картонній коробці.
Категорія відпуску. За рецептом.
Виробники.
Виробництво за повним циклом
Органон (Ірландія) Лтд, Ірландія/ Organon (Ireland) Ltd, Ireland.
Вторинна упаковка, дозвіл на випуск серії:
Н.В. Органон, Нідерланди/ N.V. Organon, the Netherlands.
Місцезнаходження.
Драйнем Роад Свордс, Ко. Дублін, Ірландія.
Drynam Road Swords, Co. Dublin, Ireland.
5349 АВ Осс, Клоостерштраат 6, Нідерланди.
Моленштраат 110, 5342 СС Осс, Нідерланди.
Kloosterstraat 6, 5349 AB Oss, the Netherlands.
Molenstraat 110, 5342 CC Oss, the Netherlands.



 Кровь на прогестерон
Кровь на прогестерон
 Бесплодный брак или как быть, когда на тесте опять одна полоска. Часть 1. Бесплодие – причины, виды, диагностика
Бесплодный брак или как быть, когда на тесте опять одна полоска. Часть 1. Бесплодие – причины, виды, диагностика
 Ведение пациенток с меноррагиями
Ведение пациенток с меноррагиями
 Бесплодие: роль методов определения овуляторного периода
Бесплодие: роль методов определения овуляторного периода