- Головна
- /
- Статті
- /
- Акушерство, гінекологія, репродуктивна медицина
- /
- Сбор пуповинной крови в акушерско-гинекологической практике
Сбор пуповинной крови в акушерско-гинекологической практике
Трансплантацию гемопоэтических стволовых клеток (ГСК) обычно используют при лечении онкологических и неонкологических заболеваний, таких как острая и хроническая лейкемия, солидные опухоли, иммунные дефициты, врожденные нарушения метаболизма, а также генетические нарушения.
Директива совета канадского общества
акушеров и гинекологов и медицинского
комитета матери и ребенка*
Трансплантацию гемопоэтических стволовых клеток (ГСК) обычно используют при лечении онкологических и неонкологических заболеваний, таких как острая и хроническая лейкемия, солидные опухоли, иммунные дефициты, врожденные нарушения метаболизма, а также генетические нарушения [1]. Стволовые клетки (СК) могут быть получены как от пациента (аутологические СК), так и от родственных или неродственных доноров (аллогенные СК). В настоящее время в медицинской практике в основном используются ГСК костного мозга или периферической крови донора. Предпочтение отдается донорам-сиблингам (родным братьям и сестрам), которые по системе гистосовместимости HLA (human leukocyte antigen) наиболее близки к пациенту. Однако даже в этом случае вероятность подбора HLA-совместимого донора составит только 25%.
В качестве альтернативного источника ГСК при подборе неродственных доноров, наравне с костным мозгом и периферической кровью, сегодня используют пуповинную кровь (ПК). Она содержит значительное количество высокопролиферативных СК, которые способны в случае необходимости полностью восстановить гемопоэтическую систему [2]. На практике уже неоднократно показано, что использование СК ПК характеризуется меньшим риском возникновения реакции «трансплантат против хозяина» и тяжестью ее протекания у HLA-совместимых и HLA-несовместимых реципиентов, простотой сбора без риска и дискомфорта для донора и, кроме того, возможностью оперативного использования протестированного и пригодного трансплантата ГСК, который хранится в замороженном состоянии.
В результате научных и медицинских исследований за последние десятилетия накоплен большой опыт применения ПК. По всему миру созданы банки ПК, в которых хранятся аутологические и аллогенные ГСК ПК. На сегодняшний день в мире уже более 145 000 образцов крови использовано для трансплантации более чем 3000 реципиентам. В большинстве случаев это были трансплантации аллогенных ГСК детям с заболеваниями крови. Также постоянно растет число частных банков ПК, которые непрерывно призывают беременных женщин к сохранению ПК для потенциального использования в будущем, предназначенного их детям или даже им самим [3].
Повышенный интерес общественности, масс-медиа и коммерческих структур к банкированию крови привел к возрастанию требований по информированию, консультированию и процедуре сбора ПК среди канадских женщин детородного возраста. По данным опроса, проведенного среди 443 беременных, 70% из них считали, что их знания о банкировании ПК недостаточны. Большинство респондентов (68%) хотели бы получить дополнительную информацию о сборе, хранении и трансплантации ПК в «школах мам» или от наблюдающего врача акушера-гинеколога. Принимая во внимание растущий спрос на информацию о таких услугах, очень важно, чтобы специалисты перинатальной службы были осведомлены о научных, клинических и этических наработках в области банкирования ПК.
Донирование пуповинной крови
Благотворительное донорство
Донорские банки ПК собирают и сохраняют образцы ПК для потенциального использования всем населением. Беременных агитируют к донированию ПК при рождении ребенка для возможности дальнейшего криосохранения, внесения в регистр и для применения реципиентом, который не может подобрать HLA-совместимого донора. ПК обычно собирается ограниченным кругом медицинских учреждений силами сотрудников банка или специально подготовленного персонала перинатальной практики. Банк ПК обеспечивает персонал родильного зала набором для сбора, а также детальными инструкциями по забору и транспортировке ПК в банк. Текущие расходы донорских банков ПК и медицинских учреждений, осуществляющих забор ПК, обычно обеспечиваются государственным бюджетом, поэтому все услуги для доноров или реципиентов ПК бесплатны. В Европе на сегодняшний день функционирует организация NETCORD, которая объединяет банки ПК под эгидой Международного реестра доноров костного мозга (Bone Marrow Donor Worldwide Registry). Помимо этого, Великобритания и США ведут свои реестры. Канадский банк ПК Альберта (Alberta Cord Blood Bank, ACBB) – единственный на сегодняшний день донорский банк ПК с ограниченным финансированием из Фонда ПК Tanya Smale [4]. К 2005 году в АСВВ было направлено около 5000 образцов ПК, из которых 2700 – обработаны и помещены на хранение; более чем 1000 – HLA-типированы и 4 образца ПК использованы при трансплантации.
Семейное донирование пуповинной крови
Некоторые центры трансплантации рекомендуют семьям, одному из членов которой требуется трансплантация СК, собирать и сохранять ПК для потенциального использования. При заблаговременно проведенном HLA-типировании для определения степени совместимости, ПК может быть использована как для больного ребенка, так и для родителей. Если же этого не происходит, в будущем образец ПК можно также применить для HLA-совместимого сиблинга – брата или сестры новорожденного. Если у новорожденного, чью кровь сохранили, развивается заболевание, в будущем его сохраненную ПК можно будет использовать в лечении с применением новых методов заместительной генной терапии. Целенаправленное донирование ПК для членов семьи обычно обеспечивается частными банками ПК, а в отдельных случаях она может быть сохранена также и в публичном (донорском) банке ПК.
Аутологическое сохранение пуповинной крови
Частные банки ПК предлагают будущим матерям сохранять ПК их новорожденных детей бессрочно, на случай если ребенку понадобится в будущем лечение с использованием СК. В настоящее время пока трудно сказать, как долго замороженные клетки ПК могут оставаться жизнеспособными. Кроме того, сложно оценить вероятность использования аутологического образца ПК. По оценкам ученых и медиков, она может понадобиться до 10-летнего возраста, и вероятность случая составляет от 1:200 000 до 1:10 000 [5]. По имеющимся данным, менее 5% сохраненных аутологических образцов были использованы в клинике.
Средняя стоимость услуг частных банков ПК в Северной Америке варьируется от 500 до 2000 дол. США с платой за хранение от 50 до 100 дол. в год. В Канаде в настоящее время насчитывается шесть частных банков ПК [6].
Отношение беременных к банкированию пуповинной крови
Недавно было проведено два исследования по оценке мнения будущих матерей о банкировании ПК [7, 8]. В ходе опроса канадских беременных 86% респондентов ответили, что сохранили бы ПК своих новорожденных детей в донорских банках ПК, 14% – выбрали хранение в частном банке для «личного» использования. Женщины, которые предпочли донирование ПК, при принятии решения руководствовались альтруизмом – возможностью пожертвования своего образца ПК «нуждающимся», а также стоимостью аутологического хранения. Что касается других потенциальных возможностей применения донированных образцов ПК, то 67% беременных согласились бы сохранять ПК своих детей для проведения научно-исследовательских работ, 39% – для использования в генной терапии и 33% – для исследований в области производства лекарственных препаратов. В Швейцарии анонимная анкета была распространена среди небольшой группы женщин 6 мес спустя после донирования ними ПК. Вопросы касались этической и эмоциональной позиции женщин, следующих за передачей ПК в банк, беспокойства по поводу генетических тестов и исследований, а также готовности сохранять ПК при последующих беременностях. Большинство из них (96,1%) утверждали, что сдали бы ПК снова, и все респонденты были уверены, что их решение было этичным. Что касается потенциальных рисков проведения генетических исследований ПК (клонирование, влияние на гены клеток при их «насильственной» дифференцировке в результате воздействия определенных физико-химических факторов) и проведения дальнейших экспериментов с ней, то наблюдалась существенная корреляция между негативным отношением и решением не сдавать ПК вновь.
Сбор пуповинной крови
Существует два основных метода забора ПК из пуповинной вены.
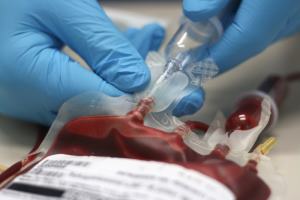
При первом методе ПК собирают после рождения ребенка и пересечения пуповины, когда плацента находится еще в утробе (in utero). При втором – после рождения ребенка и отделения и рождения плаценты (ex utero). Сбор ПК с применением метода еx utero должен выполняться в максимально кратчайшие сроки после рождения плаценты с участием квалифицированного персонала в отдельном боксовом помещении. Собирается ПК в стандартный мешок для сбора донорской крови с антикоагулянтом цитрат-фосфат-декстрозой, насыщенной или обедненной аденином. Плацента в данном случае укладывается на специально предназначенную для сбора ПК рамку, и кровь собирается самотеком из самых трудных и отдаленных мест при помощи венепункции. Пуповину тщательно обрабатывают антисептическим раствором, после чего в вену вводят иглу трансфузионной системы.
Данный метод обычно используется донорскими банками ПК, где сохраняются образцы, объем которых составляет не менее 40 мл цельной крови. Среди показаний к такому способу забора ПК называют кесарево сечение, патологические или сложные роды, продолжительные роды (более 15 ч), длина пуповины более 30 см, переношенная беременность, ребенок весом 3500 г и вес плаценты более 700 г. Следует отметить, что применение метода еx utero при сборе ПК не является предпочтительным, поскольку требуется использование дополнительных ресурсов: оснащение и время для установки (зачастую до 25 мин), достаточная площадь родильного зала или палаты, дополнительный персонал. Кроме того, в 20-30% случаев существует риск микробной контаминации вагинальной флорой при сборе ПК.
Сбор ПК методом in utero осуществляется непосредственно после рождения ребенка до момента отделения последа и рождения плаценты [9-11].
После пережатия пуповины особое внимание следует обращать на дезинфекционную обработку места венепункции. Для уменьшения риска микробной контаминации вагинальной флорой матери для сбора ПК используют закрытые трансфузионные системы (рис. 1а, 1б, 1в). Очень важно, чтобы вся процедура сбора образца ПК по времени не превышала 2-4 мин. Общее время, необходимое для сбора ПК методом in utero, не должно превышать 10 мин. Этот метод предпочтителен и не требует привлечения дополнительного персонала акушерско-гинекологической службы.
Среди факторов, которые могут неблагоприятно повлиять на объем собираемой ПК, можно назвать следующие: недоношенная беременность, множественная беременность, гипертонические состояния у рожениц, внутриматочные нарушения развития плода, анормальное строение плаценты, незапланированное кесарево сечение, стремительные роды [12]. Факторы, благоприятствующие лучшему сбору, – отсутствие осложнений во время протекания беременности и родов, а также наличие информации об анамнезе и результатах скрининговых тестов.
При решении женщины сохранить ПК для «личного» использования, специалистами перинатальных служб и частного банка отдается предпочтение сбору ПК методом in utero с дальнейшей доставкой собранного образца ПК в банк. В этом случае надо быть готовым к обучению и постоянному информированию медицинского персонала перинатальной службы о технологии сбора ПК, соблюдении мер предосторожности с акцентированием внимания медперсонала на возможных рисках для выполнения качественного сбора ПК. В Канаде сбор ПК, в случае если позволяет акушерско-гинекологическая ситуация, независимо от формы собственности банка ПК (частный или донорский) осуществляется по методу in utero.
Для оптимизации и увеличения собираемого объема ПК существуют некоторые рекомендации для специалистов перинатальной службы. Рабочая группа Grisaru проводила сбор ПК методом in utero. Исследователи обратили внимание, что время с момента рождения ребенка до нанесения зажимов на пуповину не должно превышать 30 с. Второе усовершенствование, разработанное этой группой, непосредственно касалось метода сбора ПК. При проведении стандартной техники in utero до начала сбора ПК в пуповинную вену шприцом вводили незначительное количество физиологического раствора (0,9-процентного NaCl), после чего уже проводили венепункцию. Было установлено, что такие простые манипуляции приводят к увеличению объема собранной ПК почти в 2,5 раза: среднее количество собранной ПК при использовании физиологического раствора составляло 176 мл, в то время как при обычной процедуре in utero самотеком средний объем собранной ПК был 76 мл [13, 14].
Кроме того, следует рассмотреть приоритетность используемых методoв in utero и ex utero. При любом способе сбора ПК объем колеблется в среднем от 50 до 150 мл. В научной литературе было несколько сообщений о ретроспективных сопоставлениях двух методик сбора ПК при физиологических родах и при проведении кесарева сечения. По результатам работы Laskey и соавт. было показано, что оба способа вполне сопоставимы, и нет существенных различий в получаемом объеме и количестве ядросодержащих клеток собранной ПК. Тем не менее показатели отбраковки собранной ПК из-за проблем с маркированием, микробной контаминации и коагуляции при обеих процедурах примерно одинаковые. Рабочая группа Sparrow показала, что при сравнении двух методов не существует значительных отличий в получаемых объемах ПК, концентрации лейкоцитарных клеток и общего количества ядросодержащих клеток. В недавно опубликованной работе Solves и соавт. сообщалось о получении большего объема ПК, количестве ядросодержащих клеток и CD-34 клеток при использовании метода in utero по сравнению с методом ех utero. Тем не менее при проведении кесарева сечения результаты по перечисленным показателям сопоставимы с методом in utero при физиологических родах. Однако некоторые банки ПК не принимают в обработку для дальнейшего сохранения образцы ПК, собранные при кесаревом сечении, из-за повышенного риска вагинальной микробной контаминации [15-17].
Wong и соавт. представили результаты сбора ПК у женщин одновременно двумя методами – in utero и ех utero. Было установлено, что концентрация ядросодержащих клеток и колониеформирующих единиц в крови выше при использовании техники in utero. И только при проведении рандомизированных сравнительных исследований методов in utero и ех utero Surbek с соавт. показали, что большее количество ядросодержащих клеток можно получить исключительно при постановке метода in utero. Кроме того, в рамках этого же исследования была дана характеристика собранной ПК во время кесарева сечения и проведено сравнение с ПК, собранной методами in utero и ех utero. Результаты показали, что объем ПК и количество ядросодержащих клеток были выше при технологии in utero [18, 19].
В заключение можно отметить, что вопрос о предпочтении того или иного метода сбора ПК на сегодняшний день является открытым. С одной стороны, при in utero технологии можно получить больший объем ПК и более высокую концентрацию ядросодержащих клеток в ней. С другой стороны, сбор ПК методом ех utero имеет свои преимущества с точки зрения перинатальной службы. Возможно, со временем эти методы будут дополнительно пересмотрены, уточнены и усовершенствованы.
Кроме того, следует помнить, что при сборе ПК очень важно оценивать работу акушерско-гинекологического персонала. В большинстве случаев именно от бдительности сотрудников перинатальной службы зависят бактериальная чистота, объем и качество собираемой ПК. С целью выработки оптимизированной процедуры качественного сбора ПК медицинский персонал, принимающий участие в сборе ПК (гинекологи, акушеры, семейные врачи, персонал родильных домов и палат), должен иметь четкие инструкции и предписания по всем этапам подготовки, сбора и доставки ПК в банк ПК.
Этические вопросы
В настоящее время существует целый перечень этических вопросов, связанных с клиническим и экспериментальным использованием ПК. Среди прочих – определение этических процедур по привлечению доноров, информированное согласие на донирование ПК в публичные или частные банки для исследований. Вопросы, касающиеся неприкосновенности частной жизни человека, соблюдения конфиденциальности, а также прав собственности на ПК являются весьма сложными и противоречивыми. Остаются спорными и вопросы информированности донора ПК о выявлении инфекций в крови и генетических аномалий. Наконец, на сегодняшний день ведутся серьезные дебаты о значимости и приоритетности существования частных и донорских банков ПК, в частности связанные с доступностью ПК как ценного источника СК и ресурса для клинической практики и проведения дальнейших научных исследований.
Привлечение доноров
Будущим родителям присуще стремление сделать все возможное для своих детей. Именно поэтому они очень восприимчивы к призывам и обещаниям рекламы о потенциальных выгодах банкирования ПК. Частные банки представляют ПК как «биологическую страховку» и гарантируют преимущества ее сохранения. Коммерческий подход позволяет проводить более широкое информирование населения с привлечением масс-медиа, интернета, прямых рассылок рекламной продукции, включающей видео и яркие полиграфические издания. Донорские банки ПК используют свои мотивационные приемы. Стараясь оставаться объективными, они затрагивают альтруистические наклонности людей – «безвозмездно», «ради спасения людей».
Для принятия решения семьи о сохранении ПК родители в первую очередь должны быть аккуратно и непредвзято проинформированы о потенциальных выгодах и рисках хранения ПК как в частных, так и в донорских банках. Психологическое воздействие, вызывающее чувство вины и дополнительной ответственности за решение не сохранять ПК, исключено. Кроме того, недопустимо принудительное донирование ПК для представителей этнических меньшинств. Выбор должен быть свободным и независимым.
Информированное согласие
Ни у кого не возникает сомнения, что новорожденный младенец не может дать согласия на донирование, тестирование и долгосрочное хранение ПК. Его родители должны принять это решение за него. Существует мнение о том, что ПК является «биологическим отходом» процесса родов, который просто может быть использован для трансплантации. Именно поэтому некоторые специалисты считают, что информированное согласие родителей на сбор и использование ПК не требуется. На сегодняшний день банками ПК разработано и существует несколько форм информированного согласия родителей, в числе которых – дородовое и интранатальное. В информированном согласии должны быть учтены все возможные нюансы по проведению процедуры сбора ПК, финансовые вопросы, раскрыты профессионализм персонала, материально-технические возможности, а также другие приоритеты сохранения в частных или донорских банках ПК [20-22].
Будущей матери для осознанного согласия необходимо информирование о процедурах, которые используются при сборе, обработке, тестировании, хранении, и о возможностях использования ПК. Она должна знать, какие именно меры будут приняты для того, чтобы в полной мере были соблюдены все положения сохранения конфиденциальности медицинской информации о ее образце ПК. Кроме того, матери должна быть предоставлена полная информация о собственных действиях и работе персонала банка в случае, если у ребенка будет выявлено заболевание, требующее лечения СК ПК.
В случае принятия решения о хранении собранного образца ПК в частном банке, в информированном согласии, которое предоставляется матери, должны быть освещены вопросы частной собственности относительно депозита ПК, его место хранения, а также четко представлены все материальные затраты, которые повлечет за собой хранение ПК в будущем. Принятие решения и подписание согласия – процесс трудоемкий. Интранатальная практика показала, что во время родов и переживаемого женщиной физического и эмоционального стресса, подписание информированного согласия сложнее, если не невозможно. Откладывание подписания информированного согласия на период после сбора ПК хотя и повышает эффективность, поскольку сокращает издержки работы персонала банка без дополнительного беспокойства медицинского персонала перинатальной практики, тем не менее кровь собирается без необходимой осведомленности и обязательного согласия родителей. Рабочая группа по этическим вопросам банкирования ПК (The Working Group on Ethical Issues in Umbilical Cord Blood Banking) и Американская академия педиатров (American Academy of Pediatrics) считают подобные случаи подписания информированного согласия (во время родов и после сбора) неэтичными и настоятельно рекомендует получать согласие женщины на сбор ПК в ходе оказания дородовой помощи с дальнейшим подтверждением после сбора.
Конфиденциальность
На сегодняшний день дискутабельным остается вопрос: должна ли отслеживаться связь образца ПК с донором в публичном банке? Сторонники этого положения считают, что установление связи образец-донор позволит донору и реципиенту быть информированными о позитивных результатах анализов и получать надлежащее направление и лечение. Кроме того, это позволит им получать результаты более поздних скрининговых исследований. Зарегистрированные доноры также смогут давать осознанное согласие на тестирование ПК, которое не было предусмотрено при сборе ПК.
К сожалению, автономия донора может быть нарушена в случае, если персональная и/или медицинская информация попадает в страховые компании, школы или к работодателям. Кроме того, не исключены негативные моменты при установлении серьезных врожденных или инфекционных заболеваний, которые пока еще не излечимы, таких как, например, ВИЧ.
Донор и информация о нем должны быть полностью скрыты от реципиента или заинтересованных лиц. Это необходимо для ограждения донора от повторных обращений за СК в будущем.
В целях обеспечения личной безопасности донора, защиты его частной жизни, в настоящее время все результаты тестирования ПК и личная информация должны быть тщательнейшим образом защищены и соблюдена полная конфиденциальность отношений донора с банком ПК [6].
Рекомендации
1. Персонал перинатальной медицинской практики должен быть информирован об обещающих перспективах клинического потенциала ГСК ПК, а также о показаниях для сбора ПК, хранения и применения, основанных на надежных научных доказательствах.
2. Сбор ПК может предназначаться для брата или сестры, а также для родителей, нуждающихся в трансплантации СК, в случае невозможности получения HLA-идентичных клеток костного мозга или периферической крови у близких родственников (сиблинги, родители).
3. ПК может рассматриваться в качестве аллогенного трансплантата для ребенка, который не имеет HLA-идентичного донора.
4. ПК может применяться в качестве аллогенного трансплантата для подростков и юношей с онкологическими заболеваниями крови, которым требуется срочное проведение лечения, но нет доступного HLA-идентичного донора.
5. Следует поощрять альтруистическое донорство ПК для последующей аллогенной трансплантации у женщин, вынашивающих ребенка, с привлечением персонала перинатальной медицинской практики.
6. Родильные подразделения медицинских учреждений должны проходить подготовку по унифицированным стандартизированным процедурам сбора крови для обеспечения оптимизации объема собираемой ПК и снижения отбраковки при тестировании на микробную контаминацию и коагуляцию.
7. Оказание акушерско-гинекологической помощи во время родов должно быть приоритетом. Действия по оптимизации объема ПК должны осуществляться на усмотрение перинатальной группы, принимающей роды, с учетом безопасности матери и ребенка.
8. Сбор ПК следует проводить после рождения ребенка, до момента рождения плаценты, с использованием одноразовых закрытых трансфузионных систем и соблюдением процедур, позволяющих минимизировать риск контаминации вагинальной микрофлорой.
9. Донорские и частные банки пуповинной крови должны строго придерживаться стандартизированных процедур транспортировки, тестирования, HLA-типирования, криоконсервирования и длительного хранения ПК для предотвращения нанесения вреда реципиенту, исключения риска передачи трансмиссивных инфекций и соответственно повышения эффективности трансплантации СК ПК.
10. Политика и процедуры должны быть разработаны специалистами перинатальной практики и органами здравоохранения так, чтобы соответствовать нормам сохранения ПК в частных и публичных банках.
11. Информированное согласие на сбор ПК банки должны получать в ходе перинатального наблюдения женщин до наступления родов.
12. Донору ПК должна быть обеспечена конфиденциальность медицинской и личной информации.
* Материалы предоставлены Семейным банком пуповинной крови «ГЕМАФОНД»
Литература
1. Armitage J.O. Bone marrow transplantation // N. Engl. J. Med. – 1994. – V. 330. – P. 827-38.
2. Broxmeyer H.E., Douglas G.W., Hangoc G., Cooper S., Bard J., English D. et al. Human umbilical cord blood as a potential source of transplantation hematopoietic stem/progenitor cells // Proc. Natl. Acad. Sci. USA. – 1989. – V. 86. – P. 3828-32.
3. Lewis I.D. Clinical and experimental uses of umbilical cord blood // Intern. Med. J. – 2002. – V. 32. – P. 601-9.
4. Alberta Cord Blood Bank. Help the ACBB. Available at: http://www.acbb.ca // Web site updated October 17, 2003. – Accessed October 28, 2003.
5. Kline R.M. Whose blood is it anyway? // Sci. Am. – 2001. – V. 284. – P. 42-49.
6. Armson B.A., Crane J., Brunner M. et al. Umbilical cord blood banking: implication for perinatal care providers // JOGC. – 2005. – N. 156. – P. 263-274.
7. Fernandez C.V., Gordon K., Van den Hof M., Taweel S., Baylis F. Knowledge and attitudes of pregnant women with regard to collection, testing and banking of cord blood stem cells // Can. Med. Assoc. J. – 2003. – V. 168. – P. 695-698.
8. Danzer E., Holzgreve W., Troeger C., Kostka U., Steimann S., Bitzer J. et al. Attitudes of Swiss mothers toward unrelated umbilical cord blood banking 6 months after donation // Transfusion. – 2003. – V. 43. – P. 604-608.
9. Fraser J.K., Cairo M.S., Wagner E.L., Mc Curdy P.R., Baxter-Lowe L.A., Carter S.L. et al. Cord Blood Transplantation Study COBLT): cord blood banks standard operating procedures // J. Hematother. – 1998. – V. 7. – P. 521-561.
10. Jones J., Stevens C.E., Rubinstein P., Robertazzi R.R., Kerr A., Cabbad M.F. Obstetric predictors of placental / umbilical cord blood volume for transplantation // Am. J. Obstet. Gynecol. – 2003. – V. 188. – P. 503-509.
11. Ballen K.K., Wilson M., Wuu J., Ceredon A.M., Hsieh C., Stewart F.M. et al. Bigger is better: maternal and neonatal predictors of hematopoietic potential of umbilical cord blood units // Bone Marrow Transplant. – 2001. – V. 27. – Р. 7-14.
12. Bertolini F., Lazzari L., Lauri E., Corsini C., Castelli C., Gorini F. Comparative study of different procedures for the collection and banking of umbilical cord blood // J. Hematother. – 1995. – N. 4. – P. 29-35.
13. Grisaru D., Deutsch V., Pick M., Fait G., Lessing J.B., Dollberg S. et al. Placing the newborn on the maternal abdomen after delivery increases the volume and CD34+ cell content in the umbilical cord blood collected: an old maneuver with new applications // Am. J. Obstet. Gynecol. – 1999. – V. 180. – P. 1240-1243.
14. Elchalal U., Fasouliotis S.J., Shtocckheim D., Brautbar C., Schenker J.G., Weinstein D. et al. Postpartum umbilical cord collection for transplantation: a comparison of three methods // Am. J. Obstet. Gynecol. – 2000. – V. 182. – P. 227-232.
15. Lasky L.C., Lane T.A., Miller V.P., Lindgren B., Patterson H.A., Haley N.R. et al. in utero or ex utero blood collection: which is better? // Transfusion. – 2002. – V. 42. – P. 1261-1267.
16. Sparrow R.L., Cauchi J.A., Ramadi L.T., Waugh C.M., Kirkland M.A. Influence of mode of birth and collection on WBC yields of umbilical cord blood units // Transfusion. – 2002. – V. 42 (2). – P. 210-215.
17. Solves P., Moraga R., Sancedo E., Perales A., Soler M.A., Larrea L. et al. Comparison between two strategies for umbilical cord blood collection // Bone Marrow Transplant. – 2003. – V. 4. – P. 269-273.
18. Surbek D.V., Visca E., Steinmann C., Tichelli A., Schatt S., Haln S. et al. Umbilical cord blood collection before placental delivery during cesarean delivery increases cord blood volume and nucleated cell number available for transplantation // Am. J. Obstet. Gynecol. – 2000. – V. 183. – P. 218-221.
19. Pafumi C., Farina M., Bandierra S., Cavallaro A., Pernicone G., Russo A. et al. Differences in umbilical cord blood units collected during cesarean section, before or after the delivery of the placenta // Gynecol. Obstet. Invest. – 2002. – V. 54. – P. 73-77.
20. Sugarman J., Kaalund J., Kodish E., Marshall M.F., Reisner E.G., Wilford B.S. et al. Ethical issues in cord blood banking // JAMA. – 1997. – V. 278. – P. 938-943.
21. Royal College of Obstetricians and Gynaecologists. Umbilical cord blood banking. Scientific Advisory Committee. Opinion Paper 2. October 2001.
22. Burgio G.R., Gluckman E., Locatelli F. Ethical reappraisal of 15 years of cord-blood transplantation // Lancet. – 2003. – V. 361. – P. 250-252.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Клеточная терапия: что нас ожидает завтра?
Стволовые клетки в науке и практике
Клеточная терапия: что нас ожидает завтра?
Стволовые клетки в науке и практике
 Пуповинная кровь: перспективы применения стволовых клеток
Пуповинная кровь: перспективы применения стволовых клеток
 Перспективы использования пуповинной крови в современной медицине
Перспективы использования пуповинной крови в современной медицине