- Головна
- /
- Статті
- /
- Гепатологія
- /
- Основные причины кровотечений при заболеваниях печени
Основные причины кровотечений при заболеваниях печени
Портальная гипертензионная гастропатия (ПГГ), варикоз вен желудка и пищевода, сосудистая эктазия антрального отдела желудка (GAVE-синдром – gastric antral vascular ectasia syndrome) – важнейшие причины, приводящие к развитию кровотечений при различных заболеваниях печени, – встречаются в 17-41% случаев нарушения кровообращения в портальной системе [1, 5, 8, 15].
При ПГГ и GAVE-синдроме формируются множественные анастомозы между микрососудистым руслом слизистой оболочки желудка (СОЖ), расширенными венами, прекапиллярами желудка и пищевода. При этом в СОЖ развиваются изменения, для которых характерно сочетание различных макроскопических признаков при отсутствии микроскопических воспалительных изменений и эрозирования СОЖ. Оценка состояния СОЖ при этих заболеваниях зачастую противоречива и дискутабельна в плане корреляций макро- и микроскопической картины [9].
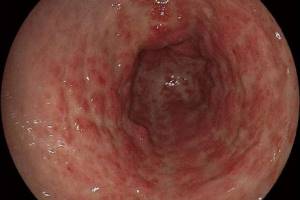
 GAVE-синдром чаще встречается у женщин среднего возраста, которые страдают различными аутоиммунными заболеваниями. Патогенез этого синдрома до конца не ясен. Обычно он проявляется наличием красных пятен в антральном отделе желудка, кардии и двенадцатиперстной кишке, которые имеют вид подслизистых геморрагий (рис. 1). Почти 2/3 больных с GAVE-синдромом не имеют цирроза печени или портальной гипертензии. У больных циррозом печени дифференциальная диагностика GAVE-синдрома и ПГГ может быть сложной. При GAVE-синдроме биопсия СОЖ из антрального или кардиального отделов желудка позволяет обнаружить расширения прекапилляров СОЖ с фибриновыми тромбами, фиброзно-мышечную гиперплазию и фиброгиалиноз. Считается, что в этиологии GAVE-синдрома ведущую роль играет шунтирование или гипердинамическая циркуляция.
GAVE-синдром чаще встречается у женщин среднего возраста, которые страдают различными аутоиммунными заболеваниями. Патогенез этого синдрома до конца не ясен. Обычно он проявляется наличием красных пятен в антральном отделе желудка, кардии и двенадцатиперстной кишке, которые имеют вид подслизистых геморрагий (рис. 1). Почти 2/3 больных с GAVE-синдромом не имеют цирроза печени или портальной гипертензии. У больных циррозом печени дифференциальная диагностика GAVE-синдрома и ПГГ может быть сложной. При GAVE-синдроме биопсия СОЖ из антрального или кардиального отделов желудка позволяет обнаружить расширения прекапилляров СОЖ с фибриновыми тромбами, фиброзно-мышечную гиперплазию и фиброгиалиноз. Считается, что в этиологии GAVE-синдрома ведущую роль играет шунтирование или гипердинамическая циркуляция.
ПГГ встречается в более чем 40% случаев при циррозе печени и часто сочетается с варикозным расширением вен пищевода и желудка. Диагноз ПГГ обычно устанавливается при эндоскопическом исследовании (рис. 2), при этом из-за опасности кровотечения биопсия проводится редко. Однако для дифференциальной диагностики с GAVE-синдромом она просто необходима [7]. Частота ПГГ повышается при увеличении тяжести заболеваний печени и тесно коррелирует с наличием пищеводных и желудочных варикозов. Более того, наличие ПГГ является предиктором будущего кровотечения из пищеводных варикозов. Облитерация пищеводных варикозов может увеличивать частоту ПГГ [13].
Эндоскопически ПГГ имеет вид мозаики, кожи змеи или арбузной корки и сопровождается изменениями в СОЖ, которые чаще всего локализованы в области тела или дна желудка. Такие изменения находят практически у 60% больных циррозом печени. Умеренная ПГГ отмечается у 65-90% больных, тяжелая – у 10-35%.
Существует несколько вариантов классификаций этой патологии. Наиболее простая из них (T.T. McCormack et al.) предполагает две степени поражения СОЖ. При ПГГ легкой степени эндоскопически выявляют мозаичный рисунок СОЖ, при тяжелой – в дополнение к мозаичному рисунку появляются диффузные темно-красные пятна, подслизистые геморрагии. Эта классификация удобна для прогнозирования вероятности развития кровотечения.
Так, при легкой степени ПГГ риск кровотечения составляет 3,5-31%, при тяжелой – 38-62%. Легкая ПГГ выявляется в 49%, а тяжелая – в 14% случаев портальной гипертензии. Существуют два более сложных варианта классификации, предложенных Новым итальянским эндоскопическим клубом и Tanoue и соавт. В первой выделены три степени ПГГ: легкая, средней тяжести и тяжелая. Вторая выделяет гастропатию І, ІІ и ІІІ степеней, причем І степени соответствует умеренно гиперемированная или застойная СОЖ, ІІ – яркая гиперемия и четко визуализирующаяся ретикулярная сеть, разделяющая участки отечной СОЖ, ІІІ – признаки ІІ степени в сочетании с точечными кровоизлияниями.
Северный итальянский клуб эндоскопистов (NIEK) почти 18 лет назад предложил макроскопическую классификацию ПГГ (табл.), которая позволила четко определять степень тяжести заболевания [7, 13]. При этом в СОЖ обычно наблюдаются слизистые и подслизистые расширения сосудов без элементов воспаления.
Выделяют 3 степени выраженности мозаично-подобной структуры:
· легкую – желудочная ареола умеренно-розовая, однородной окраски;
· умеренную – центр ареолы красного цвета;
· тяжелую – вся ареола равномерно ярко-красного цвета.
Особенности венозного кровообращения в системе воротной вены
 Любая обструкция или повышение резистентности кровотока (реже патологическое усиление портального кровотока) может приводить к портальной гипертензии, которая обусловливает повышение давления в портальной вене >12 мм рт. ст. Лидирующими причинами развития портальной гипертензии являются алкогольные и вирусные циррозы печени, у детей – тромбоз воротной вены [1].
Любая обструкция или повышение резистентности кровотока (реже патологическое усиление портального кровотока) может приводить к портальной гипертензии, которая обусловливает повышение давления в портальной вене >12 мм рт. ст. Лидирующими причинами развития портальной гипертензии являются алкогольные и вирусные циррозы печени, у детей – тромбоз воротной вены [1].
Повышение давления в портальной вене вызывает развитие портосистемной коллатеральной циркуляции, которая сопровождается портосистемным шунтированием и приводит к нарушению внутрипеченочной циркуляции крови, а также расстройству лимфатической дренажной системы.
Все это способствует развитию тяжелых осложнений при хронических диффузных заболеваниях печени, среди которых часто встречаются печеночная гастропатия и варикозное расширение вен пищевода и желудка, которые могут приводить к кровотечениям [10, 15].
Причины развития портальной гипертензии:
· повышение резистентности кровотока:
– надпеченочная портальная гипертензия (болезнь и синдром Баддa-Киари, констриктивный перикардит, застойная сердечная недостаточность);
– внутрипеченочная портальная гипертензия (цирроз печени, острый алкогольный гепатит, синдром Рея, острый жировой гепатоз беременных, шистосомоз, идиопатическая портальная гипертензия);
– подпеченочная портальная гипертензия (тромбоз воротной вены или ее обструкция, врожденная атрезия или стеноз воротной вены, тромбоз селезеночной вены, компрессия извне (опухоль, киста, инфильтрат и др.);
· увеличение портального кровотока (артериопортальная венозная фистула, увеличение селезеночного кровотока).
Анатомо-физиологические особенности системы воротной вены
Воротная вена и ее ветви не имеют клапанов, поэтому кровоток здесь возможен в двух направлениях [4]. Венозная система тесно взаимосвязана с сетью лимфатических сосудов. Между этими системами имеется множество анастомозов в разных частях тела [4]. Воротная вена делится на две части: правая следует к правой доле печени, а левая – к левой. Как правило, левая ветвь воротной вены снабжает кровью хвостатую и квадратную доли печени [4, 10].
Объем кровотока в воротной вене относительно небольшой – 1200-1500 мл/мин, а давление сравнительно низкое – 5-10 мм рт. ст., поэтому кровоток здесь зачастую носит ламинарный характер. В левую долю печени по левой ветке воротной вены поступает кровь из селезенки, поджелудочной железы, а также левой половины толстой кишки и желудка.
В правую ветвь воротной вены, которая питает кровью правую долю печени, в основном поступает кровь от тонкого кишечника, где происходят основные процессы пищеварения, осуществляется всасывание питательных веществ, а также от правой половины толстого кишечника [4].
Из особенностей строения сосудистой системы печени следует отметить, что венозная кровь от печени оттекает по печеночным (коротким) венам, которые впадают в нижнюю полую вену (их обычно три), а вена хвостатой доли у взрослого человека отстоит ниже места впадения вен печени примерно на 2-2,5 см. Это важно в тех случаях, когда поражаются печеночные вены (симптом и болезнь Бадда-Киари). При этом резко увеличивается хвостатая доля, так как она берет на себя большую нагрузку в перераспределении крови, оттекающей из печени.
Венозная сосудистая система гастроэзофагеального соединения имеет свои особенности для осуществления связи между системным и портальным кровотоком. В этой системе ведущую роль играют связи между левой желудочной, коронарной и задней желудочной венами. Под терминами «коронарная вена» и «задняя желудочная вена» подразумевают соответственно анастомозы между левой и правой желудочными венами, а также левой и короткими желудочными венами. В норме они не выражены и имеют клиническое значение при гемодинамических нарушениях, развивающихся при портальной гипертензии [2].
Между пищеводом и желудком выделяют 4 сосудистые зоны. При ПГГ, GAVE-синдроме, варикозе вен желудка и пищевода они играют роль естественных портокавальных шунтов и обозначены как желудочная, палисадная, перфорирующая и стволовая зоны [2].
Палисадная зона – наиболее важное звено в сосудистой структуре гастроэзофагеального соединения. Вены здесь находятся преимущественно в собственной пластинке. Их поверхностное расположение снижает до минимума сопротивление венозному кровотоку, которое в противном случае возникало бы в зоне высокого давления в области нижнего пищеводного сфинктера.
Большинство сосудов мелкого калибра в палисадной зоне, имеющих продольный ход параллельно друг другу, идеально приспособлены к физиологическим колебаниям давления при дыхании, которые приводят к двунаправленности циркуляции. Когда венозный отток происходит в каудальном направлении, желудочная зона собирает и дренирует кровь в систему воротной вены [2].
При нарушении кровотока в печени и селезенке кровь устремляется в краниальном направлении в венозные стволы и многочисленные вены желудка и пищевода (вены – «скрипичные ключи») в перфорирующей зоне, которые посылают кровоток кнаружи от просвета пищевода, преимущественно в непарную вену и далее в верхнюю полую вену [2, 10].
Эндоскопическая картина
Картина СОЖ при ПГГ (ее еще иногда описывают как «кожу аллигатора» или «змеиную кожу») представляет собой множественные небольшие полигональные приподнятые участки красной (розовой или вишневой) слизистой, разделенные ретикулярной сетью прожилок белесого или желтоватого цвета. В более тяжелых случаях такая картина дополняется подслизистыми кровоизлияниями и даже просачиванием крови из СОЖ. Данная патология наиболее часто локализуется в теле и дне желудка. ПГГ часто, но далеко не всегда, сочетается с варикозно расширенными венами пищевода или желудка [3, 8].
Мозаичный тип поражения СОЖ чаще отмечается в антральном отделе желудка, красноточечный тип – в любом отделе желудка, а вишневые пятна – в проксимальных отделах желудка [7].
Кроме того, при эндоскопическом исследовании иногда удается обнаружить варикоз в кардиальном отделе желудка, который можно ошибочно принять за полипоз желудка. Варикозно расширенные вены в этом отделе желудка чаще всего имеют синеватый оттенок. При этом можно выявить и варикозно расширенные вены пищевода [1, 7].
При затруднении венозного оттока, вызванного тромбозом селезеночной вены или опухолью, обнаруживается изолированное расширение вен желудка. Эндоскопическая картина при ПГГ может напоминать вид арбуза, при этом на складках СОЖ, расходящихся от привратника, видна линейная эритема. При гистологическом исследовании обнаруживается атрофия СОЖ и полнокровие (эктазия) поверхностных сосудов. Эктазия сосудов описывается как скопление красных пятен, линейно расположенных в антральном отделе желудка.
ПГГ с преобладанием в проксимальных отделах желудка расценивается как диффузный тип желудочной сосудистой эктазии. Объем жидкости в СОЖ повышается с одновременным снижением степени оксигенации, что подтверждает застойный характер патологических изменений и приводит к снижению защитных механизмов СОЖ [3, 10, 15, 17].
В большинстве случаев воспаление в СОЖ связано с наличием в ней Н. рylori. При увеличении тяжести течения портальной гастропатии частота выявления Н. pylori уменьшается. Ряд исследователей не находит коррелятивных связей между степенью колонизации Н. рylori, тяжестью портальной гастропатии и степенью расширения вен пищевода при портальной гипертензии [7, 10].
Патогенетические аспекты портальной гипертензии в связи с сосудистой патологией желудка и пищевода
Вопросы патогенеза GAVE-синдрома, ПГГ, варикоза вен желудка и пищевода во многом остаются неясными и продолжают дискутироваться. Тем не менее считается, что в основе заболевания лежит портальная гипертензия [7, 10].
Важную роль в этиопатогенезе портальной гипертензии играют вазоактивные субстанции: гистамин, серотонин и его производные из группы нейрокинуренинов, глюкагон, простагландины, цитокины, желчные кислоты, NО, бактериальные эндотоксины, эндотелин-1, тромбоксаны, простациклин и др. [1, 2, 4].
Одними из главных факторов, запускающих механизм активации индуцибельной NO-синтазы, являются провоспалительные цитокины (ІL-1 , IL-6, IL-8 и др.) и бактериальные эндотоксины (липополисахариды). Индуцибельная NО-cинтаза способна генерировать из аминокислоты аргинина длительные интенсивные потоки NО, а конститутивные формы NО-синтаз – лишь кратковременные потоки NО.
При этом потоки NО способны оказывать прямое и опосредованное воздействие. Так, прямое действие NО направлено на взаимодействие с биологическими мишенями, что приводит к образованию динитрозильных комплексов железа, оксигемоглобина, стимуляции циклооксигеназы и активации гуанилатциклазы.
При прямом действии химические реакции опосредованы активными формами NО, которые образуются при взаимодействии атомарного и молекулярного кислорода, что приводит к нитрозирующему и оксидативному стрессу.
При оксидативном стрессе происходит стимуляция перекисного окисления липидов, гидроксилирование и разрыв нитей ДНК. При нитрозирующем стрессе происходит ингибирование репарации ДНК и дезаминирование основной ДНК, усиленное образование S-нитрозотиолов и нитрозаминов.
При этом возникают нарушения обмена веществ, повреждение клеток, тканей и органов, нарушается проницаемость клеточных мембран, резко угнетается антиоксидантная система, снижается чувствительность сосудов к вазоконстрикторам, развивается эктазия сосудов.
Основные факторы риска развития портальной гипертензии:
· перестройка венозного кровотока желудка изолированной венозной гипертензией;
· развитие гипердинамического кровообращения в артериальных и венозных сосудах селезенки способствует формированию регионарного гипердинамического состояния кровообращения в верхних отделах желудка;
· вследствие артериовенозного и венозного шунтирования увеличивается артериовенозный сброс крови к венам желудка, что обусловливает обеднение кровотока в СОЖ, ее ишемию и способствует возникновению портальной гастропатии.
Кровотечение при ПГГ чаще всего носит нетяжелый характер. Частота его возникновения варьирует от 11 до 22%.
Более высокая частота желудочных варикозов наблюдается у пациентов с левосторонней портальной гипертензией вследствие тромбоза селезеночной вены. Эндоскопический контроль желудочных варикозных зон затруднен, если они не располагаются в проксимальной части малой кривизны желудка в продолжение пищеводных варикозных участков. При варикозах вен желудка целесообразно эндоскопическое применение мономера цианоакрилата [12, 18, 19]. Для купирования кровотечения в этой группе больных все чаще применяется трансъюгулярное портосистемное шунтирование.
Хотя серьезные кровотечения при ПГГ не часты, их диффузный характер затрудняет использование эндоскопического лечения, поэтому оптимальным лечением является комбинация терлипрессина и β-блокаторов [15].
Об остром гемодинамически значимом кровотечении, ассоциированном с ПГГ, можно говорить при наличии рвоты с кровью (кофейной гущей) или мелены, а также снижении гемоглобина при отсутствии других источников кровопотери. Хроническое кровотечение, ассоциированное с ПГГ, выявить сложнее. Чаще всего его подозревают при резком падении гемоглобина без признаков острого кровотечения, а также исключении других источников, в том числе в толстой и тонкой кишках. Смертность, ассоциированная с таким кровотечением, не значительна, и ПГГ не является самостоятельным прогностическим фактором выживаемости пациентов. Эрадикация варикозно расширенных вен пищевода путем как склеротерапии, так и лигирования латексными кольцами утяжеляет ПГГ и увеличивает риск кровотечения, что, возможно, объясняется местными изменениями гемодинамики – увеличением объема, скорости и давления кровотока в венах желудка.
Лечебная тактика при варикозе вен желудка, пищевода, ПГГ и GAVE-синдроме
Алгоритм диагностики и лечения портальной гастропатии представлен на рис. 5. Эндоскопическая терапия ПГГ малоэффективна, поскольку кровотечение, как правило, носит невыраженный и диффузный характер. При визуализации конкретной точки кровотечения можно использовать инъекционную терапию или коагуляцию термическим зондом или лазером. Однако исследований, посвященных эффективности и безопасности данного подхода, в доступной литературе не найдено.
Лечение ПГГ направлено на снижение портального давления, назначением неселективных β-блокаторов (пропранолол и надолол). Доза препарата варьирует от 20 до 160 мг 2 раза в день и подбирается до тех пор, пока частота сердечных сокращений в покое не будет составлять 55 уд/мин (или снизится на 25% от исходного уровня).
Если при ПГГ терапия, направленная на снижение портального давления, оказывает положительное влияние, то при GAVE-синдроме она не эффективна [7, 8]. Главная проблема при GAVE-синдроме – кровопотеря, поэтому лучшее лечение – коагуляция (аргоноплазменная), редко прибегают к резекции желудка. Трансъюгулярное внутрипеченочное портосистемное шунтирование не эффективно (рис. 3, 4) [10, 15, 17].
Соматостатин и октреотид снижают кровоток в СОЖ, однако этот эффект носит транзиторный характер. Например, время действия октреотида оценивается в 5 мин, причем его продленная инфузия не приводит к снижению портального давления, а повторное введение имеет менее выраженный эффект. Применение соматостатина у больных ПГГ с ассоциированным кровотечением в дозе 250 мкг болюсно в большинстве случаев приводит к купированию кровотечения. Соматостатин или октреотид рекомендуется применять для остановки острого кровотечения, а β-блокаторы – для профилактики его рецидива и контроля хронического кровотечения.
Многие исследователи отмечают повышение рН и снижение продукции соляной кислоты у больных, имеющих ПГГ. Этому, очевидно, способствуют гипоксия, атрофические процессы в СОЖ, снижение выработки защитной слизи. Гипохлоргидрия выявляется приблизительно у 2/3 больных с ПГГ, у которых уровень базального гастрина в сыворотке крови, как правило, повышен. При этом у 45% больных выявляются признаки умеренной атрофии [7]. Важным моментом в терапии этих состояний является применение препаратов, снижающих желудочную секрецию, особенно на фоне приема медикаментов, способствующих ее повышению. Наиболее оправданным в этих случаях является применение ингибиторов протонной помпы.
Учитывая, что ПГГ часто сочетается с варикозным расширением вен пищевода и желудка, что само по себе может быть причиной кровотечения, необходимо остановиться на основных принципах лечения кровотечения из варикозных вен пищевода и желудка, изложенных в ведущих европейских изданиях по гастроэнтерологии [8-10, 15, 17].
Лечение кровотечений из варикозных вен пищевода и желудка
Начальные мероприятия
Лечение кровотечения из варикозных вен должно проводиться в отделениях интенсивной терапии.
В первую очередь должна быть проведена интенсивная терапия по восстановлению объема циркулирующей крови (ОЦК). Пока ОЦК не будет достаточным, пациенты должны получать быструю инфузию 5% раствора декстрозы (глюкозы), коллоидные, кристаллоидные растворы до тех пор, пока давление крови не будет восстановлено и диурез не станет адекватным. Гемодинамически нестабильные, пожилые, с сопутствующими сердечными или легочными заболеваниями пациенты должны мониторироваться, т. к. необдуманное назначение кристаллоидов в комбинации с вазоактивными прапаратами может приводить к быстрому развитию отеков, асцита и гипонатриемии. Необходимо избегать избыточной инфузии, которая может вызвать повышение портального давления и повторное кровотечение. Концентрация свертывающих факторов крови обычно низкая, поэтому пациенту вводят свежую кровь или свежезамороженную плазму, витамин К. Также может быть необходима трансфузия тромбоцитов, эритроцитарной массы. Седативных препаратов следует избегать, особенно у пациентов с синдромом алкогольной абстиненции и печеночной энцефалопатией [15]. В последнее время много внимания уделяется вопросам применения антибиотиков при варикозном кровотечении. Как известно, у пациентов с варикозными кровотечениями наличие инфекции сопряжено с неудачей в купировании кровотечения и ранним повторным кровотечением. В такой ситуации раннее назначение антибиотикопрофилактики приводит к улучшению выживаемости пациентов [14]. Пациентам с энцефалопатией необходимо включать в терапию лактулозу.
Фармакологическая терапия
Сразу же после поступления в стационар до диагностической эндоскопии больному необходимо внутривенно вводить вазоактивные средства и продолжать это делать в течение 2-5 дней. С этой целью применяются такие вазоактивные средства, как аналог вазопрессина терлипрессин, соматостатин и его аналоги (октреотид, вапреотид). Октреотид уменьшает градиент печеночного венозного давления, назначается болюсно в дозе 50-100 мкг, затем в виде постоянной инфузии по 25-50 мкг/ч [14].
Согласно результатам встречи в Бавено, где был выработан консенсус по ведению пациентов с портальной гипертензией, октреотид и терлипрессин имеют такую же эффективность, как и склеротерапия, в достижении начального гемостаза, а октреотид является эффективным и безопасным в профилактике повторных кровотечений [10, 12]. Значимость применения октреотида и терлипрессина особенно возрастает в случае невозможности проведения эндоскопического лечения [18].
Эндоскопическое лечение
Проведение экстренной диагностической эзофагогастродуоденоскопии необходимо для подтверждения наличия варикозных вен и выявления источника кровотечения. Она должна быть проведена в течение первых 12 ч после поступления больного [14]. Эндотрахеальная интубация может быть необходима во время эндоскопии, особенно у пациентов с тяжелыми кровотечениями, сопровождающимися печеночной энцефалопатией, или у нестабильных больных, несмотря на интенсивную терапию. В 90% случаев кровотечения происходят из варикозных вен пищевода и лечатся преимущественно инъекциями склерозантов или лигированием вен.
Для склеротерапии применяются растворы склерозантов (полидоканол, этаноламин, тетрадецил сульфат и др.). При этом инъекция проводится в кровоточащий варикозный сосуд или подлежащую подслизистую оболочку. Инъекция в варикозный участок облитерирует просвет тромбированием, в то время как инъекция в подслизистую оболочку вызывает воспаление, приводящее к фиброзу. Первая инъекция контролирует кровотечение в 80% случаев. Если кровотечение рецидивирует, назначают повторные инъекции. Осложнения, связанные с токсичностью склерозантов, включают преходящую лихорадку, дисфагию, боль за грудиной, изъязвления, стриктуры и редко перфорацию [14, 15].
Лигирование кровоточащих сосудов производится путем перевязки сосуда с помощью специального аппарата, который надевается на верхушку эндоскопа. Варикоз аспирируется в специальную камеру для лигирования, где и происходит перевязка варикозных узлов. Для каждого варикозного узла требуется от 1 до 3 лигатур, что приводит к их тромбозу и остановке кровотечения. Лигирование сосудов убирает эзофагеальные варикозы с меньшей вероятностью осложнений, чем склеротерапия [15]. В настоящее время лигирование рассматривается как эндоскопическая терапия выбора при лечении варикозной болезни желудка и пищевода [14].
Проводятся различные исследования, сравнивающие эффективность этих двух основных эндоскопических методов купирования кровотечения – склеротерапии и лигирования. Как было показано на согласительной встрече в Бавено, лигирование имеет некоторые преимущества по сравнению со склеротерапией, особенно в плане улучшения результата и уменьшения осложнений, однако частота рецидивов после лигирования остается высокой [10, 12, 18, 19]. Комбинация лигирования и склеротерапии (одновременная или последовательная) имеет преимущества по сравнению с лигированием в плане уменьшения частоты рецидива после варикозной облитерации [10, 19].
У больных с преимущественно желудочными варикозами применяется еще один метод эндоскопического лечения – окклюзия варикозов клеем, которая состоит в эмболизации варикозов путем инъекции в них цианоакрилата. Наиболее серьезным риском этой процедуры является эмболизация легких, селезенки или мозга [14].
Альтернативное ведение пациентов
Трансьюгулярное внутрипеченочное портосистемное шунтирование (TIPS) – оптимальная процедура для пациентов, у которых кровотечение не контролируется эндоскопией. Оно является эффективным только у больных портальной гипертензией печеночного происхождения. Процедура проводится через внутреннюю югулярную вену под местной анестезией с седацией. Печеночная вена канюлируется, и создается путь через печеночную паренхиму из печеночной к портальной вене иглой с проводником под ультразвуковым и флюороскопическим контролем. Тракт расширяется, и по нему вводится стент для создания внутрипеченочного портосистемного шунта. Частота успешной процедуры высокая, изредка у пациентов с шунтами наблюдаются гемодинамические осложнения.
ТIРS – эффективная процедура, останавливающая острое варикозное кровотечение из желудочно-пищеводных варикозов и врожденных гастропатий после неудач в медикаментозном и эндоскопическом лечении. Однако из-за печеночной энцефалопатии, наблюдающейся в 25% случаев, и окклюзии стентов в течение 1 года в 50% случаев первичная задача ТIРS состоит в исправлении ситуации после недостаточного эффекта эндоскопической терапии и подготовке к последующей трансплантации печени [11, 15].
В случае невозможности экстренного проведения склеротерапии или лигирования у пациентов с активным кровотечением из вен пищевода и желудка жизнеспасающей может оказаться тампонада баллонным зондом. Пациентам с таким кровотечением перед попыткой введения пищеводно-баллонного зонда для защиты дыхательных путей должна быть введена эндотрахеальная трубка. Миннесотский баллонный зонд имеет 4 просвета: 1 – для желудочной аспирации, 2-3 – для поддувания в желудочный и пищеводный баллоны, 4 – над желудочным баллоном, для отсасывания секрета и предотвращения аспирации. Зонд вставляется через рот, правильное его местонахождение в желудке проверяется путем аускультации во время введения воздуха через желудочный канал зонда. Затем в желудочный баллон вдувается 200 мл воздуха. При полном заполнении баллон подтягивается вверх (напротив эзофаго-гастрального соединения), вызывая компрессию подслизистых варикозов. Такая позиция зонда поддерживается при помощи фиксирующего шарика по трубке у пациента во рту. Эзофагеальные баллоны используются редко. Основные осложнения пищеводных и желудочных баллонов – изъязвление желудка и пищевода, аспирационная пневмония, перфорация пищевода. Продолжающееся кровотечение во время баллонной тампонады указывает на неправильно расположенный зонд или кровотечение происходит из другого источника. После интенсивной терапии в течение 12 ч зонд извлекается, и эндоскопическое лечение повторяется [15].
Сегодня хирургическое портосистемное шунтирование применяется намного реже из-за использования ТIРS. Эта процедура требует от хирурга большого опыта и мастерства. В случае рефрактерного кровотечения и технической невозможности выполнения ТIРS у пациентов с не очень тяжелым течением цирроза может быть проведено хирургическое шунтирование (класс А или В по классификации Чайлд-Пью) [14].
Длительное ведение пациентов после купирования кровотечения
После купирования острого варикозного кровотечения для предотвращения его повторного возникновения, что наблюдается у большинства пациентов, должно быть начато лечение.
С этой целью в настоящее время используется постоянный прием неселективных β-блокаторов, чаще всего пропранолола, или эндоскопическое лигирование варикозов, а также их комбинация [14]. При их неэффективности применяют TIPS и хирургическое шунтирование, однако обе эти процедуры не улучшают выживаемости и сопряжены с высоким риском энцефалопатии [14]. Трансплантация печени должна рассматриваться во всех случаях, особенно при тяжелых формах цирроза печени (класс В или С по классификации Чайлд-Пью) [14]. рис. 6, 7 показаны алгоритмы лечения пациентов с варикозным кровотечением.
Первичная профилактика варикозных кровотечений
Всем пациентам с впервые диагностированным циррозом печени необходимо выполнить эндоскопическое исследование с целью выявления варикозов. Дальнейшая частота эндоскопических исследований зависит от размеров варикозных вен и степени поражения печени [14].
На сегодня для первичной профилактики варикозного кровотечения препаратами первой линии остаются β-блокаторы [16, 18, 19]. Было доказано, что β-блокаторы уменьшают риск кровотечения, поэтому все пациенты с варикозами должны получать их при отсутствии противопоказаний [15]. С этой целью используются неселективные β-блокаторы, чаще всего пропранолол. Обычные дозы пропранолола составляют 80-160 мг/сут. В любом случае необходимо достичь снижения ЧСС на 20-25% или до уровня 55 уд/мин [14].
В некоторых исследованиях β-блокатор с α1-адренергической активностью карведилол показал более выраженное влияние на уменьшение градиента печеночного венозного давления, чем пропранолол [19]. По некоторым данным изосорбида мононитрат может улучшать эффективность первичной профилактики варикозных кровотечений, однако некоторые авторы это положение ставят под сомнение [14, 16, 19].
Рассматривается вопрос о целесообразности использования лигирования сосудов с целью первичной профилактики варикозного кровотечения, однако до сих пор рандомизированные исследования не выявили преимуществ лигирования перед терапией β-блокаторами [11]. В настоящее время обсуждается возможность комбинации неселективных β-блокаторов и эндоскопического лигирования [16]. При средних или больших размерах варикозов у пациентов, имеющих противопоказания или толерантность к β-блокаторам, рекомендуется эндоскопическое лигирование варикозов [14].
Выводы
Портальная гастропатия, GAVE-синдром и особенно варикозное расширение вен желудка и пищевода остаются весьма распространенной патологией при диффузных заболеваниях печени, часто сопровождаются развитием опасных для жизни кровотечений.
Терапия ПГГ должна быть направлена на снижение портального давления путем применения β-блокаторов или шунтирующих процедур. В лечении ПГГ оправданным является применение ингибиторов протонной помпы, особенно на ранних стадиях цирроза печени или на фоне терапии препаратами, повышающими желудочную секрецию.
Терапия GAVE-синдрома заключается в применении эндоскопической коагуляции (аргоноплазменной) или хирургического лечения (резекции желудка). TIPS при GAVE-синдроме не эффективно.
Варикозные кровотечения – важная причина смерти у пациентов с циррозом печени. Острое ведение пациентов состоит в остановке кровотечения с восстановлением ОЦК, ранним применением вазоактивных препаратов, профилактической антибактериальной терапии и эндоскопического лечения (склеротерапия, лигирование сосудов), при необходимости TIPS или баллонной тампонады. После кровотечения пациенты нуждаются в терапии и пожизненном наблюдении для предотвращения дальнейших кровотечений. Для уменьшения риска кровотечения, с целью первичной и вторичной профилактики при отсутствии противопоказаний по сопутствующим заболеваниям все пациенты с варикозами должны получать β-блокаторы.
Многие звенья этиологии и патогенеза ПГГ, GAVE-синдрома и варикоза желудка и пищевода до конца не разработаны и нуждаются в углубленном изучении, а вопросы адекватной терапии требуют пересмотра традиционных взглядов и создания новых подходов к этой проблеме с учетом особенностей портопеченочной гемодинамики и архитектоники сети сосудов этого бассейна.
Литература
1. Буланов К.И., Чуклин С.Н. Декомпенсированный цирроз печени. – Львов, 1991. – 191 с.
2. Гарбузенко Д.В. Патогенез портальной гипертензии при циррозе печени // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. – 2002. – № 5. – С. 23-28.
3. Майер К.П. Гепатит и последствия гепатита. – М.: ГЭОТАР-Мед, 2004. – 717 с.
4. Руководство по интенсивной терапии. Пособие / Под. ред. А.И. Трещинского, Ф.С. Глумчера. – К.: Вища школа, 2004. – 582 с.
5. Степанов Ю.М., Шевченко Б.Ф., Залєвський В.І., Косинський О.В. Шлунково-кишкові кровотечі у практиці лікаря-інтерніста (причина, діагностика та лікування). Метод. рекомендації. – Дніпропетровськ, 2006. – 36 с.
6. Хомерики С.Г., Мельникова С.В., Обуховский Б.И., Яковенко Э.П. Клинико-морфологические проявления гастропатии у больных с портальной гипертензией // Гепатология. – 2005. – № 1. – С. 8-15.
7. Чуклін С.М. Портальна гастропатія та синдром шлункової антральної судинної ектазії (GAVE-синдром) // Науковий вісник Ужгородського університету, серія «Медицина». – 2005. – Вип. 26. – С. 82-85.
8. Шерлок Ш., Дули Дж. Заболевания печени. Перевод с англ. / Под. ред. З.Г. Апросиной, И.А. Мухина. – М.: ГЭОТАР-медицина, 1999. – 864 с.
9. Arroyo V. Pathophysiology, diagnosis and treatment of ascites in cirrhosis // Ann. Hepatol. – 2002. – № 1 (2). – Р. 72-79.
10. Bhasin D.K., Malhi N.J. Variceal bleeding and portal hypertension: much to learn, much to explore // Endoscopy. – 2002. – Vol. 34. – P. 119-128.
11. Binmoeller K.F., Bursato R. Variceal bleeding and portal hypertension // Endoscopy. – 2000. – Vol. 32, № 3. – Р. 189-199.
12. Bratovic I., Lacevic N. Management of esophageal varices // Med. Arh. – 2002. – Vol. 56 (Suppl. 1). – P. 11-12.
13. Burak K.W., Lee S.S., Beck P.L. Portal hypertensive gastropathy and GAVE syndrome // Gut. – 2001. – Vol. 49. – P. 866-872.
14. Dib N., Oberti F., Cales P. Current management of the complications of portal hypertension: variceal bleeding and ascites // CMAJ. – 2006. – Vol. 174. – P. 1433-1443.
15. Krige J.E.J., Beckingham ABC of diseases of liver, panereas and liary system // BMJ. – 2001; 322:416-418 (17 February); BMJ. – 2001; 322:348-351 (10 February).
16. Lo G.H. Prevention of esophageal variceal rebleeding // J. Chin. Med. Assoc. – 2006. – Vol. 69. – P. 553-560.
17. Pique J.M. Portal hypertension gastropathy // Baillieres Clin. Gastroenterology. – 1997. – Vol. 11. – P. 257-270.
18. Reyes Dorantes A.A. Endoscopic management of variceal bleeding // Rev. Gastroenterol. Mex. – 2005. – Vol. 70. – P. 50-55.
19. Seewald S., Seitz U., Yang A.M., Soehendra N. Variceal bleeding and portal hypertension: still a therapeutic challenge? // Endoscopy. – 2001. – Vol. 33. – P. 126-139.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Цирроз печени: насколько страшен диагноз…
Цирроз печени: насколько страшен диагноз…
 Нецирротический фиброз печени. Обзор литературы, клиническое наблюдение
Нецирротический фиброз печени. Обзор литературы, клиническое наблюдение
 Руководство по ведению асцита у пациентов с циррозом печени
Руководство по ведению асцита у пациентов с циррозом печени
 Цирроз печени
Цирроз печени