- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Грамположительная полирезистентная инфекция
Грамположительная полирезистентная инфекция
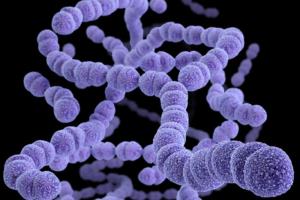
Грамположительные организмы – наиболее распространенные инфекционные агенты при госпитальных и послеоперационных инфекциях.
Данные последних исследований показывают увеличивающуюся инцидентность инфекций, вызванных грамположительными инфекционными агентами в странах Европы и Северной Америки, с середины 70-х годов прошлого века (R.N. Jones et al., 1999). Грамположительная полирезистентная микрофлора является причинным патогеном у больных с госпитальной пневмонией, перитонитом, катетерассоциированной инфекцией, бактериемией и менингитом (M.H. Kollef, S. Ward, 1998; P. Montravers et al., 1996). Кроме того, значительно возросла полилекарственная резистентность среди грамположительных инфекционных агентов, они становятся более распространенными изолятами во многих медицинских центрах. Развитие такой резистентности – важная клиническая проблема вследствие потенциального риска неадекватной эмпирической терапии и необходимости лечения в более сложных антиинфекционных режимах (J. S. Solomkin et al., 2006).
Основные грамположительные патогены, распространенные в клинике
Streptococcus pneumonia
Streptococcus pneumonia – самый распространенный негоспитальный патоген, вызывающий инфекции нижних дыхательных путей, в том числе пневмонию и некоторые другие инфекции. За последние десятилетия увеличение количества резистентных к антибиотикам штаммов
S. pneumoniae становится серьезной проблемой здраво-охранения во всем мире. Так, за последние 10 лет частота резистентности этого возбудителя существенно увеличилась с 2,2 до 17% (р < 0,001) [1]. Приведем последние данные литературы по чувствительности этого патогена.
По данным V. Ayer et al. (2007), у 38 и 25% из 244 штаммов стрептококков группы А обнаружена резистентность к тетрациклину и эритромицину, относительно высокая пропорция штаммов (15%), нечувствительны к обоим классам антибиотиков [2]. По данным греческих исследователей, чувствительность к пенициллину, цефуроксиму, цефтриаксону, эритромицину, тетрациклину и тримето-приму/сульфаметоксазолу составила 34,7; 25,1; 1; 33,5; 26,4 и 44,2% соответственно. Практически отсутствовала резистентность к респираторным фторхинолонам (лево-флоксацину и моксифлоксацину) [3].
По данным исследования (2002-2003), проведенного в семи из десяти канадских провинций, из 736 изолятов
S. pneumoniae, выделенных при бактериологических исследованиях крови в десяти центрах высокоспециализированной медицинской помощи, 16,85% оказались нечувствительны к пенициллину, 5,4% из них – в наибольшей мере. У 14,1% изолятов S. pneumoniae уменьшилась чувствительность к эритромицину; штаммов, резистентных к телитромицину, не обнаружено. Только шесть изолятов были резистентны к левофлоксацину и гатифлоксацину, из них пять имели промежуточную чувствительность к моксифлоксацину и один считался чувствительным к нему [4]. Чувствительность проверяли методом микроразведения в бульоне в соответствии с рекомендациями Института клинических и лабораторных стандартов.
Большое интернациональное исследование по антибактериальной чувствительности 6 646 изолятов S. pneumoniae PROTEKT (1999-2004) проведено в 38 странах у пациентов в возрасте старше 65 лет с негоспитальными инфекциями дыхательных путей [5]. Резистентность к эритромицину составила 36%, к пенициллину – 31,3% (11,1% – с промежуточной чувствительностью) и 37,2% – ко многим антибактериальным препаратам. В целом 37,2% изолятов нечувствительны к двум и более антибиотикам, 15,9% из них – как к пенициллину, так и к эритромицину. Антибактериальная резистентность чаще всего встречалась на Дальнем Востоке. Резистентность к телитромицину наблюдалась редко (0,12%).
Нечувствительность к антибиотикам у изолированных S. pneumoniae оценил I. Morrissey et. al. (2003) [6]. Резистентность к кларитромицину оказалась самой высокой (34,1%), к пенициллину G – меньше (22,1%). Исследователи выяснили, что уровень чувствительности в наибольшей мере зависит от возраста пациента и/или страны. Самую высокую резистентность наблюдали у детей в возрасте менее 6 лет и взрослых больных из стран Южной Африки и Франции, самую низкую – к пенициллину или амоксициллину/клавунату – в Германии. В Италии резистентность к фторхинолонам была очень низкой: к левофлоксацину – 3%, гатифлоксацину – 2,6%, моксифлоксацину – 0,4%.
A. Louie et al. провели исследование резистентности к фторхинолонам S. pneumoniae и обнаружили медленное увеличение распространенности этих штаммов в мире вследствие все более широкого использования фторхинолонов для лечения негоспитальной пневмонии [7].
В последнее время проводятся исследования по перекрест-ной резистентности S. pneumoniae к разным антибиотикам. Так, испанские исследователи изучали чувствительность 430 резистентных к пенициллину/амоксициллину изолятов S. pneumoniae относительно активности цефалоспоринов третьего поколения [8]. В сравнительных целях проверены 625 изолятов, чувствительных к пенициллину. Оказалось, что парентеральные цефалоспорины третьего поколения показали более высокую активность (минимальная подавляющая концентрация 90 [МПК] 1 мкг/мл для штаммов, резистентных к пенициллину, 2 мкг/мл –
к амоксициллину).
Инфекции, вызванные инвазивным Streptococcus группы А (GAS), сопровождаются более осложненным течением и смертностью в США. С января 2000 по декабрь 2004 года авторы собрали данные из десяти американских штатов (в совокупности – 29,7 млн чел.) [9]. Было идентифицировано 5, 4 тыс. случаев GAS-инфекции (3,5 случая на 100 тыс. чел.), из них 735 – смертельные (13,7%). Летальность при стрептококковом шоковом токсическом синдроме и некротическом фасците составила 36 и 24% соответственно. Смертность была самой высокой среди людей пожилого возраста (9,4 случаев на 100 тыс. чел.), младенцев (5,3) и афроамериканцев (4,7), оставаясь стабильной в течение долгого времени. Авторы установили, что 8 950-11 500 случаев GAS-инфекции наблюдаются в США ежегодно, что приводит к 1 050-1 850 смертельных. Независимые факторы, связанные со смертностью, включали пожилой возраст, стрептококковый токсический шоковый синдром, менингит, некротический фасцит, пневмонию или бактериемию.
Стафилококки
Стафилококки – частые причинные грамположительные патогены при негоспитальной и наиболее частые – при госпитальной инфекции. В течение 6-летнего исследования (1998-2003) в американских больницах частота инфекции S. aurеus существенно увеличилась во время
пребывания пациентов в стационаре [10]. В 2003 г. экономические затраты на лечение инфекции S. aurеus, как оценивают специалисты, составили 14,5 млрд долларов для стационарных и 12,3 млрд для хирургических больных. Однако было отмечено значительное уменьшение риска связанной с инфекцией S. aurеus внутрибольничной смертности с 1998 по 2003 год во время пребывания в стационарном (с 7,1 до 5,6%; р = 0,001) и хирургическом отделениях (с 7,1 до 5,5%; р = 0,002).
Коагулазонегативный стафилококк (CoNS), S. aureus и энтерококки составляют сегодня 50-60% случаев госпитальной бактериемии (M.B. Edmond et al., 1999;
M.J. Richards et al., 2000).
Уже через год после введения метициллина в клиническую практику в начале 60-х годов прошлого века появились штаммы cтафилококков, резистентные к этому препарату (резистентный к метициллину S. aureus [MRSA]), среди которых выделяют чувствительную к метициллину форму S. aureus (MSSA). К сожалению, на протяжении последних десятилетий резистентные формы стафилококков, в том числе MRSA получают все большее распространение во всем мире. Сегодня MRSA считается главным госпитальным инфекционным агентом и в значительной степени экономически воздействует на системы здравоохранения многих стран. MRSA
составляют в настоящее время более 50% всех стационарных штаммов S. aureus (J.M. Streit et al., 2004).
Более того, если раньше MRSA считался преимущественно госпитальным штаммом, то теперь все чаще встречается у амбулаторных пациентов, часто не имевших установленных факторов риска (S.E. Cosgrove et al., 2003). Штаммы MRSA, высеваемые вне стационара, микробиологически отличны от приобретенного госпитального штамма MRSA (ХА-MRSA), и таким образом были маркированы как негоспитальные MRSA (СА-MRSA).
Кроме того, что при инфекции MRSA возникают трудности с антибиотикотерапией, появились данные, что этот патоген более опасен для человека, чем MSSA. Процент пациентов, смерть которых связана с MRSA, достоверно выше, чем при инфицировании MSSA (11,8 против 5,1%; р < 0,001). Наблюдается отчетливая тенденция, указывающая на то, что нозокомиальная инфекция MRSA и бактериемия чаще, чем MSSA, становятся причинами летального исхода. Расходы, например, Национальной службы здравоохранения Великобритании, на лечение этой инфекции составляют не менее 500 млрд евро в год, принимая во внимание только количество койко-дней в стационарах и стоимость препаратов для лечения полирезистентной грамположительной инфекции. Кроме того, доказанная повышенная смертность при инфекции MRSA, большое количество осложнений и социальное беспокойство, связанное с инфекцией, трудно поддаются финансовой оценке (S.E. Cosgrove et al., 2003).
Предрасполагающие факторы для инфицирования MRSA:
• контакт с известным носителем MRSA;
• пребывание в стационаре в течение 12 месяцев;
• лечение в отделении интенсивной терапии (ОИТ);
• контакт с носителями или лицами, инфицированными MRSA;
• длительная антибактериальная терапия либо оперативное вмешательство;
• перевод пациента из другой больницы или страны;
• применение повторного курса антибиотиков;
• болезни почек или диабет в анамнезе;
• раны на коже (пролежни, язвы ног);
• активные дерматологические процессы (псориаз или экзема).
По данным однофакторного анализа, риск появления MRSA в хирургии увеличивают [11]:
• возраст ≥ 70 лет;
• длительность операции ≥ 4 часов;
• послеоперационная антибиотикотерапия > 1 дня;
• длительное пребывание в ОИТ;
• использование дренажей > 1 дня.
Еще более трудноразрешимой проблемой стало появление штаммов MRSA с увеличенной МПК, промежуточной чувствительностью и клинической резистентностью к гликопептидам, что потребовало использования более дорогих и менее известных лекарственных средств. Такие штаммы MRSA с уменьшенной восприимчивостью к
гликопептидам описаны в Великобритании, один аналог идентифицирован как EMRSA-17 (R.C. Hershow,
W.F. Khayr, N.L. Smith, 1992). О стойких к гликопептидам штаммах MRSA сообщали специалисты из Франции
(L. Marty, A. Flahault, B. Suarez et al., 1993).
Гетерогенно малочувствительные к ванкомицину изоляты S. aureus (hVISA) идентифицированы в Польше [12]. Они были высеяны в двух больницах Варшавы, и хотя
в одном из случаев идентификация совпала с неудачной терапией гликопептидом, условия селекции и клиническое значение появления этих микроорганизмов остаются неясными. Молекулярное типирование показало, что изоляты были близкими и принадлежали к международному штамму MRSA, аналог которого известен как «иберийский». Эпидемиологический анализ изолятов MRSA и некоторых архивных польских данных того же самого клона обнаружил существование в некоторых больницах Польши с 1998 г. фенотипа MRSA, идентифицированного как hVISA.
Согласно данным Института клинических и лабораторных стандартов, S. aurеus с промежуточной чувствительностью к ванкомицину (VISA) определяют при МПК 4-8 мкг/мл. В то же время штаммы, не содержащие резистентную к ванкомицину субпопуляцию имеют МПК 1-2 мкг/мл. Резистентные к ванкомицину S. aureus (VRSA) определяют, если они имеют МПК
≥ 16 мкг/мл. Обнаруженная уменьшенная чувствительность к ванкомицину с помощью обычного теста недостоверна, и таким образом занижает данные о частоте VRSA. В опубликованных отчетах о сниженной клинической эффективности ванкомицина с МПК 1-2 мкг/мл, пациентов с высоким риском возникновения инфекций hVISA, VISA и VRSA оказалось больше, чем в предыдущих исследованиях. Таким образом, VRSA чаще встречаются у больных пожилого возраста, с хроническими язвами нижних конечностей и у лиц, нуждающихся в длительном постельном режиме. Данные пациенты содержат стойкие к ванкомицину энтерококки, которые, вероятно, являются донорским организмом гена vanA для S. аurеus [13].
Энтерококки
Энтерококки наряду со стафилококками становятся наиболее частыми грамположительными возбудителями госпитальных инфекций, особенно острого бактериального эндокардита, лекарственная резистентность которых быстро растет. Доля энтерококков, нечувствительных к ванкомицину (VRE), продолжает расти в госпитальных условиях, при этом подавляющее большинство инфекций вызывается Enterococcus faecium. Фиксируется клональное распространение VRE, однако нередки поликлональные вспышки, ассоциированные с применением антибиотиков. Связь между применением антибиотиков и колонизацией VRE сложна и связана с антиэнтерококковой активностью, билиарной секрецией и антианаэробной активностью применяемых антибиотиков (L.B. Rice, 2006).
Антибиотики, применяемые при резистентной грамположительной микрофлоре
Ванкомицин
Ванкомицин – первый гликопептид, который стали использовать на практике. Его фармакодинамика предполагает, что у пациентов с хорошей почечной функцией назначение 1 г препарата через 12 часов оптимально, хотя есть свидетельства того, что доза 2 г один раз в день – также удовлетворительная альтернатива.
Концентрации в плазме крови ванкомицина > 10 мг/л связаны с более быстрым снижением лихорадки и уменьшением лейкоцитоза без увеличения уровня токсичности. Свидетельств увеличения токсичности при концентрации 15-25 мг/л не обнаружено. Использование непрерывной инфузии ванкомицина с целевым плато концентрации 20-25 мг/л клинического результата не изменяло, при сравнении с целевыми дозами (10-15 мг/л) нежелательных эффектов не наблюдалось.
Эффективность ванкомицина для лечения пациентов с инфекциями, вызванными S. aureus, снижается в результате его слабого проникновения в ткани и относительно слабой антибактериальной активности, которая может уменьшаться во время терапии. Увеличение дозировки или использование ванкомицина в комбинации с другими антибиотиками, которые имеют антистафилококковую активность, незначительно усиливают терапевтическую эффективность [14] .
Неэффективность лечения ванкомицином наблюдается у штаммов, восприимчивых к нему in vitro (S.E. Cosgrove et al., 2003; L.O. Conterno et al., 1998; M.A. Abramson, D.J. Sexton, 1999). Инфекции с восприимчивыми in vitro штаммами с МПК для ванкомицина > 1 мг/л, наиболее вероятно, не будут чувствительны к терапии этим антибиотиком (частота успеха – 7 из 42) по сравнению с восприимчивыми штаммами с МПК < 1 мг/л (частота успеха – 10 из 21). Возможно, для лечения инфекции MRSA с МПК 1-4 мг/л необходимы другие антибиотики (J. S. Solomkin, 2004).
Чувствительность к ванкомицину может снижаться во время терапии. Takayama et al. сообщают, что изоляты MRSA чувствительны к ванкомицину только до и на раннем этапе лечения, что объясняется увеличением МПК препарата. Имитационный анализ показал, что количество жизнеспособных бактерий уменьшалось только до
10-3-10-4 клеток через 72 часа инкубации [15].
Ванкомицин – наиболее часто применяемый антибиотик для лечения тяжелой грамположительной инфекции. Однако отсутствие возможности определить МПК и концентрацию в плазме крови делает его ненадежным средством.
Тейкопланин
Тейкопланин – второй гликопептид, применяемый в Украине. Он характеризуется длительным периодом полураспада в течение 83-168 часов. По сравнению с ванкомицином он менее токсичен, его можно применять как внутривенно, так и внутримышечно (K.W. Shea, B.A. Cunha, 1995). Начальная доза 400 мг два раза в день в течение первого дня адекватна, альтернативой могут служить более высокие дозы один раз в день, однако фармакокинетика тейкопланина плохо предсказуема, низкие дозы связаны с неэффективностью лечения (T.A. Wichelhaus, V. Schafer, B. Boddinghaus, 2001). Концентрации тейкопланина в крови при генерализованной инфекции > 10 мг/л и эндокардите > 20 мг/л способствуют хорошим результатам лечения (A.A. Firsov et al., 2004).
Дозы тейкопланина необходимо рассчитывать для поддержания в сыворотке концентрации не менее 10 мг/мл
(K.W. Shea, B.A. Cunha, 1995).
Сравнительная характеристика гликопептидов
Ванкомицин:
• производное Amycolatopsis orientalis;
• описан и внедрен в клиническую практику в 1956 г.;
• однокомпонентное вещество;
• плохо всасывается в желудочно-кишечном тракте;
• имеет неприятный вкус;
• выводится посредством клубочковой фильтрации,
5-10% метаболизируется в организме.
Тейкопланин:
• производное Actinoplanes teichomyceticus;
• описан в 1978 г., внедрен в клиническую практику в 1988 г. в Италии;
• смесь шести родственных соединений;
• плохо всасывается в желудочно-кишечном тракте;
• не имеет вкуса;
• выводится посредством клубочковой фильтрации почками в неизмененном виде.
Сравнительная активность гликопептидов [16]
Тейкопланин активнее в отношении:
• S. aureus (MSSA, MRSA) – в 2-4 раза;
• Streptococcus spp. (включая S. pneumoniae) – в 4-8 раз;
• E. faecalis, E. faecium – в 4-8 раз;
• Peptostreptococcus spp., Clostridium difficile, C. perfringens, Propionibacterium spp. – в 2-8 раз.
• Ванкомицин активнее в отношении S. haemolyticus –
в 2-4 раза.
Активность гликопептидов в отношении листерий и дифтероидов сопоставима или несколько выше (в 2 раза) у тейкопланина.
Сравнительная фармакокинетика тейкопланина и ванкомицина:
• липофильность тейкопланина в 50-100 раз выше, чем ванкомицина;
• тейкопланин хорошо проникает в клетки и ткани (особенно в легкие, кости, мягкие ткани);
• тейкопланин хорошо растворяется в виде натриевой соли;
• тейкопланин быстро всасывается при введении внутримышечно;
• ванкомицин мало растворим при физиологическом pH;
• ванкомицин вводится только внутривенно;
• у тейкопланина длительный период полувыведения (33-190 ч);
• тейкопланин можно вводить 1 раз в сутки (как правило, внутривенно или внутримышечно болюсно в течение 5 мин);
• период полувыведения ванкомицина у взрослых – 5-11 ч;
• ванкомицин вводят 2-4 раза в сутки; внутривенная инфузия – на протяжении не менее 90 мин!
Некоторые особенности тейкопланина:
• элиминация тейкопланина возрастает у новорожденных, детей, больных с ожогами, у «внутривенных» наркоманов – поддерживающие дозы должны быть > 6 мг/кг/сут;
•тейкопланин может применяться амбулаторно болюс-но 3 раза в неделю! (при остеомиелите, эндокардите);
•тейкопланин диффундирует во внутриклеточное
пространство;
• возможность увеличения дозы тейкопланина без доказанного риска возрастания токсичности;
• способность тейкопланина индуцировать резистентность ниже, чем у ванкомицина.
Показания к назначению тейкопланина – тяжелые инфекции, вызванные чувствительными к тейкопланину грамположительными микроорганизмами, в том числе резистентными к метициллину, цефалоспоринам и карбапенемам:
• инфекционный эндокардит;
• сепсис/септицемия;
• остеомиелит;
• инфекции дыхательных путей;
• инфекции кожи и мягких тканей;
• инфекции мочевых путей;
• перитонит, ассоциирующийся с хроническим
перитонеальным диализом;
• псевдомембранозный колит (внутрь).
Дозирование тейкопланина:
• препарат вводится внутривенно (болюс или инфузия в течение 30 мин) или внутримышечно;
• дети до 2 месяцев: 1-й день – 16 мг/кг 1 раз; со 2-го дня – 8 мг/кг 1 раз в сутки (внутривенная инфузия в течение 30 мин);
• дети от 2 месяцев до 16 лет: 1-й день – 10 мг/кг 2 раза в сутки; со 2-го дня – 6 мг/кг 1 раз в сутки (внутривенно или внутримышечно);
• взрослые: 1-й день – 6 мг/кг (400 мг) 2 раза в сутки; со 2-го дня – 400 мг 1 раз в сутки;
• при почечной недостаточности никаких корректировок доз не проводится до 4-го дня лечения;
• у больных с ожогами и при инфекционном эндокардите, вызванном S. aureus, поддерживающую дозу рекомендуется увеличить до 12 мг/кг (800 мг/сут).
Применение тейкопланина при тяжелых инфекциях (G. Schaison et al., 2000):
• инфекции, вызванные резистентными к β-лактамам грамположительными бактериями;
• инфекции, вызванные грамположительными бактериями у больных с аллергией на β-лактамы;
• жизнеугрожающие колиты, вызванные C. difficile, а также случаи клинической неэффективности первоначального лечения метронидазолом (внутрь);
• при абдоминальных инфекциях – только в случаях документированной инфекции MRSA или резистентными к ампициллину энтерококками;
• катетерные инфекции – при отсутствии возможности удалить катетер (например, у больных с тромбоцитопенией);
• профилактика инфекционного эндокардита у больных с аллергией на β-лактамы;
• профилактика одной дозой при хирургических вмешательствах с имплантацией протезов.
Сравнительная безопасность гликопептидов [17]:
• согласно 11 рандомизированным контролируемым
исследованиям тейкопланина и ванкомицина (1987-1995 г., 1 276 больных), частота побочных эффектов при лечении – 13,9 и 21,9% соответственно (p = 0,0003);
• синдром «красного человека»:
- покраснение и зуд в области шеи и верхней части грудной клетки, изредка – боли в грудной клетке, гипотензия, ангионевротический отек;
- часто ассоциируется с быстрым введением ванкомицина (обычно – первой дозы);
- развитие связывают с высвобождением гистамина под влиянием ванкомицина;
- не вызывается тейкопланином (в ходе клинических исследований описано всего 3 случая у 6 696 больных).
Таким образом, к преимуществам тейкопланина в сравнении с ванкомицином можно отнести следующее:
• отсутствие необходимости в мониторинге плазменных концентраций;
• возможность комбинированной терапии;
• отличная проходимость внутрь клеток (нейтрофилов) и тканей;
• возможность использования препарата в домашних условиях;
• меньший риск побочных эффектов.
Распространение негоспитальных штаммов MRSA
возобновило интерес к ранее применявшимся бактерицидным антистафилококковым средствам, потому что эти организмы часто более чувствительны к антибиотикам, чем госпитальные штаммы, а также вследствие возможности их применения в оральных формах, которые могут использовать амбулаторные пациенты.
Клиндамицин применяется при анаэробной инфекции, но обладает бактериостатическим эффектом против
S. aureus. Результаты его использования были проверены в лечении негоспитальных штаммов MRSA. Martinez-Aguilar et al. (2003) сообщили об успешном применении клиндамицина в педиатрической практике, которая включала множество серьезных инфекций. Стандартизированный тест D-зоны можно использовать для оценки индуцибeльной к клиндамицину резистентности среди стойких к эритромицину и восприимчивых к клиндамицину изолятов. К сожалению, многие негоспитальные изоляты MRSA резистентны к клиндамицину, поэтому его нельзя считать антистафилококковым средством для эмпирической монотерапии пациентов с подозрением на серьезную негоспитальную инфекцию MRSA.
Триметоприм/сульфаметоксазол сравнивали с ванкомицином как антистафилококковое средство. N. Markowitz et al. (1992) обнаружили, что этот препарат при серьезной инфекции S. aureus менее эффективен, чем ванкомицин. Однако лечение было ограничено у пациентов с инфекцией MSSA, в то время как при негоспитальной инфекции MRSA эффективность оказалась одинаковой. В настоящее время считается, что триметоприм/сульфаметоксазол эффективен при негоспитальной чувствительной к нему инфекции MRSA. Он оказался наиболее быстродействующим бактерицидным средством против негоспитальных штаммов MRSA in vitro при сравнении с большинством других пероральных антимикробных средств [18]. Однако триметоприм/сульфаметоксазол нельзя считать оптимальным лекарственным средством для монотерапии негоспитальной инфекции MRSA, по крайней мере, в дозах, используемых в проводимых исследованиях.
Тетрациклины не стали препаратами выбора для лечения стафилококковых инфекций. Однако в модели экспериментального эндокардита MRSA на животных миноциклин, применяемый в моделирующей человеческую фармакокинетику дозе, приводил к результатам, сопоставимым с полученными при назначении ванкомицина (D.P. Nicolau et al., 1994).
Систематические отчеты об использовании миноциклина (или других пероральных тетрациклинов) при негоспитальных инфекциях MRSA представляют большой интерес, хотя существует беспокойство, что при более широком использовании тетрациклинов резистентность MRSA к этим средствам может возрастать.
Линезолид
Линезолид – новый оксазолидиновый антибиотик, который применяется перорально и внутривенно, активен против грамположительных кокков, включая MRSA, альтернативное гликопептидам средство. Линезолид хорошо проникает в ткани, особенно в легкие, поэтому более эффективен, чем ванкомицин, особенно при вызванных MRSA пневмониях (W.A. Craig, 2003;
Jr. J.E. Conte et al., 2002; M. Ioanas, H. Lode, 2004; D.L. Stevens et al., 2002; S.L. Kaplan et al., 2003;
G.M. Eliopoulos, 2003). Линезолид оказался столь же, а часто более эффективен и безопасен, чем ванкомицин, при лечении взрослых и детей с инфекциями MRSA
(D.L. Stevens et al., 2002; S.L. Kaplan et al., 2003). В недавно опубликованном рандомизированном исследовании пациентов с хирургическими инфекциями MRSA клиническая и микробиологическая эффективность линезолида при вызванной MRSA пневмонии была более высокой, чем ванкомицина, хотя разница не была достоверной для всех случаев пневмонии, вызванной S. aureus.
Линезолид успешно использовали у ограниченного количества пациентов с вызванными MRSA инфекциями и уменьшенной чувствительностью к ванкомицину
(B.P. Howden et al., 2004; P.G. Charles et al., 2004). У большинства диагностировали бактериемию и/или наблюдали неэффективную предварительную терапию гликопептидом. В нескольких случаях, когда инфекция успешно контролировалась линезолидом, дальнейшее лечение было закончено комбинацией фузидиновой кислоты и рифампина. Поскольку линезолид является ингибитором бактериального белкового синтеза, эффект от его применения против энтерококков прежде всего бактериостатический, однако описано несколько случаев успешного лечения энтерококкового эндокардита (S.M. Zimmer et al., 2003; N. Rao, G.J. White, 2002;
H.M. Babcock et al., 2001) и менингита VRE (M.P. Steinmetz et al., 2001; R. Hachem et al., 2001;
C. Zeana et al., 2001; Z.H. Shaikh et al., 2001).
В настоящее время стойкие к линезолиду S. aureus и штаммы энтерококков встречаются очень редко
(V.G. Meka, H.S. Gold, 2004). A.P. Wilson et al. не обнаружили в ОИТ резистентности грамположительных патогенов к данному препарату, активность которого была несколько выше, чем у тейкопланина, и считают, что линезолид должен оставаться антибиотиком резерва [19]. Получены данные об активности линезолида против некоторых анаэробов, в частности Fusobacterium spp.
(G. Daeschlein, C. Hoehne, O. Assadian, 2006).
Наблюдение за резистентностью к линезолиду среди обычно встречающихся грамположительных патогенов в США началось по программе ZAAPS (2002) и продолжено в рамках LEADER (2004) [20]. В 2006 г. в последней
изучено 5 374 штамма из 50 медицинских центров, расположенных в пределах девяти американских областей статистики. Проверка чувствительности S. aureus, коагулазонегативного стафилококка (CoNS), энтерококков,
S. pneumoniae, группы S. viridans (189, 100.0) и бета-гемолитического стрептококка проводилась методом микроразведения в бульоне (процент чувствительности к линезолиду). Резистентными к линезолиду оказались 1 изолят S. aurеus, 13 – CoNS, 3 – E. faecalis и 10 – E. faecium. В целом 99,55% проверенных в программе LEADER 2 006 изолятов оставались чувствительны к линезолиду в соответствии с клиническими и лабораторными критериями Института стандартов.
Закончился пятый год мониторинга ежегодной программы по оценке эффективности и появления резистентности к линезолиду (зивоксу) и другим грамположительным активным средствам в странах Европы, Азии, Австралии и Латинской Америки [21]. В 2006 г. 4 216 грамположительных изолятов из 16 стран были представлены для анализа шести групп организмов, включая S. aureus (54%), CoNS (14,6%), энтерококки (10%), Str. pneumoniae (9,4%), группу Str. viridans (5%) и бета-гемолитический стрептококк (7%). Линезолид сохранил выраженную активность против S. aurеus (МПК50 и МПК90, 2 мкг/мл; 39,8% из этих штаммов были MRSA) и CoNS (МПК50 и МПК90, 1 мкг/мл; резистентных к метициллину штаммов – 74,3%). Несмотря на эндемичность стойких к ванкомицину энтерококков (до 30%) в нескольких странах, линезолид с МПК
≤ 2 мкг/мл ингибировал рост > 99% штаммов (модальная МПК, 1 мкг/мл). Среди стрептококков все значения МПК препарата были
≤ 2 мкг/мл. Редкие образцы резистентности к линезолиду обнаружены среди энтерококков (2 изолята, Китай и Германия) и CoNS
(3 изолята, Италия и Бразилия). В целом препарат оставался активным против 99,88% штаммов, проверенных в этом интернациональном исследовании.
Линезолид – перспективная альтернатива для лечения хирургических и ортопедических инфекций вследствие своей биоусвояемости при пероральном применении и активности против резистентного к метициллину стафило-кокка, а также нечувствительных к ванкомицину энтерококков. У хирургических больных препарат также может быть обоснованной альтернативой для лечения грамположительных инфекций.
Линезолид эффективен при лечении полирезистентного MRSA, даже когда его концентрации в участке инфекции уменьшены вследствие нарушения кровотока [22].
Побочные эффекты препарата. У пациентов, лечившихся линезолидом, часто наблюдали гематологические неблагоприятные события. Анализ лабораторных данных показал умеренную обратимую тенденцию к незначительной тромбоцитопении [22].
Часто неблагоприятные эффекты линезолида проявляются при длительной терапии. Врачи, длительно использующие препарат для лечения рефрактерных инфекций, должны знать, что при длительном применении линезолида возможна периферическая и/или оптическая нейропатия, любая из которых может быть необратимой (J.P. Rho et al., 2004; E. Lee et al., 2003). Серотониновый синдром наблюдался у нескольких пациентов, получавших препарат в сочетании с некоторыми лекарственными средствами (G.M.
Eliopoulos, 2003). В редких случаях возникает тяжелый молочнокислый ацидоз
(L. Palenzuela et al., 2005).
У пациентов с почечной недостаточностью, которые лечатся линезолидом более двух недель, необходимо контролировать количество тромбоцитов не менее двух раз в неделю вследствие увеличивающейся вероятности тромбо-цитопении (Y.H. Lin , V.C. Wu , I.J. Tsai , 2006).
По данным A. Soriano, при средней продолжительности лечения линезолидом острых и хронических инфекций костных и суставных имплантатов, которое составляло 47 и 60 дней, тромбоцитопения наблюдалась у 4,7% пациентов, анемия – у 5,8% [23]. Исследователи полагают, что пероральный прием линезолида – эффективная и хорошо переносимая альтернатива при лечении инфекции имплантатов.
Чтобы избежать неприятных эффектов и неблагоприятных событий, рекомендуется проводить еженедельный гематологический (если терапия длится более
2 месяцев) и периодический офтальмологический мониторинги [24].
Новые антибиотики
Поскольку резистентные к ванкомицину грамположительные кокки становятся все большей проблемой при лечении госпитальных инфекций, продолжается разработка новых антибиотиков с активностью против нечувствительных к ванкомицину и метициллину грамположительных кокков. Квинупристин/дальфопристин, даптомицин и тад-жициклин имеют in vitro активность против резистентных к метициллину стафилококков и превосходят ванкомицин при нечувствительных к ванкомицину изолятах. Далбаванцин, телаванцин и оритаванцин – новые гликопептиды, у которых фармакодинамические свойства лучше по сравнению с ванкомицином. Даптомицин обладает быстрой бактерицидной активностью против S. аureus, одобрен для
использования при бактериемии и эндокардите. Квинупристин/дальфопристин – препарат выбора при стойком к ванкомицину E. faecium, но не имеет активности против
E. faecalis. Таджициклин обладает активностью против энтерококков, MRSA, а также энтеробактера и анаэробов, что нужно учитывать при лечении внутрибрюшных инфекций и инфекций, связанных с диабетической стопой. В обзоре многочисленных моделей in vitro на животных изучено взаимодействие между этими новыми средствами и другими антистафилококковыми препаратами [25].
К сожалению, в Украине, кроме линезолида (зивокса), обладающего активностью против резистентной грамположительной флоры, антибиотиков не зарегистрировано, что затрудняет врачам выбор оптимального препарата.
Лечение
Протоколы лечения учитывают возраст пациента, клиническую тяжесть и результаты лабораторных испытаний (лейкоцитоз, уровень C-реактивного белка и прокальцитонина крови), чтобы точно определить показания к антибиотикотерапии. Неадекватная терапия инфекции тесно коррелирует с неблагоприятными результатами лечения, в том числе с увеличением стационарной смертности
(J.W. Chow et al., 1991; J. Romero-Vivas et al., 1995; L. Leibovici et al., 1998). Наличие тенденций к увеличению частоты резистентных штаммов затрудняет использование рекомендаций по применению антибиотиков [26].
В нетяжелых случаях инфекции при отсутствии опасности для жизни пациента ценность эмпирического назначения антибиотиков сомнительна. В большинстве случаев следует дожидаться результатов бактериологического исследования на чувствительность микрофлоры к антибиотикам. При инфекции средней и тяжелой степени, когда нельзя откладывать применение антибиотиков, назначать их следует эмпирически. Для большей вероятности следует, прежде всего, обращать внимание на характер инфекции (госпитальная или негоспитальная), локализацию инфекционного очага, характер антибактериальной резистентности в отделении, где находится больной. Например, при негоспитальной инфекции нижних дыхательных путей в качестве возбудителя можно ожидать грамположительную кокковую микрофлору, обладающую большей чувствительностью к антибиотикам, поэтому в качестве эмпирической терапии следует использовать современные макролиды, фторхинолоны, беталактамные антибиотики.
Получены данные, сравнивающие результаты лечения двумя наиболее часто рекомендуемыми эмпирическими режимами антибиотикотерапии при негоспитальной пневмонии (НП), – комбинированной терапией беталактамом расширенного спектра действия и макролидом (BL+M), или монотерапией фторхинолоном (F) [27]. В случаях
тяжелой НП лучшие результаты зарегистрированы при лечении BL+M. Для их подтверждения необходимо проведение рандомизированного клинического исследования.
Фторхинолоны остаются важной альтернативой лечения инфекции дыхательных путей (только у взрослых), особенно это касается моксифлоксацина – самого мощного фторхинолона против грамположительной инфекции [28].
I.A. Bliziotis et al. провели сравнительное изучение роли рифампина в качестве адъюванта для лечения грамположительных инфекций, не обнаружив ни в одном исследовании статистически значимой разницы в смертности при лечении препаратом и без него [29]. Есть только ограниченные данные, подтверждающие роль рифампина в качестве полезного адъюванта при лечении инфекций, вызванных грамположительными бактериями. Для лучшей оценки необходимо провести большое количество контролируемых исследований.
Для выбора антибиотиков в тяжелых случаях значительную помощь может оказать бактериоскопия содержимого инфекционного очага. При наличии преобладающей кокковой микрофлоры в тяжелых случаях, особенно при госпитальной инфекции, следует назначать гликопептиды.
Основным фактором для выбора антибиотиков следует считать определение чувствительности патогенов к ним
in vitro. После получения результатов антибиотикограммы необходимы также опыт врача, знание основных фармакодинамических особенностей антибиотиков и чувствительности микроорганизмов.
Все штаммы S. aureus нужно проверять на резистентность к метициллину (как альтерантива – к оксациллину). При наличии госпитальных штаммов MRSA золотым стандартом является назначение гликопептидов. При наличии тяжелой инфекции MRSA, особенно бактериемии, применение гликопептидов, вероятно, субоптимально в условиях увеличивающейся резистентности и роста показателя МПК. Линезолид (и другие новые антибиотики, если они появятся в Украине) – предпочтительный выбор лечения MRSA [30].
Все штаммы MRSA необходимо проверять на чувствительность к ванкомицину, поскольку эти фенотипы не должны быть пропущены. Выбор лечения инфекций MRSA с меньшей чувствительностью к ванкомицину ограничен (фактически только линезолид при наличии штаммов с промежуточной чувствительностью в комбинации с большими дозами гликопептидов). Быстрая идентификация пациентов, у которых высеваются VRSA, VISA или hVISA, должна способствовать изоляции, а также контролю за профилактикой распространения этих патогенов [31].
Перспективы применения
Одним из механизмов развития резистентности у микроорганизмов, в том чис
 Диагностика, профилактика и лечение инфекций, передающихся половым путем
Диагностика, профилактика и лечение инфекций, передающихся половым путем Круглый стол
 Новый противогрибковый препарат Залаин для лечения острого вульвовагинального кандидоза
Новый противогрибковый препарат Залаин для лечения острого вульвовагинального кандидоза
 Анализ причин смертности от внебольничной пневмонии в г.Киеве
Анализ причин смертности от внебольничной пневмонии в г.Киеве
 Опыт применения Синуфорте в лечении острых и хронических синуитов
Опыт применения Синуфорте в лечении острых и хронических синуитов
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
