Памидрия - 60 инструкция, аналоги и состав
| Показания: | Лікування захворювань у дорослих, що супроводжуються підвищеною активністю остеокластів: – гіперкальціємія, зумовлена злоякісними пухлинами;– метастази злоякісних пухлин у кістках (переважно остеолітичного характеру) і мієломна хвороба (множинна мієлома);– хвороба Педжета. |
| Форма випуска: | Ліофілізат для розчину для інфузій по 60 мг у флаконах № 1 |
| Производитель, страна: | Ципла Лтд, Індія |
| Действующее вещества: | 1 флакон містить динатрію памідронату пентагідрат, еквівалентний безводному динатрію памідронату 60 мг |
| МНН: | Pamidronic acid - Памидроновая кислота |
| Регистрация: | UA/11989/01/01з 25.01.2012 по 25.01.2017. Приказ 1019 від 29.12.2014 |
| Код АТХ: |
Склад:
діюча речовина: динатрію памідронату пентагідрат;
1 флакон містить динатрію памідронату пентагідрат, еквівалентний безводному динатрію памідронату 60 мг або 90 мг;
допоміжні речовини: маніт (Е 421), кислота фосфорна.
Лікарська форма. Ліофілізат для розчину для інфузій.
Фармакотерапевтична група.
Засоби, що впливають на структуру та мінералізацію кісток. Бісфосфонати.
Код АТС M05B A03.
Клінічні характеристики.
Показання.
Лікування захворювань у дорослих, що супроводжуються підвищеною активністю остеокластів:
- гіперкальціємія, зумовлена злоякісними пухлинами;
- метастази злоякісних пухлин у кістках (переважно остеолітичного характеру) і мієломна хвороба (множинна мієлома);
- хвороба Педжета.
Протипоказання.
- Підвищена чутливість до памідронату або інших бісфосфонатів чи до будь-яких інших компонентів препарату;
- період вагітності або годування груддю;
- дитячий вік.
Спосіб застосування та дози.
Препарат не можна вводити внутрішньовенно струминно.
Ліофілізат, що міститься у флаконі, слід спочатку розчинити у стерильній воді для ін'єкцій. Важливо звертати увагу на те, щоб порошок розчинявся повністю. рН відновленого розчину – 6,0-7,0. Отриманий розчин перед введенням слід додатково розвести розчином для інфузій, який не містить кальцію (наприклад, 0,9 % розчином натрію хлориду або 5 % розчином глюкози).
Отриманий внаслідок цього розчин препарату вводять внутрішньовенно, повільно, шляхом інфузії.
Концентрація Памідрії в інфузійному розчині не повинна перевищувати 90 мг/250 мл. Швидкість інфузії препарату не повинна перевищувати 60 мг/год (1 мг/хв). Як правило, дозу препарату, що становить 90 мг і міститься в 250 мл інфузійного розчину, вводять протягом 2 годин.
Для пацієнтів з мієломною хворобою і при гіперкальціємії, зумовленій злоякісними пухлинами, не рекомендується перевищувати дозу Памідрії, що становить 90 мг, і вводити її в 500 мл інфузійного розчину більше 4 годин.
Для того, щоб звести до мінімуму локальні реакції у місці інфузії препарату, ін'єкційна голка повинна бути акуратно встановлена у просвіті вени відносно великого калібру.
Застосування для лікування дорослих і пацієнтів літнього віку.
Метастази злоякісних пухлин у кістках (переважно остеолітичного характеру) і мієломна хвороба.
Памідрію застосовують у дозі 90 мг у вигляді разових інфузій, які проводяться кожні 4 тижні. У пацієнтів з метастазами злоякісних пухлин у кістках, які отримують хіміотерапію з 3-тижневими інтервалами, Памідрія в дозі 90 мг також може застосовуватися з 3-тижневими інтервалами.
Гіперкальціємія, зумовлена злоякісними пухлинами.
Перед початком застосування препарату або в ході терапії рекомендується провести регідратацію хворого за допомогою 0,9 % розчину натрію хлориду. Сумарна доза Памідрії, яку застосовують протягом курсу лікування, залежить від початкового рівня кальцію у сироватці крові пацієнта. Наведені нижче рекомендації складені на підставі клінічних даних стосовно нескоригованих значень концентрації кальцію. Однак наведені у таблиці діапазони доз препарату можна застосовувати і для тих значень рівня кальцію, які скориговані після регідратації пацієнтів з урахуванням рівня білка або альбуміну сироватки крові.
Таблиця
|
Початковий рівень кальцію у крові |
Рекомендована сумарна доза Памідрії (мг) |
|
|
(ммоль/л) |
(мг%) |
|
|
Не більше 3 |
Не більше 12 |
15 - 30 |
|
3 - 3,5 |
12 - 14 |
30 - 60 |
|
3,5 - 4 |
14 - 16 |
60 - 90 |
|
Більше 4 |
90 |
|
Сумарна доза Памідрії може бути введена як протягом одноразової інфузії, так і за допомогою декількох інфузій, що здійснюються протягом 2-4 послідовних днів.
Максимальна курсова доза препарату (і для першого, і для наступних курсів лікування) становить 90 мг.
Істотне зниження концентрації кальцію у сироватці крові, як правило, спостерігається через 24-48 годин після введення препарату, а нормалізація цього показника – протягом 3-7 днів. Якщо нормалізація рівня кальцію у крові в межах указаного часу не досягається, можливо додаткове введення препарату. Тривалість збереження отриманого ефекту в окремих груп хворих різна. При відновленні гіперкальціємії проводяться повторні курси введення Памідрії. Клінічний досвід, накопичений до цього часу, свідчить про те, що зі збільшенням кількості курсів введення препарату ефективність памідронату динатрію може знижуватися.
Кісткова хвороба Педжета.
Рекомендована сумарна доза памідронату динатрію при проведенні курсу лікування становить 180-210 мг. Сумарна доза препарату, що досягає 180 мг, може бути введена або як 6 інфузій (по 30 мг 1 раз на тиждень), або як 3 інфузії (по 60 мг через тиждень). Якщо для однієї інфузії припускається доза 60 мг, то в такому випадку для першого введення рекомендується застосовувати дозу 30 мг. Таким чином, сумарна курсова доза становить 210 мг. Цей режим дозування (але вже з пропуском початкової дози 30 мг) можна повторювати через 6 місяців до досягнення ремісії захворювання або у випадку загострення.
Застосування для лікування пацієнтів з порушенням функції нирок.
Препарат не потрібно застосовувати для лікування хворих з тяжкими порушеннями функцій нирок (кліренс креатиніну < 30 мл/хв), за винятком випадків, загрозливих для життя (гіперкальціємія, зумовлена злоякісними пухлинами, де результат є вагомішим за потенційний ризик).
Як і при застосуванні внутрішньовенно інших бісфосфонатів, рекомендується контролювати функцію нирок, наприклад, досліджувати креатинін сироватки до кожної дози препарату. У пацієнтів з метастазами злоякісних пухлин у кістках, які отримують памідронат динатрію, потрібно припинити терапію, доки функція нирок не повернеться на 10 % до початкового значення, якщо є ознаки погіршання функції нирок. Ця рекомендація основана на дослідженнях, у яких погіршання функції нирок було визначено як:
- для пацієнтів з нормальним початковим рівнем креатиніну, збільшення на 0,5 мг/дл;
- для пацієнтів з початковим рівнем креатиніну, що не відповідає нормі, збільшення на 1 мг/дл.
У пацієнтів з пухлинами з нормальною чи зниженою функцією нирок регулювання дози не потрібно при станах від незначного (кліренс креатиніну 61-90 мл/хв) до помірного погіршання функції нирок (кліренс креатиніну 30-60 мл/хв). Для таких пацієнтів інфузія не повинна перевищувати 90 мг/4 год (приблизно 20-22 мг/год).
Застосування для лікування пацієнтів з порушенням функції печінки.
Для пацієнтів з помірним порушенням функції печінки корекція дози препарату не потрібна.
Побічні реакції.
Найчастіше зустрічаються такі небажані реакції, як безсимптомна гіпокальціємія і пропасниця (підвищення температури тіла на 1-2 °С), які звичайно розвиваються у перші 48 годин після інфузії препарату. Пропасниця, як правило, минає самостійно і не потребує лікування.
Критерії оцінки: дуже часто (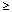 1/10), часто (
1/10), часто (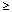 1/100, <1/10), нечасто (
1/100, <1/10), нечасто (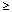 1/1000, <1/100), рідко (
1/1000, <1/100), рідко (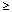 1/10 000, <1/1 000), дуже рідко (<1/10 000), включаючи окремі повідомлення.
1/10 000, <1/1 000), дуже рідко (<1/10 000), включаючи окремі повідомлення.
З боку крові: часто − анемія, тромбоцитопенія, лімфоцитопенія; дуже рідко − лейкопенія.
З боку імунної системи: нечасто − анафілактичний шок, алергічні реакції (включаючи анафілактоїдні), бронхоспазм/задишка, набряк Квінке.
З боку центральної нервової системи: часто − симптоматична гіпокальціємія (парестезія, тетанія), головний біль, безсоння, сонливість; нечасто – судоми, неспокій, запаморочення, летаргія; дуже рідко − порушення орієнтації, зорові галюцинації.
З боку органів чуття: часто − кон’юнктивіт; нечасто − увеїт (ірит, іридоцикліт); дуже рідко − склерит, епісклерит, ксантопсія.
З боку серцево-судинної системи: часто – артеріальна гіпертензія; нечасто − артеріальна гіпотензія; дуже рідко – ознаки лівошлуночкової недостатності (задишка, набряк легенів) або ознаки застійної серцевої недостатності (набряки).
З боку ШКТ: часто −нудота, блювання, анорексія, біль у животі, діарея, запор, гастрит; нечасто – диспепсія.
З боку шкіри: часто – висипання; нечасто – свербіж.
З боку скелетно-м’язової системи: часто −транзиторний біль у кістках, артралгія, міалгія, генералізований біль; нечасто − м'язові спазми.
З боку нирок: нечасто −гостра ниркова недостатність; рідко − центральний сегментний гломерулосклероз, включаючи руйнівний варіант, нефротичний синдром; дуже рідко − погіршення перебігу супутнього захворювання нирок, гематурія.
Загальні порушення: дуже часто − пропасниця і грипоподібні симптоми, які іноді супроводжуються нездужанням, ознобом, відчуттям втоми і припливами; часто − у місці інфузії препарату виникає біль, почервоніння, набряклість, затвердіння, флебіт, тромбофлебіт.
Біохімічні зміни: дуже часто − гіпокальціємія, гіпофосфатемія; часто − гіпокаліємія, гіпомагніємія, підвищення концентрації креатиніну в сироватці крові; нечасто − зміни функціональних печінкових проб, підвищення концентрації сечовини в сироватці крові; дуже рідко – гіперкаліємія, гіпернатріємія.
Випадки остеонекрозу (в основному щелепи) були відмічені у пацієнтів, які лікувалися бісфосфонатами. Більшість звітів посилається на онкохворих, яким видаляли зуби чи проводилася інша щелепна хірургія. Ймовірність остеонекрозу щелепи збільшується за наявності факторів ризику, включаючи діагноз раку, супровідної терапії (наприклад хіміотерапії, радіотерапії, терапії кортикостероїдами) та супутніх захворювань (наприклад, анемії, коагулопатії, інфекції, попередніх захворювань ротової порожнини).
Передозування. Необхідно уважно стежити за станом пацієнтів, які отримали дозу препарату, що перевищує рекомендовану. Клінічні ознаки гіпокальціємії (парестезія, тетанія і артеріальна гіпотензія) можуть бути усунені інфузією кальцію глюконату.
Застосування у період вагітності або годування груддю.
Досвіду, який би давав підстави рекомендувати застосування памідронату динатрію в період вагітності, немає, тому цей препарат під час вагітності застосовувати не слід.
Жінки, які проходять курс лікування препаратом Памідрія, в період лактації повинні відмовитися від годування груддю.
Діти.
Ефективність і безпека застосування препарату для лікування дітей не відомі, тому препарат не застосовують у педіатричній практиці.
Особливості застосування.
Препарат Памідрія не слід вводити внутрішньовенно струминно, а тільки шляхом повільної внутрішньовенної інфузії після попереднього розведення.
Бісфосфонати, у тому числі й Памідрія, пов’язані з токсичним впливом на нирки, який проявляється погіршанням функції нирок і потенційною нирковою недостатністю. Через ризик клінічно існуючого погіршання функції нирок, яке, можливо, прогресує до ниркової недостатності, одноразова доза препарату не повинна перевищувати 90 мг.
Як і при застосуванні внутрішньовенно бісфосфонатів, рекомендується контролювати функцію нирок: досліджувати рівень креатиніну сироватки крові до введення кожної дози препарату.
Препарат не слід застосовувати сумісно з іншими бісфосфонатами, оскільки наслідки такого комбінованого лікування не вивчалися.
У пацієнтів, яким протягом тривалого часу часто проводяться інфузії памідронату динатрію, особливо в тих випадках, коли в них є супутні захворювання нирок або відмічається схильність до ураження нирок унаслідок основного захворювання (наприклад, при мієломній хворобі і/або гіперкальціємії, зумовленій злоякісними пухлинами), необхідно періодично оцінювати функцію нирок (використовуючи результати стандартних лабораторних аналізів і клінічні дані).
Препарат виділяється у незміненому вигляді нирками, тому ризик негативних ниркових реакцій, можливо, є більшим у пацієнтів зі зниженою функцією нирок.
Ця рекомендація випливає з повідомлень про можливість погіршання функції нирок (навіть до розвитку ниркової недостатності) під час тривалого лікування памідронатом динатрію пацієнтів, які мають мієломну хворобу.
Введення розчину натрію хлориду, що використовується для приготування інфузійного розчину, може призводити до появи або посилення ознак серцевої недостатності (гострої лівошлуночкової або хронічної) у пацієнтів, які мають захворювання серця, особливо у пацієнтів літнього віку. Розвиток пропасниці (симптомів, що нагадують грип) також може спричинювати розвиток цього ускладнення.
У ході проведення терапії препаратом Памідрія слід регулярно контролювати стандартні гіперкальціємієзв’язані метаболічні параметри, включаючи концентрацію кальцію і фосфату в сироватці крові. Ризик розвитку гіпокальціємії підвищений у хворих, які перенесли хірургічне втручання на щитовидній залозі з приводу прихованого гіпопаратиреозу. З метою зниження ризику розвитку гіпокальціємії пацієнтам, які мають хворобу Педжета, слід додатково призначати внутрішньо препарати кальцію і вітамін D, оскільки у цих хворих високий ризик розвитку дефіциту кальцію і вітаміну D. При відсутності гіперкальціємії пацієнтам з літичними метастазами в кістки або мієломою, які піддаються ризику виникнення дефіциту кальцію або вітаміну D, і пацієнтам з хворобою Педжета слід перорально призначати кальцій і вітамін D, щоб мінімізувати ризик гіпокальціємії.
Остеонекроз щелепи виникає у пацієнтів, які хворіють на рак і приймають бісфосфонати. Багатьом із цих пацієнтів застосовують хіміотерапію та кортикостероїди. Більшість описаних випадків пов’язані зі стоматологічними процедурами (наприклад видалення зубів), у багатьох пацієнтів відзначалися ознаки локального інфекційного захворювання, включаючи остеомієліт. У пацієнтів, яким одночасно застосовується хіміотерапія, терапія кортикостероїдами, гігієна рота недостатня, перед застосуванням бісфосфонатів слід розглянути можливість стоматологічного обстеження із застосуванням профілактичних стоматологічних процедур. Цим пацієнтам, по можливості, слід уникати інвазивних стоматологічних процедур.
М’язово-скелетний біль: повідомлялось про виражений біль у кістках, суглобах і/або м’язах, який призводив до непрацездатності. Час до появи симптомів після початку прийому препарату варіює від кількох діб до кількох місяців. У більшості пацієнтів ці симптоми зникали після припинення лікування. У частини пацієнтів виникав рецидив симптомів після того, як у схему лікування включали ті самі препарати або інші бісфосфонати.
Відновлений розчин хімічно та фізично стабільний протягом 24 годин при кімнатній температурі. Однак для запобігання мікробіологічному забрудненню бажано використати розчин одразу після розведення.
Якщо розчин не використали одразу, термін та умови зберігання – на відповідальності лікаря. Загальний час між відновленням, розведенням, зберіганням у холодильнику при температурі 2-8 °С та застосуванням розчину не повинен перевищувати 24 години.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Слід попереджати пацієнтів, що після інфузії Памідрії можливі сонливість та/або запаморочення. У зв’язку з цим пацієнтам, які отримують препарат, слід утримуватися від занять потенційно небезпечними видами діяльності, що потребують підвищеної уваги і швидкості психомоторних реакцій.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Сумісне застосування Памідрії з протипухлинними засобами, які часто застосовуються, не супроводжувалося будь-якою значущою взаємодією.
При комбінованому застосуванні Памідрії і кальцитоніну у хворих з вираженою гіперкальціємією відмічався синергізм дії, що призводило до більш значного зниження концентрації кальцію в сироватці крові.
Обережність необхідна при застосуванні препарату разом з іншими потенційно нефротоксичними препаратами.
У хворих на множинну мієлому ризик ниркової дисфункції може бути збільшений якщо препарат застосовують у комбінації з талідомідом.
Фармакологічні властивості.
Фармакодинаміка.
Динатрію памідронат – активна речовина препарату Памідрія – є сильнодіючим інгібітором резорбції кісткової тканини, яка здійснюється остеокластами. Памідронат динатрію вступає у тісний зв'язок з кристалами гідроксіапатиту кісткової тканини та інгібує утворення і розчинення цих кристалів invitro. Вважається, що й invivo гальмування резорбції кісткової тканини може пояснюватися, зокрема, зв'язуванням памідронату з мінеральними речовинами.
Памідронат гальмує надходження попередників остеокластів до кісткової тканини і їх подальше перетворення у зрілі остеокласти, які відповідають за резорбцію цієї тканини. Припускають, однак, що домінуючим механізмом дії бісфосфонатів, які вступають у зв'язок з кістковою тканиною якinvitro, так і invivo,є їх локальний і прямий антирезорбтивний вплив.
Гіперкальціємія може призводити до зменшення об'єму позаклітинної рідини і зниження швидкості клубочкової ниркової фільтрації. Памідронат динатрію, зменшуючи вираженість гіперкальціємії, підвищує швидкість клубочкової фільтрації, що у більшості хворих супроводжується зниженням початково підвищеного рівня креатиніну в сироватці крові.
У хворих з кістковими метастазами (переважно остеолітичного характеру) злоякісних пухлин і мієломною хворобою препарат усуває або уповільнює прогресування змін скелета і їх наслідків (переломи, компресія спинного мозку, гіперкальціємія, потреба у променевій терапії і хірургічних втручаннях), а також знижує вираженість болю, зумовленого ураженням кісток.
Коли памідронат динатрію застосовувався у комбінації зі стандартною протипухлинною терапією, відмічалося уповільнення прогресування кісткових метастазів. Крім того, було відмічено, що у тих випадках, коли мала місце рефрактерність кісткових метастазів до цитотоксичної і гормональної терапії, під впливом памідронату динатрію відмічалася стабілізація цих змін або навіть розвиток склеротичного процесу.
Добрий терапевтичний ефект застосування памідронату динатрію відмічається при хворобі Педжета, яка характеризується локальним підвищенням резорбції кісткової тканини і якісними змінами її ремоделювання.
Фармакокінетика.
Загальні властивості. Памідронат має високу спорідненість з кальцифікованими тканинами. Повного виведення памідронату з організму не відмічено. Тому кальцифіковані тканини вважаються "місцем уявної елімінації" памідронату.
Всмоктування.Динатрію памідронат застосовується шляхом внутрішньовенних інфузій. За визначенням, по закінченні інфузії абсорбція вважається повною.
Розподіл. Від початку інфузії концентрація памідронату в плазмі крові швидко збільшується, а в кінці інфузії – так само швидко знижується. Уявний період напіввиведення памідронату з плазми становить 0,8 години. Тому рівноважні концентрації памідронату досягаються при тривалості інфузії більше 2-3 годин. При внутрішньовенній інфузії 60 мг препарату, що триває більше 1 години, максимальна концентрація памідронату у плазмі становить близько 10 нмоль/мл.
Кількість динатрію памідронату в процентному вираженні, що затримується в організмі після введення кожної дози препарату, у людини і тварини однакова. Таким чином, кумуляція памідронату у кістковій тканині не обмежена об'ємом цієї тканини, а залежить виключно від сумарної дози введеного препарату. Зв'язування циркулюючого памідронату з білками плазми відносно незначне (близько 54 %) і підвищується у випадку патологічного збільшення вмісту кальцію у крові.
Виведення.Вважається, що памідронат не зазнає біотрансформації при виведенні. Після внутрішньовенного введення (інфузії) приблизно 20-55 % введеної дози памідронату виявляється у сечі протягом 72 годин у незміненому вигляді. Решта затримується в організмі на невизначено тривалий час (у будь-якому випадку виведення памідронату не було зареєстровано). Та частина препарату (в процентному вираженні), що затримується в організмі, не залежить ні від введеної дози (в межах 15-180 мг), ні від швидкості інфузії (в межах 1,25-60 мг/год).
Виведення памідронату із сечею двофазне, уявні періоди напіввиведення становлять відповідно 1,6 і 27 годин. Загальний плазмовий кліренс становить близько 180 мл/хв, а нирковий кліренс – 54 мл/хв. Нирковий кліренс памідронату корелює з кліренсом креатиніну.
Фармакокінетика в окремих груп пацієнтів.Печінковий і метаболічний кліренс памідронату незначний. Очевидно, саме тому порушення функції печінки не впливає на фармакокінетику памідронату. Також унаслідок цього потенціал Памідрії в плані взаємодії з іншими лікарськими засобами незначний як на метаболічному рівні, так і на рівні зв'язування з білками плазми крові. У пацієнтів зі значними порушеннями функції нирок (при кліренсі креатиніну < 30 мл/хв) середнє значення площі під кривою "концентрація-час" (AUC) збільшується приблизно вдвічі. Швидкість екскреції памідронату із сечею знижується зі зниженням кліренсу креатиніну, хоча загальна кількість памідронату, що екскретується із сечею, істотно не залежить від зміни функції нирок. Тому затримка памідронату в організмі однакова у пацієнтів з порушеннями функції нирок і без таких. При застосуванні Памідрії для лікування хворих з порушеннями функції нирок у рекомендованій дозі спеціальної корекції дози не потрібно.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості: компактна маса або фрагменти пористої маси білого або майже білого кольору.
Несумісність.
Дослідження памідронату динатрію зі скляними флаконами, а також з ємкостями, виготовленими з полівінілхлориду та поліетилену (наповнених 0,9 % в/в розчином натрію хлориду чи 5 % внутрішньовенним розчином глюкози), не показали ніякої несумісності з препаратом.
Для запобігання потенційній несумісності відновлений розчин памідронату динатрію необхідно розчиняти 0,9 % внутрішньовенним розчином натрію хлориду чи 5 % внутрішньовенним розчином глюкози.
Відновлений розчин памідронату динатрію не слід змішувати з розчинами, які містять кальцій (наприклад розчин Рінгера).
Термін придатності.2 роки.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі не вище 30 °С у недоступному для дітей місці.
Приготовлений розчин придатний для застосування 24 години при зберіганні при температурі 2-8 °С.
Упаковка.
Ліофілізат у флаконах із безбарвного скла класу I з гумовою пробкою, обтиснутою алюмінієвим ковпачком з кольоровим поліпропіленовим диском. По 1 флакону в пачці з картону.
Категорія відпуску. За рецептом.
Виробник. Ципла Лтд, Індія/ CIPLA Ltd, India.
Місцезнаходження. Секція IX, Дільниці №№ L-139, S-103 та М-62, Верна Індастріал Естейт, Верна, Салцетте, Гоа – 403 722, Індія/ Unit IX, Plot No. L-139, S-103 and M-62, Verna Industrial Estate, Verna, Salcette, Goa – 403 722, India.
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Pamidronic acid - Памидроновая кислота |
| Код АТХ | M05BA03 |
| Форма выпуска | раствор |
- ПАМІРЕДИН Фармасайнс Інк., Канада
- ПАМИРЕД® Д-р Редді'с Лабораторіс Лтд (Виробнича дільниця 1), Індія
- ПАМИРЕД® Д-р Редді'с Лабораторіс Лтд (Виробнича дільниця 1), Індія
- ПОМЕГАРА Омега Лабораторіз Лімітед, Канада
- ПОМЕГАРА Омега Лабораторіз Лімітед, Канада
- СТОПКЛАСТАЛ Хоспіра ЮК Лімітед (відповідає за випуск серії)/Хоспіра Австралія ПТІ ЛТД (виробництво "in bulk", первинне та вторинне пакування, контроль якості випущених серій)/ЮПС СКС (Нідерланди) Б.В. (виробник, відповідальний за вторинне пакування)/СВУС Фарма а.с. (
- СТОПКЛАСТАЛ Хоспіра ЮК Лімітед (відповідає за випуск серії)/Хоспіра Австралія ПТІ ЛТД (виробництво "in bulk", первинне та вторинне пакування, контроль якості випущених серій)/ЮПС СКС (Нідерланди) Б.В. (виробник, відповідальний за вторинне пакування)/СВУС Фарма а.с. (
- СТОПКЛАСТАЛ Хоспіра ЮК Лімітед (відповідає за випуск серії)/Хоспіра Австралія ПТІ ЛТД (виробництво "in bulk", первинне та вторинне пакування, контроль якості випущених серій)/ЮПС СКС (Нідерланди) Б.В. (виробник, відповідальний за вторинне пакування)/СВУС Фарма а.с. (
- ПАМІФОС Медак Гезельшафт фюр клініше Шпеціальпрепарате мбХ (вторинне пакування, маркування, контроль та випуск серії)/ІДТ Біологіка ГмбХ, Німеччина/Німеччина
- Памидрия - 90 Ципла Лтд, Індія
 Настанова Європейської асоціації нефрологів, діалізологів
і трасплантологів (ERA-EDTA) з діагностики і лікування анемії у пацієнтів із хронічною нирковою
недостатністю
Настанова Європейської асоціації нефрологів, діалізологів
і трасплантологів (ERA-EDTA) з діагностики і лікування анемії у пацієнтів із хронічною нирковою
недостатністю
 Протокол діагностики та лікування грипу у дітей
Протокол діагностики та лікування грипу у дітей
 Застосування антигомотоксичних препаратів у комплексному лікуванні внутрішньоутробного інфікування плода
Застосування антигомотоксичних препаратів у комплексному лікуванні внутрішньоутробного інфікування плода
 Клініко-лабораторне обгрунтування застосування суміші «NAN-новий» у дітей із залізодефіцитними станами
Клініко-лабораторне обгрунтування застосування суміші «NAN-новий» у дітей із залізодефіцитними станами


