- Головна
- /
- Статті
- /
- Акушерство, гінекологія, репродуктивна медицина
- /
- Метаболический синдром: существует ли решение проблемы?
Метаболический синдром: существует ли решение проблемы?

В течение последних двух десятилетий в медицинском мире с возрастающим интересом обсуждается проблема метаболического синдрома (МС) у женщин в период менопаузы. Это объясняется тем, что за последнее время наблюдается заметное увеличение его распространенности.
 Термин «метаболический синдром» был впервые предложен немецкими учеными M. Henefeld и W. Leonhardt в 1980 г. Ранее это состояние было известно как метаболический трисиндром (J.P Camus., 1966) и синдром изобилия (H. Mehnert, 1968). В 1988 г. G.M. Reaven на основании анализа всех имеющихся в литературе данных, в т.ч. и собственных результатов, предложил определение «метаболический синдром Х», включив в это понятие тканевую инсулинорезистентность, дислипопротеинемию, абдоминальное ожирение и артериальную гипертензию. И лишь в конце 90-х годов клиницисты начали обсуждать проблему постменопаузального метаболического синдрома (ПМС). Причиной тому послужило неуклонное увеличение продолжительности жизни женщин. По данным статистического ежегодника США, в настоящее время 95% женщин достигают возраста менопаузы, тогда как в начале прошлого века этот показатель был ниже 60%, т.е. за столетие жизнь женского населения увеличилась на 30-40 лет. Эта ситуация поставила перед врачами практически всех медицинских специальностей множество вопросов, касающихся, главным образом, профилактики и лечения патологических состояний, развивающихся на фоне дефицита эстрогенов.
Термин «метаболический синдром» был впервые предложен немецкими учеными M. Henefeld и W. Leonhardt в 1980 г. Ранее это состояние было известно как метаболический трисиндром (J.P Camus., 1966) и синдром изобилия (H. Mehnert, 1968). В 1988 г. G.M. Reaven на основании анализа всех имеющихся в литературе данных, в т.ч. и собственных результатов, предложил определение «метаболический синдром Х», включив в это понятие тканевую инсулинорезистентность, дислипопротеинемию, абдоминальное ожирение и артериальную гипертензию. И лишь в конце 90-х годов клиницисты начали обсуждать проблему постменопаузального метаболического синдрома (ПМС). Причиной тому послужило неуклонное увеличение продолжительности жизни женщин. По данным статистического ежегодника США, в настоящее время 95% женщин достигают возраста менопаузы, тогда как в начале прошлого века этот показатель был ниже 60%, т.е. за столетие жизнь женского населения увеличилась на 30-40 лет. Эта ситуация поставила перед врачами практически всех медицинских специальностей множество вопросов, касающихся, главным образом, профилактики и лечения патологических состояний, развивающихся на фоне дефицита эстрогенов.
ПМС – это полисимптомное состояние. При обследовании пациенток с этим синдромом чаще всего выявляют нарушение толерантности к углеводам или сахарный диабет (СД) 2-го типа, дислипидемию, сердечно-сосудистые заболевания (ССЗ) и абдоминальное ожирение. Следовательно, при выборе лекарственных средств для проведения долгосрочной терапии ПМС крайне важно тщательно анализировать не только наличие и степень метаболических нарушений, но и различные сопутствующие патологии.
Предлагаем вашему вниманию заседание круглого стола по теме «Метаболический синдром: существует ли решение проблемы?».
Постменопаузальный метаболический синдром: взгляд эндокринолога
Б.Н. Маньковский, д.м.н., профессор, заместитель директора Украинского научно-практического центра эндокринной хирургии и трансплантации эндокринных органов и тканей МЗ Украины
 – По современным представлениям МС – это сочетание целого ряда патологических феноменов, к которым относятся СД 2-го типа или нарушение толерантности к глюкозе; инсулинорезистентность; артериальная гипертензия (АГ); ожирение (по андроидному типу с преимущественным отложением жировой ткани в области передней брюшной стенки живота); дислипидемия (повышение содержания триглицеридов, снижение уровня липопротеидов высокой плотности (ЛПВП) в плазме крови); сдвиги со стороны коагуляционных свойств крови (увеличение активности ингибитора тканевого плазминогена-1, фактора фон Виллебранда, фибриногена); нарушение функции эндотелия (в том числе микроальбуминурия); повышенное содержание мочевой кислоты в плазме крови; нарушение функции печени, жировая дистрофия; активация генерализованного воспаления.
– По современным представлениям МС – это сочетание целого ряда патологических феноменов, к которым относятся СД 2-го типа или нарушение толерантности к глюкозе; инсулинорезистентность; артериальная гипертензия (АГ); ожирение (по андроидному типу с преимущественным отложением жировой ткани в области передней брюшной стенки живота); дислипидемия (повышение содержания триглицеридов, снижение уровня липопротеидов высокой плотности (ЛПВП) в плазме крови); сдвиги со стороны коагуляционных свойств крови (увеличение активности ингибитора тканевого плазминогена-1, фактора фон Виллебранда, фибриногена); нарушение функции эндотелия (в том числе микроальбуминурия); повышенное содержание мочевой кислоты в плазме крови; нарушение функции печени, жировая дистрофия; активация генерализованного воспаления.
Проблема патогенеза, клинических проявлений и подходов к терапии МС привлекает внимание многих врачей-эндокринологов. Это объясняется тем, что одним из важнейших компонентов данного синдрома является нарушение углеводного обмена, которое может проявляться как СД 2-го типа, так и нарушением толерантности к глюкозе (латентным СД). Весьма часто в клинической практике, оказывая медицинскую помощь пациентам, страдающим СД 2-го типа, врач-эндокринолог обращает внимание на выявление и проведение медикаментозной коррекции других проявлений МС, прежде всего таких как АГ, дислипидемия и др. Однако большинство исследователей в настоящее время склонны считать, что в основе патогенеза МС лежит снижение чувствительности тканей к действию инсулина, так называемая инсулинорезистентность. Проблема взаимодействия инсулина с тканями-мишенями, механизмы развития инсулинорезистентности на фоне как нормального, так и нарушенного углеводного обмена привлекают особое внимание эндокринологов.
Как нам представляется, важность проблемы МС заключается прежде всего в том, что у лиц с проявлениями данного синдрома значительно повышен риск развития инфаркта миокарда (ИМ), острых нарушений мозгового кровообращения. Накопленные данные позволяют утверждать, что имеются определенные гендерные особенности как развития МС, так и его значения в качестве фактора риска развития ССЗ. В недавно опубликованном крупном метаанализе, охватившем 37 проспективных исследований, в которых участвовало 172 573 человека, было показано, что наличие МС повышает ССЗ и кардиоваскулярную смертность в 1,78 раза по сравнению с лицами, у которых отсутствовали признаки данного синдрома. При этом было обнаружено, что взаимосвязь между МС и кардиоваскулярной заболеваемостью и смертностью была значительно выше у женщин, чем у мужчин (Gami et al., 2007).
Частота МС у женщин повышается с возрастом, причем наиболее значительная его распространенность отмечается после наступления менопаузы. По всей видимости, в основе развития ПМС лежит целый ряд факторов, таких как гипоэстрогенемия и связанные с ней увеличение массы тела, накопление жировой ткани, особенно так называемого висцерального жира (именно этот вид жировой ткани более вредоносен в плане своих биологических свойств), и развивающаяся вследствие этого инсулинорезистентность. Одним из проявлений МС является предиабет – патологическое состояние, при котором отмечается нарушение гликемии натощак и/или толерантности к глюкозе. Недавно были представлены результаты крупного проспективного исследования, в котором участвовали 1455 исходно здоровых лиц в возрасте 39-79 лет в течение 6 лет. Было обнаружено, что у женщин наблюдается тесная статистически достоверная взаимосвязь между риском развития предиабета, с одной стороны, и повышенным содержанием в плазме крови целого ряда протромботических факторов (адгезивных молекул ингибитора тканевого активатора плазминогена), возрастанием частоты встречаемости АГ, с другой стороны. Вместе с тем у мужчин с предиабетом подобная взаимосвязь не была выявлена. Также при сравнении показателей лиц обоего пола с предиабетом у женщин отмечалось повышение содержания адгезивных и протромботических факторов в плазме крови (Donahue et al., 2007), что свидетельствует о возрастании риска развития ССЗ. Следовательно, можно сделать вывод о том, что формирование атеросклеротического поражения сосудов у женщин с МС начинается раньше, чем у лиц мужского пола.
Возможно, указанные различия лежат в основе опубликованных данных о том, что у пациенток с СД риск развития ИМ и инсульта по сравнению с женщинами, не болеющими СД, выше, чем аналогичный показатель у мужчин с СД. Так, в недавно опубликованном метаанализе 37 эпидемиологических исследований, включавших 447 064 больных СД, было показано, что риск смерти от ишемической болезни сердца (ИБС), обусловленный СД, был на 50% выше у женщин, чем у мужчин (Huxley et al., 2006). При этом, чем моложе больные СД, тем в большей степени повышается у них относительный риск развития ССЗ по сравнению с женщинами соответствующего возраста без диабета.
Следует помнить, что повреждающее влияние могут оказывать не только «развернутые» проявления МС, но и более «мягкие», например такие как прегипертензия, то есть когда уровень артериального давления (АД) выше 120/80, но ниже 140/90 мм рт. ст. В представленном в одном из последних номеров журнала Circulation исследовании, в котором участвовало 60 785 женщин в постменопаузальном периоде в течение 7,7 года, было выявлено, что у лиц с прегипертензией риск кардиоваскулярной смертности был выше в 1,58, ИМ – в 1,76, инсульта – в 1,93, сердечной недостаточности – в 1,36 раза по сравнению с аналогичным риском у женщин с нормальным АД (Hsia et al., 2007). Доказано, что среди пациенток, у которых имелись клинические признаки ИБС, нарушения углеводного обмена, свидетельствующие о возможном наличии МС, встречались в 1,43 раза чаще, чем у мужчин. Однако только у 19% женщин и у 27% мужчин отмечали нормальные показатели углеводного обмена (Dotevall et al., 2007).
С одной стороны, при лечении пациенток с СД следует помнить о возможности развития клинически выраженных ССЗ в относительно молодом возрасте, независимо от состояния менструальной функции, особенно на фоне длительно протекающего СД. С другой стороны, активные профилактические мероприятия, направленные на снижение риска развития кардиоваскулярной патологии, должны проводиться у женщин с СД так же агрессивно, как и у мужчин с СД. При наступлении менопаузы значительно возрастает риск формирования МС и еще больше повышается риск развития ССЗ. Актуальным сегодня является вопрос о необходимости и безопасности назначения заместительной гормональной терапии (ЗГТ) у пациенток с СД с целью профилактики развития ССЗ в период менопаузы. Следует подчеркнуть, что в последние годы не рекомендовалось использовать данные препараты как средства профилактики ИМ и инсульта, поскольку были получены предварительные результаты, свидетельствующие об увеличении риска развития этих заболеваний на фоне приема ЗГТ.
Однако после тщательного субанамнеза полученных данных в зависимости от сроков назначения ЗГТ, были обнародованы противоположные результаты. Сердечнососудистый риск (ИБС и инсульт), который исследователи WHI связывали с гормонотерапией еще в 2002 г., сейчас кажется не актуальным, по крайней мере, у пациенток до 59-летнего возраста (Rossouw J.E. et al., 2007). Таким образом, ЗГТ на ранних этапах постменопаузы (во время так называемого «терапевтического окна» – в возрасте 50-59 лет) имеет большое значение для улучшения качества жизни. Более того, существует достаточно данных в поддержку применения ЗГТ как компонента общей стратегии поддержания здоровья женщин в постменопаузе. Говоря о противоположной чаше этих весов, можно сказать, что на ранних этапах постменопаузы серьезный риск незначителен.
Лечение женщин, у которых имеют место проявления МС, должно быть поэтапным и требует назначения соответствующих лекарственных средств с целью коррекции всех имеющихся нарушений: гипогликемических препаратов – пациентам с СД, антигипертензивных препаратов – при наличии АГ, статинов и фибратов – для коррекции дислипидемии, ацетилсалициловой кислоты или клопидогреля – с целью воздействия на реологические свойства крови. У лиц с МС представляется оправданным назначение фибратов как в комбинации со статинами, так и в виде монотерапии. Это объясняется частотой встречаемости у этих пациентов гипертриглицеридемии и пониженного содержания ЛПВП. В настоящее время не существует общей терапии, оказывающей влияние на этиологические или патогенетические факторы формирования МС. В качестве универсального терапевтического подхода следует подчеркнуть необходимость снижения избыточной массы тела и повышения физической активности, благотворно воздействующих на все компоненты МС.
Таким образом, МС, развивающийся у женщин в постменопаузальном периоде, имеет определенные особенности, и у таких пациенток следует проводить активные диагностические и лечебные мероприятия, направленные на снижение риска развития у них ССЗ.
Менопаузальный метаболический синдром: взгляд кардиолога
Е.И. Митченко, д.м.н., профессор, руководитель отдела дислипидемий Института кардиологии им. Н.Д. Стражеско АМН Украины
 – Особенностью АГ у женщин в период перехода от репродуктивного возраста к менопаузе является реализация патогенетических механизмов на фоне формирующегося эстрогенового дефицита, что заключается в своеобразии патофизиологических явлений и в определенной специфике клинической картины заболевания. Следует отметить, что, судя по синдромам, данное состояние чаще всего характеризуется сочетанием АГ с формированием избыточной массы тела, появлением нарушений липидного и углеводного обмена, т.е. с постепенным развитием состояния, которое принято классифицировать как МС, а поскольку речь в данном конкретном случае идет о женской популяции, то характеризуется как менопаузальный метаболический синдром (ММС). Недооценка всей совокупности патологии нередко приводит к ошибочной трактовке отдельно взятого его проявления, как например, АГ в качестве самостоятельного заболевания, в то время как только многофакторный подход к диагностике, а в дальнейшем – к лечению и профилактике может позволить полноценно и максимально эффективно повлиять на основные показатели здоровья исследуемых групп населения. Актуальность данной проблемы усугубляется тем, что во многих развитых странах значительно увеличилась доля женщин в менопаузе, и вопросы медико-социальной реабилитации таких пациенток стали объектом пристального внимания врачей. Большинство женщин глубоко переживают наступление менопаузы, поскольку в этот период нередко появляются серьезные проблемы со здоровьем. Это обусловлено тем, что менопауза, не являясь собственно заболеванием, тем не менее нарушает существовавшее до этого времени эндокринное равновесие в организме. Дисбаланс гормонов приводит к резкому подъему уровня ССЗ, осложнения которых нередко являются основной причиной смертности.
– Особенностью АГ у женщин в период перехода от репродуктивного возраста к менопаузе является реализация патогенетических механизмов на фоне формирующегося эстрогенового дефицита, что заключается в своеобразии патофизиологических явлений и в определенной специфике клинической картины заболевания. Следует отметить, что, судя по синдромам, данное состояние чаще всего характеризуется сочетанием АГ с формированием избыточной массы тела, появлением нарушений липидного и углеводного обмена, т.е. с постепенным развитием состояния, которое принято классифицировать как МС, а поскольку речь в данном конкретном случае идет о женской популяции, то характеризуется как менопаузальный метаболический синдром (ММС). Недооценка всей совокупности патологии нередко приводит к ошибочной трактовке отдельно взятого его проявления, как например, АГ в качестве самостоятельного заболевания, в то время как только многофакторный подход к диагностике, а в дальнейшем – к лечению и профилактике может позволить полноценно и максимально эффективно повлиять на основные показатели здоровья исследуемых групп населения. Актуальность данной проблемы усугубляется тем, что во многих развитых странах значительно увеличилась доля женщин в менопаузе, и вопросы медико-социальной реабилитации таких пациенток стали объектом пристального внимания врачей. Большинство женщин глубоко переживают наступление менопаузы, поскольку в этот период нередко появляются серьезные проблемы со здоровьем. Это обусловлено тем, что менопауза, не являясь собственно заболеванием, тем не менее нарушает существовавшее до этого времени эндокринное равновесие в организме. Дисбаланс гормонов приводит к резкому подъему уровня ССЗ, осложнения которых нередко являются основной причиной смертности.
Распространенность МС среди взрослого населения, оцененная даже с помощью «щадящих» критериев (2001), довольно высока и в США составляет 23,7% (24% среди мужчин и 23,4% среди женщин). При этом в возрастных группах от 20 до 49 лет МС чаще наблюдается у мужчин, в 50-69-летнем возрасте распространенность практически одинакова у мужчин и женщин, а в возрасте старше 70 лет чаще наблюдается у женщин.
Большая по сравнению с мужчинами частота МС у женщин в старших возрастных группах обусловлена, по мнению большинства авторов, наступлением менопаузы. Сама концепция ММС впервые была выдвинута C. Spencer в 1997 г. На основании тщательного анализа работ, посвященных влиянию менопаузы на чувствительность к инсулину, показатели липидного и углеводного обмена, распределение жировой ткани и систему гемостаза, а также данных о влиянии ЗГТ на вышеизложенные параметры, большинством авторов предложено выделять ММС как комплекс факторов риска развития ИБС, в основе которого лежит дефицит эстрогенов.
Следует отметить, что единой концепции МС для лиц мужского и женского пола не существует, поскольку формирование МС у мужчин находится в прямой зависимости от выраженности абдоминального ожирения, а у женщин такая закономерность появляется только с наступлением менопаузы и гипоэстрогенемии. ММС мы сознательно выделяем, потому что 50% пациентов с АГ составляют женщины в период менопаузы, частота выявления СД 2-го типа у женщин 40-50 лет – 3-5%, а в возрасте 60 лет достигает 10-20%, т.е. с возрастом прогрессирует нарушение углеводного обмена. Различие степени риска возникновения фатальных ССЗ нашло свое отражение в системе SCORE (Sistematic Coronary Risk Evoluation), презентованной еще в 2003 г. на конгрессе Европейского общества кардиологов, из которой видно, что у мужчин ССЗ начинают прогрессировать с достижением 40-летнего возраста, тогда как у женщин такая угроза возникает лишь в возрасте 50-55 лет и с наступлением менопаузы. В исследовании DECODE (Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Europe, 2000) показано, что повышение уровня АД (>160/95 мм рт. ст.) и нарушение чувствительности к инсулину увеличивают риск развития ССЗ у женщин в постменопаузе даже при незначительных изменениях уровня АД и чувствительности к инсулину. Наиболее уязвимым периодом переходного возраста есть пременопауза, т.е. начальный период снижения функции яичников (в основном в возрасте после 45 лет и до наступления менопаузы), которая сопровождается стремительным снижением уровня эстрогенов. Реализация дефицита эстрогенов в период менопаузы включает влияние на метаболизм липопротеинов, прямое влияние на биохимические процессы в стенке сосудов через специфические рецепторы к эстрогенам, а также опосредствованное влияние через метаболизм глюкозы, инсулина, гомоцистеина, систему гемостаза и т.п.
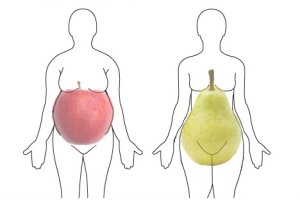
Как было установлено, именно висцеральное или абдоминальное ожирение рассматривается сегодня как основа метаболических нарушений, ассоциированных с наступлением менопаузы. Дефицит эстрогенов приводит к изменению типа распределения жировой ткани с периферического (глютеофеморального), характерного для женщин в пременопаузе, на центральный (абдоминально-висцеральный), более характерный для мужчин. Накопление абдоминальной жировой ткани, в свою очередь, приводит к инсулинорезистентности с компенсаторной гиперинсулинемией в начале процесса, повышению синтеза липопротеинов очень низкой плотности (ЛПОНП) в печени, повышению уровня триглицеридов и снижению уровня холестерина ЛПВП, а также к повышению уровня АД. Таким образом формируется клиническая картина ММС.
В пользу этой гипотезы свидетельствуют результаты нескольких исследований. Так, было показано, что в группе женщин с АГ и с ожирением количество висцеральной жировой ткани, оцененное с помощью ультразвукового исследования, тесно коррелирует с индексом инсулинорезистентности (HOMA) и со среднесуточным систолическим АД. У клинически здоровых женщин в постменопаузе, по данным компьютерной томографии, наблюдается четкая взаимосвязь объема висцеральной жировой ткани с чувствительностью тканей к инсулину, уровнем триглицеридов, холестерина ЛПВП и глюкозы в крови натощак. Гиперинсулинемия у здоровых женщин в постменопаузе четко коррелирует с антропометрическими показателями центрального, а не общего ожирения. Таким образом, перераспределение жировой ткани, ассоциированное с наступлением менопаузы, значительно увеличивает риск возникновения МС.
Альтернативная гипотеза, которая объясняет формирование ММС, – снижение чувствительности тканей к инсулину, вызванное дефицитом эстрогенов с наступлением менопаузы. Исследования с применением эугликемического клемп-теста (определение инсулинорезистентности) у больных АГ продемонстрировали, что в постменопаузе женщины более инсулинорезистентны, чем в пременопаузе, по сравнению с мужчинами соответствующего возраста и с той же степенью ожирения. Инсулинорезистентность у женщин в постменопаузе тесно связана с нарушениями липидного обмена – увеличением уровня триглицеридов, снижением холестерина ЛПВП натощак и с показателями постпрандиальной липемии (триглицеридами и ремнантными липопротеинами). Показано также, что при наличии АГ у женщин в постменопаузе уровни глюкозы и инсулина выше, чем у нормотензивных женщин; при этом наблюдается четкая корреляция показателей гиперинсулинемии и среднесуточного систолического АД. Следовательно, инсулинорезистентность, ассоциированная с наступлением менопаузы, может иметь значение для развития клинических проявлений МС – дислипидемии, АГ и гипергликемии натощак. В то же время есть данные о сопоставимой чувствительности к инсулину между женщинами в пре- и постменопаузе, при этом количество висцеральной жировой ткани выше у лиц в постменопаузе (p<0,001).
По эпидемиологическим данным, распространенность АГ у женщин в постменопаузе выше, чем в пременопаузе. В большей мере повышается уровень систолического АД как дневного, так и среднесуточного. Кроме того, есть сведения о недостаточном снижении уровня систолического и диастолического АД в ночное время (по данным суточного мониторирования) у женщин с АГ в постменопаузе. Несмотря на существование отличий, установлен ряд закономерностей, характеризующих АГ у женщин на протяжении всей перименопаузы (состоящей из пре- и постменопаузы):
- повышение активности симпатоадреналовой системы, типичное для этого периода, приводит к формированию гиперкинетического типа кровообращения;
- дискретный выброс катехоламинов определяет высокую вариабельность АД в течение суток;
- в целом происходит потенцирование клиники нейровегетативных проявлений климактерического синдрома и АГ, поэтому для эффективного лечения пациенток в ряде случаев необходимо применение сочетанной гипотензивной терапии и ЗГТ.
Влияние менопаузы на уровень АД может быть опосредовано разными механизмами. Эстрогены влияют на функцию ренин-ангиотензиновой системы, вызывая как повышение АД (путем увеличения уровня ангиотензиногена), так и снижение – за счет снижения уровня ренина. В эксперименте на животных показано, что при овариоэктомии наблюдается повышенная экспрессия рецепторов к ангиотензину типа АТ1. Важным механизмом влияния дефицита эстрогенов на АД является повышение активности симпатической нервной системы. Установлено, что уровень норадреналина в плазме после стимуляции выше у женщин с АГ в постменопаузальном периоде, нежели в пременопаузе. Трансдермальная терапия эстрогенами женщин в постменопаузе приводит к снижению симпатической активации. Кроме того, эстрогены могут прямо влиять на артериальную стенку резистивных сосудов, снижая АД. Повышение АД при ММС может быть связано также с накоплением висцеральной жировой ткани, гиперинсулинемией, а также изменениями трансмембранного транспорта катионов и структурного состояния клеточных мембран .
Наступление менопаузы ассоциируется с атерогенными сдвигами в липидном профиле сыворотки крови: увеличением общего холестерина (ОХ), триглицеридов и холестерина липопротеидов низкой плотности (ЛПНП), снижением уровня холестерина ЛПВП. Уровень холестерина ЛПНП у женщин в постменопаузе выше, чем у мужчин соответствующего возраста. Являются ли эти изменения прямым следствием дефицита эстрогенов, окончательно не исследовано. Возможно, они вторичны относительно перераспределения жировой ткани и снижения чувствительности тканей к инсулину, который наблюдается в постменопаузе. Терапия эстрогенами приводит к увеличению уровня холестерина ЛПВП и снижению уровня холестерина ЛПНП; в то же время в исследовании WHI (Women's Health Іnіtіatіve) продемонстрировано отрицательное влияние ЗГТ на заболевания сердечно-сосудистой системы у женщин в постменопаузе. Однако следует отметить явные недостатки исследования WHI, особенно такие как поздние сроки назначения ЗГТ (средний возраст пациенток составил 62 года) и неудачный выбор прогестероновой составляющей ЗГТ (медроксипрогестерона ацетат – один из наиболее атерогенных гестагенов), что обусловило инициацию проводимых в настоящее время новых многоцентровых исследований, дизайн которых составлен более корректно.
Гипергликемия натощак, нарушение толерантности к глюкозе и СД 2-го типа как проявление синдрома инсулинорезистентности часто наблюдаются у женщин в постменопаузе . Вероятность заболевания СД 2-го типа у женщин старше 45 лет в 2 раза выше, нежели у мужчин того же возраста. Риск заболеваемости ИБС у женщин с СД выше, чем у мужчин; относительный риск смерти от ИБС при наличии СД увеличивается в 1,9 раза у мужчин и в 3,3 раза у женщин.
Вместе с тем нарушения углеводного обмена приводят к потере защитных свойств эстрогенов уже в пременопаузальном периоде. Гипергликемия и формирование конечных продуктов гликозилирования снижают опосредованную эстрадиолом продукцию оксида азота и увеличивают оксидативный стресс. Следствием этих процессов есть ускорение атерогенеза. Следует отметить, что соединение нарушений углеводного обмена с другими компонентами МС у женщин, равно как и СД 2-го типа, в большей степени влияет на прогноз, нежели у мужчин. По данным исследования FOS (Framіngham Offsprіng Study), которое включало 2406 мужчин и 2569 женщин в возрасте от 18 до 74 лет, объединение трех метаболических факторов риска и более (включающих гипергликемию, снижение холестерина ЛПВП, гиперхолестеринемию, гипертриглицеридемию, ожирение и повышение уровня систолического АД) ассоциируется с увеличением риска ИБС в 2,39 раза у мужчин (95% доверительный интервал [ДИ]: 1,56-3,36) и в 5,9 раза у женщин (95% ДИ: 2,54-13,73). При этом сумма факторов риска была прямо связана с возрастом только в группе женщин.
В последние годы МС рассматривается как состояние, характеризующееся иммунным воспалением низких градаций. Данные нескольких исследований свидетельствуют, что повышение уровня С-реактивного белка (С-РБ) более 3 мг/л является независимым предиктором CCЗ в популяции и следствием увеличения секреции провоспалительного цитокина, интерлейкина-6. Продемонстрирована четкая взаимосвязь С-РБ с показателями ожирения, чувствительностью к инсулину и уровнем инсулина натощак. Повышение уровней С-РБ и интерлейкина-6 наблюдается также у больных с эссенциальной АГ и при повышении уровня пульсового АД. Установлено также, что гипергликемия индуцирует синтез интерлейкина-6 и фактора некроза опухоли в жировой ткани. В то же время концентрация в плазме крови адипонектина, противовоспалительного белка, который продуцируется жировой тканью, снижена при ожирении и при инсулинорезистентности. Таким образом, имеются доказательства взаимосвязи иммунного воспаления и МС. Наступление менопаузы ассоциируется с увеличением уровней провоспалительных цитокинов. Имеются сообщения, в которых С-РБ четко является предиктором возникновения МС у женщин, но не у мужчин. В исследовании WHS (Women's Health Study) было показано, что уровень С-РБ у лиц женского пола имеет даже большее прогностическое значение, чем уровень холестерина ЛПНП. У женщин в постменопаузе равные уровни интерлейкина-6 и С-РБ продемонстрировали отрицательную корреляцию с уровнем адипонектина. Таким образом, иммунное воспаление может играть важную роль в патогенезе ММС, однако этот вопрос требует дальнейшего изучения.
В последнее время уделяется особое внимание лечению данной патологии. Установлено, что женщины по сравнению с мужчинами в 2 раза лучше осведомлены о наличии у них АГ и в 3 раза эффективнее лечатся, принимают антигипертензивные и прочие необходимые препараты и достигают целевых уровней АД.
Снижение риска возникновения ССЗ и смертности – основная цель терапии АГ на фоне ММС. Комплексные меры воздействия на основные составные МС, которое включает мероприятия по изменению образа жизни и медикаментозную терапию, должны проводиться у каждой пациентки. Первоочередным моментом является именно модификация образа жизни. Соединение диеты и регулярных физических нагрузок приведет к улучшению или нормализации практически всех составных МС: снижению массы тела и АД, повышению чувствительности тканей к инсулину, нормализации показателей липидного и углеводного обмена и снижению маркеров иммунного воспаления. К сожалению, во многих случаях модификация образа жизни невыполнима или дает временный эффект.
Все мероприятия по изменению образа жизни можно обобщить следующим образом:
- отказ от курения;
- снижение массы тела;
- ограничение употребления алкогольных напитков;
- увеличение физических нагрузок;
- снижение потребления поваренной соли до 5 г/cут.
Медикаментозная терапия показана практически в каждом случае у больных АГ на фоне ММС. В современных рекомендациях по диагностике и лечению АГ больные с МС и женщины в постменопаузе отнесены к так называемым специальным группам, в которых при назначении антигипертензивных препаратов необходимо учитывать их метаболическую нейтральность и возможность возникновения побочных эффектов. Каждый раз, назначая антигипертензивную терапию, необходимо задавать себе вопрос: какую цену мы платим за достижение целевых уровней АД? Чтобы ответить на этот вопрос можно привести довольно демонстративные результаты исследования ALPІNE (Antihypertensive treatment and Lipid ProfIle in a North of Sweden Efficacy) относительно влияния антигипертензивной терапии на метаболический профиль больных с АГ, в котором при достижении одинакового антигипертензивного эффекта в обеих группах, в группе кандесартана и фелодипина до конца исследования лишь в 0,5% пациентов выявлены случаи возникновения СД, тогда как в группе атенолола и гидрохлортиазида таких больных было 4,1%.
Таким образом, к препаратам для лечения АГ у женщин в перименопаузе предъявляются следующие требования:
- удобный режим приёма (1-2 раза в сутки);
- отсутствие усугубляющего воздействия на нейровегетативные проявления климактерического синдрома;
- отсутствие гипотензивных реакций;
- уменьшение активности симпатоадреналовой системы;
- отсутствие отрицательного влияния на липидный и углеводный обмен;
- отсутствие отрицательного влияния на костную систему (нейтралитет в отношении остеопороза);
- при необходимости, возможность комбинации с препаратами для ЗГТ.
С учетом существующих рекомендаций и рассмотренных патогенетических механизмов ММС наиболее обоснованным является назначение лекарственных средств, влияющих на ренин-ангиотензиновую систему (ингибиторов ангиотензин-превращающего фермента (АПФ) и блокатров ангиотензиновых рецепторов) и симпатическую нервную систему (агонистов имидазолиновых рецепторов). Ингибиторы АПФ и блокаторы ангиотензиновых рецепторов рекомендуются для терапии АГ при МС; могут быть препаратами выбора. Применение современного блокатора ангиотензиновых рецепторов (например Теветена [эпросартана мезилата]) может быть обоснованным именно у пациенток с ММС, так как имеются экспериментальные данные о повышенной экспрессии рецепторов к ангиотензину типа АТ1 у больных данной категории. Кроме того, препарат Теветен имеет высокий профиль безопасности – не вызывает развития гипотензии.
Серьезные нарушения углеводного и липидного обмена, изменение вегетативного фона значительно усложняют подбор антигипертензивной терапии у пациентов с МС. Гипотензивное средство не должно усугублять обменные нарушения. Симпатикотония является важным доводом для применения β-адреноблокаторов. Однако их негативное действие на метаболизм глюкозы лимитирует назначение этой группы лекарственных средств. Кардиологи рекомендуют назначение препаратов центрального действия для устранения вегетативного компонента МС. Вместе с тем высокая частота побочных эффектов при использовании агонистов β2-адренорецепторов (клонидина) ограничивает их применение. Относительно новой группой препаратов центрального действия являются агонисты имидазолиновых рецепторов, например препарат Физиотенз. Данный препарат воздействует на центральные и периферические имидазолиновые рецепторы, снижая уровень АД до нормальных величин.
По эффекту агонисты имидазолиновых рецепторов (Физиотенз) сопоставимы с современными ингибиторами АПФ, блокаторами β-адренорецепторов, блокаторами кальциевых каналов. В экспериментах показано, что Физиотенз нормализует уровни инсулина и липидов в плазме крови за счет усиления утилизации глюкозы инсулинзависимой мышечной тканью, снижение уровня липидов, уменьшение периферической инсулинорезистентности. На основании вышесказанного Физиотенз можно считать препаратом выбора при МС.
В последних европейских исследованиях получены данные, что Физиотенз уменьшает гипертрофию левого желудочка, устраняет прогрессирование почечной недостаточности.
В особо тяжелых случаях, когда не удается снизить АД до нормального уровня и восстановить показатели углеводного обмена, назначают диуретики, корректоры углеводного обмена и гиполипидемические препараты.
Назначение агонистов имидазолиновых рецепторов (Физиотенза) приводит к снижению симпатической гиперактивации и повышает чувствительность периферических тканей к инсулину. Продемонстрирована высокая антигипертензивная эффективность Физиотенза, подтвержденная при суточном мониторировании АД у женщин с АГ в перименопаузе и у больных с ММС. В отделе дислипидемий Национального научного центра Института кардиологии им. Н.Д. Стражеско проведены исследования по использованию Физиотенза с целью выяснения влияния на АД и проявления инсулинорезистентности у больных с ММС. Через 3 мес от начала терапии получены положительные результаты в группе Физиотенза: снижение уровней глюкозы и инсулина, а также повышение чувствительности тканей к инсулину в соответствии с определением индекса HOMA.
Исходя из вышеизложенного, хотелось бы еще раз подчеркнуть, что существуют различия в формировании АГ, ИБС и МС у мужчин и у женщин.
Менопаузальный метаболический синдром: взгляд гинеколога
Т.Ф. Татарчук, д.м.н., профессор, заместитель директора по научной работе, зав. отделением эндокринной гинекологии Института педиатрии, акушерства и гинекологии АМН Украины
 При обследовании женщин с ММС чаще всего выявляют нарушение толерантности к углеводам или СД 2-го типа, дислипидемию, ССЗ и абдоминальное ожирение. Именно поэтому при выборе лекарственных средств для проведения долгосрочной терапии ПМС крайне важно тщательно анализировать не только наличие и степень метаболических нарушений, но и различной сопутствующей патологии.
При обследовании женщин с ММС чаще всего выявляют нарушение толерантности к углеводам или СД 2-го типа, дислипидемию, ССЗ и абдоминальное ожирение. Именно поэтому при выборе лекарственных средств для проведения долгосрочной терапии ПМС крайне важно тщательно анализировать не только наличие и степень метаболических нарушений, но и различной сопутствующей патологии.
Основным проявлением ММС является увеличение массы тела после менопаузы с формированием абдоминально-висцерального ожирения. В ряде крупных эпидемиологических исследований убедительно продемонстрировано, что после наступления менопаузы у 80% женщин происходит увеличение массы тела. По данным WHS, в первые три года после наступления менопаузы масса тела увеличивается на 3-5 кг и, кроме того, отмечается перераспределение и накопление жировой ткани в брюшной висцеральной области. Избыточная масса тела и ожирение – одна из наиболее важных проблем современной медицины. Даже незначительное увеличение массы тела существенно повышает риск возникновения таких заболеваний и синдромов, как СД 2-го типа, кардиоваскулярные нарушения, АГ, нарушения липидного обмена, злокачественные опухоли репродуктивной системы.
Основными особенностями обмена липидов в менопаузе являются:
- повышение уровня общих липидов, ЛПНП, триглицеридов;
- снижение уровня ЛПВП, особенно субфракций 2 и 3;
- накопление перекисномодифицированных ЛПНП и ЛПОНП;
- снижение элиминации хиломикронов, выделяемых после еды;
- снижение активности липопротеинлипазы в жировой ткани бедренно-ягодичной области при одновременном ее повышении в абдоминальных и висцеральных адипоцитах;
- изменение баланса энергии – снижение скорости обменных процессов на фоне повышения аппетита и увеличения (относительного или абсолютного) поступления энергии с пищей;
- повышение тонуса симпатической нервной системы;
- снижение уровня женских половых гормонов;
- относительная гиперандрогения;
- усиленная глюкокортикоидная стимуляция;
- снижение уровня гормона роста.
Абдоминальное ожирение является независимым фактором риска сердечно-сосудистых осложнений и смертности от ИБС не только у мужчин, но и у женщин (G.R. Dagenais et al., 2005). Очевидно, что именно висцеральное (андроидное) ожирение сочетается с инсулинорезистентностью, низким уровнем холестерина ЛПВП, повышением триглицеридов и коагуляционными нарушениями, свойственными метаболическому синдрому (Europian Consensus: Sex Steroids and Cardiovascular Disease, 2003).
Висцеральная жировая ткань имеет высокую плотность β1-адренорецепторов, андрогенных и кортикостероидных рецепторов и относительно низкую концентрацию β2-адренорецепторов и рецепторов к инсулину. Это определяет низкую чувствительность висцеральной жировой ткани к антилиполитическим эффектам инсулина, особенно в постпрандиальный период, что приводит к поступлению большого количества свободных жирных кислот в портальную систему, где они используются в качестве субстрата для синтеза триглицеридов и стимулируют глюконеогенез (В.И. Подзолков и соавт., 2004). Свободные жирные кислоты активируют секрецию инсулина поджелудочной железой и тормозят утилизацию глюкозы мышцами, способствуя развитию гипергликемии (Я.В. Благосклонная и соавт., 2001).
С возрастом у женщин происходят изменения углеводного обмена, выражающиеся в снижении секреции инсулина β-клетками поджелудочной железы и в нарушении периферической чувствительности к инсулину
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Эволюция метаболического синдрома
Эволюция метаболического синдрома
 Метаболический синдром и сахарный диабет – фокус на артериальную гипертензию
Метаболический синдром и сахарный диабет – фокус на артериальную гипертензию
 Метаболический синдром
Метаболический синдром
 Лечение больных с метаболическим синдромом
Лечение больных с метаболическим синдромом