- Головна
- /
- Статті
- /
- Кардіологія
- /
- Миокардит и дилатационная кардиомиопатия: проблемы диагностики и лечения
Миокардит и дилатационная кардиомиопатия: проблемы диагностики и лечения
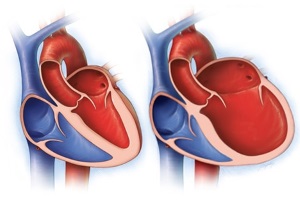
Начало изучения миокардита относится ко второй половине XIX века, термин «миокардит» был предложен G. Sobernheim в 1837 г. В то время считали, что основными признаками заболевания являются инфекционное начало, воспаление миокарда и острые

История
Начало изучения миокардита относится ко второй половине XIX века, термин «миокардит» был предложен G. Sobernheim в 1837 г. В то время считали, что основными признаками заболевания являются инфекционное начало, воспаление миокарда и острые сосудистые нарушения. В 1897 г. русский врач С.С. Абрамов опубликовал результаты наблюдения клинического случая изолированного поражения миокарда, которое характеризовалось подострым течением с развитием сердечной недостаточности. В 1901 г. французские клиницисты E. Josserand и L. Gallavardin предложили термин «первичное поражение миокарда». Однако интенсивное изучение заболевания началось лишь в XX веке, термин «кардиомиопатия» впервые прозвучал в 1957 г. и был предложен W. Brigden. В 70-80-х годах прошлого века под руководством J.F. Goodwin были проведены основополагающие исследования, в результате которых в 1973 г. ученый предложил определять кардиомиопатию как «острое, подострое или хроническое поражение мышцы сердца неизвестной или неясной этиологии, часто с вовлечением эндокарда или перикарда, и не являющееся следствием структурной деформации сердца, гипертензии (системной или легочной) или коронарного атероматоза». Тогда же впервые в отдельную нозологию была выделена застойная кардиомиопатия. В 1980 г. исследовательская группа ВОЗ и Международного общества и федерации кардиологов предложила термин «дилатационная кардиомиопатия» (ДКМП), ее классифицировали как «первичное заболевание миокарда неизвестной этиологии». И уже тогда миокардит рассматривали как один из ведущих этиопатогенетических факторов ДКМП.
Изучение особенностей развития и течения заболевания, внедрение современных инвазивных и неинвазивных методов исследования позволили установить целый ряд этиологических факторов, уточнить механизмы развития миокардиального повреждения, что, в конечном итоге, привело к пересмотру определения и классификации кардиомиопатий. С 1995 г. кардиомиопатии классифицируют как болезни миокарда, связанные с нарушением функции сердца, а ДКМП – как заболевание, характеризующееся дилатацией и снижением сократимости левого или обоих желудочков. Согласно этой классификации выделяют несколько видов ДКМП, в том числе вирусную (и/или иммунную), а в разделе «Специфические кардиомиопатии» – воспалительную. Последняя, по сути, представляет собой хронический миокардит с нарушением функции миокарда.
Патофизиология
В 1990 г. в предисловии к книге Н.М. Мухарлямова «Кардиомиопатии» академик Е.И. Чазов писал: «…эта патология плохо изучена; заболевание диагностируется, как правило, на поздних стадиях, когда у больного развиваются кардиомегалия и выраженные признаки сердечной недостаточности. Нередко вместо кардиомиопатии врачи ошибочно диагностируют пороки сердца, ишемическую болезнь, миокардиты».
С момента написания этих строк прошло более 15 лет, однако проблема дифференциальной диагностики миокардита и ДКМП остается актуальной, вопрос о том, являются ли эти заболевания различными нозологическими единицами или стадиями одного патологического процесса, остается открытым.
Гипотезу о том, что у некоторых пациентов развитию ДКМП может предшествовать миокардит, одними из первых высказали G.E. Burch и N.P. Pasquale в 1964 г.
Миокардит – поражение сердечной мышцы преимущественно воспалительного характера, обусловленное непосредственным воздействием целого ряда факторов (инфекции, паразитарной или протозойной инвазии, химических и физических факторов) или опосредованным – через иммунные механизмы. Воспалительный процесс в миокарде развивается при многих заболеваниях и патологических состояниях, однако в большинстве развитых стран мира наиболее частой причиной миокардита является вирусная инфекция (энтеровирусы, цитомегаловирусы, вирусы Эпштейна-Барра, гепатита С, D, иммунодефицита человека и т. д.). Именно миокардит вирусной этиологии рассматривают как один из важнейших факторов этиологии и патогенеза спорадической (ненаследуемой) формы ДКМП. Необходимо подчеркнуть, что острый миокардит имеет различное клиническое течение и выраженность миокардиального повреждения, дальнейшая трансформация в ДКМП происходит, главным образом, при тяжелом течении заболевания.
В результате многочисленных клинических и экспериментальных исследований была выдвинута концепция о стадийности развития миокардиального повреждения. Дисфункция миокарда и повреждение кардиомиоцитов (КМЦ) нередко обусловлены цитопатическим действием возбудителя, кардиотоксическим эффектом их токсинов (дифтерийный миокардит, стрептококковая или стафилококковая инфекция, протекающая с инфекционно-токсическим шоком), поражением эндотелия мелких венечных артерий с коронаритом (риккетсиозы), развитием иммунных и аутоиммунных реакций.
При вирусной инфекции гибель клеток миокарда происходит в результате одновременного влияния нескольких механизмов.
Обычно стадия виремии продолжается в течение непродолжительного времени – от 1 до 3 дней, в этой фазе заболевания вирус обнаруживают не только в плазме, но и в различных клетках организма. Репликация вируса происходит в клетках эндотелия, в несколько меньшей степени – в клетках селезенки, печени, поджелудочной железы, сердца и даже в В-лимфоцитах.
Процесс проникновения вируса внутрь клетки во многом определяется его связыванием со специфическими молекулами: САR (Coxackie-adenovirus receptor) и DAF (decay-accelerating factor).
После проникновения вируса в клетку его нуклеиновая кислота (НК) используется как образец для транскрипции и последующей трансляции. Происходит формирование новых вирусных НК и полипротеинов, которые в результате процессинга превращаются в индивидуальные структурные и неструктурные белки под влиянием ряда вирусных протеаз. Эти же протеазы обеспечивают выход вирионов из клетки за счет модификации и изменения проницаемости клеточной мембраны.
Несмотря на значительный прогресс, достигнутый за последние годы, многие вопросы развития и прогрессирования миокардиального повреждения окончательно не выяснены до сих пор. Известно, что энтеровирусную НК в миокарде и специфические противовирусные антитела, циркулирующие в крови, выявляют у здоровых лиц, и репликация энтеровирусов в КМЦ происходит и без развития миокардита. Определяющими для возникновения миокардита являются свойства штамма вируса – его кардиотропность и, особенно, кардиовирулентность (способность вызывать заболевание миокарда). Заболевание развивается лишь в том случае, когда в миокард проникает кардиовирулентный штамм вируса. В настоящее время известно, что кардиовирулентность вируса может быть кодируемым признаком, картированы первые участки НК, мутации или удаление которых резко ослабляет кардиовирулентность вируса.
Увеличение полостей сердца и нарушения сократимости миокарда отмечаются уже в фазе вирусной репликации (первая стадия заболевания). В основе данных нарушений лежит цитолитическое действие вируса, опосредованное его протеазами. В результате действия вирусных протеаз в КМЦ происходят изменения дистрофина (расщепление) и компонентов саркогликанового комплекса, что приводит к неблагоприятным последствиям: изменению архитектоники клеток миокарда, нарушению координации сократительной функции сердца, некрозу и/или апоптозу клеток, развитию иммунных и аутоиммунных реакций. Последним отводят одно из ведущих мест в патогенезе миокардиального повреждения не только при миокардите, но и при ДКМП.
Известно несколько путей стимуляции иммунной системы при вирусной инфекции: рецепторный (вирус может активировать ко-рецепторы киназы тирозина p56M, связанные с DAF) и классический – клеточно-опосредованный. Второй механизм обусловлен тем, что активированные Т-лимфоциты способны находить DAF- и CAR-молекулы клеток, инфицированных вирусом, и уничтожать их с помощью вырабатываемых цитокинов или перфорин-опосредованного цитолиза.
Обычно активность иммунной системы снижается до нормы после прекращения размножения вируса, и происходит выздоровление пациента. Однако в некоторых случаях иммунная активация и аутоиммунные реакции поддерживаются, а иногда и развиваются и после элиминации вируса. Причинами этого могут быть нарушения в структуре de novo синтезированных полипептидов и появление «неправильных», или агрегированных, форм белков, а также феномен молекулярной мимикрии. Оба эти механизма способны спровоцировать атаку Т-лимфоцитами собственной ткани организма, в дальнейшем эти процессы поддерживаются вновь вырабатываемыми аутоантигенами кардиомиоцитов. Происходит развитие второй фазы заболевания – аутоиммунной.
Близкая связь между инфекцией и сопутствующим иммунным ответом очень актуальна при вирусных миокардитах. В развитии миокардиального повреждения иммунные механизмы играют более важную роль, чем сами инфекции.
В результате действия цитокинов, опосредованного Т-клетками, а также продукции цитотоксических перекрестно реагирующих антител повреждаются КМЦ и уменьшается количество сократительных единиц, что приводит к ухудшению сократительной функции миокарда, а впоследствии – к ремоделированию полостей сердца.
Вторая фаза патологического процесса может закончиться как выздоровлением, так и переходом в третью стадию – хроническую. При этом персистирование вирусной НК иногда определяется даже через 90 дней после инокуляции. В экспериментальных исследованиях показано, что трансформация в ДКМП у экспериментальных животных наблюдается через 4 месяца от начала заболевания и позже. В клинической практике у части пациентов признаки воспаления в миокарде исчезают, а кардиомегалия и миокардиальная дисфункция сохраняются. В таких случаях речь идет о трансформации воспалительной кардиомиопатии в ДКМП, именно такое течение заболевания позволяет говорить о том, что хронический миокардит и ДКМП могут быть различными стадиями одного процесса. Развитие фенотипа ДКМП у пациентов происходит и спустя длительное время (через несколько лет) после острого миокардита, в связи с этим заболевание у таких больных верифицируют как «идиопатическую ДКМП». На этой стадии этиологический фактор трудно определить, считается, что у большинства пациентов развитие миокардиальной недостаточности и ремоделирование полостей сердца являются результатом пролонгированного иммунного ответа и аутоиммунных реакций.
Диагностика
Размытость клинической картины и нечеткость симптомов у многих пациентов, незнание или недооценка стадии заболевания, сложность выявления возбудителя – это факторы, которые приводят к ошибкам при диагностике. Значительные трудности возникают при дифференциальной диагностике хронического диффузного миокардита с развитием дилатации полостей сердца и нарушением его сократительной функции, иначе – воспалительной кардиомиопатии. Актуальность проблемы обусловлена тем, что диагностические ошибки не позволяют своевременно применять этиопатогенетическое лечение, следовательно, влиять на развитие заболевания и прогноз пациентов.
В первой фазе заболевания для верификации вирусологического диагноза обычно используют два метода – полимеразную цепную реакцию и гибридизацию in situ. Оба метода достаточно специфичны при вирусном миокардите, однако их сложность не позволяет быстро подтвердить или исключить наличие вирусной НК, поэтому чаще всего в клинической практике используют метод определения вируснейтрализующих антител в плазме.
Наряду с этим, информацию могут дать результаты клинико-инструментальных исследований, поскольку спектр клинических проявлений варьирует от минимальных симптомов до крайне тяжелой сердечной недостаточности.
Окончательный диагноз аутоиммунной фазы заболевания выставляют с помощью эндомиокардиальной биопсии (ЭМБ), в последующем определяют серологические маркеры иммунной активации.
В 1999 г. был достигнут консенсус по определению миокардита, или воспалительной кардиомиопатии, сочетающейся с дисфункцией сердца. Согласно рекомендациям этого консенсуса выделяют следующие формы миокардита.
- Острый (активный) миокардит: наличие инфильтрата (диффузного или локального) с определением не менее 14 инфильтрирующих лимфоцитов на 1 мм2 (главным образом, Т-лимфоциты или активированные Т-лимфоциты и до 4 макрофагов). Инфильтрат подсчитывают иммуногистохимическим методом. Определяют некроз или дегенерацию, учитывают фиброз, наличие которого не обязательно.
- Хронический миокардит: инфильтрат (не менее 14 лимфоцитов на 1 мм2, главным образом Т-лимфоциты или активированные Т-лимфоциты, и до 4 макрофагов), некроз и дегенерация обычно не выражены, учитывают фиброз.
- Отсутствие миокардита: не обнаруживают инфильтрирующих клеток или их количество менее 14 на 1 мм2.
Согласно консенсусу оценку фиброза проводят следующим образом: 0 степень – отсутствие фиброза; 1 степень – начальный; 2 степень – умеренный; 3 степень – выраженный фиброз.
В ряде случаев рекомендуется проведение повторных ЭМБ, по результатам которых можно диагностировать:
- продолжающийся (персистирующий) миокардит: критерии 1 или 2;
- разрешающийся (заживающий) миокардит: критерии 1 или 2, однако иммунологический процесс менее выражен, чем при первичной биопсии;
- разрешившийся (заживший) миокардит: соответствует «Далласской классификации», фиброз может сопутствовать или не сопутствовать всем критериям.
О необходимости проведения ЭМБ дискутируют по сей день, есть мнения о малой достоверности результатов, полученных при изучении биоптатов, о дороговизне исследования, о частых осложнениях и т. д. Мнение об опасности исследования является ошибочным, хотя оно широко распространено среди практикующих врачей. Данные, приведенные на Европейском конгрессе кардиологов в 2001 г., показывают, что частота различных осложнений при проведении ЭМБ – от 0,06 до 2,6%. Однако следует признать, что ЭМБ не является абсолютно точным диагностическим методом, впрочем, как и большинство других методов исследования. Информативная ценность ЭМБ во многом зависит от того, с какой целью и когда проводят исследование. Наибольшего доверия заслуживают результаты исследования, когда оно проведено спустя несколько дней или недель после разрешения симптомов вирусной инфекции. В этот период в миокарде выявляют множественные фокусы лимфоцитарной инфильтрации. Информативная ценность ЭМБ значительно ниже, когда исследование проводится при сохраняющихся проявлениях вирусной инфекции или же при их отсутствии. Большое значение также имеет количество взятых образцов: чем их больше, тем выше вероятность обнаружения воспалительных инфильтратов.
Однако ценность ЭМБ заключается не только в возможности подтверждения воспалительного процесса в миокарде, но и в определении его активности, то есть стадии патологического процесса в миокарде. К сожалению, при этом также возможны диагностические ошибки, в первую очередь при промежуточных фазах заболевания, когда одна фаза заболевания переходит в другую. Неправильные оценки состояния при повторной инфекции или аутоиммунной реактивации приводят к одновременному развитию и прогрессированию различных фаз заболевания. В настоящее время интенсивно изучаются возможности использования молекулярных методов при исследовании образцов ЭМБ, которые рассматриваются как наиболее перспективные.
При диагностике миокардита в аутоиммунной фазе не потеряли значения и такие методы исследования, как сцинтиграфия миокарда с помощью Ga67 и антимиозиновых антител, меченных In111. При тщательном отборе пациентов чувствительность этих методов достаточно высока, что позволяет их иногда использовать вместо ЭМБ.
В последние годы применяют такие методы исследования, как ядерно-магнитный резонанс и компьютерная томография, иногда они помогают не только уточнить диагноз, но и прицельно провести взятие эндомиокардиального биоптата, что существенно повышает информативную ценность ЭМБ.
Лечение
Лечение пациентов с воспалительной кардиомиопатией должно включать этиотропные препараты (по возможности) и терапию сердечной недостаточности. В случае тяжелого течения заболевания в первой фазе вирусного миокардита в схему лечения больных необходимо включать неспецифические противовирусные мероприятия и/или прямую антивирусную терапию. Последняя особенно актуальна в тех случаях, когда определен возбудитель. Потенциально эффективными антивирусными агентами являются нуклеозидные аналоги таких препаратов, как рибовирин, вещества, способные блокировать связывание вируса с клеточным рецептором через CAR, активаторы иммунной защиты (иммуноглобулин и интерферон). Однако целесообразность назначения последних окончательно не доказана.
Больше всего вопросов у врача возникает при лечении больных с заболеванием во второй и третьей фазах, во многом противоречивым остается назначение иммуносупрессорной терапии. Очень важно ответственно подойти к интерпретации данных, свидетельствующих об активности иммунной системы. У больных с более выраженным и ранним иммунным ответом на инфекцию (например, с высоким уровнем циркулирующих IgG) систолическая функция левого желудочка во многих случаях нарушена незначительно, размеры его полости меньше, давление заклинивания в легочных капиллярах ниже, а толерантность к физическим нагрузкам выше. При таком иммунном ответе потребность в лекарственной терапии может быть меньше, поскольку течение заболевания более короткое и благоприятное. У пациентов с выраженной поздней активацией, которая чаще всего является аутоиммунным ответом, прогноз значительно хуже, у них быстрее развивается третья фаза заболевания, они умирают от быстро прогрессирующей сердечной недостаточности, чаще всего с диагнозом ДКМП.
Вероятно, не следует назначать иммуносупрессорную терапию на ранних стадиях заболевания, поскольку подавление раннего иммунного ответа приводит к удлинению персистирования вируса или его фрагментов в организме, а следовательно, к хронизации процесса. По всей видимости, иммуносупрессорная терапия оправдана при лечении пациентов с аутоиммунной фазой заболевания, и наиболее выраженные благоприятные ее эффекты можно ожидать у пациентов с активным, быстро прогрессирующим течением миокардита, с проявлениями кардиальной недостаточности, при обязательном отсутствии вирусной репликации. Необходимо подчеркнуть, что при лечении таких пациентов следует использовать только хорошо изученные препараты, такие как азатиоприн, циклоспорин, стероиды.
К сожалению, единого мнения нет и по поводу целесообразности назначения иммуносупрессорной терапии, результаты клинических исследований однозначного ответа на этот вопрос не дают. По некоторым данным, использование стероидов у пациентов с диагнозом ДКМП и признаками иммунной активации может приводить лишь к временному улучшению сократительной функции левого желудочка. По данным исследования US Myocarditis Treatment Trial, у пациентов с миокардитом, в том числе диагностированным и по далласским критериям, иммуносупрессорная терапия, включающая стероиды, в комбинации с азатиаприном или циклоспорином положительно влияет на сократительную функцию левого желудочка, однако не влияет на прогноз заболевания.
Во второй фазе заболевания используют иммуноглобулин, который обладает как противовирусным, так и иммуномодулирующим эффектами. Перспективными, но недостаточно изученными считают препараты, влияющие на активацию цитокинов, а также вакцину с анти-T-клеточными рецепторами.
Еще одним нерешенным вопросом остается применение иммуномодулирующей терапии, к назначению которой следует подходить с большой осторожностью, поскольку большинство из иммуномодулирующих препаратов способны активировать иммунную систему. Учитывая сложности контроля за действием таких препаратов, предпочтение, по-видимому, следует отдавать «мягким» иммунокорректорам, таким как препараты системной энзимотерапии. Одним из их преимуществ является также низкая вероятность развития тяжелых побочных эффектов, характерных для традиционных иммуносупрессоров. В последние годы в комплексном лечении миокардита используют препараты этой группы, назначают их с первых дней заболевания и применяют на протяжении всего периода терапии.
Специфическое лечение пациентов в третьей фазе заболевания фактически не разработано. Благоприятные эффекты иммунокоррекции, по всей видимости, можно ожидать в случае персистирования иммунной активации и хронического воспалительного процесса в миокарде. Можно предположить, что такая терапия малоэффективна у пациентов с ДКМП. Лечение таких больных традиционно направлено на замедление непрерывного процесса ремоделирования полостей сердца путем защиты КМЦ, ослабление продолжающейся нейрогуморальной и, возможно, цитокиновой активации, снижение гемодинамического стресса и предотвращение различных осложнений. Иными словами, при отсутствии хронической персистирующей вирусной инфекции или текущей аутоиммунной активности пациентов с заболеванием в третьей фазе нужно лечить так же, как и больных с застойной сердечной недостаточностью.
Дальнейшее неблагоприятное ремоделирование левого желудочка и клиническое ухудшение у таких пациентов можно предотвратить с помощью ингибиторов ангиотензинпревращающего фермента, β-адреноблокаторов, спиронолактона и т. д. В случае зарегистрированных опасных для жизни желудочковых аритмий используют амиодарон или имплантируют кардиовертер-дефибриллятор, а при развитии тромбоэмболических осложнений применяют непрямые антикоагулянты. Наряду с этим, необходим регулярный контроль состояния больного для предупреждения рецидивов или повторных вирусных инфекций, снижения активности иммунной системы и развития аутоиммунных реакций. В терминальной стадии ДКМП применяют различные методы немедикаментозного лечения: ресинхронизацию (двухкамерную стимуляцию), поддержку сокращения желудочков с помощью аппаратов, пересадку сердца. Абсолютно не изучена, но может быть очень перспективной, имплантация культуры КМЦ (или миоцитов), стволовых или эмбриональных клеток. Вполне возможно, что через некоторое время она станет альтернативой трансплантации сердца.
«Украинский кардиологический журнал», №1, 2004.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Актуальные проблемы детских инфекционных болезней
Актуальные проблемы детских инфекционных болезней
 Современные средства для защиты рук
Современные средства для защиты рук
 Стратегия ведения пациентов с инфекциями, передающимися половым путем
Стратегия ведения пациентов с инфекциями, передающимися половым путем
 Опыт применения антибиотика Флемоксин Солютаб в амбулаторном лечении детей с инфекциями ЛОР-органов и бронхо-легочной системы
Опыт применения антибиотика Флемоксин Солютаб в амбулаторном лечении детей с инфекциями ЛОР-органов и бронхо-легочной системы