- Головна
- /
- Статті
- /
- Кардіологія
- /
- Клінічне значення та лікування шлуночкової екстрасистолії
Клінічне значення та лікування шлуночкової екстрасистолії
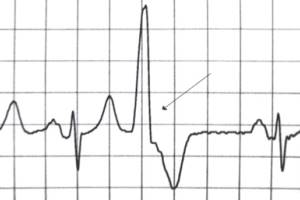
Шлуночкова екстрасистолія (ШЕ) – найбільш поширене порушення серцевого ритму, яке може істотно впливати на якість життя хворих, бути маркером структурно-функціональних змін міокарда та свідчити про виникнення небезпечних для життя аритмій серця. Вдосконалення стратегії ведення хворих із ШЕ насамперед пов'язане з розвитком концепції стратифікації ризику, тобто поділу пацієнтів на групи залежно від ступеня ризику смерті від усіх причин і, зокрема, раптової серцевої смерті (РСС).
Крім того, активно впроваджуються сучасні інструментальні методи діагностики аритмій серця, передусім – амбулаторне моніторування ЕКГ. У клінічній практиці існує очевидна потреба у створенні узгоджених рекомендацій з ведення хворих із ШЕ, узагальненні діагностичних та терапевтичних підходів.

Клiнiчне та прогностичне значення
Клiнiчне значення ШЕ в основному визначається її типом і градацією, наявністю симптомів, характером основного захворювання, ступенем ураження серця i функцiональним станом мiокарда.
Шлуночкові екстрасистоли в осiб без структурного ураження серця не є загрозливими для життя. Їх виявляють при холтерівському моніторуванні ЕКГ у більшості практично здорових осiб усiх вiкових груп, причому у 10% вони полiтопнi та рiдко – груповi. Загалом, ШЕ не обов'язково вказують на супутню кардiальну патологiю, а за відсутності серцевого захворювання не є провісником підвищення захворюваностi та смертностi. З iншого боку, у хворих з вираженим структурним ураженням серця та дисфункцією мiокарда, особливо на тлі постінфарктного кардiосклерозу або серцевої недостатності (СН), виявлення частої ШЕ є додатковим прогностично несприятливим фактором.
Ектопiчна активнiсть шлуночкiв вiдмiчається у 75-90% хворих на гострий інфаркт міокарда в першi 72 години захворювання i зумовлює високу частоту РСС у цей час, але не корелює зi смертнiстю протягом року. Наявнiсть ШЕ в пiзнiший перiод захворювання вказує на несприятливий тривалий прогноз. Короткі пароксизми шлуночкової тахікардії (ШТ) спостерiгаються у 12% хворих, а смертність від усіх причин становить до 30% протягом першого року пiсля перенесеного IМ. Поява життєво небезпечних аритмій серця після ІМ зумовлена поєднанням рецидивуючої iшемiї з метаболiчними та електролiтними розладами. Важливими факторами, що сприяють аритмогенезу, є СН i стенозуючий коронарний атеросклероз.
Парні та полiтопні ШЕ зустрічаються у 70-90% хворих із СН, а короткі епізоди ШТ – у 40-80%. У цьому випадку шлуночкові порушення серцевого ритму є несприятливим прогностичним фактором, причому 33-47% усiх випадків смерті хворих із СН припадають на РСС. Аритмогенними факторами при СН є дисфункцiя лiвого шлуночка (ФВ<45%), iшемiя мiокарда, гiпоксiя, електролiтнi розлади, а також аритмогеннi ефекти застосованих терапевтичних засобів, особливо серцевих глiкозидiв, дiуретикiв i периферичних вазодилататорiв.
Дуже високою є частота ШЕ у хворих на дилатаційну кардіоміопатію. Так, частi i полiтопнi ШЕ спостерiгаються у 80-90% хворих, короткi епiзоди ШТ – у 20-60%. Частота РСС досягає 10% на рiк; на неї припадає половина від усiх випадків смертi. Приблизно в 50% хворих виявляють передсерднi екстрасистоли. Формування аритмій пов'язане з наявнiстю вираженої дисфункції лівого шлуночка (ЛШ) і СН.
Шлуночкові екстрасистоли реєструють у 50-65% хворих на гіпертрофічну кардіоміопатію з обструкцією вихідного тракту ЛШ, у тому числi парні ШЕ – у 32%, а пароксизми ШТ – у 14-25%. Частота РСС у цих пацієнтів становить 2,5-9% на рiк. Передсердна екстрасистолiя зустрiчається рiдше, нiж шлуночковi порушення ритму. Причини та фактори, які сприяють аритмогенезу: клiтинна дезорганiзацiя в рiзних дiлянках мiокарда, гiпоксiя, гiпокалiємiя, обструкцiя вихiдного тракту ЛШ, дiастолiчна дисфункцiя ЛШ, СН, аритмогеннi впливи препаратiв, iнтенсивнi фiзичнi навантаження.
Ризик РСС внаслiдок шлуночкових порушень ритму особливо зростає у хворих з аритмогенною дисплазiєю правого шлуночка, вродженим або набутим синдромом подовженого iнтервалу QT, клапанними вадами серця (включаючи пролапс мiтрального клапана), артерiальною гiпертензiєю.
Про ступінь небезпеки, пов'язаної з ШЕ, можуть свідчити деякi особливості ЕКГ. Звичайно не є загрозливими екстрасистоли з конфігурацією блокади лiвої нiжки пучка Гiса і вертикальним положенням електричної осi передчасного комплексу QRS (тип Розенбаума), або коли комплекс QRS екстрасистоли у всiх грудних вiдведеннях спрямований уверх i нагадує графiку синдрому Вольфа-Паркінсона-Уайта типу А (тип Вольфа). Комплекс QRS таких екстрасистол не має додаткових розщеплень, його амплiтуда становить 20 мм i бiльше, тривалiсть може бути до 0,12 с, а сегмент ST i асиметричний зубець Т спрямованi дискордантно до основного зубця шлуночкового комплексу. Перегородковi ШЕ з вузькими комплексами QRS частiше спостерiгаються у молодих людей за вiдсутностi структурного ураження серця і рiдко є симптомними. Потенційно загрозливі ШЕ здебільшого виникають на тлі структурного ураження серця, мають форму блокади правої нiжки пучка Гiса, незначну амплiтуду комплекса QRS (часто до 10 мм) з додатковими розщепленнями, а тривалiсть його бiльше 0,12-0,14 с. Можуть спостерiгатися аномалiї реполяризацiї: горизонтальна депресія сегмента ST i конкордантне спрямування симетричного, загостреного зубця Т.
Принципи ведення хворих із ШЕ
Тактика ведення хворих із ШЕ залежить від: структурного захворювання серця; частоти виникнення екстрасистол, наявності групових екстрасистол або супутніх пароксизмів тахіаритмії; клінічних симптомів, пов'язаних з аритмiєю. Показаннями для призначення β-блокаторів і/або інших антиаритмічних препаратів (ААП) є такі клінічні ситуації: прогресуючий перебіг захворювання серця з істотним збільшенням кількості ШЕ; часті, політопні, парні, групові та ранні (R на T) ШЕ, загрозливі щодо подальшого виникнення пароксизмальної ШТ і фібриляції шлуночків (ФШ); алоритмія (бі-, три-, квадригемінія), короткі пробіжки ШТ, які супроводжуються ознаками СН; ШЕ на тлі захворювань, які супроводжуються збільшенням ризику життєво небезпечних аритмій (пролапс мітрального клапана, синдром подовженого інтервалу QT тощо); виникнення або збільшення частоти ШЕ під час нападів стенокардії або гострого ІМ; збереження ШЕ після припинення приступу ШТ і ФШ; екстрасистоли на тлі аномальних шляхів проведення (синдромів Вольфа-Паркінсона-Уайта та Клерка-Леві-Кристеско).
Хворі з доброякісною ШЕ спеціальної антиаритмічної терапії не потребують, але необхідне динамічне спостереження, тому що у частини з них, за даними Фремінгемського дослідження, ШЕ може бути дебютом серцевого захворювання. При екстрасистолiї в осiб молодого вiку без структурного ураження серця, особливо тій, яка зникає під час фізичного навантаження, ААП звичайно не призначають. При суб'єктивнiй непереносимостi екстрасистолiї показанi рацiональна психотерапiя, седативнi засоби, транквiлiзатори або антидепресанти. Тривалiсть лiкування залежить від медичних показань i коливається вiд 3 тижнiв до 2-3 мiсяцiв. У випадку досягнення стiйкого седативного i антиаритмiчного ефекту добова доза препарату протягом кожних 6-7 днiв зменшується на одну третину до повної вiдмiни. Якщо екстрасистолiя виникає на тлi вегетативної дисфункцiї з ознаками симпатоадреналової активації, показані β-адреноблокатори, а при домiнуваннi вагоiнсулярних симптомів – М-холiнолiтики (атропiн, препарати беладонни). Хворi з захворюваннями внутрiшнiх органiв i екстрасистолiєю насамперед потребують адекватного лiкування основного захворювання. У всіх випадках обстеження спрямоване на виявлення та усунення потенційних провокуючих факторів екстрасистолії (таких як споживання кофеїну, певні життєві ситуації), а також супутніх порушень (артеріальна гіпертензія).
При поодиноких монофокусних ШЕ у хворих із серцево-судинними захворюваннями без порушень гемодинамiки i коронарного кровообiгу призначати ААП не потрiбно. Стриманий пiдхiд до призначення ААП зумовлений тим, що ризик побічних ефектів при медикаментозному лiкуванні «доброякiсних» аритмiй більший, ніж позитивні наслідки лiкування. Передусім, ведення таких хворих полягає в лiкуваннi основного захворювання, а також використаннi седативних засобiв і методів психотерапії при суб'єктивнiй непереносимостi аритмiї.
Потенційно злоякісні шлуночкові аритмії звичайно виникають на тлі структурного захворювання серця, наприклад ІХС або після перенесеного ІМ. У таких хворих з ШЕ різних градацій існує небезпека виникнення в подальшому пароксизмів ШТ, тріпотіння або фібриляції шлуночків. Зважаючи на це, хворі з потенційно злоякісними шлуночковими аритміями передусім потребують адекватного лікування основного захворювання. З цією метою здійснюється корекція стандартних факторів ризику ІХС (артеріальна гіпертензія, куріння, гіперхолестеринемія, цукровий діабет), призначаються засоби, ефективність яких доведена у хворих з ІХС (аспірин, β-адреноблокатори, статини) і при СН (інгібітори АПФ, β-адреноблокатори, антагоністи альдостерону). При поєднанні кардiальної патологiї з частою ШЕ високих градацiй здійснюють пiдбiр адекватної антиаритмiчної терапiї. Препаратами вибору найчастіше є β-адреноблокатори, особливо за наявностi додаткових показань: IХС, артерiальної гiпертензiї, синусової тахiкардiї. Високу ефективність цих препаратів пов'язують з їх антиангінальною, антиаритмічною та брадикардичною дією. За необхідності β-адреноблокатори поєднують з ААП I класу (пропафенон, етмозин, етацизин, дизопірамід), з урахуванням доцільності їх подальшого тривалого застосування.
Гіпотеза про профілактичну ефективність ААП І класу при ШЕ для запобігання раптовій смерті була переглянута після оприлюднення результатів дослідження CAST (1989). Прийом флекаїніду та енкаїніду в постінфарктних хворих з безсимптомними ШЕ високих градацій супроводжувався достовірним збільшенням ризику раптової смерті порівняно з плацебо. Вказаний феномен пов'язують з аритмогенною і негативною інотропною дією ААП І класу. Водночас негативні підсумки дослідження CAST та інших досліджень ефективності ААП І класу не виключають можливості їх ефективного нетривалого використання для лікування ШЕ у хворих на ІХС, а також при інших причинах шлуночкових аритмій.
При недостатній ефективності β-адреноблокаторів i ААП I класу призначають аміодарон (Кордарон, «Санофі-Авентіс») – найбiльш потужний з існуючих антиаритмiчних засобiв з найнижчою ймовірністю аритмогенних ефектів. Кордарон застосовують при резистентностi до iнших ААП; крім того, він є препаратом вибору у хворих із життєво небезпечними та клінічно вираженими аритмiями на тлі тяжкого структурного захворювання серця. Обнадійливі результати отримали при застосуванні Кордарону у хворих з частою ШЕ після перенесеного ІМ у метааналізі АТМА (1997). У групах хворих, які отримували Кордарон, істотно зменшувалась імовірність РСС, але не спостерігали достовірного зменшення загальної смертності. Кордарон – препарат вибору для лікування та попередження шлуночкових аритмій у хворих із систолічною дисфункцією міокарда і СН. Використання Кордарону в малих дозах (200 мг на добу) дозволяє зменшити до мінімуму кількість некардіальних побічних ефектів. Альтернативним засобом лікування хворих із шлуночковими аритміями на тлі ІХС є соталол – ААП ІІІ класу з β-блокуючими властивостями.
Висока ефективність Кордарону і соталолу при лікуванні хворих зі злоякісними шлуночковими аритміями не свідчить про відсутність проблеми безпеки цих засобів. ААП ІІІ класу подовжують коригований інтервал QT, безпечна межа якого становить 440-460 мс. Якщо показники інтервалу QTс перевищують указані межі, діагностують набутий синдром подовженого інтервалу QT. Характерним та специфічним проявом цього стану є поліморфна ШТ (пірует-тахікардія), яка може трансформуватися у ФШ. Ризик розвитку аритмогенної дії соталолу найбільший у перші три дні прийому препарату. Загалом, аритмогенні ефекти соталолу спостерігаються частіше, ніж при застосуванні Кордарону.
Висновки
Шлуночкова екстрасистолія – найбільш поширене в клінічній практиці порушення ритму серця. Вона може виникати при багатьох кардіальних і екстракардіальних захворюваннях, бути випадковою знахідкою у практично здорових осіб. Комплекс сучасних інструментальних і лабораторних методів обстеження пацієнтів із ШЕ спрямований на встановлення її причин та механізмів, кількості і градації, клінічного і прогностичного значення, здійснення стратифікації ризику. Загальна стратегія ведення хворих із ШЕ і, зокрема, доцільність її усунення за допомогою ААП визначаються залежно від співвідношення потенційної користі лікування для усунення аритмій, покращання прогнозу виживання і ризику виникнення аритмогенних та інших побічних ефектів терапії.
 Що потрібно робити, щоб взнати стан свого серця і судин
Що потрібно робити, щоб взнати стан свого серця і судин
 Липразид — клинико-фармакологическая активность (укр)
Липразид — клинико-фармакологическая активность (укр)
 Рекомендовані схеми діагностики та лікування пацієнтів з некоронарогенними хворобами та вадами серця
Рекомендовані схеми діагностики та лікування пацієнтів з некоронарогенними хворобами та вадами серця
 Комбинированные препараты в лечении артериальной гипертензии и хронической сердечной недостаточности (укр)
Комбинированные препараты в лечении артериальной гипертензии и хронической сердечной недостаточности (укр)
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення
