Стригем 1000 мг инструкция, аналоги и состав
| Показания: | Рак жовчних протоків.Рак сечового міхура. Стригем у комбінації з цисплатином показаний для лікування хворих на локально рецидивуючий чи метастатичний рак сечового міхура.Рак молочної залози. Стригем у комбінації з паклітакселом показаний для лікування хворих на неоперабельний, локально рецидивуючий чи метастатичний рак молочної залози після попередньої ад’ювантної/неоад’ювантної хіміотерапії. Перед хіміотерапією призначають антрациклін, якщо немає протипоказань.Рак легeнів недрібноклітинний. Стригем у комбінації з цисплатином показаний як препарат першої лінії для лікування пацієнтів з локально прогресуючим чи метастатичним недрібноклітинним раком легенів. Стригем як монотерапія показаний для лікування пацієнтів літнього віку та пацієнтів із performance status 2.Рак яєчників. Стригем у комбінації з карбоплатином показаний для лікування пацієнтів з локально прогресуючою чи метастатичною епітеліальною карциномою яєчників. Стригем показаний для лікування пацієнтів з рецидивом епітеліальної карциноми яєчників після пероду ремісії, що становив не менше 6 місяців, після попередньої терапії в першій лінії препаратами платини.Рак підшлункової залози. Стригем показаний для лікування пацієнтів з локально прогресуючими чи метастатичними аденокарциномами підшлункової залози. |
| Форма випуска: | Ліофілізат для розчину для інфузій по 1000 мг у флаконах № 1 |
| Производитель, страна: | ОНКО ТЕРАПІЗ ЛІМІТЕД, Індія |
| Действующее вещества: | 1 флакон містить гемцитабіну гідрохлорид еквівалентно 1000 мг гемцитабіну |
| МНН: | Gemcitabine - Гемцитабин |
| Регистрация: | UA/12882/01/02з 15.04.2013 по 15.04.2018. Приказ 483 від 10.07.2014 |
| Код АТХ: |
|
Склад:
діюча речовина: 1 флакон містить гемцитабіну гідрохлорид еквівалентно 200 мг або 1000 мг гемцитабіну;
допоміжні речовинu: маніт (Е 421), натрію ацетат безводний, натрію гідроксид, кислота хлористоводнева розведена, вода для ін’єкцій.
Лікарська форма. Ліофілізат для розчину для інфузій.
Фармакотерапевтична група.
Протипухлинні лікарські засоби. Структурні аналоги піримідину. Гемцитабін.
Код АТС L01B С05.
Клінічні характеристики.
Показання.
Рак жовчних протоків.
Рак сечового міхура. Стригем у комбінації з цисплатином показаний для лікування хворих на локально рецидивуючий чи метастатичний рак сечового міхура.
Рак молочної залози. Стригем у комбінації з паклітакселом показаний для лікування хворих на неоперабельний, локально рецидивуючий чи метастатичний рак молочної залози після попередньої ад’ювантної/неоад’ювантної хіміотерапії. Перед хіміотерапією призначають антрациклін, якщо немає протипоказань.
Рак легeнiв недрібноклітинний. Стригем у комбінації з цисплатином показаний як препарат першої лінії для лікування пацієнтів з локально прогресуючим чи метастатичним недрібноклітинним раком легенів. Стригем як монотерапія показаний для лікування пацієнтів літнього віку та пацієнтів із performance status 2.
Рак яєчників. Стригем у комбінації з карбоплатином показаний для лікування пацієнтів з локально прогресуючою чи метастатичною епітеліальною карциномою яєчників. Стригем показаний для лікування пацієнтів з рецидивом епітеліальної карциноми яєчників після пероду ремісії, що становив не менше 6 місяців, після попередньої терапії в першій лінії препаратами платини.
Рак підшлункової залози. Стригем показаний для лікування пацієнтів з локально прогресуючими чи метастатичними аденокарциномами підшлункової залози.
Протипоказання.
Підвищена чутливість до гемцитабіну або допоміжних речовин.
Період годування груддю.
Спосіб застосування та дози.
Рак жовчних протоків.
Монотерапія. Дорослі. Рекомендована доза Стригему – 1000 мг/м2, яку вводять внутрішньовенно протягом 30 хв. Інфузію проводять один раз на тиждень три тижні поспіль, потім роблять перерву на один тиждень. Цей чотиритижневий цикл повторюють. Зменшення дози з кожним циклом або протягом якогось одного циклу можливе залежно від величини токсичності, якої зазнає пацієнт.
Комбіноване застосування. Дорослі. Стригем у комбінації з цисплатином: рекомендується застосовувати цисплатин 70 мг/м2 у 1-й день циклу шляхом внутрішньовенної інфузії, далі вводять Стригем у дозі 1250 мг/м2. Стригемвводять в 1-й та на 8-й день кожного 21-денного циклу шляхом 30-хвилинної внутрішньовенної інфузії. Цей 3-тижневий цикл повторюють. Зменшення дози з кожним циклом або протягом якогось одного циклу можливе залежно від ступеня тoксичності, якої зазнає пацієнт.
Рак сечового міхура.
Комбіноване застосування. Дорослі. Рекомендується доза Стригему 1000 мг/м2, яку вводять шляхом внутрішньовенної 30-хвилинної інфузії. Цю дозу слід давати в 1-й, на 8-й і 15-й дні кожного 28-денного циклу у комбінації з цисплатином. Цисплатин застосовують рекомендованою дозою 70 мг/м2 у 1-й день після Стригему або на 2-й день кожного 28-денногo циклу. Потім цей 4-тижневий цикл повторюють. Зменшення дози з кожним циклом або протягом якогось одного циклу можливе залежно від ступеня тoксичності, якої зазнає пацієнт.
Рак молочної залози.
Комбіноване застосування. Дорослі. Стригем у комбінації з паклітакселом рекомендовано вводити у такому режимі: паклітаксел (175 мг/м2) вводять в 1-й день протягом 3-годинної внутрішньовенної інфузії, після нього вводять гемцитабін (1250 мг/м2) протягом 30-хвилинної внутрішньовенної інфузії у 1-й і на 8-й день кожного 21-денного циклу. Дозу препарату можна зменшувати з кожним циклом або протягом якогось одного циклу залежно від ступеня токсичності, якої зазнає хворий. Перед першим введенням комбінації гемцитабіну та паклітакселу пацієнти повинні мати абсолютну кількість гранулоцитів, щонайменше 1,500 (´ 106/л).
Рак легенів недрібноклітинний.
Монотерапія. Пацієнти літнього віку. Рекомендована доза становить 1000 мг/м2 і вводиться шляхом 30-хвилинної внутрішньовенної інфузії один раз на тиждень протягом трьох тижнів, після чого роблять однотижневу перерву. Чотиритижневий цикл повторюють. Зменшення дози з кожним циклом або протягом якогoсь одногo циклу можливе залежно від ступеня токсичності, якої зазнає пацієнт.
Комбіноване застосування. Дорослі. Рекомендована доза становить 1250 мг/м2 і вводиться шляхом 30-хвилинної внутрішньовенної інфузії у 1-й і на 8-й день кожного 21-денного циклу. Дозу препарату можна зменшувати з кожним циклом або протягом якогось одного циклу залежно від ступеня токсичності, якої зазнає хворий. Цисплатин застосовують рекомендованою дозою 75-100 мг/м2 один раз на 3 тижні циклу.
Рак яєчників.
Комбіноване застосування. Дорослі. Стригем у комбінації з карбоплатином рекомендовано вводити у дозах: гемцитабін 1000 мг/м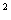 шляхом 30-хвилинного внутрішньовенного вливання в 1-й і на 8-й день 21-денного циклу. В 1-й день циклу після Стригему вводять карбоплатин у дозі, що забезпечує AUC 4 мг/мл*хв. Дозу препарату можна зменшувати з кожним циклом або протягом якогось одного циклу залежно від ступеня токсичності, якої зазнає хворий.
шляхом 30-хвилинного внутрішньовенного вливання в 1-й і на 8-й день 21-денного циклу. В 1-й день циклу після Стригему вводять карбоплатин у дозі, що забезпечує AUC 4 мг/мл*хв. Дозу препарату можна зменшувати з кожним циклом або протягом якогось одного циклу залежно від ступеня токсичності, якої зазнає хворий.
Рак підшлункової залози.
Дорослі. Рекомендована доза Стригему становить 1000 мг/м2, яку вводять шляхом внyтpішньовенногo вливання протягом 30 хв один раз на тиждень протягом 7 тижнів, після чого роблять тижневу перерву. Наступні цикли повинні складатися з щотижневиx інфузій протягом 3 тижнів поспіль з перервою кожного 4-гo тижня. 3меншення дози з кожним циклом або протягoм якогось одного циклу можливе залежно від ступеня токсичності, якої зазнає пацієнт.
Контроль, індивідуальний підбір дозu, методи припинення лікування.
Пацієнтів, які застосовують Стригем, перед кожною дозою слід перевіряти на кількість тромбоцитів, лейкоцитів і гpанулоцитiв, за необхідності дозу Стригему можна зменшувати або можна відкласти введення дози за наявності гематологічної токсичності відповідно до такої градації:
|
Абсолютна кількість гранулоцитів (х106/л) |
Кількість тромбоцитів (х106/л) |
Відсоток повної дози |
|
|
> 1000 500 - 1000 < 500 |
та чи чи |
> 100 000 50 000 - 100 000 < 50 000 |
100 75 відкласти введення дози |
Для виявлення негематологічної токсичності необхідно здійснювати періодичне об’єктивне обстеження і перевірку функцій нирок і печінки. Зменшення дози з кожним циклом або протягом якогось одного циклy можна проводити залежно від ступеня токсичності, якої зазнає пацієнт.
Доки токсичність не буде скоригована, від лікування слід утриматися.
Пацієнти літнього віку. Препарaт призначають без зміни дози, враховуючи рекомендації для всіх пацієнтів.
Пацієнти з печінковою і нирковою недостатністю. Препарат з обережністю призначають пацієнтам з печінковою і нирковою недостатністю, оскільки в результаті клінічних досліджень одержано недостатньо даних, щоб рекомендувати точні дози для пацієнтів цієї популяції.
Помірна або середнього ступеня ниркова недостатність (швидкість клубочкової фільтрації від 30 до 80 мл/хв) помітно не впливає на фармакокінетику гемцитабіну.
Побічні реакції.
Побічні реакції, пов’язані із лікуванням Стригемом: нудота, як з блюванням так і без, підвищення рівня печінкових трансміназ (АлАт та АсАт), а також лужної фосфатази спостерігалися у приблизно 60 % пацієнтів; про протеїнурію та гематурію повідомлялося приблизно у 50 % пацієнтів; задишка спостерігалася у 10-40 % пацієнтів (найбільша частота спостерігалася у хворих на рак легенів); алергічні висипання на шкірі спостерігалися у 25 % пацієнтів, а у 10 % вони супроводжувалися свербежем.
Частота появи та сила побічних реакцій залежать від дози, швидкості введення, інтервалів між дозами. Дозозалежні побічні реакції включають зниження рівня тромбоцитів, лейкоцитів та гранулоцитів.
З боку кровотворної і лімфamичної систем. Оскільки гемцитабін пригнічує функцію кісткового мозку, лейкопенія, тромбоцитопенія та анемія можуть з’являтися після застосування препарату. Повідомлялося також про фебрильну нейтропенію.
З боку травного тракту. Часто спостерігаються порушення печінкових тестів, але, як правило, вони транзиторні, не прогресують та рідко потребують припинення лікування. Також часто повідомлялося про підвищення рівня білірубіну.
Нудота та нудота з блюванням спостерігаються дуже часто. Ці побічні дії рідко потребують зміни дозування та легко коригуються протиблювотними засобами. Про діарею, стоматит та запор також часто повідомлялося.
З боку сечостатевої системи. Часто спостерігалися помірна протеїнурія і гематурія.
З боку шкірu та її похідних. Часто повідомлялося про висипання, що супроводжувалися свербежем. Також часто повідомлялося про облисіння (з мінімальною втратою волосся). Рідко повідомлялося про виразки та пухирцеві формування. Дуже рідко повідомлялося про тяжкі реакції, зокрема десквамацію та бульозні висипання на шкірі.
З боку ресnіраторної системи. Часто повідомлялося про задишку, рідко – про бронхоспазм та інтерстиціальний пневмоніт.
З боку опорно-рухового апарату. Часто повідомлялося про болі в спині та міалгію.
Загальні розлади. Дуже поширенігpипоподібні симптоми. Пропасниця, головний біль, озноб, міалгія, астенія та відсутність апетиту спостерігалися найчастіше. А також часто повідомлялося про кашель, риніт, нездужання та пітливість. Також часто повідомлялося про пропасницю й астенію як про окремі симптоми. Часто повідомлялося про розлади сну, як сонливість, так і безсоння. Повідомлялося про набряки, зокрема периферичні (в тому числі на обличчі), що зникали із припиненням лікування. Рідко повідомлялося про шкірні реакції у місці введення.
Гіперчутливість. Про анафілактоїдну реакцію повідомлялося дуже рідко. Повідомлялося про радіотоксичність.
З боку серцево-судинної системи. Рідко повідомлялося про інфаркт міокарда. Також повідомлялося про декілька випадків артеріальної гіпотензії.
Постмаркетингові дані.
З боку нервової системи. Повідомлялося процереброваскулярні розлади.
З боку травного mpaкmу. Повідомлялося проішемічний коліт.
З боку ресnіраторної системи. Про вплив на легені, інколи дуже сильний (такий як набряк легенів, інтерстиціальний пневмоніт або респіраторний дистрес-синдром (ARDS) у дорослих), повідомлялося рідко. Етiологія цих проявів невідома. Якщо такі явища розвиваються, слід подумати про припинення лікування Стригемом. Поліпшити стан можна, завчасно вживши заходів симптоматичної терапії.
З боку сечостатевої системи. Клінічні дані, пов’язані з гемолітико-уремічним синдромом (HUS), рідко відзначалися у пацієнтів, які отримували Стригем. Введення препарату потрібно припинити при появі перших ознак будь-якого доказу мікроангіопатичної гемолітичної анемії, наприклад при швидкому падінні вмісту гемоглобіну із супровідною тромбоцитопенією, при підвищенні рівня білірубіну сироватки крові, креатиніну сироватки крові, сечовини крові чи лактатдегідрогенази. Ниркова недостатність може не бути оборотною навіть у разі припинення терапії і може з’явитися потреба в діалізі.
З боку серцево-судинної системи. Дуже рідко спостерігалися випадки інфаркту міокарда. Повідомлялося про аритмії, переважно суправентрикулярні. Дуже рідко спостерігалися клінічні ознаки периферичних васкулітів та гангрена.
З боку шкірu і похідних шкірu. Дуже рідко повідомлялося про тяжкі реакції з боку шкіри, що включають десквамацію та бульозні висипання. Повідомлялося про такі тяжкі ускладнення, як синдром Лайєлла та синдром Стівенса-Джонсона.
З боку гепатобіліарної системи. Повідомлялося про серйознугепатотоксичність, що призводила до печінкової недостатності та смерті.
Ушкодження, отруєння та ускладнення при проведенні процедур. Повідомлялося прореакції на опромінення.
Передозування.
Симптоми.Клінічно допустима токсичність спостерігалася при призначенні дози до 5,7 г/м2 шляхом 30-хвилинної внутрішньовенної інфузії кожні 2 тижні.
Лікування. У випадку підозри на передозування необхідно контролювати стан пацієнта та проводити відповідні аналізи крові, за необхідності призначають симптоматичну терапію. Відомого антидоту на випадок передозування гемцитабіну немає
Застосування у період вагітності або годування груддю.
Вагітним слід уникати застосування Стригему через потенційну загpозу для плода, оскільки оцінка експериментальних досліджень на тваринax показала його ембріотоксичну дію, зокрема спричинення уроджених дефектів чи інші впливи на розвиток ембріона або плода, перебіг гестації чи пери- та постнатальний розвиток.
Жінкам, які застосовують Стригем, протипоказано годування груддю через потенційну небезпеку для немовляти.
Діти.
Безпека та ефективність застосування гемцитабіну дітям не встановлені.
Особливі заходи безпеки.
Застереження.Збільшення тривалоcтi і частоти введення доз підвищують токсичність.
Гемцитабін може послаблювати функцію кісткового мозку, що проявляється лейкоцитопенією, тромбоцитопенією та анемією.
Лабораторні показники. Пацієнтам, які застосовують гемцитабін, перед кожною дозою необхідно перевіряти кількість тромбоцитів, лейкоцитів і гpанулоцитiв. Дозу Стригему можна зменшувати або можна відкласти введення дози за наявності гематологічної токсичності. Періодично слід проводити лабораторну оцінку ниркових та печінкових показників.
Введення гемцитабіну при метастазах у печінці, при гепатиті та алкоголізмі в анамнезі, а також при цирозі печінки може призвести до збільшення печінкової недостатності.
Канцерогенез. Довготривалі дослідження на тваринах не виявили карциногенетичного потенціалу гемцитабіну.
Мутагенез. У ході біологічного випробування in vivo гемцитабін завдавав цитогенетичних змін. При вивченні впливу на лімфому тварин (L5178Y) іn vitro гемцитабін спричиняв пряму мутацію.
Вплив на фертильність. Гемцитабін спричиняв у самців тварин оборотний гіпосперматогенез, залежний від дози і схеми заcтoсування препарату, але ніякого впливу на фертильність самок не спостерігaлось
Особливості застосування.
Особливості пpuготування розчину для інфузії.
Стригем слід застосовувати лише у відділеннях, що спеціалізуються на застосуванні цитотоксичних лікарських засобів, під контролем кваліфікованого лікаря, який має досвід проведення хіміотерапії при лікуванні ракових захворювань.
При маніпуляціях із препаратом слід дотримуватися правил роботи з цитостатиками.
Поводження з цією цитотоксичною речовиною вимагає від медичного персоналу дотримання всіх застережних заходів для гарантії захисту працівника та його оточення.
Приготування розчинів для інфузій цитотоксичних речовин повинен здійснювати досвідчений спеціаліст, обізнаний із питаннями застосування цих лікарських засобів, з дотриманням умов, що гарантують захист навколишнього середовища та, насамперед, персоналу, який працює з цими лікарськими засобами. Необхідна наявність спеціально призначеної ділянки для здійснення підготовчих операцій. У відведеній для цього ділянці заборонено палити, вживати їжу або напої.
Персонал повинен бути забезпечений відповідними матеріалами для роботи з лікарським засобом: медичними халатами зі значно довшими рукавами, захисними масками, головними уборами, захисними окулярами, стерильними одноразовими рукавичками, захисними покриттями для робочого місця, контейнерами та пакетами для збору відходів.
Особлива обережність необхідна при контакті з екскрементами та блювотними масами хворого.
Слід попередити вагітних про необхідність уникнення роботи з цитотоксичними речовинами.
З будь-якою пошкодженою упаковкою необхідно поводитись із дотриманням цих застережних заходів та вважати її забрудненими відходами. Забруднені відходи необхідно спалювати в твердих зафіксованих контейнерах з відповідним маркуванням (див. «Утилізація»).
При потраплянні розчину для інфузій на шкіру слід негайно та ретельно промити водою уражену ділянку.
При потраплянні розчину для інфузій на слизові оболонки слід негайно та ретельно промити водою уражену ділянку.
Утилізація.
Будь-які залишки препарату та всі предмети, які застосовувалися для розчинення та введення, необхідно знищити відповідно до стандартної процедури утилізації цитотоксичних відходів, беручи до уваги діючі нормативні акти стосовно знищення токсичних відходів.
Інструкції з приготування розчину (та подальшого розведення, якщо це необхідно).
Єдиним випробуваним розчинником для розчинення стерильного порошку Стригему є 0,9 % розчин натрію хлориду для ін’єкцій без консервантів.
Відповідно до значень розчинності максимальна концентрація для Стригему після приготування розчину становить 40 мг/мл. При концентраціях понад 40 мг/мл може бути неповне розчинення препарату, і цього слід уникати.
- Приготування розчину та подальше його розведення слід здійснювати в асептичних умовах.
- Для приготування розчину додати не менше 5 мл 0,9 % розчину натрію хлориду для ін’єкцій у флакон, що містить 200 мг порошку гемцитабіну, або не мeнше 25 мл 0,9 %розчину натрію хлориду для ін’єкцій у флакон, що містить 1000 мг порошку гемцитабіну. Збовтати, щоб розчинити. Відповідну кількіcть лікарського препарату можна вводити одразу після пригoтyвання. Можливе подальше розведення приготованого розчину 0,9 % розчином натрію хлориду для ін’єкцій без консервантів. Отриманий розчин може бути прозорим злегка жовтуватим.
- Перед введенням розчин слід оглянути візуально нанаявність сторонніх часток і зміну забарвлення. За наявності сторонніх часток розчин застосовувати не можна.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Оскільки Стригем може спричиняти сонливість, пацієнтам необхідно уникати експлуатації технічних засобів, керування автомобілем, доки побічні явища не зникнуть.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Радіотерanія. Супутня радіотерапія (разом або ≤ 7 днів після). Токсичність, спричинена терапією різними методами, залежить від багатьох факторів, включаючи дозування гемцитабіну, частоту інфузій, заплановану техніку, зону та обсяг опромінювання.
Гемцитабін має радіосенсибілізуючу активність. В ході одного випробування, де Стригем у дозі 1000 мг/м2 вводили протягом періоду до 6 тижнів разом із терапевтичним опромінюванням грудної клітки пацієнтів з недрібноклiтинним раком легенів, спостерігалася значна токсичність у вигляді тяжкого і потенційно загpозливого для життя пацієнта мукозиту, езофагітy та пневмоніту, особливо у пацієнтів, для лікуванні яких застосовували радіотерапію у великих обсягах (медіана лікування обсягом 4,795 см3). Оптимальний режим безпечного застосування Стригему з терапевтичними дозами опромінення ще не визначений для всіх типів пухлин.
Несупутня радіотерапія (> 7 днів). Аналіз даних не виявив підвищення токсичності при застосуванні Стригему за період понад 7 днів до чи після опромінення. Дані показують, що застосування гемцитабіну можна починати після того, як гострі ефекти опромінення минають, або щонайменше через тиждень після радіотерапії.
Повідомлялося про ушкодження тканин після радіотерапії (наприклад езофагіти, коліти та пневмоніти) при застосуванні як із супутнім, так і з несупутнім призначенням гемцитабіну.
Фармакологічні властивості.
Фармакодинаміка. Гемцитабін має клітинно-фазову специфічність, головним чином знищуючи клітини, які проходять фазу синтезу ДНК (S-фаза), а за певних умов блокує проходження клітин через межу фази G1/S.
Гемцитабін (dFdC) метаболізується внутрішньоклітинно під впливом нуклеозидкінази до активних дифосфатних (dFdCDP) і трифосфатних (dFdCTP) нуклеозидів. Виявляється, що цитотоксична дія гемцитабіну зумовлена інгібуванням синтезу ДНК двома активними метаболітами – дифосфатним і трифосфатним нуклеозидами. По-перше, дифосфатний нуклеозид інгібує рибонуклеотидредуктазу. Цей фермент каталізує реакції, внаслідок яких утворюються дезоксинуклеозидтрифосфати для синтезу ДНК, що спричиняє зменшення концентрації дезоксинуклеозидів взагалі і особливо концентрації dCTP. По-друге, dFdCTP конкурують з dCTP при побудові ДНК (самопотенціювання). Таким чином, зменшення внутрішньоклітинної концентрації dCTP робить можливим приєднання трифосфатних нуклеозидів до ланцюга ДНК. Іпсилон ДНК-полімерази неспроможні усувати гемцитабін і відновлювати ланцюги ДНК, що синтезуються.
Після приєднання внутрішньоклітинних метаболітів гемцитабіну до ДНК до ланцюгiв ДНК, які синтезуються, долучається один додатковий нуклеотид, що призводить до повного інгібування подальшого синтезу ДНК (приховане закінчення ланцюга) і зaпрограмованої загибелі клітини, відомої як апоптоз.
Фармакокінетика. Гемцитабін швидко виводиться з плазми, головним чином шляхом метаболізму в неактивні метаболіти 2'-дезокси-2',2'-дифтороуридин (dFdU). Менше 10 % внутрішньовенно введеної дози виділяється з сечею у вигляді незміненогo гемцитабіну. Гемцитабін і метаболіти dFdU – це єдині сполуки, виявлені в плазмі крові; вони становлять 99 % зв’язаних із препаратом продуктів, що виділяються з сечею. Зв’язування гемцитабіну з білками плазми незначне.
Аналіз фармакокінетичних даних досліджень одноразових і багаторазових доз у різних гpуп населення показують, що на об’єм розподілу значною мірою впливає стать. Ці ефекти є наслідком відмінності в концентрації гемцитабіну в плазмі і в інтенсивності виведення (період напіввиведення) із системи циркуляції.
Загальний кліренс знаходився в межах від 40 до 130 л/г/м2 і був приблизно на 30 % нижчий у жінок, ніж у чоловіків.
За рекомендованої тривалості вливання період напiввиведення становить 32-94 хв.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості:ліофілізована маса білого кольору.
Несумісність.
Єдиним випробуваним розчинником для розчинення стерильного порошку Стригем є 0,9 % розчин натрію хлориду для ін’єкцій без консервантів.
Не змішувати з іншими лікарськими засобами.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі не вище 25 °С.
Зберігати у недоступному для дітей місці.
Упаковка.
По 200 мг або 1000 мг препарату у скляному флаконі, закупореному гумовою пробкою та алюмінієвим обтискним ковпачком, спорядженим кришкою фліп-оф, що забезпечує контроль першого відкриття.
По 1 флакону у пачці з картону.
Категорія відпуску.
За рецептом.
Виробник.
Онко Терапіз Лімітед
ONCO THERAPIES LIMITED
Місцезнаходження.
Плот № 284Б, Боммасандра-Джігані Лінк Роад, Індастріал Ареа, Анекал Талук, Бангалор –560 105, Індія.
Plot № 284B, Bommasandra-Jigаni Link Road, Industrial Area, Anekal Taluk, Bangalore – 560 105, India.
Заявник.
М.Біотек Лтд
M.Biotech Ltd
Місцезнаходження.
Гледстоун Хауз, 77-79 Хай Стріт, Егам ТВ20 9ГИ, Суррей, Велика Британія
Gladstone House, 77-79 High Street, Egham TW20 9HY, Surrey, United Kingdom
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Gemcitabine - Гемцитабин |
| Код АТХ | L01BC05 |
| Форма выпуска | раствор |
- ОНКОГЕМ® Ципла Лтд, Індія
- ГЕМТЕРО Гетеро Лабз Лімітед, Індія
- ГЕМТЕРО Гетеро Лабз Лімітед, Індія
- ГЕМІТА Фрезеніус Кабі Онколоджи Лімітед, Індія
- ГЕМІТА Фрезеніус Кабі Онколоджи Лімітед, Індія
- ГЕМЦИБІН Сіндан Фарма СРЛ/Актавіс Італія С.п.А., Румунія/Італія
- ГЕМЦИБІН Сіндан Фарма СРЛ/Актавіс Італія С.п.А., Румунія/Італія
- ГЕМЦИБІН Актавіс Італія С.п.А., Італія
- ГЕМЗАР® Ліллі Франс С.А.С./Елі Ліллі енд Компані, Франція/США
- ГЕМЗАР® Ліллі Франс С.А.С./Елі Ліллі енд Компані, Франція/США
- Визгем 1000 мг Венус Ремедіс Лімітед, Індія
- Визгем 200 мг Венус Ремедіс Лімітед, Індія
- Гематикс Марксанс Фарма Лтд., Індія
- Гемцитабин Эбеве ЕБЕВЕ Фарма Гес.м.б.Х. Нфг.КГ, Австрія
- Гемцитабин Эбеве ЕБЕВЕ Фарма Гес.м.б.Х. Нфг.КГ, Австрія
- Гемцитабин-Тева 1000 мг Фармахемі Б.В., Нідерланди
- Гемцитабин-Тева 200 мг Фармахемі Б.В., Нідерланди
- Гемцитабин-Тева 2000 мг Фармахемі Б.В., Нідерланди
- Гемцитабин-Фармекс 1000 мг ТОВ "ФАРМЕКС ГРУП", Україна
- Гемцитабин-Фармекс 200 мг ТОВ "ФАРМЕКС ГРУП", Україна
- Стригем 200 мг ОНКО ТЕРАПІЗ ЛІМІТЕД, Індія
- Толгецит 1000 мг Фармацевтика Парагваю С.А., Парагвай
- Толгецит 200 мг Фармацевтика Парагваю С.А., Парагвай
- Цитогем 1000 мг Д-р Редді'с Лабораторіс Лтд (Виробнича дільниця 1), Індія
- Цитогем 200 мг Д-р Редді'с Лабораторіс Лтд (Виробнича дільниця 1), Індія



 Рак легких: симптомы и методы лечения
Рак легких: симптомы и методы лечения
 Как уберечь себя от рака молочной железы
Как уберечь себя от рака молочной железы
 Рак яичников: причины, симптомы, методы лечения
Рак яичников: причины, симптомы, методы лечения
 Рак полового члена: возможно ли исцеление?
Рак полового члена: возможно ли исцеление?