Бериате 250 МО инструкция, аналоги и состав
| Показания: | Лікування та профілактика кровотечі у пацієнтів, хворих на гемофілію А (спадкова недостатність фактору коагуляції крові VIII). Препарат може застосовуватися в лікуванні набутої недостатності фактора VIII. Препарат не містить фактора фон Віллебранда у фармакологічно ефективних кількостях і тому не показаний для лікування хвороби фон Віллебранда. |
| Форма випуска: | Порошок для розчину для ін'єкцій або інфузій по 250 МО у флаконі в комплекті з розчинником (вода для ін'єкцій) по 2,5 мл у флаконі та пристроєм з вбудованим фільтром для додавання розчинника, № 1; або у комплекті з набором для внутрішньовенного введення в окремій картонній коробці |
| Производитель, страна: | ЦСЛ Берінг ГмбХ, Німеччина |
| Действующее вещества: | 1 флакон з порошком містить: фактор коагуляції крові людини VIII - 250 МО |
| МНН: | Coagulation factor VIII - Фактор коагуляции крови человека VIII |
| Регистрация: | UA/13049/01/01з 27.09.2013 по 27.09.2018. Приказ 336 від 12.06.2015 |
| Код АТХ: |
Загальна характеристика.
міжнародна непатентована назва: Coagulation factor VІІІ.
основні властивості лікарської форми: порошок білого або майже білого кольору; відновлений розчин від безбарвного до світло-жовтого кольору, прозорий або слабо опалесціюючий.
ЯКІСНИЙ ТА КІЛЬКІСНИЙ СКЛАД:
1 флакон з порошком містить:
діючі речовини: фактор коагуляції крові людини VIII - 250 МО, 500 МО або 1000 МО;
допоміжні речовини: гліцин, кальцію хлорид, D(+) сахароза, натрію хлорид.
Розчинник (вода для ін'єкцій) - по 2,5 мл, 5 мл і 10 мл.
Препарат, відтворений додаванням відповідно 2,5 мл, 5 мл і 10 мл води для ін'єкцій, містить приблизно 100 МО/мл фактору коагуляції крові людини VIII.
Активність (МО) визначається за допомогою хромогенного аналізу у відповідності до Європейської Фармакопеї. Середня питома активність Бериате® становить приблизно 270МО/мг білків.
ФОРМА ВИПУСКУ: порошок та розчинник для розчину для ін'єкцій або інфузій.
КОД за АТС: B02BD02. Гемостатичні препарати: фактор коагуляції крові VІІІ.
ІМУНОЛОГІЧНІ ТА БІОЛОГІЧНІ ОСОБЛИВОСТІ:
Фармакодинамічні властивості
Комплекс фактор коагуляції крові VІІІ/фактор фон Віллебранда складається з двох молекул з різними фізіологічними функціями.
При проведенні інфузії пацієнту, хворому на гемофілію, фактор коагуляційї крові VІІІ зв'язується з фактором фон Віллебранда в системі кровообігу пацієнта.
Активізований фактор коагуляції крові VІІІ діє як ко-фактор для активізованого фактора IX, прискорюючи конверсію фактора X в активізований фактор X. Активізований фактор X перетворює протромбін на тромбін. Потім тромбін перетворює фібриноген у фібрин, і може утворитися згусток крові.
Гемофілія A є пов’язаним зі статтю спадковим порушенням в системі згортання крові внаслідок зниження рівнів фактора VIIІ:C, яке спричинює профузні кровотечі в суглоби, м'язи або внутрішні органи спонтанно, або в результаті випадкової чи хірургічної травми. Завдяки замісній терапії підвищуються рівні фактора коагуляції крові VІІІ у плазмі, уможливлюючи у такий спосіб тимчасову корекцію дефіциту фактору і виправлення тенденцій до кровотеч.
На додаток до своєї функції білка, що захищає фактор VIII, фон Віллебранд є медіатором зчеплення тромбоцитів з ділянками судинних ушкоджень і відіграє певну роль в агрегації тромбоцитів.
Результати клінічної ефективності та безпеки, отримані на основі наявних даних щодо лікування 16 дітей віком менше 6 років, узгоджуються із досвідом застосування препарату дорослим пацієнтам.
Фармакокінетичні властивості
Після внутрішньовенного введення активність фактора VІІІ зменшується одно- або двофазно. Кінцевий період напіввиведення варіює в інтервалі від 5 до 22 годин, в середньому приблизно 12 годин. Підвищення активності фактора VІІІ після введення фактора VIIІ в дозі 1 МО/кг маси тіла (поступове відновлення) становило приблизно 2 % з варіабельністю між окремими пацієнтами (від 1,5 до 3 %). Середній час утримання (MRT) складає 17 годин (стандартне відхилення 5,5 годин), середня площа під кривою «концентрація-час», що оцінена на основі екстраполяції (AUDC) була еквівалентна 0,4 год x кг/мл (стандартне відхилення 0,2), середній кліренс - 3 мл/год/кг (стандартне відхилення 1,5 мл/год/кг).
Доклінічні дані щодо безпеки препарату
Загальна токсичність
Токсикологічні дослідження з повторним дозуванням не проводилися через розвиток антитіл проти гетерологічного білка.
Навіть дози, що в декілька разів перевищували рекомендовану для людини дозу на 1 кілограм маси тіла, не показували ніяких токсичних ефектів на лабораторних тварин.
Тести термообробленого препарату фактору VІІІ з поліклональними преципітуючими антитілами (кролики) в аналізі по Оухтерлоні та в аналізі пасивної шкірної анафілаксії на морських свинках не показали змін в імунологічних реакціях порівняно з необробленим білком.
Мутагенність
Оскільки в клінічному досвіді відсутні будь-які дані щодо можливих туморогенних і мутагенних ефектів фактора коагуляції крові людини VІІІ, проведення експериментальних досліджень, особливо на гетерологічних видах, не вважається доцільним.
ПОКАЗАННЯ ДЛЯ ЗАСТОСУВАННЯ:
Лікування та профілактика кровотечі у пацієнтів, хворих на гемофілію А (спадкова недостатність фактору коагуляції крові VIII). Препарат може застосовуватися в лікуванні набутої недостатності фактора VIII. Препарат не містить фактора фон Віллебранда у фармакологічно ефективних кількостях і тому не показаний для лікування хвороби фон Віллебранда.
СПОСІБ ЗАСТОСУВАННЯ ТА ДОЗИ:
Лікування слід проводити під наглядом лікаря, який має досвід у лікуванні хворих на гемофілію.
Дозування
Визначення дози і тривалості замісної терапії залежать від ступеня дефіциту недостатності фактора коагуляції крові VIІІ, локалізації та інтенсивності кровотечі, а також від клінічного стану пацієнта.
Кількість призначених одиниць фактору VІІІ виражається в міжнародних одиницях (МО) у відповідності до поточного стандарту Всесвітньої організації охорони здоров'я для препаратів, що містять фактор коагуляції крові VІІІ. Активність фактора VІІІ у плазмі визначається у відсотках (відносно нормальної плазми людини) або в міжнародних одиницях (відносно Міжнародного стандарту вмісту фактора VІІІ у плазмі).
1 МО активності фактору VІІІ еквівалентна кількості фактору VІІІ в 1 мл нормальної плазми людини.
Розрахунок необхідної дози фактору VIІІ розраховується на основі емпіричного досвіду, згідно з яким 1 МО фактору VІІІ на кг маси тіла підвищує активність фактору VІІІ у плазмі приблизно на 2 % від нормальної активності (2 МО/дл). Необхідна доза розраховується за наступною формулою:
Необхідна кількість одиниць = маса тіла (кг) x бажане підвищення FVIII (% або МО/дл) x 0,5.
Доза та частота введень мають завжди розраховуватися з урахуванням клінічної ефективності в кожному індивідуальному випадку.
У разі виникнення наступних геморагічних явищ, активність фактора VІІІ за відповідний період не повинна бути нижче рівня активності плазми (у % від нормального рівня або в МО/дл).
Для розрахунку доз препарату при кровотечах та в хірургічній практиці можна використовувати таблицю нижче:
|
Ступінь кровотечі / Тип хірургічного втручання |
Необхідний рівень фактора VІІІ (% або МО/дл) |
Частота введення доз (години) / Тривалість терапії (дні) |
|
Кровотеча |
||
|
Ранній гемартроз, м'язова або ротова кровотеча |
20 - 40 |
Повторна інфузія кожні 12-24 години. Принаймні 1 день, поки не буде зупинена кровотеча (за больовими відчуттями), або поки не відбудеться загоєння |
|
Більш обширний гемартроз, м'язова кровотеча або гематома |
30-60 |
Повторна інфузія кожні 12-24 години протягом 3-4 днів або більше, поки не мине біль і тяжка недієздатність |
|
Кровотеча, що становить загрозу для життя |
60 - 100 |
Повторна інфузія кожні 8-24 години, поки не зникне загроза життю |
|
Хірургічні втручання |
||
|
Незначні, включаючи видалення зуба |
30 - 60 |
Кожні 24 години, принаймні 1 день, поки не відбудеться загоєння |
|
Великі |
80 – 100 (до і після операції) |
Повторна інфузія кожні 8-24 години до адекватного загоєння рани, потім терапія протягом не менш 7 днів для підтримання активності фактору VІІІ на рівні 30-60% (МО/дл) |
Під час курсу лікування розрахунок дози і частоти повторних інфузій рекомендовано проводити на основі належного визначення рівнів фактора VIII. При великих хірургічних втручаннях є обов’язковим проведення ретельного контролю замісної терапії за допомогою аналізу коагуляції (активність фактору VIII). У пацієнтів може спостерігатися індивідуальна реакція на лікування фактором VIII, in vivo демонструючи різні показники відновлення i періоду напіввиведення.
При довгостроковій профілактиці кровотеч у пацієнтів з тяжкою гемофілією А звичайні дози становлять 20-40 МО фактора VІІІ на 1 кг маси тіла з інтервалом введення 2-3 дні. У деяких випадках, особливо у молодих пацієнтів, можуть знадобитися більш короткі інтервали або більш високі дози.
Розрахунок доз препарату у дітей відбувається виходячи з маси тіла, а отже, загалом на тих самих керівних принципах, що й для дорослих пацієнтів. При визначенні частоти введення препарату слід враховувати клінічну ефективність в кожному окремому випадку. Існує певний досвід лікування дітей віком менше 6 років (див. розділ "Фармакодинамічні властивості").
Необхідно проводити контроль утворення інгібіторів фактора VІІІ у пацієнтів. Якщо при застосуванні препарату не було досягнуто очікуваних рівнів активності фактора VІІІ в плазмі, або якщо не вдається контролювати кровотечу належною дозою, необхідно провести аналіз на наявність інгібітора фактора VІІІ.
У пацієнтів з високим вмістом інгібіторів терапія фактором VIІІ може бути неефективною. В таких випадках слід розглядати можливість альтернативних варіантів лікування. Ведення таких пацієнтів мають здійснювати лікарі, які мають досвід лікування пацієнтів, хворих на гемофілію (див. також розділ "Особливості застосування").
Спосіб застосування
Відновити препарат згідно з описом в розділі "Інструкція стосовно приготування препарату перед використанням".
Перед застосуванням препарат слід нагріти до кімнатної температури або температури тіла. Вводити препарат шляхом внутрішньовенної ін’єкції або повільної інфузії з такою швидкістю, при якій пацієнт буде почуватися комфортно. Швидкість ін’єкції або інфузії не повинна перевищувати 2 мл за хвилину.
Необхідно вести спостереження за пацієнтом для виявлення будь-якої алергічної реакції миттєвого типу. У разі виникнення будь-якої реакції, що може бути пов'язана із застосуванням Бериате®, слід зменшити швидкість інфузії або взагалі припинити інфузію, в залежності від клінічного стану пацієнта (див. також розділ "Особливості застосування").
ПОБІЧНА ДІЯ:
Наведені нижче побічні реакції базуються на даних постмаркетингового спостереження і наукової літератури. Використовуються такі стандартні категорії частоти виникнення:
Дуже часто ≥ 1/10
Часто ≥ 1/100 і <1/10
Іноді ≥ 1/1,000 і <1/100
Рідко ≥ 1/10,000 і <1/1,000
Дуже рідко < 1/10,000 (включаючи поодинокі повідомлені випадки)
Порушення імунної системи
Алергічні реакції або реакції гіперчутливості (які можуть включати ангіоневротичний набряк, відчуття пощипування та печіння у місці інфузії, озноб, прилив крові до обличчя, генералізовану кропивницю, головний біль, висип, гіпотензію, сонливість, нудоту, збудження, тахікардію, утруднене дихання, поколювання, блювання та стридорозне дихання спостерігалися дуже рідко і в деяких випадках можуть розвинутися в тяжку анафілаксію (включаючи шок).
У пацієнтів з гемофілією А можуть утворюватись нейтралізуючі антитіла (інгібітори) фактора VIII. У разі виникнення таких інгібіторів цей стан проявить себе як недостатня клінічна реакція. У таких випадках рекомендується отримати консультацію в спеціалізованому центрі лікування гемофілії.
Досвід клінічних випробувань препарату Бериате® за участі пацієнтів, які раніше не отримували лікування, є дуже обмеженим. З цієї причини немає достовірних даних щодо частоти виникнення клінічно значимих специфічних інгібіторів.
Загальні порушення
У дуже рідких випадках спостерігалася гарячка.
Інформація про вірусну безпеку наводиться в розділі "Особливості застосування".
ПРОТИПОКАЗАННЯ:
Підвищена чутливість до діючої речовини або будь-якого іншого компоненту препарату.
ОСОБЛИВОСТІ ЗАСТОСУВАННЯ:
Як і при застосуванні будь-яких інших білкових препаратів для внутрішньовенного введення, можливий розвиток реакцій гіперчутливості алергічного типу. Пацієнтів слід повідомити про ранні симптоми реакцій гіперчутливості, таких як висип, генералізовану кропивницю, стискання в грудях, важке дихання, гіпотензію та анафілаксію. У разі виникнення цих симптомів пацієнтам рекомендується негайного звернутися до свого лікаря та припинити застосування препарату.
У випадку розвитку шоку необхідно дотримуватись стандартних методів лікування шоку.
Бериате® містить до 28 мг натрію на 1000 МО, що необхідно враховувати пацієнтам з контрольованою натрієвою дієтою.
Вірусна безпека
Стандартні заходи по запобіганню передачі інфекції внаслідок застосування лікарських препаратів, виготовлених з людської крові або плазми, складаються з відбору донорів, скринінгу донорського матеріалу і пулів плазми на наявність специфічних маркерів інфекцій, а також впроваджених в технологічні етапи виробництва процедур щодо інактивації/видалення вірусів. Незважаючи на це, при застосуванні лікарських препаратів, виготовлених з людської крові або плазми, можливість передачі інфекційних агентів не може бути повністю виключена. Це також стосується невідомих або нових вірусів та інших патогенних організмів.
Вжиті заходи вважаються ефективними для вірусів з оболонкою, таких як ВІЛ, віруси гепатиту B і С, а також для вірусів без оболонки - HAV (вірусу гепатиту A) і парвовірусу B19.
Як загальний профілактичний засіб для пацієнтів, які регулярно/повторно застосовують препарати фактора VІІІ, отримані із людської плазми, слід розглядати відповідне щеплення (проти гепатиту А і гепатиту B).
Утворення нейтралізуючих антитіл (інгібіторів) FVІІІ є відомим ускладненням при лікуванні пацієнтів з гемофілією А. Цими інгібіторами зазвичай є імуноглобуліни класа IgG, спрямовані проти прокоагуляційної активності фактора VІІІ, кількість яких визначається в Одиницях Бетезда (BU) на 1 мл плазми шляхом модифікованого аналізу. Ризик утворення інгібіторів пов’язаний зі ступенем впливу антигемофільного фактора VІІІ; цей ризик є найвищим протягом перших 20 днів експозиції. У поодиноких випадках інгібітори можуть утворюватись після перших 100 днів використання фактору VІІІ. Пацієнти, які одержують лікування фактором коагуляції крові людини VІІІ, мають знаходитись під ретельним контролем за допомогою відповідних клінічних спостережень та лабораторних аналізів для виявлення розвитку інгібіторів (див. також розділ "Побічні реакції".
При кожному застосуванні Бериате® пацієнту настійно рекомендується реєструвати назву і номер серії препарату, щоб можна було простежити зв’язок між пацієнтом і серією препарату.
Взаємодія з іншими лікарськими препаратами та інші форми взаємодії: немає даних про взаємодії препаратів фактора коагуляції крові людини VІІІ з іншими лікарськими препаратами.
Несумісність:
Не змішувати Бериате® з іншими лікарськими препаратами, речовинами для розведення та розчинниками.
Вагітність та лактація:
Дослідження репродуктивної функції у тварин з використанням фактору VІІІ не проводились.
Через невелику кількість випадків виникнення гемофілії А у жінок відсутні дані щодо застосування фактора VІІІ під час вагітності та годування груддю. Тому використання препарату можливе тільки при наявності однозначних показань, якщо користь переважає ризик.
Вплив на здатність керувати транспортними засобами та механізмами:
Вплив на здатність керувати транспортними засобами та механізмами не відмічено.
Інструкція стосовно приготування препарату перед використанням:
Загальні інструкції
-Відновлений розчин має бути прозорим або слабо опалесцюючим. Після фільтрації та перед введенням рекомендується візуально оглянути відновлений препарат на наявність часток і зміну забарвлення. Не використовуйте каламутний розчин або розчин, що містить осад (дрібні частки).
-Відновлення розчину та витягнення виконуються в асептичних умовах.
-Після застосування препарату будь-який невикористаний продукт або відходи мають бути утилізовані у відповідності до місцевих вимог.
Відновлення розчину
Доведіть розчинник до кімнатної температури. Зніміть ковпачки з флаконів з препаратом і розчинником. Пробки обробіть асептичним розчином і дайте їм висохнути до відкриття пристрою для додавання розчинника з вбудованим фільтром (Mix2Vial).
|
|
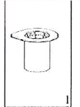
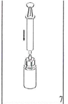
1.Відкрийте блістерну упаковку пристрою для додавання розчинника з вбудованим фільтром. НЕвиймайте Mix2Vial з блістерної упаковки! |
|
|
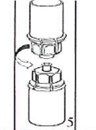
2. Помістіть флакон з розчинником на рівну чисту поверхню і міцно тримайте флакон. Візьміть Mix2Vial разом із блістерною упаковкою і гострим стрижнем синьої частини пристрою проткніть прямо вниз пробку флакону з розчинником. |
|
|
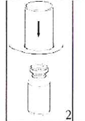
3. Обережно зніміть блістерну упаковку з пристрою для додавання розчинника, тримаючи його за край і тягнучи вертикально вгору. Переконайтесь, що знята лише тільки блістерна упаковка, а не витягнутий сам пристрій. |
|
|
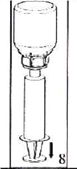
4. Помістіть флакон з препаратом на рівну тверду поверхню. Переверніть флакон з розчинником з приєднаним до нього пристроєм Mix2Vial, потім гострим стрижнем прозорої частини пристрою проткніть прямо вниз пробку флакону з порошком. Розчинник автоматично переміститься до флакону з порошком. |
|
|
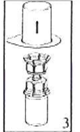
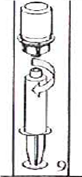
5. Однією рукою тримайте пристрій Mix2Vial зі сторони флакону з препаратом, а іншою - зі сторони флакона з розчинником, і обережно повертаючи, роз’єднайте набір на дві частини. Відкладіть убік флакон з розчинником з приєднаним синім адаптером Mix2Vial. |
|
|
6. Обережно обертайте круговими рухами флакон препарату з приєднаним прозорим адаптером, поки речовина не розчиниться повністю. Не трусіть флакон. |
|
|
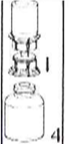
7. Утягніть повітря в порожній, стерильний шприц. Тримаючи флакон з препаратом вертикально, приєднайте шприц до наконечника Luer пристрою Mix2Vial. Введіть повітря всередину флакону з препаратом. |
Витягнення та утилізація препарату
|
|
8. Тримаючи поршень шприца натиснутим, переверніть систему догори дном і втягніть відновлений розчин у шприц, повільно відтягуючи поршень назад. |
|
|
9. Тепер, коли відновлений розчин набраний у шприц, міцно тримайте циліндр шприца (поршень шприца має бути спрямований униз) і від'єднайте пристрій для додавання розчинника від шприца. |
Для ін'єкцій Бериате® рекомендується використовувати одноразові пластикові шприци, оскільки розчин препарату цього типу може прилипати до стінок цільноскляних шприців.
Повільно введіть розчин внутрішньовенно (див. розділ «Спосіб застосування та дози»), звертаючи увагу на те, щоб у шприц з препаратом не потрапила кров.
ПЕРЕДОЗУВАННЯ:
На цей час не спостерігалось симптомів передозування фактором коагуляції крові людини VІІІ.
УМОВИ ЗБЕРІГАННЯ: Зберігати у холодильнику при температурі від 2 до 8 °C. Не заморожувати. Зберігати ємність у зовнішній картонній коробці для захисту від світла.
Протягом строку придатності Бериате® можна зберігати при температурі до 25 °C, але сумарний час його зберігання при такій температурі не повинен перевищувати 1 місяць. Кожний період зберігання Бериате® при кімнатній температурі необхідно документувати, щоб не перевищити сумарний період в 1 місяць.
Не піддавати флакони прямому нагріванню. Флакони не повинні нагріватись вище температури тіла (37 °C). Зберігати в недоступному для дітей місці.
ТЕРМІН ПРИДАТНОСТІ: 3 роки.
Була продемонстрована хімічна та фізична стабільність відновленого продукту у використанні протягом 8 годин при температурі 25 °C. З мікробіологічної точки зору продукт слід застосовувати негайно. Якщо препарат не був застосований одразу, час його зберігання не повинен перевищувати 8 годин при кімнатній температурі.
Не використовувати після закінчення терміну придатності, вказаного на упаковці.
ПАКУВАННЯ:
Порошок для розчину для ін’єкцій або інфузій по 250 МО, 500 МО та 1000 МО у флаконі в комплекті з розчинником (вода для ін’єкцій) по 2,5 мл, 5 мл та 10 мл у флаконі та пристроєм з вбудованим фільтром для додавання розчинника. По 1 флакону з порошком, 1 флакону з розчинником та 1 пристрою з вбудованим фільтром для додавання розчинника (який запакований в блістер поліетилентерефталат/папір, ламінований поліетиленом) разом з інструкцією про застосування вкладають в картону коробку.
Додатково додається: набір для внутрішньовенного введення (одноразовий шприц, голка-метелик, 2 дезінфікуючі серветки в індивідуальних герметичних упаковках та нестерильний лейкопластир) в окремій картонній коробці.
Одна картонна коробка з препаратом, розчинником, пристроєм для додавання розчинника та одна картонна коробка з набором для внутрішньовенного введення складені разом та скріплені стрічкою.
Флакони з порошком по 250 МО та 500 МО виготовлені з прозорого безбарвного скла ( І тип, Євр. Фарм.), флакони з порошком по 1000 МО з прозорого безбарвного скла ( ІІ тип, Євр. Фарм.), укупорені пробкою з бромбутилового каучуку та обкатані алюмінієвими ковпачками з пластиковим диском. Флакони з розчинником виготовлені з прозорого безбарвного скла (I тип, Євр. Фарм.).
ВИРОБНИК:
CSL Behring GmbH, Emil-von-Behring-Straβe 76, 35041 Marburg, Hessen, Germany
ЦСЛ Берінг ГмбХ, Еміль-фон-Берінг-Штрассе 76, 35041 Марбург, Гессен, Німеччина.
УМОВИ ВІДПУСКУ: за рецептом.
У випадку підозри на побічну дію (ускладнення) після застосування МІБП необхідно направити термінове повідомлення до: Управління лікарських засобів та медичної продукції МОЗ України (01021, м. Київ, вул. Грушевського, 7, тел. (044)253-61-94); Державного підприємства „Державний експертний центр Міністерства охорони здоров’я України” (03151, м. Київ, вул. Ушинського, 40, тел. (044)393-75-86) та на адресу виробника).
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Coagulation factor VIII - Фактор коагуляции крови человека VIII |
| Код АТХ | B02BD02 |
| Форма выпуска | порошок |
- Адвейт фактор коагуляции крови человека viii рекомбинантный (октоког альфа) БАКСТЕР АГ/Baxter BioScience Manufacturing Sarl/Бакстер С.А., Австрія/Швейцарія/Бельгія
- Бериате 1000 МО ЦСЛ Берінг ГмбХ, Німеччина
- Бериате 500 МО ЦСЛ Берінг ГмбХ, Німеччина
- Октанат ОКТАФАРМА Фармацевтика Продуктіонсгенс. м.б.Х. (виробництво за повним циклом)/ОКТАФАРМА С.А.С. (виробництво за повним циклом)/ОКТАФАРМА АБ (виробництво за повним циклом)/ОКТАФАРМА ГмбХ, Дессау (вторинне пакування), Австрія/Франція/Швеція/Німеччина
- Рекомбинант фактор коагуляции крови человека viii, рекомбинантный (октоког альфа) Бакстер Хелскеа Корпорейшн/Бакстер С.А., США/Бельгія
- Рефакто-Af Ваєт Фарма С.А./Ветер Фарма-Фертигунг ГмбХ і Ко КГ ( виробник розчинника), Іспанія/Німеччина




 Оригинальные препараты компании «Здоровье» на страже здоровья
Оригинальные препараты компании «Здоровье» на страже здоровья
 Гепатит С: лечится или нет?
Гепатит С: лечится или нет?
 Алкогольный гепатит – болезнь от человеческих слабостей
Алкогольный гепатит – болезнь от человеческих слабостей
 Гепатит А: профилактика и лечение
Гепатит А: профилактика и лечение