Пегасис инструкция, аналоги и состав
| Показания: | Хронічний гепатит СДорослі пацієнтиПегасіс® у комбінації з іншими лікарськими засобами показаний для лікування хронічного гепатиту С з компенсованим захворюванням печінки (див. розділи «Спосіб застосування та дози», «Особливості застосування» та «Фармакологічні властивості»).Про специфічну активність щодо генотипу вірусу гепатиту С див. розділ «Спосіб застосування та дози» та «Фармакологічні властивості».Діти віком від 5 років Лікування хронічного гепатиту С у раніше не лікованих дітей і підлітків віком від 5 років із позитивним аналізом сироватки на РНК вірусу гепатиту С (ВГС).Приймаючи рішення про лікування в дитячому віці, слід врахувати пригнічення росту, індуковане комбінованою терапією. Невідомо, чи пригнічення росту є оборотним. Рішення про призначення лікування слід приймати щодо кожного пацієнта індивідуально (див. розділ «Особливості застосування»).Хронічний гепатит ВЛікування хронічного гепатиту В, HВеAg-позитивного і HВeAg-негативного, у дорослих пацієнтів з компенсованим ураженням печінки і ознаками вірусної реплікації, підвищеною активністю АЛТ і гістологічно підтвердженим запаленням печінки та/або фіброзом (див. розділи «Особливості застосування» та «Фармакологічні властивості»). |
| Форма випуска: | Розчин для ін'єкцій, 90 мкг/0,5 мл у попередньо наповненому шприці № 1 |
| Производитель, страна: | Ф. Хоффманн-Ля Рош Лтд (виробництво нерозфасованої продукції, первинне та вторинне пакування, випробування контролю якості, випуск серії), Швейцарія |
| Действующее вещества: | 1 попередньо наповнений шприц містить 90 мкг пегінтерферону альфа-2а |
| МНН: | Peginterferon alfa-2a - Пег-интерферон альфа-2а |
| Регистрация: | UA/14223/01/01з 03.03.2015 по 03.03.2020. Приказ 880 від 18.12.2015 |
| Код АТХ: |
Склад:
діюча речовина: пегінтерферон альфа-2а;
1 попередньо наповнений шприц містить 90 мкг пегінтерферону альфа-2а;
допоміжні речовини: натрію хлорид; спирт бензиловий; натрію ацетат, тригідрат;кислота оцтова льодяна; полісорбат 80; натрію ацетат, тригідрат, 10 % розчин до рН 6,0 (додається тільки за необхідності); кислота оцтова, 10% розчин до рН 6,0 (додається тільки за необхідності); вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозора рідина від безбарвного до світло-жовтого кольору.
Фармакотерапевтична група.
Імуностимулятори, інтерферони, пегінтерферон альфа-2а.
Код АТХ. L03A B11.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Пегінтерферон альфа-2а являє собою ковалентний кон'югат білка інтерферону альфа-2а, отриманого за допомогою технології рекомбінантної ДНК в Escherichia coli, із ПЕГ-реагентом (біс-монометоксиполіетиленгліколем). Іn vitro Пегасіс® проявляє противірусні та антипроліферативні властивості, що є характерними для інтерферону альфа-2а. Інтерферон альфа-2а кон’югований з біс-монометоксиполіетиленгліколем із ступенем заміщення одного моля полімеру одним молем протеїну. Середня молекулярна маса сполуки становить приблизно 60 000, близько 20 000 припадає на білкову складову.
У пацієнтів з хронічним гепатитом С (ХГС) зниження рівня РНК вірусу гепатиту С (ВГС) при відповіді на терапію препаратом Пегасіс® відбувається у дві фази. Початкове зниження відбувається через 24-36 годин після введення першої дози препарату Пегасіс®, друга фаза зниження триває протягом наступних 4-16 тижнів у пацієнтів, у яких вдалося досягти стійкої вірусологічної відповіді.
Рибавірин не чинив значного впливу на початкову вірусну кінетику в перші 4-6 тижнів у пацієнтів, які застосовували рибавірин у комбінації з пегільованим інтерфероном альфа-2а чи інтерфероном альфа.
Фармакокінетика.
Всмоктування. Після однократного підшкірного введення 180 мкг пегінтерферону альфа-2а здоровим особам препарат визначається в сироватці крові через 3-6 годин. Через 24 години концентрація в сироватці крові досягає 80 % від максимальної. Всмоктування пегінтерферону альфа-2а тривале, максимальні концентрації у сироватці крові відзначаються через 72-96 годин після введення препарату. Абсолютна біодоступність пегінтерферону альфа-2а становить 84 % і аналогічна такій у інтерферону альфа-2а.
Розподіл. Пегінтерферон альфа-2а виявляється переважно в крові і позаклітинній рідині. Об’єм розподілу у рівноважному стані (Vss) після внутрішньовенного введення становить 6-14 л. По даним мас-спектрометрії, розподіл по тканинам і ауторадіолюмінографії, які отримані в дослідженнях на щурах, пегінтерферон альфа-2а виявляється у високих концентраціях в крові і також в печінці, нирках і кістковому мозку.
Метаболізм. Особливості метаболізму препарату Пегасіс® охарактеризовані не повністю. Однак дослідження на щурах свідчать, що радіомаркований препарат виводиться переважно нирками.
Виведення. Системний кліренс пегінтерферону альфа-2а у людини у 100 разів нижчий, ніж аналогічний показник для інтерферону альфа-2а. Після внутрішньовенного введення термінальний період напіввиведення у здорових добровольців становить близько 60-80 годин у порівнянні зі стандартним інтерфероном – 3-4 години. Після підшкірного введення термінальний період напіввиведення становить близько 160 годин (від 84 до 353 годин). Термінальний період напіввиведення може відображати не лише фазу виведення сполуки, але також і стійку абсорбцію препарату Пегасіс®.
При введенні препарату Пегасіс® 1 раз на тиждень спостерігається дозозалежне збільшення експозиції препарату у здорових добровольців і у пацієнтів з хронічним гепатитом В або С. У хворих хронічним гепатитом В або С через 6-8 тижнів терапії пегінтерфероном альфа-2а один раз на тиждень досягається рівноважна концентрація, яка в 2-3 рази вища, ніж після однократного введення. Після 8-го тижня лікування при введенні препарату один раз на тиждень подальшої кумуляції не відбувається. Через 48 тижнів терапії співвідношення максимальної і мінімальної концентрації становить 1,5-2,0. Концентрації препарату Пегасіс® у сироватці крові підтримуються протягом тижня (168 годин) після введення.
Фармакокінетика в особливих групах хворих
Хворі з порушенням функції нирок
Порушення функції нирок асоціюється з незначним зниженням кліренсу і збільшенням періоду напіввиведення. У пацієнтів з кліренсом креатиніну 20-40 мл/хв відмічається зниження кліренсу пегінтерферону альфа-2а на 25% у порівнянні з пацієнтами без порушення функції нирок. У пацієнтів з термінальною стадією хронічної ниркової недостатності, які отримують сеанси гемодіалізу, відмічається зниження кліренсу пегінтерферону альфа-2а на 25-45%, і експозиція препарату після дози 135 мкг подібна до експозиції, відзначеної у пацієнтів з нормальною нирковою функцією після дози 180 мкг.
Стать
Фармакокінетичні показники препарату Пегасіс® у жінок і чоловіків після одноразової підшкірної ін’єкції були порівнянними.
Діти
В популяційному фармакокінетичному дослідженні (NR16141) 14 дітей віком від 2 до 8 років з хронічним гепатитом С отримували монотерапію препаратом Пегасіс® у дозі: 180 мгк × площа поверхні тіла/1,73 м2. Фармакокінетична модель, розроблена на основі результатів цього дослідження, показала лінійний вплив площі поверхні тіла на явний кліренс препарату у дітей з вивченим віковим діапазоном. Тому чим менша площа поверхні тіла, тим менше кліренс препарату і вище результуюча експозиція. Середня прогнозована експозиція (AUC) під час інтервалів між застосуванням доз препарату на 25-70% вища за таку у дорослих, які отримують фіксовану дозу 180 мкг.
Хворі літнього віку
У пацієнтів віком від 62 років всмоктування препарату Пегасіс® після одноразової підшкірної ін’єкції 180 мкг було сповільненим (однак стійким) у порівнянні з молодими здоровими добровольцями (tmax 115 годин у порівнянні з 82 годинами). Площа під кривою «концентрація – час» (AUC) дещо збільшується у пацієнтів віком від 62 років (1663 у порівнянні з 1295 нг × год/мл), однак максимальні концентрації у молодих і літніх пацієнтів були однакові (9,1 і 10,3 нг/мл відповідно). Дані щодо експозиції, фармакодинамічної відповіді і переносимості свідчать про те, що зниження початкової дози препарату для таких пацієнтів не потрібне.
Хворі з порушенням функції печінки
Фармакокінетика препарату Пегасіс® у здорових осіб і хворих на гепатит С або В однакова. У хворих з цирозом (клас А за шкалою Чайлда–П’ю) фармакокінетичні характеристики такі ж, як у хворих без цирозу.
Місце ін’єкції
Підшкірне введення препарату Пегасіс® слід обмежити ділянкою передньої черевної стінки та стегон, оскільки ступінь всмоктування, на основі AUC, була на 20-30% вищою при ін’єкції саме в ці ділянки. Концентрація препарату була нижча в дослідженнях, у яких Пегасіс®вводили підшкірно в ділянку плеча.
Клінічні характеристики.
Показання.
Хронічний гепатит С
Дорослі пацієнти
Пегасіс® у комбінації з іншими лікарськими засобами показаний для лікування хронічного гепатиту С з компенсованим захворюванням печінки (див. розділи «Спосіб застосування та дози», «Особливості застосування» та «Фармакологічні властивості»).
Про специфічну активність щодо генотипу вірусу гепатиту С див. розділ «Спосіб застосування та дози» та «Фармакологічні властивості».
Діти віком від 5 років
Лікування хронічного гепатиту С у раніше не лікованих дітей і підлітків віком від 5 років із позитивним аналізом сироватки на РНК вірусу гепатиту С (ВГС).
Приймаючи рішення про лікування в дитячому віці, слід врахувати пригнічення росту, індуковане комбінованою терапією. Невідомо, чи пригнічення росту є оборотним. Рішення про призначення лікування слід приймати щодо кожного пацієнта індивідуально (див. розділ «Особливості застосування»).
Хронічний гепатит В
Лікування хронічного гепатиту В, HВеAg-позитивного і HВeAg-негативного, у дорослих пацієнтів з компенсованим ураженням печінки і ознаками вірусної реплікації, підвищеною активністю АЛТ і гістологічно підтвердженим запаленням печінки та/або фіброзом (див. розділи «Особливості застосування» та «Фармакологічні властивості»).
Протипоказання.
Підвищена чутливість до діючої речовини, інтерферонів альфа або будь-якої з допоміжних речовин (див. розділ «Склад»).
Аутоімунний гепатит.
Тяжке порушення функції печінки або декомпенсований цироз печінки.
Наявність в анамнезі тяжкої хвороби серця, в тому числі нестабільної або неконтрольованої хвороби серця у попередні шість місяців.
Цироз із сумою балів ≥6 за шкалою Чайлда–П’ю у пацієнтів з коінфекцією ВІЛ–ВГС, за умови, що підвищення цього показника не пов’язане з непрямою гіпербілірубінемією внаслідок прийому препаратів, таких як атазанавір і індинавір.
Комбіноване лікування препаратом Пегасіс® та телбівудином (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Протипоказано новонародженим та дітям до 3 років, оскільки препарат містить як допоміжну речовину спирт бензиловий (див. розділ «Особливості застосування»).
Протипоказано дітям з тяжкими психічними розладами, особливо тяжкою депресією, суїцидальним настроєм і суїцидальними спробами, в тому числі в анамнезі.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження взаємодії проводилися лише у дорослих.
Терапія препаратом Пегасіс® 180 мкг/тиждень протягом 4 тижнів не впливала на фармакокінетичний профіль толбутаміду, мефенітоїну, дапсону і дебризохіну у здорових чоловіків-добровольців, що свідчить про те, що Пегасіс®in vivo не впливає на метаболічну активність ізоферментів цитохрому Р450 2С9, 2С19, 2D6 і 3А4.
У тому самому дослідженні відзначалося збільшення AUC теофіліну (маркера активності цитохрому Р450 1А2) на 25%, що свідчить про те, що Пегасіс® є інгібітором активності цитохрому Р450 1А2. При супутньому застосуванні теофіліну та препарату Пегасіс® слід контролювати концентрації теофіліну у сироватці крові та належним чином відкоригувати дозу цього препарату. Максимального рівня взаємодія між теофіліном та препаратом Пегасіс® досягає, імовірно, більше ніж через 4 тижні застосування препарату Пегасіс®.
Пацієнти, інфіковані лише вірусом гепатиту С або вірусом гепатиту В.
У дослідженні фармакокінетики у 24 пацієнтів з ХГС, які супутньо застосовували метадон у підтримувальних дозах (середня – 95 мг; інтервал доз: 30-150 мг), лікування препаратом Пегасіс® у дозі 180 мкг підшкірно один раз на тиждень протягом 4 тижнів призводило до зростання середніх рівнів метадону на 10% та 15% порівняно з вихідним значенням. Клінічна значущість цих даних невідома; попри те за пацієнтами слід спостерігати для виявлення можливих симптомів токсичного впливу метадону. Особливо слід зважати на ризик подовження інтервалу QTc у пацієнтів, які приймають метадон у високих дозах.
Рибавірин, інгібуючи інозин-монофосфат-дегідрогеназу, може втручатися у метаболізм азатіоприну; це призводить до акумуляції 6-метилтіоінозин-монофосфатази (6-МТІМФ), що супроводжується мієлотоксичністю у пацієнтів, які лікуються азатіоприном. Слід уникати супутнього застосування пегінтерферону альфа-2а і рибавірину з азатіоприном. В окремих випадках, коли користь від супутнього застосування рибавірину та азатіоприну виправдовує можливий ризик, рекомендується пильно контролювати гематологічні показники протягом терапії азатіоприном для виявлення можливої мієлотоксичності, і у разі її виникнення припинити застосування цих препаратів.
Результати досліджень фармакокінетики в рамках основних досліджень фази ІІІ не свідчили про фармакокінетичну взаємодію між ламівудином та препаратом Пегасіс® у пацієнтів з ХГВ або препаратом Пегасіс® та рибавірином у пацієнтів з ХГС.
У клінічному дослідженні комбінації телбівудину в дозі 600 мг на добу з пегільованим інтерфероном альфа-2а в дозі 180 мкг один раз на тиждень підшкірно у пацієнтів з ХГВ було встановлено, що така комбінація асоційована з підвищеним ризиком розвитку периферичної нейропатії. Механізм цього явища невідомий; тому супутнє застосування телбівудину та інших інтерферонів (пегільованих чи стандартних) також може супроводжуватися підвищеним ризиком. До того ж користь від застосування телбівудину з інтерфероном альфа (пегільованим або стандартним) на цей час не встановлена. Тому комбінація препарату Пегасіс® з телбівудином протипоказана.
Коінфекція ВІЛ–ВГС.
Не відзначалося виражених ознак міжлікарської взаємодії у 47 пацієнтів з коінфекцією ВІЛ–ВГС, які взяли участь у 12-тижневому дослідженні фармакокінетики з вивчення впливу рибавірину на внутрішньоклітинне фосфорилювання деяких нуклеозидних інгібіторів зворотної транскриптази (ламівудину та зидовудину або ставудину). Однак через значну варіабельність довірчі інтервали були досить широкими. Супутнє застосування нуклеозидних інгібіторів зворотної транскриптази (НІЗТ) не впливало на плазмові експозиції рибавірину. Не рекомендується супутнє застосування рибавірину та диданозину. Експозиції диданозину або його активного метаболіту (дидеоксіаденозин-5’-трифосфату) in vitro зростали при супутньому застосуванні диданозину з рибавірином. На фоні прийому рибавірину відзначені випадки летальної печінкової недостатності, а також периферичної нейропатії, панкреатиту та симптоматичної гіперлактатемії/лактацидозу.
Загострення спричиненої рибавірином анемії відзначалося при застосуванні зидовудину як складової терапії ВІЛ, хоча точний механізм цього явища досі не з'ясований. Через підвищений ризик анемії не рекомендується застосовувати рибавірин супутньо із зидовудином. Слід розглянути альтернативу зидовудину у складі комбінованої антиретровірусної терапії, якщо таку вже призначено. Це особливо важливо для пацієнтів із спричиненою зидовудином анемією в анамнезі.
Особливості застосування.
Нейропсихічні розлади.
У деяких хворих, як під час лікування препаратом Пегасіс®, так і протягом 6 місяців після припинення лікування, спостерігалися тяжкі побічні реакції з боку центральної нервової системи (ЦНС), зокрема: депресія, суїцидальний настрій і суїцидальні спроби. При терапії інтерферонами альфа спостерігалися й інші побічні реакції з боку ЦНС, у тому числі агресивна поведінка, іноді направлена проти інших людей (наприклад гомоцидні ідеї), біполярні розлади, манія, сплутаність свідомості та зміна психічного стану. Слід уважно спостерігати за станом пацієнтів для виявлення симптомів психічних розладів. Якщо такі симптоми виникають, то лікар повинен пам’ятати про потенційну серйозність вказаних небажаних явищ і необхідність відповідного лікування. У випадку, якщо симптоми психічних розладів зберігаються або посилюються, виявляється суїцидальний настрій, рекомендується відмінити терапію препаратом Пегасіс® і призначити відповідне лікування.
Пацієнти з тяжкими психічними захворюваннями (у тому числі в анамнезі): якщо приймається рішення про необхідність лікування препаратом Пегасіс® пацієнтів з тяжкими психічними захворюваннями (в тому числі в анамнезі), то терапію слід починати лише після проведення відповідного обстеження і лікування психічного розладу.
Лікування препаратом Пегасіс® протипоказане дітям та підліткам з тяжкими психічними розладами, в тому числі в анамнезі (див. розділ «Протипоказання»).
Пацієнти, які вживають наркотики/ зловживають психоактивними речовинами: при лікуванні інтерферонами альфа пацієнти, які інфіковані ВГС і одночасно мають розлади, пов’язані із зловживанням психоактивними речовинами (алкоголь, каннабіс, інші), мають підвищений ризик розвитку психічних розладів або загострення вже існуючих психічних розладів. Якщо приймається рішення про призначення інтерферонів альфа, перед початком лікування слід ретельно оцінити наявність супутніх психічних розладів і можливість вживання пацієнтом інших психоактивних речовин і взяти ситуацію під контроль. При необхідності слід розглянути питання про міждисциплінарний підхід, включаючи залучення психіатра або нарколога для обстеження, лікування і спостереження пацієнтів. За такими пацієнтами слід ретельно спостерігати під час лікування і навіть після завершення лікування. Рекомендується раннє втручання для запобігання повторного виникнення психічних розладів і вживання пацієнтом психоактивних речовин.
Ріст і розвиток (діти і підлітки): під час курсу лікування препаратом Пегасіс® з рибавірином, який триває до 48 тижнів, у пацієнтів віком від 5 до 17 років часто спостерігається втрата ваги і пригнічення росту (див. розділ «Побічні реакції»).
Очікувану користь лікування слід ретельно оцінювати в індивідуальному порядку враховуючи результати клінічних досліджень з безпеки для дітей і підлітків (див. розділ «Побічні реакції»).
Важливо враховувати, що комбінована терапія індукує пригнічення росту протягом лікування, і оборотність цього явища не визначена.
Цей ризик слід оцінювати із врахуванням особливостей захворювання дитини, таких як наявність підтверджень прогресування захворювання (зокрема фіброзу), супутніх захворювань, які можуть сприяти прогресуванню захворювання (таких як коінфекція ВІЛ), а також прогностичних факторів відповіді (генотип ВГС і вірусне навантаження).
При можливості дитину слід лікувати після пубертатного стрибка росту з метою зменшення ризику пригнічення росту. Немає даних щодо тривалого впливу на статеве дозрівання.
З метою покращення відстежуваності біологічних лікарських засобів торгова назва застосованого препарату має бути чітко вказана у медичній документації пацієнта.
Лабораторні показники до і під час лікування
До початку лікування препаратом Пегасіс® хворим рекомендується пройти стандартні загальні клінічні і біохімічні аналізи крові.
Пегасіс® можна призначати при таких лабораторних показниках: число тромбоцитів ³ 90 000 клітин у 1 мкл, абсолютне число нейтрофілів ≥ 1500 клітин у 1 мкл, належний контроль функції щитоподібної залози (ТТГ та Т4).
В клінічних дослідженнях при лікуванні препаратом Пегасіс® знижувалося абсолютне число нейтрофілів (АЧН), зазвичай в перші 2 тижні терапії. Прогресуюче зниження АЧН через 8 тижнів терапії зустрічалося нечасто. Зменшення АЧН було оборотним після зменшення дози або відміни препарату, у більшості пацієнтів показник АЧН досягав нормального значення через 8 тижнів і повертався до початкового значення в усіх пацієнтів приблизно через 16 тижнів.
При лікуванні препаратом Пегасіс® спостерігалося зменшення числа тромбоцитів, яке протягом періоду спостереження після лікування поверталося до початкового рівня. У деяких випадках може потребуватися зміна дози.
В клінічних дослідженнях при комбінованому лікуванні препаратом Пегасіс® і рибавірином виникнення анемії (гемоглобін ≤ 10 г/дл) спостерігалося у 15 % пацієнтів з хронічним гепатитом С. Частота виникнення анемії залежить від тривалості курсу терапії і дози рибавірину. У жінок ризик розвитку анемії вищий.
Як і при застосуванні інших інтерферонів, необхідно обережно призначати препарат Пегасіс® у комбінації з іншими потенційно мієлотоксичними препаратами.
У медичній літературі описане виникнення панцитопенії (анемія, нейтропенія, тромбоцитопенія) і пригнічення кісткового мозку протягом 3-7 тижнів після супутнього застосування рибавірину та азатіоприну. Вказані прояви мієлотоксичності були оборотними протягом 4-6 тижнів після відміни противірусної терапії ХГС і супутньо призначеного азатіоприну і не повторювалися після продовження лікування окремо кожним із препаратів (див. розділ «Взаємодія з іншими лікарськими засобами»).
Застосування комбінації препарату Пегасіс® з рибавірином пацієнтам з хронічним гепатитом С, у яких попереднє лікування було припинено через небажані явища з боку крові досліджено недостатньо. Лікарям, які призначають лікування таким хворим, слід ретельно зважити користь та ризики, пов'язані з повторною терапією.
Ендокринна система: при застосуванні інтерферонів альфа, в тому числі препарату Пегасіс®, спостерігалися порушення функції щитоподібної залози або погіршення перебігу вже наявних захворювань щитоподібної залози. Перед початком лікування препаратом Пегасіс® слід визначити рівні ТТГ і Т4. Лікування препаратом Пегасіс® можна почати або продовжити, якщо рівень ТТГ може підтримуватися в межах нормальних значень медикаментозно. При виникненні клінічних симптомів дисфункції щитоподібної залози необхідно визначати ТТГ під час лікування. Як і при терапії іншими інтерферонами, при застосуванні препарату Пегасіс®спостерігалися гіпо- і гіперглікемія, розвиток цукрового діабету. Пацієнти з вище перерахованими станами, які не піддаються адекватній корекції, не повинні починати терапію препаратом Пегасіс® або комбіновану терапію Пегасіс® плюс рибавірин, а у випадку розвитку подібних станів під час лікування терапію слід припинити.
Серцево-судинна система: артеріальна гіпертензія, суправентрикулярні аритмії, застійна серцева недостатність, біль у грудній клітці та інфаркт міокарда асоціювалися з терапією інтерферонами альфа, у тому числі препаратом Пегасіс®. Пацієнтам із серцево-судинною патологією перед початком терапії рекомендується проводити електрокардіологічний контроль. У випадку погіршення серцево-судинного статусу терапію слід перервати або відмінити. У пацієнтів із серцево-судинними захворюваннями анемія може призвести до необхідності зменшити дозу або припинити прийом рибавірину.
Порушення функції печінки. При розвитку печінкової недостатності Пегасіс® слід відмінити. Як і при терапії іншими інтерферонами альфа, збільшення активності АЛТ порівняно з початковим значенням спостерігалося під час терапії препаратом Пегасіс®, включаючи пацієнтів з вірусологічною відповіддю. При прогресуючому або клінічно значимому збільшенні активності АЛТ, незважаючи на зменшення дози, або якщо це збільшення супроводжується підвищенням рівня прямого білірубіну, терапію варто відмінити.
На відміну від ХГС, при ХГВ загострення захворювання печінки зустрічається нерідко і супроводжується минущим і потенційно значимим підвищенням активності АЛТ. В клінічних дослідженнях раптове виражене підвищення активності АЛТ при терапії препаратом Пегасіс® у пацієнтів з ХГВ супроводжувалося легкими змінами лабораторних показників без ознак декомпенсації функції печінки. У половині випадків раптового підвищення активності АЛТ, що в 10 разів перевищувала межу норми, доза препарату Пегасіс® була зменшена або терапія була тимчасово відмінена до нормалізації показника, у той час як у другої половини пацієнтів терапію продовжували без змін. Рекомендуєтся частіше контролювати функцію печінки в усіх випадках.
Реакції гіперчутливості. При терапії інтерфероном альфа рідко спостерігаються серйозні реакції гіперчутливості негайного типу (наприклад, кропив’янка, ангіоневротичний набряк, бронхоспазм, анафілаксія). У таких випадках препарат відміняють і негайно призначають відповідну медикаментозну терапію. Скороминучий висип не потребує відміни терапії.
Аутоімунні захворювання. При лікуванні інтерферонами альфа описане виникнення аутоантитіл і аутоіммунних захворювань. В групі підвищеного ризику знаходяться пацієнти із схильністю до розвитку аутоіммунних захворювань. Пацієнтів із ознаками або симптомами, які схожі з ознаками аутоіммунних захворювань, слід ретельно обстежити і повторно оцінити співвідношення користі від продовження лікування інтерфероном і ризику.
У пацієнтів з вірусним гепатитом С, які отримували лікування інтерфероном, спостерігалися випадки синдрому Фогта–Коянагі–Харади (Vogt-Koyanagi-Harada, (VKH) – увеаменінгеальний синдром). Синдром VKH – гранулематозне запальне захворювання, яке вражає очі, слухову систему, оболонки головного мозку і шкіру. При підозрі на синдром VKH противірусне лікування слід відмінити і розглянути питання про призначення кортикостероїдів.
Лихоманка та інфекції. Хоча підвищення температури може бути обумовлене грипоподібним синдромом, що часто відзначається на фоні інтерферонотерапії, необхідно виключити інші причини лихоманки (зокрема серйозні бактеріальні, вірусні і грибкові інфекції), особливо у хворих з нейтропенією. При лікуванні інтерферонами альфа, у тому числі препаратом Пегасіс®, спостерігалися інфекційні захворювання (бактеріальні, вірусні, грибкові). При виникненні тяжких інфекційних ускладнень слід відмінити лікування препаратом Пегасіс® та призначити відповідну терапію.
Офтальмологічні зміни. При лікуванні препаратом Пегасіс® зрідка відзначалася ретинопатія з геморагією сітківки, а також “ватні” плями на сітківці, набряк диска зорового нерва, нейропатія зорового нерва та обструкція артерії чи вени сітківки, що може призводити до втрати зору. Всім хворим перед призначенням терапії необхідно провести офтальмологічне обстеження для виявлення патології очного дна. При появі скарг на погіршення гостроти або звуження полів зору слід негайно провести офтальмологічне обстеження. Хворим (дорослим та дітям) з супутніми захворюваннями органів зору (наприклад діабетична або гіпертонічна ретинопатія) необхідно проводити додаткові огляди під час терапії препаратом Пегасіс®. Лікування препаратом Пегасіс® необхідно відмінити при виникненні або загостренні офтальмологічних розладів.
Зміни з боку органів дихання. Під час терапії препаратом Пегасіс® виникала легенева симптоматика, включаючи задишку, легеневі інфільтрати, пневмонію і пневмоніт. При наявності персистувальних (стійких) легеневих інфільтратів, інфільтратів незрозумілого генезу або при порушенні функції дихання терапію слід відмінити.
Зміни з боку шкіри. Застосування інтерферонів альфа асоціювалося із загостренням або індукуванням псоріазу і саркоїдозу. Хворим псоріазом Пегасіс® варто призначати з обережністю, а при появі або загостренні захворювання слід розглянути питання про відміну терапії.
Трансплантація. Безпека та ефективність застосування комбінованої схеми Пегасіс® плюс рибавірин не встановлена для пацієнтів з трансплантацією печінки та інших органів. При застосуванні препарату Пегасіс®, як у монотерапії чи в комбінації з рибавірином, спостерігалися випадки відторгнення трансплантата печінки і нирок.
Коінфекція ВІЛ-ВГС. Перед початком лікування слід уважно ознайомитися з можливими побічними ефектами антиретровірусних препаратів, які пацієнт буде приймати разом з препаратами для терапії ХГС. У пацієнтів, які одночасно отримували ставудин і інтерферон з рибавірином чи без нього, частота виникнення панкреатиту і/або лактатацидозу становила 3%. Пацієнти з коінфекцією ВІЛ-ВГС, які отримують високоактивну антиретровірусну терапію (ВААРТ), мають ризик лактатацидозу. Тому необхідно дотримуватися обережності при додаванні препарату Пегасіс® і рибавірину до ВААРТ.
У пацієнтів з коінфекцією і вираженим цирозом, які отримують ВААРТ, при комбінованій терапії рибавірином і інтерферонами, включаючи Пегасіс®, існує підвищений ризик розвитку летальної печінкової недостатності. Початкові ознаки, які можуть бути пов’язані з печінковою декомпенсацією у пацієнтів з коінфекцією і цирозом, включають в себе: підвищений сироватковий білірубін, знижений рівень гемоглобіну, підвищену лужну фосфатазу або знижений рівень тромбоцитів. Лікування диданозином (ddI) також може спричиняти печінкову декомпенсацію у таких пацієнтів.
Одночасне застосування рибавірину і зидовудину не рекомендується через підвищений ризик виникнення анемії.
Необхідний ретельний моніторинг на предмет виявлення симптомів печінкової декомпенсації (включаючи асцит, енцефалопатію, кровотечу з варикозно розширених вен, порушення синтетичної функції печінки; показник за шкалою Чайльда–П’ю ≥7) у пацієнтів з коінфекцією під час лікування. Показник за шкалою Чайльда–П’ю не завжди достовірно відображає наявність печінкової декомпенсації і може змінюватися під впливом таких факторів, як непряма гіпербілірубінемія, гіпоальбумінемія внаслідок медикаментозної терапії. При розвитку печінкової декомпенсації терапію препаратом Пегасіс® слід негайно відмінити.
Щодо пацієнтів з коінфекцією ВІЛ-ВГС з кількістю CD4+ - лімфоцитів менше 200 клітин/мкл недостатньо даних з ефективності і безпеки застосування препарату Пегасіс®. Слід виявляти обережність при призначенні препарату Пегасіс® пацієнтам з низьким рівнем CD4+- лімфоцитів.
Стоматологічні зміни.У пацієнтів, які отримують комбіновану терапію препаратом Пегасіс® і рибавірином, спостерігалася патологія зубів і пародонту, яка може призвести до втрати зубів. Окрім цього, тривалий курс лікування препаратом Пегасіс® і рибавірином може викликати сухість порожнини рота, що руйнівним чином діє на зуби і слизову оболонку ротової порожнини. Пацієнтам слід ретельно чистити зуби двічі на день та регулярно проходити обстеження у стоматолога. У деяких пацієнтів може виникати блювання, після якого рекомендується ретельно полоскати рота.
Застосування пегінтерферону як тривалої підтримувальної монотерапії (застосування поза зареєстрованими показаннями)
У рандомізованому контрольованому дослідженні (HALT-C) у пацієнтів з ХГС і фіброзом печінки різної стадії, які не відповіли на попереднє лікування, при монотерапії препаратом Пегасіс® у дозі 90 мкг/тиждень протягом 3,5 років не спостерігалося значного скорочення швидкості прогресування фіброзу або пов’язаних з ним клінічних подій.
Допоміжні речовини.Пегасіс® містить спирт бензиловий. Препарат не можна застосовувати недоношеним дітям та новонародженим. Спирт бензиловий може спричиняти токсичні реакції і анафілактоїдні реакції у новонароджених і дітей віком до 3 років.
Утилізація невикористаного препарату та препарату із простроченим терміном придатності: надходження препарату у зовнішнє середовище необхідно звести до мінімуму. Препарат не слід викидати у стічні води і побутові відходи. Для утилізації необхідно використовувати так звану «систему збору відходів» за наявності такої.
Застосування у період вагітності або годування груддю.
Вагітність
Даних щодо застосування пегінтерферону альфа-2а вагітним жінкам немає або ці дані є обмеженими. У дослідженнях інтерферону альфа-2а у тварин було виявлено токсичний вплив на репродуктивну функцію, потенційний ризик для людини невідомий. Пегасіс® слід застосовувати в період вагітності, лише якщо потенційна користь виправдовує можливий ризик для плода.
Годування груддю
Невідомо чи пегінтерферон альфа-2а/ метаболіти екскретуються у грудне молоко людини. Через можливість побічних реакцій у немовлят грудне вигодовування слід припинити перед початком лікування.
Фертильність
Немає даних щодо впливу пегінтерферону альфа-2а на фертильність у жінок. У самок мавп спостерігалося подовження менструального циклу при застосування пегінтерферону альфа-2а.
Застосування з рибавірином
Значний тератогенний та/або ембріоцидний ефект спостерігався в усіх видів тварин, яким вводили рибавірин. Застосування рибавірину в період вагітності протипоказане. Особливої обережності слід дотримуватися для уникнення вагітності жінкам, які приймають Пегасіс® у комбінації з рибавірином, або партнеркам чоловіків, які застосовують таку комбінацію препаратів. Жінкам, здатним до народження дітей, слід використовувати ефективні засоби контрацепції протягом періоду лікування та ще 4 місяці після його завершення. Пацієнти-чоловіки або їх партнерки повинні застосовувати ефективні засоби контрацепції протягом лікування та 7 місяців після його завершення (див. інструкцію для медичного застосування рибавірину).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Пегасіс® чинить незначний вплив на здатність керування автотранспортом або працювати з механізмами. При виникненні запаморочення, сонливості, сплутаності свідомості і слабкості слід утриматися від керування автомобілем або роботи з машинами і механізмами.
Спосіб застосування та дози.
Розчин для ін'єкцій призначено тільки для разового застосування. Перед застосуванням розчин слід перевіряти візуально на наявність часток та зміну кольору.
Лікування повинен розпочинати лише лікар із досвідом лікування хворих на гепатит В або С.
У разі застосування препарату Пегасіс® у комбінації з іншим лікарським засобом, будь ласка, зверніться також до інструкції для медичного застосування цього лікарського засобу. Монотерапія препаратом Пегасіс® показана, лише якщо протипоказання до застосування інших лікарських засобів.
Пегасіс® слід вводити підшкірно, в ділянку передньої черевної стінки чи стегна. В дослідженнях експозиція препарату Пегасіс® зменшувалася після введення в руку.
Пегасіс® розроблений для введення пацієнтом або медичним працівником. Кожен шприц слід застосовувати лише для однієї особи і кожен шприц призначений лише для одноразового застосування.
Хронічний гепатит В (ХГВ): дорослі пацієнти
При HВеAg-позитивному і HВeAg-негативному хронічному гепатиті В рекомендована доза препарату Пегасіс® становить 180 мкг 1 раз на тиждень підшкірно, в ділянку передньої черевної стінки чи стегна, протягом 48 тижнів.
Хронічний гепатит С (ХГС)
Пацієнти, які раніше не отримували лікування
При монотерапії або комбінованій терапії з рибавірином рекомендована доза препарату Пегасіс® становить 180 мкг 1 раз на тиждень підшкірно, в ділянку передньої черевної стінки чи стегна.
Дози рибавірину, що застосовуються у комбінації з препаратом Пегасіс®, наведені у таблиці 1. Застосовувати рибавірин рекомендовано під час їжі.
Тривалість лікування: двохкомпонентна терапія препаратом Пегасіс® і рибавірином
При комбінованій терапії з рибавірином ХГС тривалість терапії і доза рибавірину залежать від генотипу вірусу.
Тривалість терапії пацієнтів з генотипом 1, у яких на 4-му тижні лікування визначається РНК вірусу гепатиту С (РНК ВГС), має становити 48 тижнів, незалежно від початкового вірусного навантаження.
Тривалість терапії протягом 24 тижнів можна розглядати для пацієнтів:
- з генотипом 1 і початковим низьким вірусним навантаженням (≤800 000 МО/мл);
- з генотипом 4, у яких на 4-му тижні результат визначення РНК ВГС негативний і залишається негативним на 24-му тижні.
Однак загалом тривалість лікування протягом 24 тижнів асоціюється з високим ризиком рецидиву у порівнянні з тривалістю лікування 48 тижнів. У таких пацієнтів при вирішенні питання про тривалість лікування необхідно враховувати переносимість комбінованої терапії та додаткові прогностичні фактори, зокрема ступінь фіброзу. З іще більшою обережністю слід підходити до питання про скорочення тривалості терапії у пацієнтів з генотипом 1 і високим початковим вірусним навантаженням (>800 000 МО/мл), у яких через 4 тижні терапії результат визначення РНК ВГС негативний і залишається негативним через 24 тижні лікування, оскільки деякі дані свідчать, що скорочення тривалості терапії може негативно вплинути на стійкість вірусологічної відповіді. У пацієнтів з 2-м та 3-м генотипом, у яких через 4 тижні терапії виявляється РНК ВГС незалежно від початкового рівня вірусного навантаження, тривалість лікування має становити 24 тижні. Можливе скорочення терапії до 16 тижнів в окремих групах пацієнтів з генотипом 2 або 3 з низьким початковим вірусним навантаженням (≤800 000 МО/мл), у яких через 4 тижні терапії результат визначення РНК ВГС негативний і залишається негативним через 16 тижнів. Загалом, у разі 16-тижневого курсу імовірність відповіді на лікування менша, а ризик рецидиву більший, ніж у разі 24-тижневої терапії. У таких пацієнтів при вирішенні питання про тривалість лікування необхідно враховувати переносимість комбінованої терапії та додаткові прогностичні фактори, зокрема ступінь фіброзу. З іще більшою обережністю слід підходити до питання про скорочення тривалості терапії у пацієнтів з генотипом 2 або 3 і високим початковим вірусним навантаженням (>800 000 МО/мл), у яких через 4 тижні терапії результат визначення РНК ВГС негативний, оскільки деякі дані свідчать, що скорочення тривалості терапії може негативно вплинути на стійкість вірусологічної відповіді.
Клінічні дані щодо пацієнтів з генотипом 5 і 6 обмежені, рекомендується комбінована терапія препаратом Пегасіс® і рибавірином (1000-1200 мг/добу) протягом 48 тижнів.
Таблиця 1. Режим дозування препарату Пегасіс® і рибавірину
|
Генотип |
Доза препарату Пегасіс® |
Добова доза рибавірину |
Тривалість лікування |
|
Генотип 1, низьке вірусне навантаження зі ШВВ* |
180 мкг |
<75 кг = 1000 мг ³75 кг = 1200 мг |
24 тижні чи 48 тижнів |
|
Генотип 1, високе вірусне навантаження зі ШВВ* |
180 мкг |
<75 кг = 1000 мг ³75 кг = 1200 мг |
48 тижнів |
|
Генотип 4 зі ШВВ* |
180 мкг |
<75 кг = 1000 мг ³75 кг = 1200 мг |
24 тижні чи 48 тижнів |
|
Генотип 1 чи 4 без ШВВ |
180 мкг |
<75 кг = 1000 мг ³75 кг = 1200 мг |
48 тижнів |
|
Генотип 2, 3, низьке вірусне навантаження зі ШВВ** |
180 мкг |
800 мга |
16 тижніва чи 24 тижні |
|
Генотип 2, 3, високе вірусне навантаження зі ШВВ** |
180 мкг |
800 мг |
24 тижні |
|
Генотип 2, 3, без ШВВ |
180 мкг |
800 мг |
24 тижні |
* Швидка вірусологічна відповідь (ШВВ) – відсутність РНК ВГС при визначенні через 4 тижні і через 24 тижні лікування.
** Швидка вірусологічна відповідь (ШВВ) – негативна РНК ВГС при визначенні через 4 тижні.
Низьке вірусне навантаження – ≤800 000 МО/мл. Високе вірусне навантаження – >800 000 МО/мл.
а На цей час невідомо, чи вища доза рибавірину (наприклад 1000/1200 мг/добу залежно від маси тіла) забезпечує більшу частоту стійкої вірусологічної відповіді, ніж доза 800 мг/добу при скороченні тривалості лікування до 16 тижнів.
Остаточний клінічний ефект скорочення початкового курсу лікування до 16 тижнів замість 24 тижнів невідомий, враховуючи потребу у повторному лікуванні пацієнтів, які не відповіли на лікування, та пацієнтів із рецидивом.
Рекомендована тривалість монотерапії препаратом Пегасіс® становить 48 тижнів.
Лікування хворих, у яких попередня інтерферонотерапія була неефективною
Рекомендована доза препарату Пегасіс® в комбінації з рибавірином становить 180 мкг 1 раз на тиждень. Доза рибавірину становить 1000 мг/добу при масі тіла <75 кг і 1200 мг/добу при масі тіла ≥75 кг. При виявленні вірусу на 12-му тижні лікування терапію слід припинити. Рекомендована загальна тривалість лікування становить 48 тижнів. Рекомендована загальна тривалість лікування пацієнтів з генотипом 1, які не відповіли на попереднє лікування пегільованим інтерфероном і рибавірином, має становити 72 тижні.
Коінфекція ВІЛ-ВГС
180 мкг 1 раз на тиждень як монотерапія або в комбінації з рибавірином протягом 48 тижнів. Доза рибавірину для пацієнтів з генотипом 1 становить 1000 мг/добу при масі тіла <75 кг і 1200 мг/добу при масі тіла ≥75 кг. Доза рибавірину для пацієнтів, інфікованих іншими генотипами, становить 800 мг/добу. Курс лікування тривалістю менше 48 тижнів належним чином не досліджувався.
Тривалість комбінованого лікування препаратом Пегасіс® та іншими лікарськими засобами
Дивись інструкції для медичного застосування лікарських засобів, які застосовуються у комбінації з препаратом Пегасіс®.
Прогнозування ефективності лікування у пацієнтів, які раніше не лікувалися двохкомпонентною терапією препаратом Пегасіс® і рибавірином
У разі ранньої вірусологічної відповіді (зниження вірусного навантаження нижче порога визначення або не менше 2 log10) на 12-му тижні терапії можна прогнозувати досягнення стійкої вірусологічної відповіді (таблиця 2).
Таблиця 2. Прогностична цінність вірусологічної відповіді на 12-му тижні комбінованої терапії в рекомендованому режимі
|
Генотип |
Негативний |
Позитивний |
||||
|
Відсутність відповіді на 12-му тижні |
Відсутність стійкої відповіді |
Прогностична цінність |
Відповідь на 12-му тижні |
Стійка відповідь |
Прогностична цінність |
|
|
Генотип 1 (n=569) |
102 |
97 |
95% (97/102) |
467 |
271 |
58% (271/467) |
|
Генотип 2 і 3 (n=96) |
3 |
3 |
100% (3/3) |
93 |
81 |
87% (81/93) |
Негативне прогностичне значення стійкої відповіді у пацієнтів, які застосовували Пегасіс® у вигляді монотерапії, становило 98%.
Подібне негативне прогностичне значення відмічалося у пацієнтів з коінфекцією ВІЛ-ВГС, які застосовували Пегасіс® окремо або у комбінації з рибавірином (100% (130/130) або 98% (83/85) відповідно). Позитивні прогнозні значення 45% (50/110) та 70% (59/84) відзначалися у пацієнтів, інфікованих ВГС генотипу 1 та 2/3 із супутньою ВІЛ-інфекцією, які одержували комбіноване лікування.
Прогнозованість відповіді та її відсутності у пацієнтів, які раніше отримували лікування двохкомпонентною терапією препаратом Пегасіс® і рибавірином
У хворих, які не відповіли на лікування, при повторному лікуванні протягом 48 або 72 тижнів було показано, що супресія вірусу на 12-му тижні (рівень РНК ВГС неможливо визначити, тобто <50 МО/мл) є прогностичним критерієм досягнення стійкої вірусологічної відповіді. Імовірність недосягнення стійкої вірусологічної відповіді при тривалості лікування 48 або 72 тижні, у випадку відсутності вірусної супресії на тижні 12, становила 96% (363 з 380) та 96% (324 з 339) відповідно. Імовірність досягнення стійкої вірусологічної відповіді при тривалості лікування 48 або 72 тижні, у випадку вірусної супресії на тижні 12, становила 35% (20 з 57) та 57% (57 зі 100) відповідно.
Корекція дози з огляду на небажані реакції
Загальні. Якщо корекція дози потрібна через побічні клінічні або лабораторні реакції середнього і тяжкого ступеня, звичайно буває достатньо знизити дозу до 135 мкг. Однак у деяких випадках потрібно зменшувати дозу до 90 мкг або 45 мкг. Після зменшення вираженості побічних реакцій можна розглядати питання про збільшення дози, аж до початкової (див. розділи «Особливості застосування» та «Побічні реакції»).
Гематологічні (табл. 3). Зменшення дози рекомендується при зниженні числа нейтрофілів менше 750 клітин у 1 мкл. У хворих з абсолютним числом нейтрофілів менше 500 клітин у 1 мкл лікування варто перервати, поки цей показник не перевищить 1000 клітин у 1 мкл. Застосування препарату Пегасіс® слід відновити у дозі 90 мкг, контролюючи число нейтрофілів.
Зменшення дози до 90 мкг рекомендується при зниженні числа тромбоцитів менше 50 000 клітин у 1 мкл. У хворих з абсолютним числом тромбоцитів менше 25 000 клітин у 1 мкл препарат потрібно відмінити.
Рекомендації щодо лікування анемії, яка виникла під час терапії
- Рекомендується зменшити дозу рибавірину до 600 мг/добу (200 мг вранці і 400 мг ввечері) за таких ситуацій:
- гемоглобін знижується до рівня менше 10 г/дл, але залишається вище 8,5 г/дл у пацієнтів без супутньої серцево-судинної патології;
- гемоглобін знижується на 2 г/дл або більше протягом будь-яких 4 тижнів терапії у пацієнтів із стабільним перебігом серцево-судинних захворювань.
Не рекомендується збільшувати дозу рибавірину до початкової.
- Прийом рибавірину необхідно припинити за таких ситуацій:
- гемоглобін знижується до рівня менше 8,5 г/дл у пацієнтів без супутньої серцево-судинної патології;
- рівень гемоглобіну залишається менше 12 г/дл через 4 тижні, незважаючи на зменшення дози, у пацієнтів із стабільним перебігом серцево-судинних захворювань.
Після припинення прийому рибавірину та нормалізації рівня гемоглобіну можливе поновлення його прийому у дозі 600 мг/добу з подальшим підвищенням до 800 мг/добу на розсуд лікаря. Не рекомендується збільшувати дозу рибавірину до початкової (1000 мг або 1200 мг).
При непереносимості рибавірину слід продовжити монотерапію препаратом Пегасіс®.
Таблиця 3. Корекція дози при виникненні побічної дії (див. також вище)
|
Зниження дози рибавірину до 600 мг |
Призупинення прийому рибавірину |
Зменшення дози препарату Пегасіс®до 135/90/45 мкг |
Призупинення прийому препарату Пегасіс® |
Відміна комбінованого лікування |
|
|
Абсолютне число нейтрофілів |
<750/мм3 |
<500/мм3 |
|||
|
Число тромбоцитів |
<50 000/мм3 >25 000/мм3 |
<25 000/мм3 |
|||
|
Гемоглобін (серцево-судинні хвороби відсутні) |
< 10 г/дл та ≥8,5 г/дл |
<8,5 г/дл |
|||
|
Гемоглобін (стабільна серцево-судинна хвороба) |
Зниження на ≥2 г/дл протягом будь-яких 4 тижнів |
<12 г/дл незважаючи на 4 тижні застосування зменшеної дози |
Пов’язані з порушенням функції печінки. У хворих на хронічний гепатит відзначаються часті коливання підвищеної активності функціональних печінкових проб. Як і при терапії іншими препаратами інтерферону альфа, при терапії препаратом Пегасіс® спостерігається підвищення активності АЛТ вище показника до лікування, у тому числі і у пацієнтів з вірусологічною відповіддю. В клінічних дослідженнях у 8 з 451 пацієнта з хронічним гепатитом С, які отримували комбіновану терапію, спостерігалося ізольоване підвищення активності АЛТ (яке перевищувало верхнюю межу норми у ≥10 разів або яке перевищувало початковий рівень у ≥2 рази у пацієнтів з початковим рівнем активності АЛТ, що в 10 разів вище верхньої межі норми), яке зникло без зміни дози. При прогресуючому підвищенні АЛТ у пацієнтів з вірусним гепатитом С, у порівнянні з показниками до лікування, дозу препарату Пегасіс® потрібно спочатку зменшити до 135 мкг. Якщо активність АЛТ продовжує збільшуватися, незважаючи на зниження дози, або супроводжується підвищенням концентрації білірубіну чи ознаками печінкової декомпенсації, препарат варто відмінити.
У пацієнтів з хронічним гепатитом В можливе скороминуче підвищення рівня АЛТ, що іноді перевищує верхню межу норми у 10 разів і може свідчити про імунний кліренс. Лікування зазвичай не слід починати, якщо активність АЛТ перевищує верхнюю межу норми більше ніж у 10 разів. При продовженні терапії необхідний частіший контроль рівня АЛТ. При зниженні дози або тимчасовій відміні препарату Пегасіс® терапія може бути продовжена або відновлена після нормалізації активності АЛТ.
Особливі групи хворих
Літній вік. Для хворих літнього віку корекція рекомендованої дози 180 мкг один раз на тиждень не потрібна.
Ниркова недостатність. У пацієнтів з термінальною стадією ниркової недостатності розпочинати лікування препаратом Пегасіс® слід з дози 135 мкг на тиждень (див. розділ «Фармакокінетика в особливих групах хворих»). Незалежно від початкової дози і ступеня тяжкості ниркової недостатності за такими пацієнтами необхідно ретельно спостерігати і знижувати дозу у випадку виникнення побічних реакцій.
Печінкова недостатність. Для хворих з компенсованим цирозом печінки (клас А за Чайлдом–П’ю) Пегасіс® ефективний та безпечний. У хворих з декомпенсованим цирозом печінки (клас В/С за Чайлдом–П’ю або кровотеча з варикозно-розширених вен стравоходу) застосування препарату Пегасіс® не вивчалося (див. розділ «Протипоказання»).
Діти
Застосування препарату Пегасіс® новонародженим та дітям віком до 3 років протипоказане, оскільки препарат містить бензиловий спирт (див. розділи «Протипоказання» та «Особливості застосування»).
Для дітей та підлітків віком від 5 до 17 років з хронічним гепатитом С і площею поверхні тіла (ППТ) більше 0,7 м2 рекомендована доза препарату Пегасіс® і рибавірину вказана у таблицях 4 і 5. Дітям рекомендується застосувати препарат Пегасіс® у попередньо наповнених шприцах. Пацієнтам, лікування яких розпочинається до дати їхнього 18-ліття, слід застосовувати дитячу дозу до завершення лікування.
Пегасіс® не слід застосовувати дітям, які мають площу поверхні тіла менше 0,71 м2, оскільки на сьогодні немає даних щодо вказаної категорії дітей.
Для розрахунку площі поверхні тіла рекомендується застосовувати формулу Мостеллера:
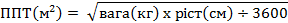
Тривалість лікування
Тривалість лікування препаратом Пегасіс® у комбінації з рибавірином для дітей з хронічним гепатитом С залежить від генотипу вірусу. Тривалість лікування у пацієнтів, інфікованих 2-м або 3-м генотипом, має становити 24 тижні, у пацієнтів, інфікованих іншими генотипами, – 48 тижнів.
У пацієнтів, у яких виявляється РНК ВГС незважаючи на початкові 24 тижні лікування, терапію слід припинити, оскільки малоймовірно, що у цих пацієнтів буде отримана стійка вірусологічна відповідь при продовженні лікування.
Таблиця 4. Рекомендації щодо дозування препарату Пегасіс® для дітей віком від 5 до 17 років
|
Площа поверхні тіла (м2) |
Тижнева доза (мкг) |
|
0,71-0,74 |
65 |
|
0,75-1,08 |
90 |
|
1,09-1,51 |
135 |
|
>1,51 |
180 |
Дітям і підліткам віком від 5 до 17 років з хронічним гепатитом С рекомендована доза рибавірину розраховується в залежності від маси тіла, при цьому цільова доза становить 15 мг/кг на добу, яку слід розділити на два прийоми. Для дітей і підлітків з масою тіла 23 кг або вище схема дозування із застосуванням рибавірину у дозі 200 мг у таблетках подана у таблиці 5. Не можна розламувати таблетки рибавірину дозуванням по 200 мг.
Таблиця 5. Рекомендації щодо дозування рибавірину для дітей віком від 5 до 17 років
|
Маса тіла, кг |
Добова доза рибавірину (приблизно 15 мг/кг/добу) |
Кількість таблеток рибавірину |
|
23-33 |
400 мг/добу |
1 × 200 мг до 12:00 1 × 200 мг після 12:00 |
|
34-46 |
600 мг/добу |
1 × 200 мг до 12:00 2 × 200 мг після 12:00 |
|
47-59 |
800 мг/добу |
2 × 200 мг до 12:00 2 × 200 мг після 12:00 |
|
60-74 |
1000 мг/добу |
2 × 200 мг до 12:00 3 × 200 мг після 12:00 |
|
≥75 |
1200 мг/добу |
3 × 200 мг до 12:00 3 × 200 мг після 12:00 |
Корекція дози з огляду на небажані реакції у дітей
У дітей в залежності від проявів токсичності (див. таблицю 6) існує 3 рівні модифікації дози до призупинення або відміни лікування.
Таблиця 6. Рекомендації щодо корекції дози препарату Пегасіс® у дітей
|
Початкова доза (мкг) |
1-й рівень зниження (мкг) |
2-й рівень зниження (мкг) |
3-й рівень зниження (мкг) |
|
65 |
45 |
30 |
20 |
|
90 |
65 |
45 |
20 |
|
135 |
90 |
65 |
30 |
|
180 |
135 |
90 |
45 |
При розвитку токсичних явищ, які можуть бути пов’язані із застосуванням препарату Пегасіс® чи рибавірину, можна знизити дозу одного або обох препаратів. Крім того, лікування рибавірином або комбіноване лікування препаратом Пегасіс® плюс рибавірин може бути відмінене. Важливо пам’ятати, що рибавірин ніколи не можна застосовувати у режимі монотерапії. Рекомендації щодо модифікації дози у зв’язку з токсичними явищами, які асоціюються із застосуванням препарату Пегасіс® і є специфічними для дітей, подано у таблиці 7. Якщо не вказано інше, при виникненні токсичних явищ слід дотримуватися рекомендацій, наведених для дорослих.
Таблиця 7. Рекомендації щодо корекції дози через токсичні явища у дітей
|
Токсичні явища |
Корекція дози препарату Пегасіс® |
|
Нейтропенія |
750-999 клітин/мм3: 1-2-й тиждень – негайна корекція 1-го рівня; 3-48-й тижні: корекція не проводиться. 500-749 клітин/мм3: 1-2-й тиждень – припинення введення препарату до моменту досягнення кількості нейтрофілів >750 клітин/мм3, після чого відновлення дози з корекцією 1-го рівня; щотижнева перевірка кількості нейтрофілів протягом наступних трьох тижнів з метою підтвердження того, що кількість нейтрофілів становить >750 клітин/мм3; 3-48-й тижні – негайна корекція 1-го рівня. 250-499 клітин/мм3: 1-2-й тиждень – припинення введення препарату до моменту досягнення кількості нейтрофілів >750 клітин/мм3, після чого відновлення дози з корекцію 2-го рівня; 3-48-й тижні – негайна корекція 1-го рівня. <250 клітин/мм3 (або фебрильна нейтропенія) – припинити лікування. |
|
Підвищення рівня АЛТ |
Стійке або подальше підвищення ≥5 але < 10 ВМН, зниження дози з корекцією 1-го рівня і щотижневий моніторинг рівня АЛТ з метою підтвердження того, що рівень АЛТ стабілізувався або знижується. |
У дітей при виникненні токсичних явищ, асоційованих із застосуванням рибавірину, таких як анемія, яка розвинулася на фоні лікування, слід знижувати повну дозу рибавірину (див. таблицю 8).
Таблиця 8. Рекомендації щодо корекції дози рибавірину для дітей
|
Повна доза (приблизно 15 мг/кг/день) |
Одноетапна модифікація дози (приблизно 7,5 мг/кг/день) |
Кількість таблеток рибавірину |
|
400 мг/день |
200 мг/день |
1 × 200 мг до 12:00 |
|
600 мг/день |
400 мг/день |
1 × 200 мг до 12:00 1 × 200 мг після 12:00 |
|
800 мг/день |
400 мг/день |
1 × 200 мг до 12:00 1 × 200 мг після 12:00 |
|
1000 мг/день |
600 мг/день |
1 × 200 мг до 12:00 2 × 200 мг після 12:00 |
|
1200 мг/день |
600 мг/день |
1 × 200 мг до 12:00 2 × 200 мг після 12:00 |
Досвід застосування препарату Пегасіс® дітям із хронічним гепатитом С віком від 3 до 5 років та пацієнтам, у яких попередня терапія була неефективною обмежений. Немає даних щодо дітей з коінфекцією ВГС/ВІЛ або з порушенням функції нирок.
Передозування.
Описано випадки передозування препарату Пегасіс® при застосуванні препарату протягом двох днів поспіль (без дотримання тижневого інтервалу) і щоденному застосуванні протягом одного тижня (сумарна доза 1260 мкг на тиждень). Будь-яких незвичайних, серйозних і побічних ефектів, що впливають на лікування, не відмічалося. У клінічних дослідженнях при злоякісних новоутвореннях нирки і хронічному мієлолейкозі препарат застосовували в дозах до 540 і 630 мкг на тиждень. Ознаками токсичності, що обмежують подальше застосування в цих дозах, були слабкість, підвищення активності печінкових ферментів, нейтропенія і тромбоцитопенія, які можуть виникнути і при лікуванні звичайними інтерферонами.
Побічні реакції.
Хронічний гепатит С
Частота і ступінь тяжкості найбільш поширених побічних реакцій при лікуванні препаратом Пегасіс® подібні до відзначених при лікуванні інтерфероном альфа-2а. Найбільш поширені побічні реакції при лікуванні препаратом Пегасіс® у дозі 180 мкг виражені, як правило, легко або помірно і не потребують корекції дози або відміни препарату.
Хронічний гепатит В
Протягом курсу терапії (48 тижнів) і під час спостереження без лікування (24 тижні) профіль безпеки препарату Пегасіс® при ХГВ був порівнянним з таким при ХГС, хоча частота побічних ефектів при ХГВ була значно меншою, за винятком частоти виникнення лихоманки. У 88 % пацієнтів, які отримували Пегасіс®, були відмічені небажані явища, у порівнянні з 53 % пацієнтів, які отримували ламівудин. Серйозні небажані явища були зареєстровані у 6 % та 4 % пацієнтів відповідно. У 5 % пацієнтів, які отримували Пегасіс®, і менше ніж у 1 % пацієнтів, які отримували ламівудин, терапія була відмінена у зв’язку з небажаними явищами. Відсоток пацієнтів із цирозом, які припинили лікування, у кожній групі лікування був подібним до такого у загальній популяції.
Хронічний гепатит С: пацієнти, які не відповіли на попереднє лікування
В цілому профіль безпеки препарату Пегасіс® у комбінації з рибавірином у пацієнтів, які не відповіли на попереднє лікування, був порівнянним з таким у пацієнтів, які раніше не отримували лікування. В клінічному дослідженні, яке включало 72- і 48-тижневе лікування пацієнтів, які не відповіли на попередню терапію пегільованим інтерфероном альфа-2b/рибавірином, лабораторні відхилення або небажані явища призводили до відміни препарату Пегасіс® та рибавірину у 6% та 7% відповідно при тривалості лікування 48 тижнів та у 12% і 13% відповідно при тривалості лікування 72 тижні. Аналогічно у пацієнтів з цирозом частота відміни терапії препаратом Пегасіс® і рибавірином була вищою в групі хворих, які отримували лікування протягом 72 тижнів (13 % та 15 %), ніж в групі хворих, які отримували лікування протягом 48 тижнів (6 % та 6 %). В дослідження не включалися пацієнти, у яких було відмінене попереднє лікування (пегільованим інтерфероном альфа-2b/рибавірином) у зв’язку з гематологічною токсичістю.
В іншому клінічному дослідженні пацієнти, які не відповіли на попередню терапію, з поширеним фіброзом або цирозом (3-6 балів за шкалою Ishak) та початковим рівнем тромбоцитів не більше 50 000/мм3, отримували 48-тижневий курс лікування. До гематологічних розладів, відзначених у перші 20 тижнів дослідження, належала анемія (у 26% пацієнтів рівень гемоглобіну становив <10 г/дл), нейтропенія (у 30% – абсолютне число нейтрофілів становило < 750/мм3) та тромбоцитопенія (у 13% пацієнтів кількість тромбоцитів була <50 000/мм3).
Коінфекція ВІЛ-ВГС
Профіль безпеки препарату Пегасіс® (монотерапія чи комбінація з рибавірином) у хворих з коінфекцією ВІЛ-ВГС був порівнянним із таким у пацієнтів з хронічним гепатитом С. До інших небажаних явищ, які виникали у 1-2% пацієнтів з коінфекцією ВІЛ-ВГС при лікуванні препаратом Пегасіс®/рибавірином, належать: гіперлактацидемія/лактатацидоз, грип, пневмонія, емоційна лабільність, апатія, дзвін у вухах, болі в горлі і гортані, хейліт, набута ліподистрофія і хроматурія.
Терапія препаратом Пегасіс® асоціювалася із зниженням абсолютної кількості CD4+- лімфоцитів в перші 4 тижні лікування без зміни їх відсоткового вмісту. Кількість CD4+- лімфоцитів поверталася до початкового рівня після зниження дози або відміни терапії. Призначення препарату Пегасіс® не впливало негативно на показник вірусного навантаження ВІЛ під час терапії і в період спостереження після закінчення терапії. Дані про застосування пацієнтам із кількістю CD4+- лімфоцитів менше 200 клітин/мкл обмежені.
Побічні реакції при монотерапії препаратом Пегасіс ® хронічного гепатиту В і хронічного гепатиту С, а також при терапії препаратом Пегасіс ® в комбінації з рибавірином хронічного гепатиту С
Для опису частоти побічних реакцій використовуються такі категорії: дуже поширені (≥1/10), поширені (≥ 1/100 і < 1/10), непоширені (≥1/1000 і < 1/100), рідко поширені (> 1/10000 і < 1/1000), дуже рідко поширені (< 1/10000), частота невідома. У кожній групі за частотою побічні реакції наводяться у порядку зменшення серйозності.
Інфекції та інвазії: поширені – інфекції верхніх дихальних шляхів, бронхіт, кандидоз порожнини рота, простий герпес, грибкові, вірусні та бактеріальні інфекції; непоширені – пневмонія, інфекції шкіри; рідко поширені – ендокардит, зовнішній отит; частота невідома –сепсис.
Доброякісні та злоякісні новоутворення (включаючи кісти та поліпи): рідко поширені – новоутворення печінки.
Порушення з боку крові та лімфатичної системи: поширені – тромбоцитопенія, анемія, лімфаденопатія; рідко поширені – панцитопенія; дуже рідко поширені – апластична анемія; частота невідома – парціальна червоноклітинна аплазія кісткового мозку.
Порушення з боку імунної системи: непоширені – саркоїдоз, тиреоїдит; рідко поширені – анафілаксія, системний червоний вовчак, ревматоїдний артрит; дуже рідко поширені – ідіопатична або тромботична тромбоцитопенічна пурпура, ангіоневротичний набряк; частота невідома – відторгнення трансплантата печінки і нирок, хвороба Догта–Коянагі–Харада.
Ендокринні розлади: поширені – гіпотиреоз, гіпертиреоз; непоширені – цукровий діабет; рідко поширені – діабетичний кетоацидоз.
Порушення обміну речовин, метаболізму: дуже поширені – анорексія; непоширені – дегідратація.
Психічні розлади: дуже поширені – депресія*, неспокій, безсоння*; поширені – емоційні розлади, зміна настрою, агресивність, нервозність, зниження лібідо; непоширені – суїцидальні думки, галюцинації; рідко поширені – суїцид, психічні розлади; частота невідома – манія, біполярні розлади, гоміцидальні ідеї.
Неврологічні розлади: дуже поширені – головний біль, запаморочення*, порушення концентрації уваги; поширені – порушення пам’яті, синкопальні стани, слабкість, мігрень, гіпестезія, гіперестезія, парестезія, тремор, порушення смакових відчуттів, нічні кошмари, сонливість; непоширені – периферична невропатія; рідко поширені – кома, судоми, неврит лицевого нерва; частота невідома – ішемія головного мозку.
Порушення з боку органів зору: поширені – порушення зору, біль в очному яблуці, запальні захворювання очей, ксерофтальмія; непоширені – крововилив у сітківку; рідко поширені – неврит зорового нерва, набряк диска зорового нерва, ураження судин сітківки, ретинопатія, виразка рогівки; дуже рідко поширені – втрата зору; частота невідома – серйозні випадки розшарування сітківки.
Порушення з боку органів слуху та вестибулярного апарату: поширені – вертиго, біль у вусі; непоширені: втрата слуху.
Кардіальні та судинні порушення: поширені – тахікардія, серцебиття, периферичні набряки, припливи; непоширені – артеріальна гіпертензія; рідко поширені – інфаркт міокарда, застійна серцева недостатність, стенокардія, суправентрикулярна тахікардія, аритмія, фібриляція передсердь, перикардит, кардіоміопатія, крововилив у головний мозок, васкуліт; частота невідома – ішемія периферичних судин.
Порушення з боку дихальної системи, органів грудної клітки та середостіння: дуже поширені – задишка, кашель; поширені – задишка при фізичному навантаженні, носова кровотеча, назофарингіт, набряки пазух, закладеність носа, риніт, біль у горлі; непоширені – свистяче дихання; рідко поширені – інтерстиційна пневмонія (включаючи випадки з летальним наслідком), емболія легеневої артерії.
Шлунково-кишкові розлади: дуже поширені – діарея*, нудота*, біль у животі*; поширені – блювання, диспепсія, дисфагія, вкривання виразками слизової оболонки ротової порожнини, кровоточивість ясен, глосит, стоматит, метеоризм, сухість слизової оболонки ротової порожнини; непоширені – шлунково-кишкова кровотеча; рідко поширені – пептична виразка, панкреатит; частота невідома – ішемічний коліт, пігментація язика.
Розлади гепатобіліарної системи: непоширені – порушення функції печінки; рідко поширені – печінкова недостатність, холангіт, жирова дистрофія печінки.
Зміни з боку шкіри і підшкірної клітковини: дуже поширені – алопеція, дерматит, свербіж, сухість шкіри; поширені – висипання, підвищене потовиділення, псоріаз, кропив’янка, екзема, шкірні реакції, реакції фотосенсибілізації, нічне потіння; дуже рідко поширені – токсичний епідермальний некроліз, синдром Стівенса–Джонсона, мультиформна еритема.
Порушення з боку опорно-рухової системи та сполучної тканини: дуже поширені – міальгії, артралгії; поширені – болі в спині, артрит, м’язова слабкість, болі в кістках, болі в шиї, кістково-м’язовий біль, м’язові судоми; рідко поширені – міозит; частота невідома – рабдоміоліз.
Розлади репродуктивної системи та молочних залоз: поширені – імпотенція.
Розлади з боку сечовидільної системи: рідко поширені – ниркова недостатність.
Загальні розлади: дуже поширені – лихоманка, озноб*, біль*, астенія, слабкість, подразливість*, реакції в місці ін’єкції*, поширені – болі в грудній клітці, грипоподібний синдром, нездужання, загальмованість, припливи, спрага, зниження маси тіла.
Травми та отруєння: рідко поширені – передозування речовини.
*Вказані побічні реакції були поширеними (≥ 1/100 і < 1/10) у пацієнтів з ХГВ, які отримували монотерапію препаратом Пегасіс®.
Опис окремих побічних реакцій
Лабораторні показники
Лікування препаратом Пегасіс® супроводжувалося такими змінами гематологічних показників: підвищенням активності АЛТ, гіпербілірубінемією, електролітними порушеннями (гіпокаліємія, гіпокальціємія, гіпофосфатемія), гіпо- і гіперглікемією, гіпертригліцеридемією.
При монотерапії препаратом Пегасіс® і при комбінованій терапії з рибавірином у 2% пацієнтів спостерігалося підвищення активності АЛТ, що призводило до зменшення дози або припинення лікування.
Терапія препаратом Пегасіс® асоціювалася зі зниженням гематологічних показників (лейкопенією, нейтропенією, тромбоцитопенією і зниженням гемоглобіну), які покращувалися при зміні дози і поверталися до початкового рівня через 4-8 тижнів після припинення терапії. У 24% пацієнтів, які отримували 180 мкг препарату Пегасіс® і 1000-1200 мг рибавірину протягом 48 тижнів, спостерігалася нейтропенія середнього ступеня тяжкості (абсолютне число нейтрофілів: 0,749-0,5 × 109/л), а у 5% пацієнтів – тяжка нейтропенія (абсолютне число нейтрофілів: <0,5 × 109/л).
Антитіла до інтерферону: у 1-5 % пацієнтів, які отримували препарат Пегасіс®в монотерапії або комбіноване лікування препаратом Пегасіс® та рибавірином, відмічалося утворення нейтралізуючих антитіл до інтерферону. Як і при терапії іншими інтерферонами, нейтралізуючі антитіла до інтерферону частіше спостерігалися при хронічному гепатиті В. Однак кореляція між появою антитіл і відсутністю відповіді на лікування не виявлена.
Функція щитоподібної залози: лікування препаратом Пегасіс® супроводжувалося клінічно суттєвими змінами лабораторних показників функції щитоподібної залози, що потребували медичного втручання. Частота виникнення (4,9%) цих змін при терапії препаратом Пегасіс® та іншими інтерферонами однакова.
Лабораторні показники при коінфекції ВІЛ-ВГС: незважаючи на те, що явища гематологічної токсичності (нейтропенія, тромбоцитопенія, анемія) у пацієнтів з коінфекцією ВІЛ-ВГС зустрічаються частіше, більшість з них корегується зміною дози і використанням факторів росту, і передчасна відміна терапії потребується рідко. Зниження абсолютного числа нейтрофілів нижче 500 клітин/мкл спостерігалося у 13% і 11% пацієнтів, які отримували монотерапію препаратом Пегасіс® і терапію препаратом Пегасіс®/рибавірином відповідно. Зниження тромбоцитів нижче 50 000 клітин/мл спостерігалося при монотерапії препаратом Пегасіс® у 10% пацієнтів, а при комбінованій терапії – у 8%. У 7% хворих, які отримували монотерапію препаратом Пегасіс®, і у 14% хворих, які отримували Пегасіс®/рибавірин, була зареєстрована анемія (гемоглобін < 10 г/дл).
Діти
Хронічний гепатит С
В клінічному дослідженні, в якому брали участь 114 дітей віком від 5 до 17 років, що отримували лікування препаратом Пегасіс® в режимі монотерапії або препаратом Пегасіс® у комбінації з рибавірином, корекція дози була потрібною приблизно одній третині пацієнтів, найчастіше у зв’язку з нейтропенією та анемією. В цілому, профіль безпеки у пацієнтів дитячого віку був порівнянним із таким у дорослих. В дослідженні найбільш поширеними побічними реакціями у дітей, які отримували комбіноване лікування препаратом Пегасіс® та рибавірином, були грипоподібне захворювання (91%), головний біль (64%), розлади з боку шлунково-кишкового тракту (56%), реакції в місці ін’єкцій (45%). Повний перелік побічних реакцій, про які повідомлялося у вказаній групі лікування (n = 55), вказано нижче. Комбінована терапія препаратом Пегасіс® і рибавірином протягом 48 тижнів була припинена у 7 пацієнтів у зв’язку з проблемами з безпекою (депресія, патологія за результатами психіатричного дослідження, транзиторна сліпота, ексудати сітківки очей, гіперглікемія, цукровий діабет 1-го типу, анемія). Більшість побічних реакцій, про які повідомлялося в клінічних дослідженнях, були легкого або помірного ступеня тяжкості. Тяжкі побічні реакції спостерігалися у 2 пацієнтів, які отримували комбіноване лікування препаратом Пегасіс® і рибавірином (гіперглікемія і холецистектомія).
Інфекції та інвазії: поширені – інфекційний мононуклеоз, стрептококовий фарингіт, грип, вірусний гастроентерит, кандидоз, гастроентерит, абсцес зуба, ячмінь, інфекція сечовивідних шляхів, назофарингіт.
Порушення з боку крові та лімфатичної системи: поширені – анемія.
Порушення обміну речовин, метаболізму: дуже поширені – зниження апетиту; поширені –гіперглікемія, цукровий діабет 1-го типу.
Психічні розлади: дуже поширені – безсоння; поширені – депресія, тривога, галюцинації, патологічна поведінка, агресивність, гнів, дефіцит уваги/ гіперактивність.
Неврологічні розлади: дуже поширені – головний біль; поширені – запаморочення, порушення уваги, мігрень.
Порушення з боку органів зору: поширені – минуча сліпота, ексудати сітківки, порушення зору, подразнення очей, біль в очах, свербіж в очах.
Порушення з боку органів слуху та вестибулярного апарату: поширені – біль у вухах.
Порушення з боку дихальної системи, органів грудної клітки та середостіння: поширені – задишка, носова кровотеча.
Шлунково-кишкові розлади: дуже поширені – розлади з боку шлунково-кишкового тракту; поширені – біль у верхніх відділах живота, стоматит, нудота, афтозний стоматит, розлади з боку ротової порожнини.
Зміни з боку шкіри і підшкірної клітковини: дуже поширені – висипання, свербіж, алопеція; поширені – набряк обличчя, медикаментозне висипання.
Порушення з боку опорно-рухової системи та сполучної тканини: дуже поширені – м’язово-скелетний біль; поширені – біль у спині, біль у кінцівках.
Розлади з боку сечовидільної системи: поширені – дизурія, нетримання, розлади з боку сечовидільної системи.
Порушення з боку репродуктивної системи та молочної залози: поширені – виділення з піхви.
Загальні розлади: дуже поширені – грипоподібні розлади, реакції в місці ін’єкції, чутливість, слабкість; поширені – підвищення температури, гематома в місці проколювання судини, біль.
Обстеження: поширені – патологія за результатами психіатричного дослідження.
Хірургічні та медичні процедури: поширені – видалення зуба, холецистектомія.
Соціальні обставини: поширені – проблеми з освітою.
У пацієнтів дитячого віку спостерігалося пригнічення росту (див. розділ «Особливості застосування»). У пацієнтів дитячого віку, які отримували комбіноване лікування препаратом Пегасіс® і рибавірином, спостерігалася затримка маси і росту, яка збільшилася через 48 тижнів терапії порівняно з початковим рівнем. Під час лікування спостерігалося зниження «ваги для даного віку» та «росту для даного віку» у процентилях норми для популяції. Через 2 роки спостереження після завершення лікування у більшості пацієнтів спостерігалося повернення до початкової норми кривої росту у процентилях для ваги і росту (середній процентиль для ваги становив 64% до початку лікування і 56% через 2 роки після лікування; середній процентиль для росту становив 54% до початку лікування і 56% через 2 роки після лікування). В кінці лікування у 43% пацієнтів спостерігалося зниження ваги на 15 процентилів або більше, і у 25% (13 з 53) пацієнтів – зниження росту на 15 процентилів або більше по нормативній кривій росту. Через 2 роки після лікування 16% (6 з 38) пацієнтів залишилися на 15% або більше нижче їх початкової кривої ваги і 11% (4 з 38) залишилися на 15 процентилів або більше нижче їх початкової кривої росту.
55% (21 з 38) пацієнтів, які завершили участь у оригінальному дослідженні, включені у подальше розширене дослідження тривалістю до 6 років після лікування. Дослідження показало, що відновлення росту на 2-му році після лікування зберігалося до 6 років після лікування. Для кількох пацієнтів, у яких на 2-му році після лікування спостерігалось зниження росту на 15 або більше процентилів нижче їх початкової кривої росту, ці дані або повернулись до початково порівнюваних рівнів процентилів на 6-му році після лікування, або було виявлено не пов’язаний з ліуванням причинний фактор. Об’єм доступних даних недостатній щоб робити висновок що пригнічення росту через використання препарату Пегасіс® є завжди оборотним.
Лабораторні показники
Зниження дози або відміна лікування можуть бути необхідні при зниженні рівня гемоглобіну, зменшенні числа нейтрофілів і тромбоцитів (див. таблиці 3 і 7). У більшості випадків відхилення лабораторних показників, яке спостерігалося під час клінічного дослідження, повернулося до початкового рівня невдовзі після припинення лікування.
Термін придатності.
3 роки.
Умови зберігання.
Зберігати у недоступному для дітей місці. Зберігати при температурі від 2 до 8 °С в оригінальній упаковці з метою захисту від світла. Не заморожувати.
Несумісність.
Оскільки досліджень сумісності не проводилося, лікарський засіб не слід змішувати з іншими препаратами.
Упаковка.
1 попередньо наповнений шприц по 90 мкг/0,5 мл разом з 1 стерильною голкою для ін’єкцій (голка для ін’єкцій вкладена в пластмасовий контейнер) в картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
Ф.Хоффманн-Ля Рош Лтд, Швейцарія.
Місцезнаходження виробника та його адреса місця провадження діяльності. Грензахерштрассе 124, СН-4070 Базель, Швейцарія.
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Peginterferon alfa-2a - Пег-интерферон альфа-2а |
| Код АТХ | L03AB11 |
| Форма выпуска | раствор |
- ПЕГФЕРОН ТОВ "ЛЮМ'ЄР ФАРМА" (пакування з форми in bulk виробництва: Ф.Хоффманн-Ля Рош Лтд, Швейцарія (Базель); Ф.Хоффманн-Ля Рош Лтд, Швейцарія (Кайсераугст)), Україна
- Пегасис Ф. Хоффманн-Ля Рош Лтд (виробництво нерозфасованої продукції, первинне пакування для попередньо наповнених шприців; випробування контролю якості; випуск серії; вторинне пакування; випробування контролю якості)/Рош Діагностикс ГмбХ (виробництво нерозфасова
- Пегферон Пег-Интерферон Альфа-2а ТОВ "ЛЮМ'ЄР ФАРМА" (виробництво з пакування in bulk: Ф. Хоффманн-Ля Рош Лтд, Швейцарія (Базель); Ф. Хоффманн-Ля Рош Лтд, Швейцарія (Кайсераугст)), Україна

 Глутаргин: новый подход к патогенетическому лечению вирусных гепатитов
Глутаргин: новый подход к патогенетическому лечению вирусных гепатитов
 Пегасис против «ласкового убийцы»
Пегасис против «ласкового убийцы»
 Современные подходы к лечению вирусных гепатитов у детей
Современные подходы к лечению вирусных гепатитов у детей
 Внутрипеченочный холестаз беременных
Внутрипеченочный холестаз беременных