Эпайдра инструкция, аналоги и состав
| Показания: | Цукровий діабет, коли необхідне застосування інсуліну дорослим, підліткам і дітям віком від 6 років і старше. |
| Форма випуска: | Розчин для ін'єкцій, 100 ОД/мл по 3 мл у картриджі № 5 у блістерах; по 3 мл у картриджі, вмонтованому в одноразовий пристрій - шприц-ручку СолоСтар® (без голок для ін'єкцій) № 5 у коробках; по 10 мл у флаконах № 1 |
| Производитель, страна: | Санофі-Авентіс Дойчланд ГмбХ, Німеччина |
| Действующее вещества: | 1 мл розчину містить інсуліну глюлізину (продукту рекомбінантної ДНК-технології із застосуванням Escherichia coli) 100 одиниць, що еквівалентно 3,49 мг |
| МНН: | Insulin glulisine - Инсулин глюлизин |
| Регистрация: | UA/10240/01/01з 10.10.2014 по 10.10.2019. Приказ 626 від 25.09.2015 |
| Код АТХ: |
Склад:
діюча речовина: інсулін глюлізин;
1мл розчину містить інсуліну глюлізину (продукту рекомбінантної ДНК-технології із застосуванням Escherichia coli) 100 одиниць, що еквівалентно 3,49 мг;
1 картридж містить 3 мл розчину для ін’єкцій, що еквівалентно 300 Од. інсуліну глюлізину;
допоміжні речовини: м-крезол, трометамін, натрію хлорид, полісорбат 20, натрію
гідроксид, кислота хлористоводнева концентрована, вода для ін`єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий безбарвний водний розчин.
Фармакотерапевтична група. Протидіабетичні засоби. Інсуліни та аналоги швидкої дії.
Код АТX А10А В06.
Фармакологічні властивості.
Фармакодинаміка. Інсулін глюлізин є рекомбінантним аналогом інсуліну людини, що за своєю силою дії подібний до інсуліну людини. Інсулін глюлізин діє швидше та має меншу тривалість дії, ніж звичайний інсулін людини.
Основна дія інсулінів та їх аналогів, включаючи інсулін глюлізин, спрямована на регулювання метаболізму глюкози. Інсуліни знижують рівень вмісту глюкози у крові шляхом стимуляції периферійної утилізації глюкози, особливо у скелетних м’язах і жировій тканині, та пригнічення синтезу глюкози у печінці. Інсулін запобігає ліполізу в адипоцитах, протеолізу та посилює синтез протеїну.
Дослідження за участю здорових добровольців і хворих на цукровий діабет продемонстрували, що при підшкірному введенні інсулін глюлізин діє швидше та має меншу тривалість дії, ніж звичайний інсулін людини. Якщо інсулін глюлізин застосовується у вигляді ін’єкції підшкірно, зниження рівня глюкози у крові починається протягом 10-20 хвилин. При застосуванні підшкірно інсуліну глюлізину та звичайного інсуліну людини у дозі 0,15 Од/кг у різний час відносно 15-хвилинного стандартного прийому їжі було встановлено, що при введенні інсуліну глюлізину за умови введення за 2 хвилини до прийому їжі спостерігається постпрандіальний глікемічний контроль, подібний до такого при введенні звичайного інсуліну людини, що застосовувався за 30 хвилин до прийму їжі. При порівнянні гіпоглікемичних ефектів інсуліну глюлізину та звичайного інсуліну людини при введені за 2 хвилини до прийому їжі інсулін глюлізин забезпечував кращий постпрандіальний контроль, ніж звичайний інсулін людини. Застосування інсуліну глюлізину через 15 хвилин після початку прийому їжі забезпечує глікемічний контроль, подібний до такого при застосуванні звичайного інсуліну людини, що введений за 2 хвилини до початку прийому їжі.
Ожиріння.
Інсулін глюлізин зберігає свої швидкодіючі властивості у рпзі застосування пацієнтам з ожирінням. Час до досягнення 20 % загальної AUC та показник AUC (0-2 години), що є показниками ранньої дії інсулінів щодо зниження рівня глюкози, дорівнювали відповідно 114 хв. і 427 мг/кг для інсуліну глюлізину, 121 хв. і 354 мг/кг для інсуліну ліспро, 150 хв. і 197 мг/кг для звичайного інсуліну людини.
Раса та стать.
У ході контрольованих клінічних досліджень за участю дорослих пацієнтів інсулін глюлізин не продемонстрував різниці у безпеці та ефективності в підгрупах, що відрізнялися за расою та статтю.
Фармакокінетика.
Більш швидка абсорбція інсуліну глюлізину забезпечується заміною амінокислоти аспарагіну у позиції В3 інсуліну людини лізином і лізину у позиції В29 глютаміновою кислотою.
Абсорбція та біодоступність.
Фармакокінетичні профілі у здорових добровольців і хворих на цукровий діабет (І або ІІ типу) продемонстрували, що рівень абсорбції інсуліну глюлізину був у два рази вищий, а максимальна концентрація, приблизно у два рази вища порівняно з таким у звичайного інсуліну людини.
У хворих на цукровий діабет І типу після підшкірної ін’єкції у дозі 0,15 Од/кг показники Тмакс для інсуліну глюлізину дорівнювали 55 хв. і Смакс був 82 ± 1,3 µОд/мл порівняно з Тмакс , 82 хв. і Смакс 46 ± 1,3 µОд/мл для звичайного інсуліну людини. Середній час наявності в організмі інсуліну глюлізину був коротшим (98 хв.), ніж звичайного інсуліну людини (161 хв.).
У хворих на цукровий діабет ІІ типу після підшкірного застосування інсуліну глюлізину у дозі 0,2 Од/кг Смакс становить 91µОд/мл з інтервалом вірогідності від 78 до 104 µОд/мл.
При підшкірній ін’єкції інсуліну глюлізину у черевну стінку, стегно або дельтоподібний м’яз абсорбція препарату є більш швидкою при застосуванні в ділянку стінки живота, ніж у стегно. Абсорбція у місці ін’єкції в ділянці дельтоподібного м’яза була середньою між вищезазначеними показниками. Абсолютна біодоступність (70 %) інсуліну глюлізину була подібною у вищезазначених місцях ін’єкцій та мала низьку індивідуальну варіативність (11 % CV). Внутрішньовенне болюсне застосування інсуліну глюлізину було причиною більшого системного впливу порівняно з такими при підшкірній ін’єкції, причому значення Сmax було приблизно в 40 разів більшим.
Розподіл і виведення.
Розподіл і виведення інсуліну глюлізину і звичайного людського інсуліну після внутрішньовенного введення є подібним, при цьому об’єми розподілу становлять 13 л і 22 л, а періоди напіввиведення – 13 хв і 18 хв відповідно.
Після підшкірного застосування інсулін глюлізин виводиться швидше, ніж звичайний інсулін людини, з середньою тривалістю періодів напіввиведення 42 хв для інсуліну глюлізину порівняно з 86 хв для звичайного інсуліну. При аналізі перехресного дослідження інсуліну глюлізину за участю здорових добровольців або хворих на цукровий діабет І або ІІ типу середня тривалість періоду напіввиведення була від 37 до 75 хвилин (інтервал вірогідності).
Інсулін глюлізин, як і людський інсулін, погано зв’язується з білками плазми крові.
Особливості застосування препарату специфічним групам пацієнтів
- Пацієнти з порушеннями функції нирок.
При порушенні функції нирок потреба в інсуліні може знижуватись, однак здатність інсуліну глюлізину швидко діяти зберігається.
- Пацієнти з порушеннями функції печінки.
Фармакокінетичні властивості інсуліну глюлізину не досліджувались у пацієнтів з порушенням функції печінки.
- Пацієнти літнього віку.
Стосовно пацієнтів літнього віку, хворих на цукровий діабет, існує дуже обмежена база даних щодо фармакокінетики препарату.
- Діти та підлітки.
Фармакокінетичні та фармакодинамічні властивості інсуліну глюлізину у дітей (7-11 років) і підлітків (12-16 років), хворих на цукровий діабет І типу, такі: інсулін глюлізин швидко засвоюється у хворих обох вікових груп і має такі ж показники Тмакс та Смакс, як і у дорослих. Введення інсуліну глюлізину безпосередньо перед прийомом їжі дітям та підліткам забезпечує кращий постпрандіальний глікемічний контроль порівняно зі звичайним інсуліном людини, як і у дорослих хворих. Відхилення рівня глюкози (AUC) становить 641 мг/год/дл для інсуліну глюлізину та 801 мг/год/дл для звичайного інсуліну людини.
Доклінічні дані щодо безпеки застосування
Доклінічні дані не вказують на наявність токсичності (крім тієї, що пов’язана з гіпоглікемією), яка б відрізнялася від показників звичайного інсуліну людини або була клінічно значущою для людей.
Клінічні характеристики.
Показання.
Цукровий діабет, коли необхідне застосування інсуліну дорослим, підліткам і дітям віком від 6 років і старше.
Протипоказання.
Гіперчутливість до інсуліну глюлізину або будь-якого компонента препарату. Гіпоглікемія.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження щодо типів фармакокінетичних взаємодій не проводилися. З огляду на емпіричні знання стосовно інших подібних лікарських засобів, прояв клінічно релевантних фармакокінетичних взаємодій є малоймовірним.
На метаболізм глюкози впливає цілий ряд речовин і лікарських препаратів. Отже, це може потребувати регулювання дози інсуліну глюлізину та особливо ретельного нагляду за хворим.
До речовин, що можуть посилити глюкозознижувальну активність та збільшити сприйнятливість до гіпоглікемії, належать пероральні антидіабетичні засоби, інгібітори ангіотензинперетворювального ферменту, дизопірамід, фібрати, флуоксетин, інгібітори моноаміноксидази, пентоксифілін, пропоксифен, саліцилати та сульфаніламідні антибіотики.
Речовини, що можуть призвести до зростання рівня глюкози у крові: кортикостероїди, даназол, діазоксид, діуретики, глюкагон, ізоніазид, похідні фенотіазину, соматропін, симпатоміметичні агенти (такі як, епінефрин [адреналін], сальбутамол, тербуталін), тиреоїдні гормони, естрогени, прогестини (наприклад, у складі пероральних контрацептивів), інгібітори протеїнази та атипічні антипсихотичні лікарські засоби (зокрема оланзапін і клозапін).
Бета-блокатори, клонідин, солі літію або алкоголь можуть призвести як до підвищення, так і до зниження властивості інсуліну зменшувати рівень глюкози у крові. Пентамідин може спричинювати розвиток гіпоглікемії, що іноді супроводжується гіперглікемією.
Крім того, під впливом симпатолітичних лікарських засобів, таких як клонідин, гуанетидин, резерпін, і бета-блокаторів ознаки адренергічного зворотного регулювання можуть бути ослаблені або навіть відсутні.
Особливості застосування.
Перехід пацієнта на застосування нового типу або препарату інсуліну повинно відбуватися під ретельним наглядом лікаря. Зміни сили дії, типу препарату (виробника), виду препарату (звичайний, НПХ, ленте, тривалої дії тощо), походження (тваринний, людський, аналог людського інсуліну) та/або методу виробництва можуть потребувати зміни дози. Також може виникати необхідність у регулюванні схеми супутнього застосування пероральних антидіабетичних препаратів.
Гіперглікемія.
Застосування невідповідних доз або припинення лікування, особливо у хворих на інсулінозалежний діабет, може призвести до розвитку гіперглікемії та діабетичного кетоацидозу – станів, що є потенційно летальними.
Гіпоглікемія.
Гіпоглікемія виникає залежно від профілю дії інсулінів, що застосовуються, та може змінюватися при переході на новий режим лікування.
Умови, які можуть зробити ранні попереджувальні симптоми гіпоглікемії нетиповими або менш вираженими, включають значну тривалість захворювання на діабет, інтенсивну інсулінотерапію, діабетичну нейропатію, застосування лікарських препаратів, таких як бета-блокатори, або перехід з інсуліну тваринного походження на інсулін людини. Потреба у корекції дози також може виникнути, якщо пацієнти підвищують режим фізичної активності або змінюють свою звичайну харчову дієту. Фізичні навантаження одразу після їди підвищують ризик розвитку гіпоглікемії.
Гіпоглікемія після ін’єкції швидкодіючих аналогів інсуліну, як правило, виникає раніше, ніж при застосуванні розчинного інсуліну людини.
Гіпоглікемічні або гіперглікемічні реакції, якщо не надати пацієнту відповідної допомоги, можуть призвести до втрати свідомості, коми або летального наслідку.
Потреба в інсуліні може змінюватися при наявності іншої хвороби або емоційних порушень.
Надходили повідомлення про помилкове введення препаратів, коли замість інсуліну глюлізину випадково вводилися інші інсуліни, зокрема інсуліни тривалої дії. Перед кожною ін’єкцією слід перевіряти інформацію на етикетці картриджа, щоб уникнути помилкового введення замість інсуліну глюлізину інших інсулінів.
Одна доза цього лікарського засобу містить менше ніж 1 ммоль (23 мг) натрію, тобто він практично не містить натрію.
Епайдра® містить м-крезол, який може спричинити алергічні реакції.
Комбінація препаратуЕпайдра®зпіоглітазоном.
Про випадки серцевої недостатності повідомлялося при застосуванні піоглітазону в поєднанні з інсуліном, особливо в пацієнтів, які мають ризик розвитку серцевої недостатності. Це потрібно враховувати при розгляді можливості проведення лікування комбінацією піоглітазону і препарату Епайдра®. При застосуванні цієї комбінації за пацієнтами потрібно спостерігати щодо появи ознак і симптомів серцевої недостатності, збільшення маси тіла і набряку. При будь-якому погіршенні кардіологічних симптомів застосування піоглітазону потрібно припинити.
Застосування у період вагітності або годування груддю.
Вагітність
Дані щодо застосування інсуліну глюлізину вагітним жінкам відсутні або обмежені (менше ніж 300 результатів вагітності).
В ході досліджень впливу на репродуктивну функцію, проведених на тваринах, не було виявлено жодних відмінностей між застосуванням інсуліну глюлізину та інсуліну людини стосовно впливу на вагітність, розвиток ембріона/плода, пологи або постнатальний розвиток (див. розділ “Фармакологічні властивості”).
Вагітним жінкам цей препарат слід застосовувати з обережністю. Необхідно ретельно контролювати рівень глюкози.
Пацієнтам з діагностованим або гестаційним цукровим діабетом у період вагітності слід підтримувати належний метаболічний контроль. Потреба організму в інсуліні може зменшуватися в першому триместрі вагітності та, як правило, збільшується в період другого та третього триместрів. Одразу після пологів потреба організму в інсуліні швидко зменшується.
Годування груддю
Невідомо, чи екскретується інсулін глюлізин у грудне молоко людини, проте звичайно інсулін не проникає до грудного молока та не абсорбується після перорального прийому.
Жінкам, які годують груддю, може бути необхідно скоригувати дозу інсуліну та раціон харчування.
Фертильність
В ході досліджень впливу інсулінy глюлізинy на репродуктивну функцію, проведених на тваринах, не було виявлено жодних небажаних впливів на фертильність.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Здатність пацієнта концентрувати увагу та його реакція можуть порушуватись унаслідок розвитку гіпоглікемії або гіперглікемії або, наприклад, у результаті порушення зору. Це може становити ризик у ситуаціях, коли наявність таких симптомів є особливо важливою (зокрема, під час керування автомобілем або механізмами).
Пацієнтам слід рекомендувати бути обережними та запобігати розвитку гіпоглікемії під час керування транспортом. Це особливо важливо для тих, хто недостатньо поінформований або зовсім не поінформований щодо симптомів-провісників гіпоглікемії, і для тих хворих, у кого часто виникають епізоди гіпоглікемій. За цих обставин слід розглянути доцільність керування транспортом.
Спосіб застосування та дози.
Сила дії цього препарату виражається в одиницях, які використовуються виключно для препарату Епайдра® і відрізняються від МО чи одиниць, у яких виражається сила дії інших аналогів інсуліну.
Препарат Епайдра® можна застосовувати у режимах інсулінотерапії, що включають інсулін середньої або довготривалої дії, або аналог базального інсуліну, та можна застосовувати одночасно з пероральними протидіабетичними засобами.
Дозу препарату Епайдра® підбирають та регулюють індивідуально.
Особливі категорії пацієнтів.
Пацієнти з порушеннями функції нирок.
Фармакокінетичні властивості інсуліну глюлізину в цілому зберігаються у пацієнтів з порушенням функції нирок. Однак у разі порушення функції нирок потреба в інсуліні може знижуватися (див. розділ «Фармакокінетика»).
Пацієнти з порушеннями функції печінки.
Фармакокінетичні властивості інсуліну глюлізину не вивчались у пацієнтів зі зниженою функцією печінки. У пацієнтів з порушенням функції печінки потреба в інсуліні може бути меншою через зниження глюконеогенезу та здатності інсуліну метаболізуватися.
Пацієнти літнього віку.
Наявні дані з фармакокінетики інсуліну у пацієнтів літнього віку, хворих на цукровий діабет є недостатніми. Погіршання функції нирок може призвести до зниження потреби в інсуліні.
Діти та підлітки.
Не існує достовірної клінічної інформації щодо застосування препарату Епайдра® дітям віком до 6 років.
Застосування.
Препарат Епайдра® слід вводити шляхом підшкірної ін’єкції незадовго (за 0-15 хвилин) до чи одразу після прийому їжі або шляхом постійної підшкірної інфузії за допомогою інсулінового насоса.
Препарат Епайдра® застосовують підшкірно у ділянці черевної стінки, стегна або дельтоподібного м’яза або шляхом безперервної інфузії під шкіру передньої стінки живота. Місця для ін’єкцій або інфузій у зоні ін’єкції (передня стінка черевної порожнини, стегно або дельтоподібний м’яз) слід по черзі змінювати. Ступінь абсорбції і, ймовірно, початок та термін дії можуть залежати від певного місця ін’єкції, техніки її виконання та інших змінних показників. Підшкірна ін’єкція у черевну стінку забезпечує трохи швидшу абсорбцію, ніж введення препарату в інші місця для ін’єкцій.
Необхідно слідкувати за тим, щоб не пошкоджувати кровоносні судини. Після введення препарату не слід масажувати місця ін’єкції.
Пацієнтів слід навчати дотримуватись правильної процедури виконання ін’єкції.
Епайдра®, розчин для ін’єкцій у картриджах, призначений для використання з інсуліновими шприц-ручками OптіПен, КлікСтар, Аутопен 24, Тактіпен або AllStarTM, відповідно до рекомендацій, що містяться в інструкції виробника приладу. Картриджі не можна застосовувати в інших шприц-ручках багаторазового використання, оскільки точність дозування була визначена тільки для зазначених шприц-ручок.
Не усі з цих шприц-ручок можуть бути наявними у вашій країні.
Слід чітко дотримуватися інструкцій виробника щодо використання шприц-ручки під час заправки картриджа, приєднання голки та проведення ін’єкції інсуліну. Перед використанням картридж потрібно ретельно оглянути. Він придатний до застосування, якщо розчин у ньому прозорий, безбарвний, не містить видимих твердих часток. Картридж слід тримати протягом 1-2 годин при кімнатній температурі перед встановленням його у шприц-ручку багаторазового використання. Пухирці повітря слід видалити з картриджа перед виконанням ін’єкції (див. інструкцію для використання шприц-ручки). Порожні картриджі не дозволяється заповнювати повторно.
У разі несправності шприц-ручки (дивіться інструкцію з використання шприц-ручки) розчин з картриджа можна набрати у шприц, що підходить для введення інсуліну та розрахований на 100 Од./мл, та зробити ін’єкцію. Якщо шприц-ручка для введення інсуліну пошкоджена або не працює належним чином (через механічні дефекти), її слід знищити, а замість неї використовувати нову шприц-ручку.
З метою запобігання інфікуванню шприц-ручка для багаторазового використання використовується лише одним пацієнтом.
Перед кожною ін’єкцією слід перевіряти інформацію, зазначену на етикетці, щоб уникнути помилкового введення замість інсуліну глюлізину інших інсулінів (див. розділ «Особливості застосування»).
Змішування з іншими інсулінами.
Препарат Епайдра®, який вводиться у вигляді підшкірної ін’єкції, забороняється змішувати з будь-якими іншими лікарськими засобами, окрім людського інсуліну НПХ (нейтрального протаміну Хагедорна). При змішуванні з НПХ - інсуліном людини спочатку слід набрати у шприц препарат Епайдра®. Ін’єкцію потрібно робити одразу ж після змішування, оскільки належних даних стосовно стабільності сумішей, приготовлених задовго до введення, немає.
Діти. Даних щодо клінічного застосування препарату Епайдра® дітям віком до 6 років недостатньо.
Передозування.
Гіпоглікемія може виникати як наслідок надмірної дії інсуліну відносно об’єму прийнятої їжі та витрат енергії.
Специфічні дані щодо передозування інсуліну глюлізину відсутні. Проте гіпоглікемія може розвинутися поступово.
Помірні гіпоглікемічні епізоди можуть лікуватися шляхом перорального застосування глюкози або цукру. Таким чином, хворому на цукровий діабет рекомендується постійно мати при собі кілька шматочків цукру, цукерок, печива або фруктового соку з цукром. Цукрозамінники не можна використовувати для лікування гіпоглікемічних станів.
Тяжкі гіпоглікемічні епізоди, при яких пацієнт втрачає свідомість, можна усувати шляхом введення глюкагону (0,5-1 мг) внутрішньом’язово або підшкірно, що може зробити відповідним чином проінструктована особа, або шляхом внутрішньовенного введення глюкози, що має виконати медичний працівник. Глюкоза вводиться внутрішньовенно також у разі, якщо стан пацієнта не покращується протягом 10 або 15 хв після введення глюкагону.
Коли хворий опритомніє, рекомендується застосувати вуглеводи перорально з метою запобігання рецидиву гіпоглікемії.
Після ін’єкції глюкагону пацієнта слід обстежити у лікарні для виявлення причини виникнення тяжкої гіпоглікемії та запобігання виникненню подібних нападів.
Побічні реакції.
Найпоширенішою побічною дією інсулінотерапії є гіпоглікемія, що виникає як наслідок застосування значно більшої дози інсуліну, ніж це потрібно.
Відповідні побічні реакції, продемонстровані під час проведення клінічних досліджень, наводяться нижче за класами систем органів та у порядку зменшення частоти виникнення: дуже часто (≥ 1/10); часто (≥ 1/100 - < 1/10); нечасто (≥ 1/1 000 - < 1/100); рідко (≥ 1/10 000 - < 1/1 000); дуже рідко (< 1/10 000), частота невідома (не можна розрахувати за наявними даними).
У кожній з груп побічні явища представлені у порядку зменшення ступеня їх серйозності.
|
Клас органів та систем MedDRA |
Дуже часто |
Часто |
Нечасто |
Рідко |
|
Метаболічні та аліментарні розлади |
Гіпоглікемія |
|||
|
Розлади з боку шкіри та підшкірних тканин |
Реакції у місці ін’єкції, місцеві реакції гіперчутливості |
Ліподистрофія |
||
|
Порушення загального стану та реакції у місці введення |
Системні реакції гіпер-чутливості |
Метаболічні та аліментарні розлади.
Симптоми гіпоглікемії, як правило, виникають раптово. Вони включають холодний піт, холодну бліду шкіру, втомлюваність, нервозність або тремор, відчуття неспокою, незвичну втомлюваність або слабкість, збентеження, порушення концентрації уваги, сонливість, сильне відчуття голоду, порушення зору, головний біль, нудоту та сильне серцебиття. Гіпоглікемія може досягти значного ступеня і призвести до втрати свідомості та/або судом і спричинити тимчасове або постійне порушення функції мозку або навіть стати причиною летального наслідку.
Розлади з боку шкіри та підшкірних тканин.
Місцеві реакції гіперчутливості (почервоніння, набряк і свербіж у місці ін’єкції) можливі під час лікування із застосуванням інсуліну. Такі реакції, як правило, є минущими та зазвичай зникають у разі продовження лікування.
Ліподистрофія може виникати у місці ін’єкції як наслідок недотримання порядку зміни місця ін’єкції.
Порушення загального стану та реакції у місці введення.
Cистемні реакції гіперчутливості можуть включати кропив’янку, стиснення у грудях, задишку, алергічний дерматит і свербіж. Тяжкі випадки включають генералізовану алергічну реакцію разом з анафілактичною реакцією, що може загрожувати життю.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати у недоступному для дітей місці.
Зберігати у холодильнику при температурі від +2ºС до +8ºС в оригінальній упаковці для захисту від дії світла. Не заморожувати. Запобігати контакту зі стінками холодильника або накопичувачами холоду.
Умови зберігання під час користування.
Розпочаті картриджі необхідно використати протягом 4 тижнів. Під час використання зберігати при температурі не вище +25°С подалі від джерел прямого тепла та прямого світла. Зберігати в оригінальній упаковці для захисту від дії світла. Шприц-ручка з картриджем не повинна зберігатись в холодильнику. Після кожної ін’єкції необхідно надягнути ковпачок на шприц-ручку для захисту від світла.
Несумісність.
Препарат Епайдра® не слід змішувати з іншими препаратами, відмінними за складом від НПХ (нейтрального протаміну Хагедорна) інсуліну людини.
Упаковка. № 5: по 3 мл у картриджі; по 5 картриджів у блістерній упаковці в картонній коробці.
Категорія відпуску. За рецептом.
Виробник. Санофі-Авентіс Дойчланд ГмбХ, Німеччина/ Sanofi-Aventis Deutschland GmbH, Germany.
Місцезнаходженнявиробника та його адреса місця провадження діяльності.
Брюнінгштрассе 50 Н600, H500, H590 65926 Франкфурт-на-Майні, Німеччина/ Bruningstrasse 50 Н600, H500, H590 65926 Frankfurt am Main, Germany.
Заявник. ТОВ «Санофі-Авентіс Україна», Україна/ Sanofi-Aventis Ukraine LLC, Ukraine.
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЕПАЙДРА®
(APIDRA®)
Склад:
діюча речовина:інсулін глюлізин;
1мл розчину містить інсуліну глюлізину (продукту рекомбінантної ДНК-технології із застосуванням Escherichia coli) 100 одиниць, що еквівалентно 3,49 мг;
1 флакон містить 10 мл розчину для ін’єкцій, що еквівалентно 1000 Од. інсуліну глюлізину;
допоміжні речовини: м-крезол, трометамін, натрію хлорид, полісорбат 20, натрію
гідроксид, кислота хлористоводнева концентрована, вода для ін`єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий безбарвний водний розчин.
Фармакотерапевтична група. Протидіабетичні засоби. Інсуліни та аналоги швидкої дії.
Код АТХ А10А В06.
Фармакологічні властивості.
Фармакодинаміка. Інсулін глюлізин є рекомбінантним аналогом інсуліну людини, що за своєю силою дії подібний до інсуліну людини. Інсулін глюлізин діє швидше та має меншу тривалість дії, ніж звичайний інсулін людини.
Основна дія інсулінів та їх аналогів, включаючи інсулін глюлізин, спрямована на регулювання метаболізму глюкози. Інсуліни знижують рівень вмісту глюкози у крові шляхом стимуляції периферійної утилізації глюкози, особливо у скелетних м’язах і жировій тканині, та пригнічення синтезу глюкози у печінці. Інсулін запобігає ліполізу в адипоцитах, протеолізу та посилює синтез протеїну.
Дослідження за участю здорових добровольців і хворих на цукровий діабет продемонстрували, що при підшкірному введенні інсулін глюлізин діє швидше та має меншу тривалість дії, ніж звичайний інсулін людини. Якщо інсулін глюлізин застосовується у вигляді ін’єкції підшкірно, зниження рівня глюкози у крові починається протягом 10-20 хвилин. При застосуванні підшкірно інсуліну глюлізину та звичайного інсуліну людини у дозі 0,15 Од/кг у різний час відносно 15-хвилинного стандартного прийому їжі було встановлено, що при введенні інсуліну глюлізину за умови введення за 2 хвилини до прийому їжі спостерігається постпрандіальний глікемічний контроль, подібний до такого при введенні звичайного інсуліну людини, що застосовувався за 30 хвилин до прийму їжі. При порівнянні гіпоглікемичних ефектів інсуліну глюлізину та звичайного інсуліну людини при введені за 2 хвилини до прийому їжі інсулін глюлізин забезпечував кращий постпрандіальний контроль, ніж звичайний інсулін людини. Застосування інсуліну глюлізину через 15 хвилин після початку прийому їжі забезпечує глікемічний контроль, подібний до такого при застосуванні звичайного інсуліну людини, що введений за 2 хвилини до початку прийому їжі.
Ожиріння.
Інсулін глюлізин зберігає свої швидкодіючі властивості у рпзі застосування пацієнтам з ожирінням. Час до досягнення 20 % загальної AUC та показник AUC (0-2 години), що є показниками ранньої дії інсулінів щодо зниження рівня глюкози, дорівнювали відповідно 114 хв. і 427 мг/кг для інсуліну глюлізину, 121 хв. і 354 мг/кг для інсуліну ліспро, 150 хв. і 197 мг/кг для звичайного інсуліну людини.
Раса та стать.
У ході контрольованих клінічних досліджень за участю дорослих пацієнтів інсулін глюлізин не продемонстрував різниці у безпеці та ефективності в підгрупах, що відрізнялися за расою та статтю.
Фармакокінетика.
Більш швидка абсорбція інсуліну глюлізину забезпечується заміною амінокислоти аспарагіну у позиції В3 інсуліну людини лізином і лізину у позиції В29 глютаміновою кислотою.
Абсорбція та біодоступність.
Фармакокінетичні профілі у здорових добровольців і хворих на цукровий діабет (І або ІІ типу) продемонстрували, що рівень абсорбції інсуліну глюлізину був у два рази вищий, а максимальна концентрація, приблизно у два рази вища порівняно з таким у звичайного інсуліну людини.
У хворих на цукровий діабет І типу після підшкірної ін’єкції у дозі 0,15 Од/кг показники Тмакс для інсуліну глюлізину дорівнювали 55 хв. і Смакс був 82 ± 1,3 µОд/мл порівняно з Тмакс , 82 хв. і Смакс 46 ± 1,3 µОд/мл для звичайного інсуліну людини. Середній час наявності в організмі інсуліну глюлізину був коротшим (98 хв.), ніж звичайного інсуліну людини (161 хв.).
У хворих на цукровий діабет ІІ типу після підшкірного застосування інсуліну глюлізину у дозі 0,2 Од/кг Смакс становить 91µОд/мл з інтервалом вірогідності від 78 до 104 µОд/мл.
При підшкірній ін’єкції інсуліну глюлізину у черевну стінку, стегно або дельтоподібний м’яз абсорбція препарату є більш швидкою при застосуванні в ділянку стінки живота, ніж у стегно. Абсорбція у місці ін’єкції в ділянці дельтоподібного м’яза була середньою між вищезазначеними показниками. Абсолютна біодоступність (70 %) інсуліну глюлізину була подібною у вищезазначених місцях ін’єкцій та мала низьку індивідуальну варіативність (11 % CV). Внутрішньовенне болюсне застосування інсуліну глюлізину було причиною більшого системного впливу порівняно з такими при підшкірній ін’єкції, причому значення Сmax було приблизно в 40 разів більшим.
Розподіл і виведення.
Розподіл і виведення інсуліну глюлізину і звичайного людського інсуліну після внутрішньовенного введення є подібним, при цьому об’єми розподілу становлять 13 л і 22 л, а періоди напіввиведення – 13 хв і 18 хв відповідно.
Після підшкірного застосування інсулін глюлізин виводиться швидше, ніж звичайний інсулін людини, з середньою тривалістю періодів напіввиведення 42 хв для інсуліну глюлізину порівняно з 86 хв для звичайного інсуліну. При аналізі перехресного дослідження інсуліну глюлізину за участю здорових добровольців або хворих на цукровий діабет
І або ІІ типу середня тривалість періоду напіввиведення була від 37 до 75 хвилин (інтервал вірогідності).
Інсулін глюлізин, як і людський інсулін, погано зв’язується з білками плазми крові.
Особливості застосування препарату специфічним групам пацієнтів
- Пацієнти з порушеннями функції нирок.
При порушенні функції нирок потреба в інсуліні може знижуватись, однак здатність інсуліну глюлізину швидко діяти зберігається.
- Пацієнти з порушеннями функції печінки.
Фармакокінетичні властивості інсуліну глюлізину не досліджувались у пацієнтів з порушенням функції печінки.
- Пацієнти літнього віку.
Стосовно пацієнтів літнього віку, хворих на цукровий діабет, існує дуже обмежена база даних щодо фармакокінетики препарату.
- Діти та підлітки.
Фармакокінетичні та фармакодинамічні властивості інсуліну глюлізину у дітей (7-11 років) і підлітків (12-16 років), хворих на цукровий діабет І типу, такі: інсулін глюлізин швидко засвоюється у хворих обох вікових груп і має такі ж показники Тмакс та Смакс, як і у дорослих. Введення інсуліну глюлізину безпосередньо перед прийомом їжі дітям та підліткам забезпечує кращий постпрандіальний глікемічний контроль порівняно зі звичайним інсуліном людини, як і у дорослих хворих. Відхилення рівня глюкози (AUC) становить 641 мг/год/дл для інсуліну глюлізину та 801 мг/год/дл для звичайного інсуліну людини.
Доклінічні дані щодо безпеки застосування
Доклінічні дані не вказують на наявність токсичності (крім тієї, що пов’язана з гіпоглікемією), яка б відрізнялася від показників звичайного інсуліну людини або була клінічно значущою для людей.
Клінічні характеристики.
Показання.
Цукровий діабет, коли необхідне застосування інсуліну дорослим, підліткам і дітям віком від 6 років і старше.
Протипоказання.
Гіперчутливість до інсуліну глюлізину або будь-якого компонента препарату. Гіпоглікемія.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження щодо типів фармакокінетичних взаємодій не проводилися. З огляду на емпіричні знання стосовно інших подібних лікарських засобів, прояв клінічно релевантних фармакокінетичних взаємодій є малоймовірним.
На метаболізм глюкози впливає цілий ряд речовин і лікарських препаратів. Отже, це може потребувати регулювання дози інсуліну глюлізину та особливо ретельного нагляду за хворим.
До речовин, що можуть посилити глюкозознижувальну активність та збільшити сприйнятливість до гіпоглікемії, належать пероральні антидіабетичні засоби, інгібітори ангіотензинперетворювалього ферменту, дизопірамід, фібрати, флуоксетин, інгібітори моноаміноксидази, пентоксифілін, пропоксифен, саліцилати та сульфаніламідні антибіотики.
Речовини, що можуть призвести до зростання рівня глюкози у крові: кортикостероїди, даназол, діазоксид, діуретики, глюкагон, ізоніазид, похідні фенотіазину, соматропін, симпатоміметичні агенти (такі як, епінефрин [адреналін], сальбутамол, тербуталін), тиреоїдні гормони, естрогени, прогестини (наприклад, у складі пероральних контрацептивів), інгібітори протеїнази та атипічні антипсихотичні лікарські засоби (зокрема, оланзапін і клозапін).
Бета-блокатори, клонідин, солі літію або алкоголь можуть призвести як до підвищення, так і до зниження властивості інсуліну зменшувати рівень глюкози у крові. Пентамідин може спричинювати розвиток гіпоглікемії, що іноді супроводжується гіперглікемією.
Крім того, під впливом симпатолітичних лікарських засобів, таких як клонідин, гуанетидин, резерпін, і бета-блокаторів ознаки адренергічного зворотного регулювання можуть бути ослаблені або навіть відсутні.
Особливості застосування.
Перехід пацієнта на застосування нового типу або іншої торгової марки препарату інсуліну повинно відбуватися під ретельним наглядом лікаря. Зміни сили дії, торгової марки (виробника), типу препарату (звичайний, НПХ [нейтральний протамін Хагедорна], ленте, тривалої дії тощо), походження (тваринний, людський, аналог людського інсуліну) та/або методу виробництва можуть обумовлювати виникнення потреби у зміні дози. Також може виникати необхідність у внесенні змін до схеми супутнього застосування пероральних протидіабетичних препаратів.
Гіперглікемія
Застосування невідповідних доз або припинення лікування, особливо у хворих на інсулінозалежний діабет, може призвести до розвитку гіперглікемії та діабетичного кетоацидозу – станів, що є потенційно летальними.
Гіпоглікемія
Час розвитку гіпоглікемії залежить від профілю дії використовуваних інсулінів і, таким чином, може змінюватися після зміни схеми лікування.
Умови, які можуть зробити ранні попереджувальні симптоми гіпоглікемії нетиповими або менш вираженими, включають значну тривалість захворювання на діабет, інтенсивну інсулінотерапію, діабетичну нейропатію, застосування лікарських препаратів, таких як бета-блокатори, або перехід з інсуліну тваринного походження на інсулін людини.
Потреба у корекції дози також може виникнути, якщо пацієнти збільшують свою фізичну активність або змінюють свій звичайний раціон харчування. Фізичні навантаження одразу після прийому їжі можуть підвищувати ризик розвитку гіпоглікемії.
Гіпоглікемія після введення швидкодіючих аналогів інсуліну може виникати раніше, ніж при застосуванні розчинного інсуліну людини.
Якщо не надати пацієнту відповідної допомоги, гіпоглікемічні або гіперглікемічні реакції можуть призвести до втрати свідомості, коми або летального наслідку.
Потреба в інсуліні може змінюватися при наявності іншої хвороби або емоційних порушень.
Помилкове введення іншого препарату
Надходили повідомлення про помилкове введення препаратів, коли замість інсуліну глюлізину випадково вводилися інші інсуліни, зокрема інсуліни тривалої дії. Перед кожною ін’єкцією слід перевіряти інформацію на етикетці препарату, щоб уникнути помилкового введення замість інсуліну глюлізину інших інсулінів.
Безперервна підшкірна інфузія інсуліну
Несправність інсулінового насоса чи системи для інфузійного введення або неправильне поводження з ними може призводити до швидкого розвитку гіперглікемії, кетозу або діабетичного кетоацидозу.У таких випадках необхідне швидке визначення та усунення причини гіперглікемії, кетозу або діабетичного кетоацидозу.
Повідомлялося про випадки розвитку діабетичного кетоацидозу при введенні препарату Епайдра® шляхом безперервної підшкірної інфузії інсуліну за допомогою насосних систем. Більшість із цих випадків була пов'язана з неправильним поводженням з насосними системами або з їхніми несправностями.
Може бути потрібне тимчасове введення препарату Епайдра® шляхом підшкірних ін'єкцій.Пацієнтів, які отримують інсулінотерапію шляхом безперервної підшкірної інфузії інсуліну за допомогою насосних систем, необхідно навчити вводити інсулін за допомогою ін'єкцій. Такі пацієнти повинні мати напоготові інший засіб введення інсуліну на випадок несправності насосної системи (див. розділи «Особливості застосування » і «Побічні реакції»).
Допоміжні речовини
Одна доза цього лікарського засобу містить менше ніж 1 ммоль (23 мг) натрію, тобто він практично не містить натрію.
Епайдра® містить м-крезол, який може спричинити алергічні реакції.
Комбінація препарату Епайдра з піоглітазоном
Повідомлялося про випадки серцевої недостатності при застосуванні піоглітазону в поєднанні з інсуліном, особливо в пацієнтів, які мають фактори ризику розвитку серцевої недостатності. Це потрібно враховувати при розгляді можливості проведення лікування комбінацією піоглітазону і препарату Епайдра®. При застосуванні цієї комбінації за пацієнтами потрібно спостерігати щодо появи ознак і симптомів серцевої недостатності, збільшення маси тіла і появи набряків.
При будь-якому погіршенні кардіологічних симптомів застосування піоглітазону потрібно припинити.
Застосування у період вагітності або годування груддю.
Вагітність
Дані щодо застосування інсуліну глюлізину вагітним жінкам відсутні або обмежені (менше ніж 300 результатів вагітності).
В ході досліджень впливу на репродуктивну функцію, проведених на тваринах, не було виявлено жодних відмінностей між застосуванням інсуліну глюлізину та інсуліну людини стосовно впливу на вагітність, розвиток ембріона/плода, пологи або постнатальний розвиток (див. розділ «Фармакологічні властивості»).
Вагітним жінкам цей препарат слід застосовувати з обережністю. Необхідно ретельно контролювати рівень глюкози.
Пацієнтам з діагностованим або гестаційним цукровим діабетом у період вагітності слід підтримувати належний метаболічний контроль. Потреба організму в інсуліні може зменшуватися в першому триместрі вагітності та, як правило, збільшується в період другого та третього триместрів. Одразу після пологів потреба організму в інсуліні швидко зменшується.
Годування груддю
Невідомо, чи екскретується інсулін глюлізин у грудне молоко людини, проте звичайно інсулін не проникає до грудного молока та не абсорбується після перорального прийому.
Жінкам, які годують груддю, може бути необхідно скоригувати дозу інсуліну та раціон харчування.
Фертильність
В ході досліджень впливу інсулінy глюлізинy на репродуктивну функцію, проведених на тваринах, не було виявлено жодних небажаних впливів на фертильність.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Здатність пацієнта концентрувати увагу та його реакція можуть порушуватись унаслідок розвитку гіпоглікемії або гіперглікемії або, наприклад, у результаті порушення зору. Це може становити ризик у ситуаціях, коли наявність таких симптомів є особливо важливою (зокрема, під час керування автомобілем або механізмами).
Пацієнтам слід рекомендувати бути обережними та запобігати розвитку гіпоглікемії під час керування транспортом. Це особливо важливо для тих, хто недостатньо поінформований або зовсім не поінформований щодо симптомів-провісників гіпоглікемії, і для тих хворих, у кого часто виникають епізоди гіпоглікемій. За цих обставин слід розглянути доцільність керування транспортом.
Спосіб застосування та дози.
Сила дії цього препарату виражається в одиницях. Ці одиниці використовуються виключно для препарату Епайдра® і відрізняються від МО чи одиниць, у яких виражається сила дії інших аналогів інсуліну.
Препарат Епайдра® можна застосовувати у режимах інсулінотерапії, що включають інсулін середньої або довготривалої дії, або аналог базального інсуліну, та можна застосовувати одночасно з пероральними протидіабетичними засобами.
Дозу препарату Епайдра® підбирають та регулюють індивідуально.
Особливі категорії пацієнтів
Пацієнти з порушеннями функції нирок
Фармакокінетичні властивості інсуліну глюлізину в цілому зберігаються у пацієнтів з порушенням функції нирок. Однак у разі порушення функції нирок потреба в інсуліні може знижуватися (див. розділ «Фармакокінетика»).
Пацієнти з порушеннями функції печінки
Фармакокінетичні властивості інсуліну глюлізину не вивчались у пацієнтів зі зниженою функцією печінки. У пацієнтів з порушенням функції печінки потреба в інсуліні може бути меншою через зниження глюконеогенезу та здатності інсуліну метаболізуватися.
Пацієнти літнього віку
Наявні дані з фармакокінетики інсуліну у пацієнтів літнього віку, хворих на цукровий діабет, є недостатніми. Погіршення функції нирок може призвести до зменшення потреби в інсуліні.
Діти та підлітки
Не існує достовірної клінічної інформації щодо застосування препарату Епайдра® у дітей віком до 6 років.
Застосування.
Препарат Епайдра® слід вводити шляхом підшкірної ін’єкції незадовго (за 0‑15 хвилин) до чи одразу після прийому їжі або шляхом постійної підшкірної інфузії за допомогою інсулінового насоса.
Препарат Епайдра® потрібно вводити підшкірно в ділянку передньої стінки живота, стегна чи дельтоподібного м’яза або шляхом безперервної інфузії під шкіру передньої стінки живота. Місця для ін’єкцій або інфузій у зоні ін’єкції (передня стінка живота, стегно або дельтоподібний м’яз) слід по черзі змінювати. Ступінь абсорбції і, ймовірно, початок та термін дії можуть залежати від певного місця ін’єкції, техніки її виконання та інших змінних показників. Підшкірна ін’єкція у передню стінку живота забезпечує дещо швидшу абсорбцію, ніж введення препарату в інші місця для ін’єкцій.
Слід дотримуватися обережності, щоб виключити введення препарату безпосередньо у кровоносну судину. Після введення препарату не слід масажувати місце ін’єкції.
Пацієнтів слід навчати дотримуватись правильної процедури виконання ін’єкцій.
Змішування з іншими інсулінами
Препарат Епайдра®, який вводиться у вигляді підшкірної ін’єкції, забороняється змішувати з будь-якими іншими лікарськими засобами, окрім людського інсуліну НПХ (нейтрального протаміну Хагедорна). При змішуванні з НПХ (нейтральним протаміном Хагердона) інсуліном людини спочатку слід набрати у шприц препарат Епайдра®. Ін’єкцію потрібно робити одразу ж після змішування, оскільки належних даних стосовно стабільності сумішей, приготовлених задовго до введення, немає.
Безперервна підшкірна інфузія інсуліну
Препарат Епайдра® можна застосовувати для безперервної підшкірної інфузії інсуліну (CSII) через насосні системи, призначені для проведення інфузії інсуліну та укомплектовані відповідними катетерами та резервуарами. Пацієнтів, які користуються CSII, потрібно ретельно проінструктувати щодо застосування насосних систем.
Систему інфузійного введення та резервуар, які використовуються для введення препарату Епайдра®, потрібно заміняти принаймні кожні 48 годин із дотриманням правил асептики. Ці інструкції можуть відрізнятися від загальних інструкцій з використання насосних систем. Важливо, щоб при застосуванні препарату Епайдра® пацієнти дотримувалися специфічних інструкцій щодо цього препарату. Недотримання специфічних інструкцій щодо препарату Епайдра® може призвести до серйозних небажаних явищ.
При підшкірному введенні за допомогою інсулінового інфузійного насоса препарат Епайдра® забороняється змішувати з розчинниками або будь-яким іншим інсуліном.
Пацієнти, які застосовують препарат Епайдра® за допомогою CSII, повинні додатково мати інший засіб введення інсуліну на випадок несправності насосної системи (див. розділи «Особливості застосування » і «Побічні реакції»).
Діти. Даних щодо клінічного застосування препарату Епайдра® дітям віком до 6 років недостатньо.
Передозування.
Гіпоглікемія може виникати як наслідок надмірної дії інсуліну відносно до об’єму прийнятої їжі та витрат енергії.
Специфічні дані щодо передозування інсуліну глюлізину відсутні. Проте гіпоглікемія може розвинутися поступово.
Помірні гіпоглікемічні епізоди можуть лікуватися шляхом перорального застосування глюкози або цукру. Таким чином, хворому на цукровий діабет рекомендується постійно мати при собі кілька шматочків цукру, цукерок, печива або фруктового соку з цукром. Цукрозамінники не можна використовувати для лікування гіпоглікемічних станів.
Тяжкі гіпоглікемічні епізоди, при яких пацієнт втрачає свідомість, можна усувати шляхом введення глюкагону (0,5-1 мг) внутрішньом’язово або підшкірно, що може зробити відповідним чином проінструктована особа, або шляхом внутрішньовенного введення глюкози, що має виконати медичний працівник. Глюкоза вводиться внутрішньовенно також у разі, якщо стан пацієнта не покращується протягом 10 або 15 хвилин після введення глюкагону.
Коли хворий опритомніє, рекомендується застосувати вуглеводи перорально з метою запобігання рецидиву гіпоглікемії.
Після ін’єкції глюкагону пацієнта слід обстежити у лікарні для виявлення причини виникнення тяжкої гіпоглікемії та запобігання виникненню подібних нападів.
Побічні реакції.
Найпоширенішою побічною дією інсулінотерапії є гіпоглікемія, що виникає як наслідок застосування значно більшої дози інсуліну, ніж це потрібно.
Відповідні побічні реакції, продемонстровані під час проведення клінічних досліджень, наводяться нижче за класами систем органів та у порядку зменшення частоти виникнення: дуже часто (≥ 1/10); часто (≥ 1/100 - < 1/10); нечасто (≥ 1/1 000 - < 1/100); рідко (≥ 1/10 000 - < 1/1 000); дуже рідко (< 1/10 000), частота невідома (не можна розрахувати за наявними даними).
У кожній з груп побічні явища представлені у порядку зменшення ступеня їх серйозності.
|
Класи систем органів за MedDRA |
Дуже часто |
Часто |
Нечасто |
Рідко |
Частота невідома |
|
Метаболічні та аліментарні розлади |
Гіпоглікемія |
Гіперглікемія (що потенційно може призводити до діабетичного кетоацидозу(1)) |
|||
|
Розлади з боку шкіри та підшкірної клітковини |
Реакції у місці ін’єкції. |
Ліпо-дистрофія |
|||
|
Загальні розлади та реакції у місці застосування |
Системні реакції гіперчутли-вості |
(1) Більшість з цих випадків була пов'язана із неправильним поводженням із насосною системою або її несправностями при застосуванні препарату Епайдра® за допомогою CSII.
Опис окремих небажаних реакцій
Метаболічні та аліментарні розлади.
Симптоми гіпоглікемії, як правило, виникають раптово. Вони включають холодний піт, холодну бліду шкіру, втомлюваність, нервозність або тремор, відчуття неспокою, незвичну втомлюваність або слабкість, збентеження, порушення концентрації уваги, сонливість, сильне відчуття голоду, порушення зору, головний біль, нудоту та сильне серцебиття. Гіпоглікемія може досягти значного ступеня і призвести до втрати свідомості та/або судом і спричинити тимчасове або постійне порушення функції мозку або навіть стати причиною летального наслідку.
Повідомлялося про випадки розвитку гіперглікемії при застосуванні препарату Епайдра® за допомогою CSII (див. розділ «Особливості застосування»), які призводили до виникнення діабетичного кетоацидозу (ДКА); більшість з цих випадків була пов'язана із неправильним поводженням із насосною системою або її несправностями. Пацієнт повинен завжди дотримуватися специфічних інструкцій із введення препарату Епайдра® та обов'язково мати напоготові інший засіб введення інсуліну на випадок несправності насосної системи.
Розлади з боку шкіри та підшкірних тканин.
Місцеві реакції гіперчутливості (почервоніння, набряк і свербіж у місці ін’єкції) можливі під час лікування із застосуванням інсуліну. Такі реакції, як правило, є минущими та зазвичай зникають у разі продовження лікування.
Ліподистрофія може виникати у місці ін’єкції як наслідок недотримання порядку зміни місця ін’єкції.
Порушення загального стану та реакції у місці введення.
Cистемні реакції гіперчутливості можуть включати кропив’янку, стиснення у грудях, задишку, алергічний дерматит і свербіж. Тяжкі випадки включають генералізовану алергічну реакцію разом з анафілактичною реакцією, що може загрожувати життю.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати у недоступному для дітей місці.
Зберігати у холодильнику при температурі від +2ºС до +8ºС в оригінальній упаковці для захисту від дії світла. Не заморожувати. Запобігати контакту зі стінками холодильника або накопичувачами холоду.
Умови зберігання після відкриття флакону.
Відкриті флакони необхідно використати протягом 4 тижнів. Під час використання зберігати при температурі не вище +25°С подалі від джерел прямого тепла та прямого світла. Зберігати в оригінальній упаковці для захисту від дії світла. Рекомендується зазначати на етикетці дату першого використання флакона.
Несумісність.
Підшкірне введення.
Препарат Епайдра® не слід змішувати з іншими препаратами, відмінними за складом від НПХ (нейтрального протаміну Хагедорна) інсуліну людини.
При підшкірному введенні за допомогою інсулінового інфузійного насосу препарат Епайдра® забороняється змішувати з іншими лікарськими засобами.
Упаковка. № 1: по 10 мл у флаконі; по 1 флакону в картонній коробці.
Категорія відпуску. За рецептом.
Виробник. Санофі-Авентіс Дойчланд ГмбХ, Німеччина/ Sanofi-Aventis Deutschland GmbH, Germany.
Місцезнаходженнявиробника та його адреса місця провадження діяльності.
Брюнінгштрассе 50 Н600, H500, H590 65926 Франкфурт-на-Майні, Німеччина/ Bruningstrasse 50 Н600, H500, H590 65926 Frankfurt am Main, Germany.
Заявник. ТОВ «Санофі-Авентіс Україна», Україна/ Sanofi-Aventis Ukraine LLC, Ukraine.
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЕПАЙДРА®
(APIDRA®)
Склад:
діюча речовина:інсулін глюлізин;
1мл розчину містить інсуліну глюлізину (продукту рекомбінантної ДНК-технології із застосуванням Escherichia coli) 100 одиниць, що еквівалентно 3,49 мг;
1 шприц-ручка СолоСтар® містить 3 мл розчину для ін’єкцій, що еквівалентно 300 Oд. інсуліну глюлізину;
допоміжні речовини: м-крезол, трометамін, натрію хлорид, полісорбат 20, натрію
гідроксид, кислота хлористоводнева концентрована, вода для ін`єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий безбарвний водний розчин.
Фармакотерапевтична група. Протидіабетичні засоби. Інсуліни та аналоги швидкої дії. Код АТС А10А В06.
Фармакологічні властивості.
Фармакодинаміка. Інсулін глюлізин є рекомбінантним аналогом інсуліну людини, що за своєю силою дії подібний до інсуліну людини. Інсулін глюлізин діє швидше та має меншу тривалість дії, ніж звичайний інсулін людини.
Основна дія інсулінів та їх аналогів, включаючи інсулін глюлізин, спрямована на регулювання метаболізму глюкози. Інсуліни знижують рівень вмісту глюкози у крові шляхом стимуляції периферійної утилізації глюкози, особливо у скелетних м’язах і жировій тканині, та пригнічення синтезу глюкози у печінці. Інсулін запобігає ліполізу в адипоцитах, протеолізу та посилює синтез протеїну.
Дослідження за участю здорових добровольців і хворих на цукровий діабет продемонстрували, що при підшкірному введенні інсулін глюлізин діє швидше та має меншу тривалість дії, ніж звичайний інсулін людини. Якщо інсулін глюлізин застосовується у вигляді ін’єкції підшкірно, зниження рівня глюкози у крові починається протягом 10-20 хвилин. При застосуванні підшкірно інсуліну глюлізину та звичайного інсуліну людини у дозі 0,15 Од/кг у різний час відносно 15-хвилинного стандартного прийому їжі було встановлено, що при введенні інсуліну глюлізину за умови введення за 2 хвилини до прийому їжі спостерігається постпрандіальний глікемічний контроль, подібний до такого при введенні звичайного інсуліну людини, що застосовувався за 30 хвилин до прийму їжі. При порівнянні гіпоглікемичних ефектів інсуліну глюлізину та звичайного інсуліну людини при введені за 2 хвилини до прийому їжі інсулін глюлізин забезпечував кращий постпрандіальний контроль, ніж звичайний інсулін людини. Застосування інсуліну глюлізину через 15 хвилин після початку прийому їжі забезпечує глікемічний контроль, подібний до такого при застосуванні звичайного інсуліну людини, що введений за 2 хвилини до початку прийому їжі.
Ожиріння.
Інсулін глюлізин зберігає свої швидкодіючі властивості у рпзі застосування пацієнтам з ожирінням. Час до досягнення 20 % загальної AUC та показник AUC (0-2 години), що є показниками ранньої дії інсулінів щодо зниження рівня глюкози, дорівнювали відповідно 114 хв. і 427 мг/кг для інсуліну глюлізину, 121 хв. і 354 мг/кг для інсуліну ліспро, 150 хв. і 197 мг/кг для звичайного інсуліну людини.
Раса та стать.
У ході контрольованих клінічних досліджень за участю дорослих пацієнтів інсулін глюлізин не продемонстрував різниці у безпеці та ефективності в підгрупах, що відрізнялися за расою та статтю.
Фармакокінетика.
Більш швидка абсорбція інсуліну глюлізину забезпечується заміною амінокислоти аспарагіну у позиції В3 інсуліну людини лізином і лізину у позиції В29 глютаміновою кислотою.
Абсорбція та біодоступність.
Фармакокінетичні профілі у здорових добровольців і хворих на цукровий діабет (І або ІІ типу) продемонстрували, що рівень абсорбції інсуліну глюлізину був у два рази вищий, а максимальна концентрація, приблизно у два рази вища порівняно з таким у звичайного інсуліну людини.
У хворих на цукровий діабет І типу після підшкірної ін’єкції у дозі 0,15 Од/кг показники Тмакс для інсуліну глюлізину дорівнювали 55 хв. і Смакс був 82 ± 1,3 µОд/мл порівняно з Тмакс , 82 хв. і Смакс 46 ± 1,3 µОд/мл для звичайного інсуліну людини. Середній час наявності в організмі інсуліну глюлізину був коротшим (98 хв.), ніж звичайного інсуліну людини (161 хв.).
У хворих на цукровий діабет ІІ типу після підшкірного застосування інсуліну глюлізину у дозі 0,2 Од/кг Смакс становить 91µОд/мл з інтервалом вірогідності від 78 до 104 µОд/мл.
При підшкірній ін’єкції інсуліну глюлізину у черевну стінку, стегно або дельтоподібний м’яз абсорбція препарату є більш швидкою при застосуванні в ділянку стінки живота, ніж у стегно. Абсорбція у місці ін’єкції в ділянці дельтоподібного м’яза була середньою між вищезазначеними показниками. Абсолютна біодоступність (70 %) інсуліну глюлізину була подібною у вищезазначених місцях ін’єкцій та мала низьку індивідуальну варіативність (11 % CV). Внутрішньовенне болюсне застосування інсуліну глюлізину було причиною більшого системного впливу порівняно з такими при підшкірній ін’єкції, причому значення Сmax було приблизно в 40 разів більшим.
Розподіл і виведення.
Розподіл і виведення інсуліну глюлізину і звичайного людського інсуліну після внутрішньовенного введення є подібним, при цьому об’єми розподілу становлять 13 л і 22 л, а періоди напіввиведення – 13 хв і 18 хв відповідно.
Після підшкірного застосування інсулін глюлізин виводиться швидше, ніж звичайний інсулін людини, з середньою тривалістю періодів напіввиведення 42 хв для інсуліну глюлізину порівняно з 86 хв для звичайного інсуліну. При аналізі перехресного дослідження інсуліну глюлізину за участю здорових добровольців або хворих на цукровий діабет
І або ІІ типу середня тривалість періоду напіввиведення була від 37 до 75 хвилин (інтервал вірогідності).
Інсулін глюлізин, як і людський інсулін, погано зв’язується з білками плазми крові.
Особливості застосування препарату окремим групам пацієнтів
- Пацієнти з порушеннями функції нирок.
При порушенні функції нирок потреба в інсуліні може знижуватись, однак здатність інсуліну глюлізину швидко діяти зберігається.
- Пацієнти з порушеннями функції печінки.
Фармакокінетичні властивості інсуліну глюлізину не досліджувались у пацієнтів з порушенням функції печінки.
- Пацієнти літнього віку.
Стосовно пацієнтів літнього віку, хворих на цукровий діабет, існує дуже обмежена база даних щодо фармакокінетики препарату.
- Діти та підлітки.
Фармакокінетичні та фармакодинамічні властивості інсуліну глюлізину у дітей (7-11 років) і підлітків (12-16 років), хворих на цукровий діабет І типу, такі: інсулін глюлізин швидко засвоюється у хворих обох вікових груп і має такі ж показники Тмакс та Смакс, як і у дорослих. Введення інсуліну глюлізину безпосередньо перед прийомом їжі дітям та підліткам забезпечує кращий постпрандіальний глікемічний контроль порівняно зі звичайним інсуліном людини, як і у дорослих хворих. Відхилення рівня глюкози (AUC) становить 641 мг/год/дл для інсуліну глюлізину та 801 мг/год/дл для звичайного інсуліну людини.
Доклінічні дані щодо безпеки застосування
Доклінічні дані не вказують на наявність токсичності (крім тієї, що пов’язана з гіпоглікемією), яка б відрізнялася від показників звичайного інсуліну людини або була клінічно значущою для людей.
Клінічні характеристики.
Показання. Цукровий діабет, коли необхідне застосування інсуліну дорослим, підліткам і дітям віком від 6 років і старше.
Протипоказання.
Гіперчутливість до інсуліну глюлізину або до будь-якого компонента препарату. Гіпоглікемія.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження щодо типів фармакокінетичних взаємодій не проводилися. З огляду на емпіричні знання стосовно інших подібних лікарських засобів, прояв клінічно релевантних фармакокінетичних взаємодій є малоймовірним.
На метаболізм глюкози впливає цілий ряд речовин і лікарських препаратів. Отже, це може потребувати регулювання дози інсуліну глюлізину та особливо ретельного нагляду за хворим.
До речовин, що можуть посилити глюкозознижувальну активність та збільшити сприйнятливість до гіпоглікемії, належать пероральні антидіабетичні засоби, інгібітори ангіотензинперетворювального ферменту, дизопірамід, фібрати, флуоксетин, інгібітори моноаміноксидази, пентоксифілін, пропоксифен, саліцилати та сульфаніламідні антибіотики.
Речовини, що можуть призвести до зростання рівня глюкози у крові: кортикостероїди, даназол, діазоксид, діуретики, глюкагон, ізоніазид, похідні фенотіазину, соматропін, симпатоміметичні агенти (такі як, епінефрин [адреналін], сальбутамол, тербуталін), тиреоїдні гормони, естрогени, прогестини (наприклад, у складі пероральних контрацептивів), інгібітори протеїнази та атипічні антипсихотичні лікарські засоби (зокрема, оланзапін і клозапін).
Бета-блокатори, клонідин, солі літію або алкоголь можуть призвести як до підвищення, так і до зниження властивості інсуліну зменшувати рівень глюкози у крові. Пентамідин може спричинювати розвиток гіпоглікемії, що іноді супроводжується гіперглікемією.
Крім того, під впливом симпатолітичних лікарських засобів, таких як клонідин, гуанетидин, резерпін, і бета-блокаторів ознаки адренергічного зворотного регулювання можуть бути ослаблені або навіть відсутні.
Особливості застосування.
Перехід пацієнта на застосування нового типу або препарату інсуліну повинно відбуватися під ретельним наглядом лікаря. Зміни сили дії, типу препарату (виробника), виду препарату (звичайний, НПХ, ленте, тривалої дії тощо), походження (тваринний, людський, аналог людського інсуліну) та/або методу виробництва можуть потребувати зміни дози. Також може виникати необхідність у регулюванні схеми супутнього застосування пероральних антидіабетичних препаратів.
Гіперглікемія.
Застосування невідповідних доз або припинення лікування, особливо у хворих на інсулінозалежний діабет, може призвести до розвитку гіперглікемії та діабетичного кетоацидозу – станів, що є потенційно летальними.
Гіпоглікемія.
Гіпоглікемія виникає залежно від профілю дії інсулінів, що застосовуються, та може, таким чином, змінюватися при переході на новий режим лікування.
Умови, які можуть зробити ранні попереджувальні симптоми гіпоглікемії нетиповими або менш вираженими, включають значну тривалість захворювання на діабет, інтенсивну інсулінотерапію, діабетичну нейропатію, застосування лікарських препаратів, таких як бета-блокатори, або перехід з інсуліну тваринного походження на інсулін людини. Потреба у корекції дози також може виникнути, якщо пацієнти підвищують режим фізичної активності або змінюють свою звичайну харчову дієту. Фізичні навантаження одразу після їди підвищують ризик розвитку гіпоглікемії.
Гіпоглікемія після ін’єкції швидкодіючих аналогів інсуліну, як правило, виникає раніше, ніж при застосуванні розчинного інсуліну людини. Гіпоглікемічні або гіперглікемічні реакції, якщо не надати пацієнту відповідної допомоги, можуть призвести до втрати свідомості, коми або летального наслідку.
Потреба в інсуліні може змінюватися при наявності іншої хвороби або емоційних порушень.
Надходили повідомлення про помилкове введення препаратів, коли замість інсуліну глюлізину випадково вводилися інші інсуліни, зокрема інсуліни тривалої дії. Перед кожною ін’єкцією слід перевіряти інформацію на етикетці, щоб уникнути помилкового введення замість інсуліну глюлізину інших інсулінів.
Одна доза цього лікарського засобу містить менше ніж 1 ммоль (23 мг) натрію, тобто він практично не містить натрію.
Епайдра® містить м-крезол, який може спричинити алергічні реакції.
Комбінація препаратуЕпайдра® зпіоглітазоном.
Про випадки серцевої недостатності повідомлялося при застосуванні піоглітазону в поєднанні з інсуліном, особливо в пацієнтів, які мають ризик розвитку серцевої недостатності. Це потрібно враховувати при розгляді можливості проведення лікування комбінацією піоглітазону і препарату Епайдра®. При застосуванні цієї комбінації за пацієнтами потрібно спостерігати щодо появи ознак і симптомів серцевої недостатності, збільшення маси тіла і набряку. При будь-якому погіршенні кардіологічних симптомів застосування піоглітазону потрібно припинити.
Застосування у період вагітності або годування груддю.
Вагітність
Дані щодо застосування інсуліну глюлізину вагітним жінкам відсутні або обмежені (менше ніж 300 результатів вагітності).
В ході досліджень впливу на репродуктивну функцію, проведених на тваринах, не було виявлено жодних відмінностей між застосуванням інсуліну глюлізину та інсуліну людини стосовно впливу на вагітність, розвиток ембріона/плода, пологи або постнатальний розвиток (див. розділ «Фармакологічні властивості»).
Вагітним жінкам цей препарат слід застосовувати з обережністю. Необхідно ретельно контролювати рівень глюкози.
Пацієнтам з діагностованим або гестаційним цукровим діабетом у період вагітності слід підтримувати належний метаболічний контроль. Потреба організму в інсуліні може зменшуватися в першому триместрі вагітності та, як правило, збільшується в період другого та третього триместрів. Одразу після пологів потреба організму в інсуліні швидко зменшується.
Годування груддю
Невідомо, чи екскретується інсулін глюлізин у грудне молоко людини, проте звичайно інсулін не проникає до грудного молока та не абсорбується після перорального прийому.
Жінкам, які годують груддю, може бути необхідно скоригувати дозу інсуліну та раціон харчування.
Фертильність
В ході досліджень впливу інсулінy глюлізинy на репродуктивну функцію, проведених на тваринах, не було виявлено жодних небажаних впливів на фертильність.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Здатність пацієнта концентрувати увагу та його реакція можуть порушуватись унаслідок розвитку гіпоглікемії або гіперглікемії або, наприклад, у результаті порушення зору. Це може становити ризик у ситуаціях, коли наявність таких симптомів є особливо важливим (зокрема, під час керування автомобілем або механізмами).
Пацієнтам слід рекомендувати бути обережними та запобігати розвитку гіпоглікемії під час керування транспортом. Це особливо важливо для тих, хто недостатньо поінформований або зовсім не поінформований щодо симптомів-провісників гіпоглікемії, і для тих хворих, у кого часто виникають епізоди гіпоглікемії. За цих обставин слід розглянути доцільність керування транспортом.
Спосіб застосування та дози.
Сила дії цього препарату виражається в одиницях, які застосовуються виключно для препарату Епайдра® і відрізняються від МО чи одиниць, у яких виражається сила дії інших аналогів інсуліну.
Препарат Епайдра® застосовують у режимах інсулінотерапії, що включають інсулін середньої або довготривалої дії, або аналог базального інсуліну та можна використовувати одночасно з пероральними гіпоглікемічними засобами.
Дозу препарату Епайдра® підбирають та регулюють індивідуально.
Особливі категорії пацієнтів.
Пацієнти з порушеннями функції нирок.
Фармакокінетичні властивості інсуліну глюлізину в цілому зберігаються у пацієнтів з порушенням функції нирок. Однак у разі порушення функції нирок потреба в інсуліні може знижуватися (див. розділ «Фармакокінетика»).
Пацієнти з порушеннями функції печінки.
Фармакокінетичні властивості інсуліну глюлізину не вивчались у пацієнтів зі зниженою функцією печінки. У пацієнтів з порушенням функції печінки потреба в інсуліні може бути меншою через зниження глюконеогенезу та здатності інсуліну метаболізуватися.
Пацієнти літнього віку.
Наявні дані з фармакокінетики інсуліну у пацієнтів літнього віку, хворих на цукровий діабет, є недостатніми. Погіршання функції нирок може призвести до зниження потреби в інсуліні.
Діти та підлітки.
Не існує достовірної клінічної інформації щодо застосування препарату Епайдра® дітям віком до 6 років.
Застосування.
Препарат Епайдра® слід вводити шляхом підшкірної ін’єкції незадовго (за 0-15хвилин) до чи одразу після прийому їжі або шляхом постійної підшкірної інфузії за допомогою інсулінового насоса.
Препарат Епайдра® застосовують підшкірно у ділянку черевної стінки, стегна або дельтоподібного м’яза, або шляхом безперервної інфузії під шкіру передньої стінки живота. Місця для ін’єкцій або інфузій у зоні ін’єкції (передня стінка черевної порожнини, стегно або дельтоподібний м’яз) слід по черзі змінювати. Ступінь абсорбції і, ймовірно, початок та термін дії можуть залежати від певного місця ін’єкції, техніки її виконання та інших змінних показників. Підшкірна ін’єкція у черевну стінку забезпечує трохи швидшу абсорбцію, ніж введення препарату в інші місця для ін’єкцій.
Необхідно слідкувати за тим, щоб не пошкоджувати кровоносні судини. Після введення препарату не слід масажувати місце ін’єкції. Пацієнтів слід навчати дотримуватись правильної процедури виконання ін’єкцій.
Змішування з іншими інсулінами.
Інсулін глюлізин не слід змішувати з іншими лікарськими засобами, крім людського інсуліну НПХ (нейтрального протаміну Хагедорна).
ІНСТРУКЦІЯ
з використання шприц-ручки CолоСтар®
Перед першим застосуванням шприц-ручку слід витримати при кімнатній температурі протягом 1-2 годин.
Перевірте картридж перед його використанням. Його можна застосовувати лише тоді, коли розчин у ньому є прозорим, безбарвним, без видимих твердих часточок та має таку ж консистенцію, як і вода. Оскільки Епайдра® є розчином, вона не потребує ресуспендування перед застосуванням.
Порожні шприц-ручки не можна використовувати знову, їх потрібно належним чином знищити.
Щоб запобігти інфікуванню, кожна попередньо наповнена шприц-ручка повинна використовуватися лише однією особою.
Перед кожною ін’єкцією слід перевіряти інформацію на етикетці, щоб уникнути помилкового введення замість інсуліну глюлізину інших інсулінів (див. розділ «Особливості застосування»).
Схематичне зображення шприц-ручки СолоСтар®
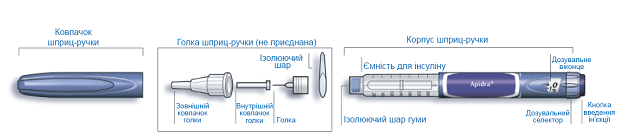
Важлива інформація для використанняшприц-ручки СолоСтар®:
- Для кожної ін’єкції використовуйте нову голку, сумісну виключно зі шприц-ручкою СолоСтар®. Не обирайте дозу та не натискайте кнопку введення, якщо голка не приєднана до шприц-ручки.
- Тест на безпеку виконуйте перед кожною ін’єкцією.
- Шприц-ручка призначений особисто Вам, і не слід передавати її іншим особам.
- Якщо ін’єкцію Вам вводить інша особа, ця особа має вживати спеціальних заходів безпеки для запобігання нещасних випадків, пов’язаних із застосуванням голки та перенесенням інфекції.
- Не використовуйте шприц-ручку СолоСтар® у разі пошкодження або при наявності сумнівів щодо правильності її функціонування.
- Завжди необхідно мати запасну шприц-ручку СолоСтар® на випадок втрати або пошкодження.
Інструкції щодо зберігання.
Уважно ознайомтеся з інформацією щодо зберігання шприц-ручки СолоСтар®.
Якщо Ваша шприц-ручка СолоСтар® зберігається в холодильнику, вийміть її звідти за
1-2 години перед введенням препарату, щоб він нагрівся до кімнатної температури. Ін’єкційне введення охолодженого інсуліну є більш болісним.
Використана шприц-ручка СолоСтар® підлягає знищенню згідно з встановленими правилами.
Експлуатація.
Оберігайте шприц-ручку СолоСтар® від пилу та бруду.
Очистити зовні шприц-ручку СолоСтар® можна, протираючи її вологою тканиною.
Не занурюйте в рідину, не промивайте і не змазуйте шприц-ручку, оскільки цим Ви можете пошкодити її.
СолоСтар® призначений для акуратної і безпечної роботи.
Його необхідно використовувати з обережністю. Уникайте ситуацій, при яких можливе пошкодження шприц-ручки СолоСтар®. Якщо Ви підозрюєте, що шприц-ручка СолоСтар® пошкоджена, використайте нову шприц-ручку.
Стадія 1. Контроль інсуліну.
A. Уважно прочитайте інформацію на етикетці шприц-ручки СолоСтар® для того, щоб переконатися у введенні відповідного інсуліну. Шприц-ручка СолоСтар® з Епайдрою® синього кольору, кнопка для введення препарату – темно-синього кольору з рельєфним кільцем у верхній частині.
B. Зніміть ковпачок шприц-ручки.
C. Проконтролюйте зовнішній вигляд інсуліну. Епайдра® є прозорим інсуліном. Не використовуйте шприц-ручку СолоСтар®, якщо інсулін мутний, забарвлений або має сторонні частки.
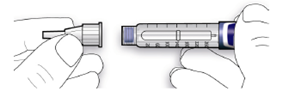
Стадія 2. Приєднання голки.
Для кожної ін’єкції завжди застосовуйте нову стерильну голку. Це допоможе запобігти забрудненню, а також можливому засміченню голки.
А. Знімітьзахисну етикетку з контейнера голки.
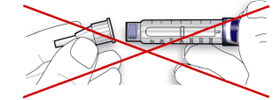
В. Встановіть голку на одній лінії зі шприц-ручкою, а потім утримуйте на одній прямій до її приєднання (нагвинчують або насаджують залежно від типу голки).
- Якщо голка не знаходиться на одній лінії зі шприц-ручкою в момент приєднання, це може призвести до порушення ізолюючого шару гуми і спричинити витікання рідини або перелом голки.
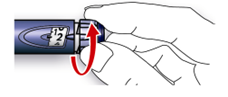
Стадія 3. Виконання тесту на безпеку.
У всіх випадках виконуйте тест на безпеку перед кожною ін’єкцією. Цим Ви забезпечуєте одержання точної дози завдяки:
- перевірці того, що шприц-ручка і голка функціонують нормально;
- видаленню пухирців повітря.
A. Відміряйте дозу, що дорівнює 2 одиницям, повертаючи дозувальний селектор.
B. Зніміть зовнішній ковпачок з голки і зберігайте його, щоб потім помістити в нього використану після введення ін’єкції голку. Зніміть внутрішній ковпачок з голки і викиньте його.
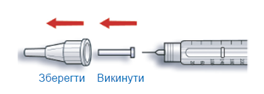
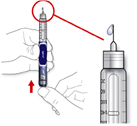
C. Розмістіть шприц-ручку голкою вгору.
D. Кінчиками пальців постукайте обережно по ємності для інсуліну, щоб усі пухирці повітря піднялися вгору в напрямку; голки.
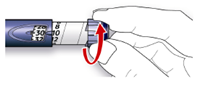
E. Натисніть на кнопку введення ін’єкції до упору. Перевірте, чи з’являється інсулін на кінчику голки.
Ви можете провести випробування на безпеку кілька разів, поки не з’явиться інсулін.
- Якщо інсулін не з’явився, проведіть контроль наявності пухирців повітря і повторно проведіть випробування на безпеку більше двох разів до їх видалення.
- Якщо появи інсуліну не спостерігається, це може бути спричинено блокуванням голки. Зніміть голку і повторіть випробування.
- Якщо появи інсуліну не спостерігається після заміни голки, Ваша шприц-ручка СолоСтар® може бути зіпсована. Не використовуйте її.
Стадія 4. Вибір дози.
Ви можете встановити дозу з точністю до 1 одиниці (від мінімальної дози 1 одиниця до максимальної дози 80 одиниць). Якщо Вам необхідно ввести дозу, що перевищує 80 одиниць, потрібно ввести 2 або більше ін’єкцій.
A. Перевірте, щоб дозувальне віконце показувало «0» після завершення випробування на безпеку.
B. Виберіть необхідну Вам дозу (на нижченаведеному прикладі обрана доза становить
30 одиниць). Якщо Ви встановили дозу, що перевищує необхідну, слід повернути дозувальний селектор у початкове положення.
- Не натискайте на кнопку введення ін’єкції під час обертання селектора, інакше інсулін витече.
- Ви не зможете повернути дозувальний селектор до числа одиниць, що перевищує кількість, яка залишилася у шприц-ручці. Не намагайтеся силою повернути дозувальний селектор. У цьому випадку Ви повинні або ввести залишок інсуліну і доповнити необхідну Вам дозу за допомогою нової шприц-ручки СолоСтар®, або використати нову шприц-ручку СолоСтар® для введення повної дози.
Стадія 5. Техніка введення ін’єкції.
А. Дотримуйтеся техніки введення ін`єкції, з якою Вас ознайомив лікар.
В. Введіть голку у шкіру.
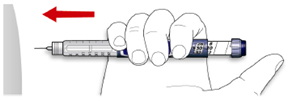
С. Введіть дозу за допомогою натискання на кнопку введення ін’єкції до упору в одному напрямку. Після введення ін’єкції у дозувальному віконці має встановитися «0».

Д. Залиште кнопку введення ін’єкції в натиснутому положенні. Повільно рахуйте до
10 перед витяганням голки зі шкіри. При цьому забезпечується введення повної дози.
Стадія 6. Видалення та утилізація голки.
У всіх випадках видаляйте голку після кожної ін’єкції та зберігайте шприц-ручку без прикріпленої голки. Цим забезпечується профілактика:
- забруднення та/або потрапляння інфекції;
- потрапляння повітря до ємності для інсуліну та витікання інсуліну, що може призвести до неправильного дозування.
A. Насадіть зовнішній ковпачок голки назад на голку і використовуйте його для згвинчування голки зі шприц-ручки. Для зниження ризику нещасних випадків, пов’язаних із застосуванням голки, ніколи не насаджуйте назад внутрішній ковпачок голки.
- Якщо введення препарату було здійснено іншою особою, спеціальні заходи безпеки при видаленні та утилізації голки вживаються цією ж особою. Дотримуйтеся рекомендованих заходів безпеки для видалення та утилізації голок (наприклад техніки насаджування ковпачка однією рукою) для зниження ризику нещасних випадків, пов’язаних із застосуванням голки, а також перенесення інфекційних захворювань.
B. Обережно викиньте голку (згідно з інструкціями лікаря).
C. У всіх випадках поміщайте ковпачок назад на шприц-ручку та зберігайте шприц-ручку до наступної ін’єкції.
Діти. Даних щодо клінічного застосування препарату Епайдра® дітям віком до 6 років недостатньо.
Передозування.
Гіпоглікемія може виникати як наслідок надмірної дії інсуліну відносно об’єму вжитої їжі та витрат енергії.
Специфічні дані щодо передозування інсуліну глюлізину відсутні. Проте гіпоглікемія може розвинутися поступово.
Помірні гіпоглікемічні епізоди можна лікувати шляхом перорального застосування глюкози або цукру. Тому хворому на цукровий діабет рекомендується постійно мати при собі кілька шматочків цукру, цукерок, печива або фруктового соку з цукром.
Цукрозамінники не можна застосовувати для лікування гіпоглікемічних станів!
Тяжкі гіпоглікемічні епізоди, при яких пацієнт втрачає свідомість, можна усунути за допомогою введення глюкагону (0,5–1 мг) внутрішньом’язово або підшкірно, що може зробити відповідним чином проінструктована особа, або за допомогою внутрішньовенного введення глюкози, що повинен виконати медичний працівник. Глюкозу вводять внутрішньовенно також у разі, якщо стан пацієнта не покращується протягом 10–15 хв після введення глюкагону.
Коли хворий опритомніє, рекомендується застосування вуглеводів перорально з метою запобігання рецидиву гіпоглікемії.
Після ін’єкції глюкагону пацієнта слід обстежити в лікарні для виявлення причини виникнення тяжкої гіпоглікемії та запобігання виникненню подібних нападів.
Побічні реакції.
Найпоширенішою побічною дією інсулінотерапії є гіпоглікемія, що виникає як наслідок застосування більшої дози інсуліну, ніж це потрібно.
Відповідні побічні реакції, продемонстровані під час проведення клінічних досліджень, наводяться нижче за класами систем органів та у порядку зменшення частоти виникнення: дуже часто (≥ 1/10); часто (≥ 1/100 - < 1/10); нечасто (≥ 1/1 000 - < 1/100); рідко (≥ 1/10 000 - < 1/1 000); дуже рідко (< 1/10 000), частота невідома (не можна розрахувати за наявними даними).
У кожній з груп побічні явища представлені у порядку зменшення ступеня їх серйозності.
|
Клас органів та систем MedDRA |
Дуже часто |
Часто |
Нечасто |
Рідко |
|
Метаболічні та аліментарні розлади |
Гіпоглікемія |
|||
|
Розлади з боку шкіри та підшкірних тканин |
Реакції у місці ін’єкції, місцеві реакції гіперчутливості |
Ліподистрофія |
||
|
Порушення загального стану та реакції у місці введення |
Системні реакції гіперчутливості |
Метаболічні та аліментарні розлади.
Симптоми гіпоглікемії, як правило, виникають раптово. Вони включають холодний піт, холодну бліду шкіру, втомлюваність, нервозність або тремор, відчуття неспокою, незвичну втомлюваність або слабкість, збентеження, порушення концентрації уваги, сонливість, сильне відчуття голоду, порушення зору, головний біль, нудоту та сильне серцебиття. Гіпоглікемія може досягти значного ступеню і призвести до втрати свідомості та/або судом і спричинити тимчасове або постійне порушення функції мозку або навіть стати причиною летального наслідку.
Розлади з боку шкіри та підшкірних тканин.
Місцеві реакції гіперчутливості (почервоніння, набряк і свербіж у місці ін’єкції) можливі під час лікування із застосуванням інсуліну. Такі реакції, як правило, є минущими та зазвичай зникають у разі продовження лікування.
Ліподистрофія може виникати у місці ін’єкції як наслідок недотримання порядку зміни місця ін’єкції.
Порушення загального стану та реакції у місці введення.
Cистемні реакції гіперчутливості можуть включати кропив’янку, стиснення у грудях, задишку, алергічний дерматит і свербіж. Тяжкі випадки включають генералізовану алергічну реакцію разом з анафілактичною реакцією, що може загрожувати життю.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати у недоступному для дітей місці.
Зберігати у холодильнику при температурі від +2ºС до +8ºС в оригінальній упаковці для захисту від дії світла. Не заморожувати. Запобігати контакту зі стінками холодильника або накопичувачами холоду.
Умови зберігання під час користування.
Після початку застосування шприц-ручку необхідно використати протягом 4 тижнів. Під час використання зберігати при температурі не вище +25°С подалі від джерел прямого тепла та прямого світла. Зберігати в оригінальній упаковці для захисту від дії світла. Шприц-ручка з картриджем не повинна зберігатись в холодильнику. Після кожної ін’єкції необхідно надягнути ковпачок на шприц-ручку для захисту від світла.
Несумісність.
Епайдру® не слід змішувати з іншими препаратами, відмінними за складом від НПХ (нейтрального протаміну Хагедорна) інсуліну людини.
Упаковка. № 5: по 1 картриджу по 3 мл, вмонтованому в одноразовий пристрій – шприц-ручку СолоСтар® (без голок для ін’єкцій), по 5 шприц-ручок у картонній коробці.
Категорія відпуску. За рецептом.
Виробник. Санофі-Авентіс Дойчланд ГмбХ, Німеччина/ Sanofi-Aventis Deutschland GmbH, Germany.
Місцезнаходженнявиробника та його адреса місця провадження діяльності.
Брюнінгштрассе 50 Н600, H500, H590 65926 Франкфурт-на-Майні, Німеччина/ Bruningstrasse 50 Н600, H500, H590 65926 Frankfurt am Main, Germany.
Заявник. ТОВ «Санофі-Авентіс Україна», Україна/ Sanofi-Aventis Ukraine LLC, Ukraine.



 Себорейная экзема (дерматит)
Себорейная экзема (дерматит)
 Аллергический дерматит
Аллергический дерматит
 Кожный кандидоз: откуда он берется и как с ним бороться?
Кожный кандидоз: откуда он берется и как с ним бороться?
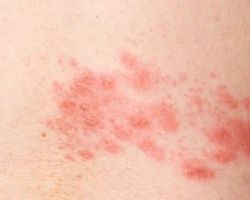 Кожная сыпь у взрослых: задача с множеством неизвестных
Кожная сыпь у взрослых: задача с множеством неизвестных