Наследственный ангионевротический отек
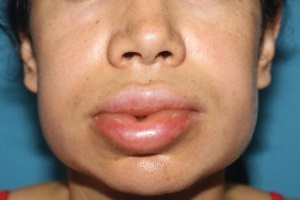
Наследственный ангионевротический отек (НАО) – аутосомно-доминантное заболевание, характеризующееся рецидивирующим ангионевротическим отеком любой области тела. Причина заболевания – снижение функции белка (количественное или функциональное), ингибирующего С1-эстеразу, что приводит к быстрой неконтролируемой активации, преимущественно компонентов комплемента, брадикининового каскада, калликреиновой системы.
Клинические проявления НАО характеризуются рецидивирующими отеками различной локализации: кожи лица (губы, периорбитальная область), шеи, туловища, конечностей, слизистых оболочек верхних отделов дыхательных путей, желудочно-кишечного (приступообразная боль в животе) и урогенитального трактов. У большинства больных дебют заболевания возникает до 20 лет (60%), гораздо реже – в среднем и даже пожилом возрасте. В пубертатном периоде течение заболевания может утяжеляться в связи с гормональной перестройкой. Провоцирующими факторами в развитии отека, как правило, являются травма (даже минимальная) и хирургическое вмешательство, в том числе стоматологические манипуляции.
Отек верхних дыхательных путей может возникать с вовлечением пищевода и гортани, проявляться дисфагией, дисфонией, симптоматикой обструкции дыхательных путей, напоминающей в ряде случаев бронхиальную астму, и прогрессировать вплоть до асфиксии. Отек в области абдоминальных органов, как правило, сопровождается выраженным спазмом гладкой мускулатуры, тошнотой, рвотой и диареей. Клиническая картина часто напоминает «острый живот» или кишечную непроходимость. Зуд и крапивница для НАО не характерны, однако у некоторых пациентов в продромальном периоде отека отмечается сыпь, напоминающая мультиформную эритему.
В редких случаях при локализации отека на лице могут вовлекаться менингеальные оболочки с проявлением менингеальных симптомов (ригидность затылочных мышц, резкая цефалгия, рвота, иногда судороги), при поражении лабиринтных систем развивается синдром Меньера, что выражается головокружением, тошнотой, рвотой. Все эти симптомы могут встречаться как одновременно, так и по отдельности.
При атипичном течении заболевания отеки могут отсутствовать, возможны изолированные абдоминалгии, характерны полиартралгии. В очень редких случаях описаны эпилептический приступ, уртикарии, кожная пурпура, синдром Рейно.
При лабораторном обследовании больных НАО обнаруживается следующее: содержание ингибитора С1 обычно не более 20-30% от нормального (или отсутствие даже в период полной ремиссии), концентрации С2- и С4-компонентов – не более 30-40% от нормальных (нормальный уровень этих фракций исключает вероятность НАО). Следует также отметить, что дефицит ингибитора С1 может быть приобретенным (у пожилых людей). Он ассоциирован с лимфопролиферативными заболеваниями, наличием антител к С1-ингибитору (аутоиммунной патологией) или с хронической инфекцией. Однако для приобретенного ангионевротического отека, в отличие от наследственного, характерен низкий уровень С1q-фракции.
Очень важно для установления диагноза обследование близких родственников больного НАО, вероятность тяжелого приступа при неустановленном диагнозе составляет 30-35%. Отсутствие в семейном анамнезе сведений о НАО не исключает возможности постановки подобного диагноза.
Существуют определенные трудности ранней диагностики НАО. Больные неоднократно наблюдаются у различных специалистов и не сразу обращаются к аллергологу-иммунологу. Заболевание может оставаться нераспознанным на протяжении десятков лет, типичными ошибочными диагнозами являются «аллергический ангионевротический отек» и «анафилаксия». В то же время подходы к лечению этих заболеваний в корне отличаются. Адреналин, антигистаминные препараты и кортикостероиды, назначаемые при ангионевротическом отеке аллергического происхождения, неэффективны при НАО. Для купирования острого приступа наследственного ангионевротического отека в/в капельно вводится свежезамороженная нативная плазма (200-300 мл); в более легких случаях – e-аминокапроновая кислота 5% – 100 мл в/в капельно. Для улучшения состояния пациента с целью долгосрочной профилактики назначают e-аминокапроновую кислоту 1-4 г/сут под контролем свертываемости крови каждые 2 недели или даназол 100-600 мг/сут, в зависимости от тяжести заболевания.
В связи с тем, что несвоевременная постановка диагноза НАО обусловливает высокий процент смертности (20-30% пациентов умирают от отека гортани), очень важно проводить дифференциальную диагностику НАО, прежде всего, с ангионевротическим отеком аллергического происхождения (таблица), а также с «острым животом», ангиной, лимфостазом, ревматической патологией, мигренью, отеками лица при хронических заболеваниях почек, сердечно-сосудистой системы, эндокринных органов.
Клинический случай наследственного ангионевротического отека, представленный ниже, показателен в плане необходимости проведения дифференциальной диагностики у больных с НАО.
Молодая женщина (25 лет) из г. Коломии (Ивано-Франковская область) обратилась в Центр аллергических заболеваний верхних дыхательных путей и уха (Институт отоларингологии им. А.И. Коломийченко) самостоятельно в июле 2005 года, прочитав публикацию в газете «Аргументы и факты» о наследственном ангионевротическом отеке. По материнской линии подобных отеков ни у кого не отмечалось, отец умер, когда пациентка была еще совсем маленькой, и связь с его родней утеряна. Женщина страдает отеками с 14 лет – с периода полового созревания. Отеки провоцируют травмы, даже небольшие (тесная обувь), ОРВИ, стрессы. Хирургические вмешательства, посещение стоматолога всегда были предвестником отека, который возникал не только тогда, когда вводился анестетик, что расценивалось как лекарственная аллергия, но и при сильном надавливании стоматологическим зеркалом. Та же картина наблюдалась после гинекологического осмотра.
Отеки кистей рук и ног, лица и гениталий, а также эпизоды боли в животе повторялись до шести раз в год: в течение нескольких часов нарастали, продолжались не более суток и через 72 часа (после трех суток) исчезали. В 1996 г. пациентка была госпитализирована в хирургическое отделение с диагнозом «острый живот», проведена аппендэктомия, в 2000 г. – прооперирована по поводу кисты яичника. После перенесенной в 2002 г. травмы головы отеки усилились, стали чаще возникать на лице, трансформируясь в отек гортани.
К моменту обращения к нам пациентка в течение двух последних лет принимала преднизолон – 8 мг/сут, но урежения отеков не отмечала. В выписке из реанимационного и терапевтического отделений Коломийской ЦРБ за май 2005 г. ей установлен диагноз «рецидивирующая ангионевротическая реакция по типу отека Квинке, острый аллергический ларингит». Назначено лечение: адреналин, эуфиллин, супрастин, преднизолон, дексаметазон, аминокапроновая кислота, фуросемид, тавегил, кетотифен. Комплексное обследование, в том числе иммунологическое, помимо хронического холецистита (очевидно, связанного с длительным приемом таблетированного преднизолона), не выявило каких-либо отклонений в состоянии здоровья. Пациентка была здорова и находилась в хорошей физической форме.
Аллергологическое обследование: кожные тесты с бытовыми, пыльцевами, пищевыми аллергенами отрицательны, IgE – 21,8 IU/ml (норма – >100 IU/ml).
Анамнез болезни, связь с травмой, отсутствие эффекта от проводимой кортикостероидной терапии позволили заподозрить наследственный ангионевротический отек, и пациентка была обследована на содержание компонентов комплемента и ингибитора С1-эстеразы. Результаты иммунологического обследования: С3 – 0,2 г/л (норма – 0,7-1,8 г/л), С4 – 0,05 г/л (норма – 0,15-0,4 г/л); С1-ингибитор – 25% (норма – 66-166%) подтвердили диагноз наследственного ангионевротического отека.
Учитывая молодой возраст пациентки, положительный эффект от введения аминокапроновой кислоты, мы решили не прибегать к терапии даназолом. Больной был назначен профилактический курс аминокапроновой кислоты в форме порошка per os в течение 6 месяцев по 1500 мг дважды в день под контролем свертывания крови с дальнейшим снижением дозы до 500 мг/сут. Это позволило не только уменьшить частоту приступов, но и повысить качество жизни пациентки. Таблетированный преднизолон был отменен.
Из-за отсутствия информации по отцовской линии, к сожалению, проследить наследственный характер заболевания и составить генеалогическое дерево не удалось.
Пациенты с наследственным ангионевротическим отеком до установления диагноза, как правило, имеют большое количество выписок с различными диагнозами, в том числе из стационаров хирургического профиля, и этот клинический случай, к сожалению, – не исключение. Пациентам проводят лапаротомию, обусловленную отеком внутренних органов (аппендэктомию, холецистэктомию, нефрэктомию, гинекологические операции), а также трахеотомию из-за невозможности купировать отек верхних дыхательных путей. У больных НАО даже описан феномен «географического живота» – результат операций, характеризующийся наличием многочисленных послеоперационных рубцов.
Подозрение на НАО должно возникать при рецидивирующем ангионевротическом отеке или рецидивирующем абдоминальном болевом синдроме, при выявлении сниженного количества С2- и С4-фракций комплемента в сыворотке крови. Это заболевание требует внимания врачей всех специальностей, особенно оториноларингологов, врачей скорой помощи, хирургов, педиатров и терапевтов.
Генетические аспекты
Существуют три клинически идентичные типа наследственного ангионевротического отека, определить которые можно лишь при исследовании компонентов комплемента в крови. НАО 1-го типа (85-90% случаев) связан с отсутствием гена, кодирующего С1-ингибитор, или с различными его мутациями. При 2-м типе НАО (10-15% пациентов) отеки обусловлены функциональной неполноценностью С1-ингибитора, хотя его вырабатывается в достаточном количестве. Нефункционирующий ингибитор не расходуется, накапливается в сыворотке крови и регистрируется в повышенном количестве. НАО 3-го типа – это заболевание описано недавно, и распространенность его неизвестна. Концентрация С1-ингибитора в плазме крови нормальная, механизм заболевания, вероятно, не связан с ингибитором С1. Этот тип наблюдается только у женщин, характер родословных предполагает Х-сцепленный доминантный тип наследования.
Патогенез
C1-ингибитор – высокогликозилированный белок сыворотки, синтезируемый в печени и угнетающий протеолитическую активность субкомпонентов Clr и Cls, предупреждая таким образом активацию С4 и С2 компонентов комплемента. Недостаточность Cl-ингибитора приводит к неконтролируемой активации ранних компонентов комплемента.
Патогенез НАО сходен с патогенезом крапивницы и связан с дилатацией и повышением проницаемости сосудов (преимущественно венул) глубоких (в отличие от крапивницы) слоев дермы и подслизистого слоя, вызванной компонентами комплемента и кининами калликреин-брадикининовой цепи. Кроме того, эти вазоактивные пептиды вызывают спазм гладкой мускулатуры пищеварительного тракта и полых органов.
Литература
- C1 inhibitor deficiency: consensus document // 2005 British Society for Immunology, Clinical and Experimental Immunology, 139: 379-394.
- Bowen T., Cicardi M., Farkas H., Bork K. et al. Canadian 2003 international consensus algorithm for the diagnosis, therapy and management of hereditary angioedema. Journal of Allergy and Clinical Immunology 2004; 114: 629-637. IF: 7, 205.
- Farkas H., Harmat G., Fay A., Fekete B., Karadi I., Visy В., Varga L. Erythema marginatum preceding an acute oedematous attack of hereditary angioneurotic oedema. Acta Dermato-Venereologica 2001; 81: 376-377. IF: 1, 477.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Помощь при аллергии
Помощь при аллергии
 Аллергия на руках
Аллергия на руках
 Первая помощь при аллергии
Первая помощь при аллергии
 Лекарственная аллергия
Лекарственная аллергия