- Головна
- /
- Статті
- /
- Гастроентерологія
- /
- Вторичные поражения желудка и пищевода при патологии респираторного тракта
Вторичные поражения желудка и пищевода при патологии респираторного тракта
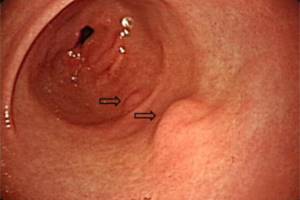
По мнению ряда авторов, вторичные поражения желудка очень часто являются патогенетически параллельными, как правило, протекающими с взаимным отягощением. Так, наиболее изученные вторичные поражения желудка – симптоматические язвы – порой весьма трудно дифференцировать с язвенной болезнью, ассоциированной с Helicobacter pylori (Hp) [2, 7].
В последнее время в клинике внутренних болезней все большее внимание врачей-интернистов привлекает проблема закономерно частых сочетаний определенных болезней, характеризующихся общностью или близостью этиологических и патогенетических факторов.
По данным различных авторов, частота развития симптоматических гастродуоденальных язв у больных хроническими неспецифическими заболеваниями легких (ХНЗЛ) колеблется от 2,6 до 30%. Симптоматический характер гастродуоденальных язв при легочной патологии подтверждается достаточно зрелым возрастом больных, отсутствием длительного «желудочного» анамнеза, значительной длительностью основного заболевания, атипичностью клинической картины, развитием внезапных тяжелых осложнений. Отмечено, что гастродуоденальные язвы особенно часто развиваются в терминальной стадии ХНЗЛ на фоне прогрессирующей легочно-сердечной недостаточности.
 Патогенез симптоматических поражений желудка при ХНЗЛ очень сложен и еще недостаточно изучен. Особое внимание в патогенезе данной сочетанной патологии уделяется гиперкапнии. В последнее время было установлено, что именно гиперкапния вызывает спазм артерий подслизистого слоя стенки желудка, что, безусловно, приводит к ишемии и гипоксии слизистой оболочки желудка. Воздействие гиперкапнии на микроциркуляторное русло сходно с эффектами гипоксии. Гиперкапния сама по себе определяет развитие нескольких факторов: накопление в тканях недоокисленных продуктов обмена; развитие ацидоза; появление вазоактивных метаболитов, в основном действующих как вазодилататоры, и веществ типа тканевых медиаторов; снижение тонуса гладкомышечных клеток в стенках резистивных сосудов; увеличение проницаемости обменных микрососудов и капилляров. Доказано, что гиперкапния играет первичную, пусковую роль в нарушении регуляции сосудистого тонуса стенки желудка [1, 3].
Патогенез симптоматических поражений желудка при ХНЗЛ очень сложен и еще недостаточно изучен. Особое внимание в патогенезе данной сочетанной патологии уделяется гиперкапнии. В последнее время было установлено, что именно гиперкапния вызывает спазм артерий подслизистого слоя стенки желудка, что, безусловно, приводит к ишемии и гипоксии слизистой оболочки желудка. Воздействие гиперкапнии на микроциркуляторное русло сходно с эффектами гипоксии. Гиперкапния сама по себе определяет развитие нескольких факторов: накопление в тканях недоокисленных продуктов обмена; развитие ацидоза; появление вазоактивных метаболитов, в основном действующих как вазодилататоры, и веществ типа тканевых медиаторов; снижение тонуса гладкомышечных клеток в стенках резистивных сосудов; увеличение проницаемости обменных микрососудов и капилляров. Доказано, что гиперкапния играет первичную, пусковую роль в нарушении регуляции сосудистого тонуса стенки желудка [1, 3].
В таблице предложены объективные критерии, позволяющие дифференцировать язвенную болезнь на фоне ХНЗЛ с симптоматическими гастродуоденальными язвами.
Лечение ХНЗЛ должно проводиться с учетом имеющихся вторичных поражений желудка. Питание больных с выраженной дыхательной недостаточностью (ІІ-ІІІ ст.) по качеству приготовления пищи и составу блюд должно соответствовать столу № 1, но количество углеводов должно быть ограничено. Необходимо учитывать, что углеводная нагрузка при гиперкапнии может привести к декомпенсации дыхательного ацидоза. В связи с этим рекомендуется гипокалорийная диета (600 ккал/сут) с ограничением углеводов (30 г углеводов, 35 г жиров, 35 г белков) в течение 2-8 нед. В некоторых случаях диетическое лечение при хронической гиперкапнии оказывается более эффективным, чем длительная оксигенотерапия.
С целью профилактики поражений желудка больным ХНЗЛ при выраженной дыхательной недостаточности наряду с антисекреторными препаратами целесообразно назначать лекарственные средства, улучшающие кровоток в слизистой оболочке желудка. Для купирования бронхообструктивного синдрома у больных ХНЗЛ предпочтительным является ингаляционное применение глюкокортикостероидов (ГКС). Безусловно, повреждения слизистой оболочки желудка могут возникнуть из-за побочного действия лекарственных средств, применяемых для лечения ХНЗЛ, например, производных метилксантина, β-адреностимуляторов, системных ГКС. Теофиллин и его аналоги могут способствовать развитию гастростаза и снижению тонуса сфинктера пищевода, адреномиметики усиливают тканевую гипоксию слизистой оболочки желудка и кишечника. Широко известно ульцерогенное действие системных ГКС. Так, на фоне их применения при бронхиальной астме (БА) увеличивается частота и выраженность таких заболеваний, как эзофагит, хронический гастрит, симптоматические язвы, дуоденит. В связи с этим применение глюкокортикостероидов и бронхолитиков у больных с патологией желудка должно строго регламентироваться.
Хотя поражение желудка при туберкулезе встречается довольно редко, в последние годы в Украине наблюдается значительный рост заболеваемости и смертности от этого заболевания, что обусловлено рядом причин:
- резким увеличением миграции населения;
- недостаточным уровнем противотуберкулезных мероприятий;
- учащением случаев туберкулеза, вызванного лекарственно-устойчивыми микобактериями.
Гастроинтестинальная форма туберкулеза встречается у 2-3% больных этим заболеванием и может быть проявлением каждого из трех основных патогенетических и клинико-морфологических видов туберкулеза – первичного, гематогенного и вторичного.
Поражение желудка чаще наблюдается при вторичном туберкулезе, что обусловлено заглатыванием больным мокроты, содержащей микобактерии. Кроме того, поражение слизистой оболочки желудка может быть следствием распространения инфекции по лимфатическим сосудам из пораженных мезентериальных лимфоузлов.
Выделяют такие формы туберкулезного поражения желудка:
- язвенную;
- гипертрофическую (опухолевидную);
- фиброзно-склеротическую;
- язвенно-гипертрофическую (смешанную).
Туберкулез органов пищеварения отличается значительным полиморфизмом клинической картины, а иногда может протекать только с лихорадкой без каких-либо симптомов, характерных для заболеваний желудочно-кишечного тракта, в том числе и поражений желудка.
Распознавание гастроинтестинального туберкулеза является достаточно сложной задачей. Такой диагноз верифицируется преимущественно на основании результатов бактериологического или гистологического исследования. Помимо сбора анамнеза, направленного на выявление связи заболевания с туберкулезной инфекцией, необходимо использовать все существующие на сегодня методы диагностики: осмотр, перкуссию, пальпацию больного, выявление микобактерии туберкулеза в содержимом желудка и кишечника, туберкулинодиагностику, полимеразную цепную реакцию для идентификации специфического возбудителя, выявление в крови антигенов микобактерий и антител иммунологическими методами (иммуноферментный анализ), рентгенологические, инструментальные методы, гистологическое и бактериологическое исследования биопсийного материала, сонографию.
При лечении больных гастроинтестинальным туберкулезом, как и другими его формами, первостепенное значение имеет химиотерапия, которая должна быть как можно более ранней, длительной (6-8 мес), комплексной и двухэтапной. На первом этапе (2-3 мес) применяют 4-5 химиопрепаратов, на втором (4-5 мес) проводят поддерживающую терапию. Основными химиопрепаратами являются изониазид, рифампицин, пиразинамид, этамбутол, стрептомицин. При лекарственной устойчивости микобактерий и появлении побочных реакций следует использовать резервные препараты – феназид и метазид. Больные гастроинтестинальным туберкулезом должны избегать приема таких лекарственных препаратов, как этамбутол, этиопамид, усугубляющих диспепсические явления и оказывающих гепатотоксическое действие. Наряду со специфическими антибактериальными препаратами таким больным назначают полноценную диету и симптоматические средства.
Профилактика гастроинтестинального туберкулеза состоит в полноценном лечении больных с первичными формами туберкулеза, соблюдении гигиенических норм при употреблении продуктов, которые могут быть источником заражения.
Отмечено, что патология желудочно-кишечного тракта весьма часто (до 60% случаев) встречается при БА [1]. Особый интерес представляет гастроэзофагеальный рефлюкс (ГЭР), рассматриваемый в качестве триггера приступов БА, преимущественно в ночной период.
Приступ удушья, связанный с аспирацией желудочного содержимого, впервые описал Osler еще в 1892 г. Исследования Mendelson (1946), Friedland (1966) положили начало дальнейшему изучению проблемы, при этом был впервые введен термин «рефлюкс-индуцированная астма». Mansfield и Stein выявили снижение проходимости дыхательных путей на фоне изжоги (одного из главных проявлений гастроэзофагеальной рефлюксной болезни – ГЭРБ), что позже было подтверждено экспериментально [2, 3].
Согласно современным представлениям патогенез легочных заболеваний, в том числе и БА, возникающих на фоне ГЭРБ, связан с двумя механизмами: прямым (развитием бронхоспазма в результате заброса желудочного содержимого в просвет бронхиального дерева) и непрямым (индуцированием приступа удушья в результате стимуляции вагусных рецепторов дистальной части пищевода) (Goodall и соавт., 1981).
Прямой путь развития респираторных нарушений в первую очередь обусловлен макроаспирацией желудочного содержимого с развитием механической бронхообструкции и (реже) пневмонии. Макроаспирация кислого материала (pH<2,5) может вызывать рефлекторное закрытие просвета дыхательных путей, разрушение сурфактанта, повреждение эпителия, в тяжелых случаях – отек легких и кровотечения.
Защита против бронхолегочной аспирации включает координацию глотательного рефлекса и закрытие голосовой щели во время глотания. Исходя из этого, можно предполагать, что в ряде случаев особое значение приобретает состояние надгортанника. Кроме этого, развитию микроаспирации при ГЭРБ способствуют состояние верхнего пищеводного сфинктера и перистальтика пищевода.
Непрямой (невральный) путь развития ГЭРБ-зависимых респираторных проявлений реализуется по афферентным волокнам вагуса с развитием системы бронхосуживающих рефлексов и, как следствие, бронхоспазма. Существует точка зрения, согласно которой необходимым атрибутом для развития бронхоспазма у больных БА является эзофагит, раздражающий афферентные вагусные рецепторы. Схематично описанный механизм выглядит так: ГЭР – эзофагит – раздражение афферентных рецепторов вагуса – повышение реактивности трахеобронхиального дерева – увеличение лабильности мускулатуры бронхов – бронхоспазм [4, 7]. Ряд авторов высказывают предположение о наличии специфических рецепторов повреждения слизистой оболочки пищевода – так называемых ноцицепторов, которые, как предполагается, функционируют только при измененной слизистой пищевода. Эта гипотеза, возможно, объясняет, почему физиологический ГЭР не приводит к кашлю и приступам удушья [3, 7]. В литературе имеется информация о влиянии некоторых нейропептидов на изменение бронхиальной проводимости, особенно в случае повреждения слизистой пищевода. Влияя на тонус гладкомышечных волокон бронхов и кровеносных сосудов, стимулируя выход гистамина, лейкотриенов и других медиаторов, нейропептиды изменяют реактивность трахеобронхиального дерева [9].
Рассматривая исследуемую проблему с другой стороны, необходимо отметить провоцирующее влияние на развитие ГЭРБ респираторной патологии. Любые респираторные расстройства и симптомы могут провоцировать ГЭРБ, если они изменяют какие-либо аспекты «антирефлюксного барьера».
Основные механизмы патологического влияния респираторных расстройств на развитие ГЭРБ:
- увеличение градиента давления – повышение отрицательного внутригрудного и положительного внутрибрюшного давления;
- снижение давления в области нижнего пищеводного сфинктера;
- повышение кислотной продукции;
- нарушение эвакуации пищи из желудка и др. [1, 6].
В качестве иллюстрации вышесказанного можно привести некоторые известные примеры: внутрибрюшное давление увеличивается при форсированном выдохе во время кашля или чихания при БА, муковисцидозе (МВ), бронхопульмональной дисплазии, респираторных инфекциях. При этом увеличивается и частота ГЭРБ, особенно у пациентов с недостаточностью кардии или скользящей грыжей пищеводного отверстия диафрагмы.
Критерии диагностики ГЭР-зависимой бронхиальной обструкции:
- приступы кашля и/или удушья, преимущественно в ночное время, после обильной еды;
- доказанное сочетание респираторных и «верхних» диспептических признаков (отрыжка, изжога, регургитация и т. д.);
- положительный эффект от антирефлюксной терапии ex juvantibus;
- признаки торпидности к адекватной базисной терапии;
- неатопические варианты БА [1, 3, 6, 8, 9].
Возникает один из ключевых вопросов «взаимоотношений» ГЭРБ и БА: играет ли ГЭРБ роль единственного пускового момента механизма бронхообструкции или выступает как составная часть некоего комбинированного механизма?
К сожалению, точного ответа на этот вопрос пока нет, и можно назвать только две ситуации, позволяющие связывать ГЭРБ с синдромом бронхиальной обструкции или БА:
- «чистый» ГЭРБ-зависимый вариант;
- вариант, при котором ГЭРБ играет определенную негативную роль в генезе БА наряду с другими факторами.
В подобных случаях система доказательств выстраивается на основе достоверной диагностики ГЭРБ с помощью всех доступных методов (гастроэнтерологических, пульмонологических, аллергологических). При этом оптимальным является проведение ФГДС с прицельной биопсией; гистологического исследования биоптатов; суточного рН-мониторинга пищевода; спирометрии; бронхопровокационных проб с физической нагрузкой, физиологическим раствором, гистамином; рентгенографии легких (по показаниям); аллергообследования.
Таким образом, вторичные поражения желудка и пищевода при респираторной патологии характеризуются своеобразием клинического течения, высоким процентом осложнений и трудностью диагностики. Симптоматические поражения желудка и пищевода могут вуалировать симптоматику основного заболевания, тем самым приводя к серьезным диагностическим ошибкам.
Литература
- Бейтуганова И.М., Чучалин А.Г. Рефлюкс-индуцированная бронхиальная астма // Русский медицинский журнал. – 1998. – Т. 6, № 17. – С. 1102-1107.
- Зернов Н.Г., Сашенкова Т.П., Остроухова И.П. Заболевания пищевода. – М.: Медицина, 2000.
- Приворотский В.Ф., Луппова Н.Е. Кислотозависимые заболевания. – СПб., 2002. – 89 с.
- Федосеев Г.В. Механизмы обструкции бронхов. – СПб.: МИА, 2000. – 333 с.
- Хавкин А.И., Приворотский В.Ф. Гастроэзофагеальная рефлюксная болезнь. – М., 2001. – С. 45-57.
- Benjamin Stanley B., Kern Deschner. Extra-esophageal manifestations of gastroesophageal reflux // Am. J. Gastroenterol. – 2003; 84 (1):1-5.
- Ekstrom T., Tibbling L. Esophageal acid perfusion airway function and symptoms in asthmatic patients with marked bronchial hyperreactivity // Chest. – 2001; 96 (5):963.
- Pediatric gastrointestinal motility disease / Ed. by R. Wyllie, J.S. Hyams. – Philadelphia, 2000. – P164-187.
- Wasowska-Krolikowska K., Toporowska-Kowalska E., Krogulska A. Astma and gastroesophageal reflux in children // Med. Sci. Monit. – 2002; 8 (3):RА64-71.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Современные терапевтические возможности в клинике внутренних болезней
Современные терапевтические возможности в клинике внутренних болезней
 Терапевтические чтения: алгоритмы современной диагностики и лечения внутренних болезней
Терапевтические чтения: алгоритмы современной диагностики и лечения внутренних болезней
 Новые возможности в лечении заболеваний легких
Новые возможности в лечении заболеваний легких
 Проблемные вопросы нозокомиальной пневмонии в практике врача-клинициста
Проблемные вопросы нозокомиальной пневмонии в практике врача-клинициста