- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Клиническая инфектология и паразитология. Часть 2
Клиническая инфектология и паразитология. Часть 2

Тактика ведения пациентов с инфекцией, вызванной вирусом гепатита С. Клинические рекомендации Европейской ассоциации по изучению болезней печени (ЕАИП/EASL) 2015 г.
Ледипасвир/Софосбувир можно принимать со всеми антиретровирусными препаратами. Тем не менее, в связи с увеличением концентрации Тенофовира, когда фармакокинетический усилитель (Ритонавир или Кобицистат) присутствует в антиретровирусной терапии, эти комбинации (т.е. Атазанавир/Ритонавир, Дарунавир/Ритонавир, Лопинавир/Ритонавир, Элвитегравир/Кобицистат, Дарунавир/Кобицистат, все в сочетании с Тенофовиром/Эмтрицитабином) следует использовать с осторожностью, с частым контролем функции почек, если другие варианты недоступны. В настоящее время нет безопасных и эффективных данных по комбинации Софосбувира и Ледипасвира, которая вводится при усиленных схемах протеазосодержащих препаратов при ВИЧ-инфекции, и взаимодействие не смягчается варьирующимся приемом препарата через 12 ч. Концентрация Тенофовира также увеличивается при схемах лечения препаратами, содержащими Эфавиренц, поэтому требуется осторожность при лечении.
Таблица 4E Лекарственные взаимодействия между ВГС ПППД и сердечно-сосудистыми препаратами
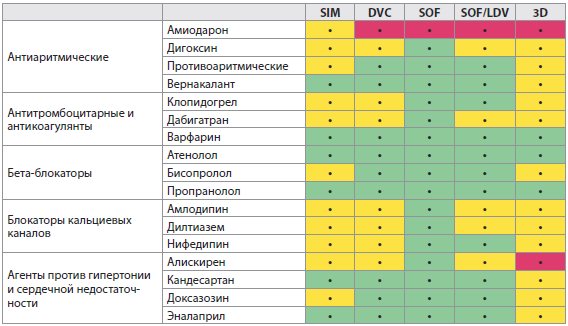
- В зависимости от функции печени может потребоваться изменение дозировки для некоторых лекарств. Пожалуйста, обратитесь к инструкции по медицинскому применению препарата для конкретных препаратов для получения совета относительно дозировки.
- Символ (зеленый, желтый, красный), используемый для ранжирования клинического значения взаимодействия препаратов, основывается на www.hep-druginteractions.org (Ливерпульский университет). Для получения дополнительной информации по взаимодействию лекарственных средств и по более широкому кругу препаратов, детализации фармакокинетического взаимодействия и корректировки дозирования обратитесь к вышеупомянутому сайту.
Таблица 4F Лекарственные взаимодействия между ВГС ПППД и иммунодепрессантами

- В зависимости от функции печени может потребоваться изменение дозировки для некоторых лекарств. Пожалуйста, обратитесь к инструкции по медицинскому применению препарата для конкретных препаратов для получения совета относительно дозировки.
- Символ (зеленый, желтый, красный), используемый для ранжирования клинического значения взаимодействия препаратов, основывается на www.hep-druginteractions.org (Ливерпульский университет). Для получения дополнительной информации по взаимодействию лекарственных средств и по более широкому кругу препаратов, детализации фармакокинетического взаимодействия и корректировки дозирования обратитесь к вышеупомянутому сайту.
Симепревир следует вводить в дозе 150 мг (1 капсула) 1 раз в день. Симепревир активно связывается с белками плазмы крови (>99,9%), главным образом с альбумином. Симепревир в первую очередь подвергается окислительному метаболизму в печени системой CYP3A. Выведение происходит через желчную экскрецию, тогда как почечная экскреция незначительна.
Среднее стационарное состояние AUC* (*АUС - площадь под фармакологической кривой - кривой «концентрация - время» - изменение концентрации активного вещества в плазме или сыворотке крови во времени.) Симепревира в 2,4 раза выше у ВГС- неинфицированных субъектов с умеренной печеночной недостаточностью (Класс B). Этот показатель в 5,2 раза выше у ВГС-неинфицированных больных с тяжелой печеночной недостаточностью (Класс C).
Применение Симепревира не было широко изучено у таких больных, но он использовался в реальных условиях. Однако в этой группе наблюдается значительно более высокая концентрация Симепревира, и Симепревир не рекомендуется для этой группы пациентов.
Так как основным ферментом, участвующим в метаболизме Симепревира, является CYP3A4, совместное введение Симепревира с веществами, которые являются умеренными или сильными индукторами или блокаторами CYP3A4, не рекомендуется, поскольку это может привести к значительно более низкой или более высокой концентрации Симепревира соответственно. Ряд соединений противопоказаны пациентам, принимающим Симепревир, в том числе противосудорожные (Карбамазепин, Окскарбазепин, Фенобарбитал, Фенитоин), антибиотики (Эритромицин, Кларитромицин, Телитромицин), противотуберкулезные препараты (Рифампицин, Рифабутин, Рифапентин), системно принимаемые противогрибковые пре-параты (Итраконазол, Кетоконазол, Позаконазол, Флуконазол, Вориконазол), системно принимаемый Дексаметазон, Цизаприд, растительные продукты (марьин чертополох, зверобой) и ряд антиретровирусных препаратов, в том числе схемы на основе Кобицистата, Эфавиренца, Этравирина, Невирапина, Ритонавира и любого блокатора протеазы ВИЧ, усиленные или нет Ритонавиром. Ралтегравир, Маравирок, Рилпивирин, Тенофовир, Эмтрицитабин, Ламивудин и Абакавир не имеют взаимодействия с Симепревиром, и, таким образом, их можно безопасно использовать у пациентов, получающих этот препарат. Дозу необходимо корректировать с некоторыми антиаритмическими средствами, Варфарином, блокаторами кальциевых каналов, блокаторами HMG СоА-редуктазы и седативными транквилизаторами.
Никаких изменений дозы не требуется при использовании в сочетании с иммунодепрессантами Такролимусом и Сиролимусом, хотя рекомендуется плановый контроль концентрации иммунодепрессанта в крови. И наоборот, использование Симепревира с Циклоспорином приводит к значительному повышению концентрации Симепревира в плазме крови (из-за блокирования транспортеров печеночных накоплений), так что не рекомендуется совместное введение этих препаратов.
Даклатасвир следует вводить в дозе 60 мг (1 таблетка) или 30 мг (1 таблетка) - при необходимости меньшей дозы, 1 раз в день. Примерно 90% Даклатасвира выводится из организма с фекалиями (половина в неизмененном виде) и менее 10% - с мочой (в первую очередь в виде неизмененного препарата).
Фармакокинетика Даклатасвира у субъектов, неинфицированных ВГС, с легкой (Класс А), умеренной (Класс В) и тяжелой (Класс С) печеночной недостаточностью показывает, что концентрация общего Даклатасвира (свободного и связанного с белком препарата) ниже у пациентов с печеночной недостаточностью. Тем не менее, печеночная недостаточность не имеет клинически значимого влияния на концентрации свободного препарата Даклатасвир. Таким образом, корректировка дозы Даклатасвира для пациентов с легкой (Класс А), умеренной (Класс В) или тяжелой (Класс С) печеночной недостаточностью не требуется. Была исследована фармакокинетика Даклатасвира с последующим приемом единичной пероральной дозы 60 мг у ВГС-неинфицированных субъектов с почечной недостаточностью. Оцененная АUС, не связанная с Даклатасвиром, была на 18%, 39% и 51% выше у субъектов с клиренсом креатинина 60, 30 и 15 мл/мин соответственно по сравнению с субъектами с нормальной функцией почек. У субъектов, требующих гемодиализа, рост АUС Даклатасвира составил 27% и рост несвязанной АиС по сравнению с субъектами с нормальной функцией почек - 20%. Таким образом, корректировка дозы Даклатасвира не требуется для пациентов с любой степенью почечной недостаточности.
Никакого подбора дозировки Симепревира не требуется для пациентов с легкой, умеренной или тяжелой почечной недостаточностью. Безопасность и эффективность Симепревира не были изучены у больных с уровнем клиренса креатинина ниже 30 мл/мин или терминальной стадией почечной недостаточности, в том числе у больных на диализе. Тем не менее, из-за того, что Симепревир прочно связан с белком, диализ вряд ли приведет к значительному удалению Симепревира.
*AUC – площадь под фармакологической кривой – кривой «концентрация – время» – изменение концентрации активного вещества в плазме или сыворотке крови во времени.
Наиболее часто сообщалось о таких побочных эффектах при применении Даклатасвира, как утомляемость, головная боль и тошнота.
Даклатасвир является субстратом CYP34A и субстратом и блокатором P-GP. Кроме того, он является блокатором OATP1B1 и BCRP. Противопоказано комбинированное назначение Даклатасвира с препаратами, которые сильно индуцируют CYP3A4 и P-GP и тем самым уменьшают воздействие Даклатасвира. Это противосудорожные препараты (Карбамазепин, Фенитоин, Oкскарбазепин, Фенобарбитал), противотуберкулезные препараты (Рифампицин, Рифабутин, Рифапентин), системный Дексаметазон и зверобой. Сильные блокаторы CYP3A4 повышают уровни Даклатасвира в плазме, поэтому рекомендуются корректировки доз Даклатасвира. Доза Даклатасвира должна быть снижена до 30 мг 1 раз в день с Атазанавиром/Ритонавиром и Кобицистатом в схеме лечения антиретровирусными препаратами. Напротив, последние данные показывают, что регулировка дозы не требуется ни с Дарунавиром/Ритонавиром, ни с Лопинавиром/Ритонавиром. В исследовании ALLY-2 у пациентов с сочетанной ВИЧ-инфекцией, получающих Софосбувир и Даклатасвир, больных, получающих лечение на основе Дарунавира, которым была снижена доза Даклатасвира до 30 мг (на основе исходных данных исследования Атазанавира/Ритонавира), наблюдался пониженный уровень УBO12, особенно в группе 8-недельного лечения, что указывает на необходимость применения стандартной дозы Даклатасвира у больных на фоне усиленного блокатора протеазы. С применением Эфавиренца (индуктор фермента) рекомендуется увеличить дозу Даклатасвира до 90 мг. Из-за отсутствия данных это же не рекомендуется при приеме Этравирина и Невирапина, оба являются индукторами ферментов. Нет взаимодействий с такими препаратами, как Тенофовир, Эмтрицитабин, Ламивудин, Абакавир, Зидовудин, Ставудин, Рилпивирин, Ралтегравир, Долутегравир и Маравирок.
Доза Даклатасвира также должна быть снижена до 30 мг при приеме с такими антибактериальными препаратами, как Кларитромицин, Телитромицин, Эритромицин, а также с противогрибковыми препаратами - Кетоконазолом, Итраконазолом, Вориконазолом и Позаконазолом. Были проведены исследования с кислотными восстановителями (Фамотидин, Oмепразол), Эсциталопрамом и оральными контрацептивами без коррекции дозы Даклатасвира или сопутствующих препаратов. Тем не менее, из-за того, что Даклатасвир блокирует некоторые транспортные белки, необходим контроль Дабигатрана и Дигоксина и других P-GP-субстратов.
Паритапревир, Омбитасвир и Дасабувир, усиленные Ритонавиром. Паритапревир является блокатором протеазы NS3-4A, который метаболизируется главным образом CYP3A4 и назначается в низкой дозировке блокатора Ритонавира CYP3A в качестве фармакокинетического усилителя. Он позволяет принимать препарат 1 раз в день и в более низкой дозировке, чем требовалось бы без Ритонавира. Oмбитасвир является блокатором NS5A, назначается в фиксированной дозировке в комбинации с Паритапревиром/Ритонавиром. Рекомендуемая доза этой комбинации - 2 таблетки Ритонавира/Паритапревира/Омбитасвира (50 мг/75 мг/12,5 мг на таблетку), которая принимается перорально 1 раз в день с пищей. Дасабувир является ненуклеозидным блокатором РНК-зависимой РНК-полимеразы ВГС в таблетках по 250 мг и принимается 2 раза в день в сочетании с Ритонавиром/Паритапревиром/Oмбитасвиром пациентами с генотипом 1.
Паритапревир выводится преимущественно с фекалиями. Oмбитасвир показывает линейную кинетику и преимущественно выводится с калом. Дасабувир метаболизируется в печени, и его преобладающий метаболит выводится в основном с желчью и фекалиями с минимальным почечным клиренсом.
Фармакокинетические результаты исследования печеночной недостаточности показали, что у пациентов с тяжелой печеночной недостаточностью (Класс C) AUC Паритапревира выросла в 9,5 раза, в то время как Oмбитасвира - снизилась на 54%, а Дасабувира - увеличилась в 3,3 раза. В результате не требуется коррекция дозы для пациентов с легкой печеночной недостаточностью (Класс A) и не ожидается, что коррекция дозы потребуется для пациентов с умеренной печеночной недостаточностью (Класс В). И напротив, эта комбинация противопоказана пациентам с тяжелой печеночной недостаточностью (Класс С).
ДиС Паритапревира увеличилась на 45% у пациентов с тяжелой почечной недостаточностью (клиренс креатинина 15-29 мл/мин) в отличие от 114% - Ритонавира и 50% - Дасабувира. В настоящее время никакого подбора дозировки не требуется для пациентов с легкой, умеренной или тяжелой почечной недостаточностью. Неизвестно, выводится ли частично Пари- тапревир, Омбитасвир и/или Дасабувир при диализе.
В сообщениях о наиболее распространенных побочных эффектах, относящихся к комбинациям Паритапревира, Омбитасвира и Дасабувира, усиленных Ритонавиром, говорилось об утомляемости и тошноте.
Паритапревир в первую очередь метаболизируется CYP3A4, тогда как Дасабувир в первую очередь метаболизируется CYP2C8, а Омбитасвир подвергается гидролизу. Тем не менее, как и Омбитасвир, Дасабувир может метаболизироваться CYP3A4. Транспортеры, кажется, играют важную роль в расположении этих препаратов, где Паритапревир блокирует ОАТР1В1/В3, P-GP и ВСRР. Дасабувир и Ритонавир могут также блокировать Р-GР и ВСКР. Учитывая метаболический профиль препаратов и присутствие Ритонавира, существует потенциал для многих лекарственных взаимодействий. Была проведена комплексная программа оценки взаимодействия препаратов на основе Регуляторного руководства как Европейского агентства по лекарственным средствам, так и Управления по контролю пищевых продуктов и лекарственных средств США. Важно учитывать профиль лекарственного взаимодействия соединений в виде комбинации (с или без Дасабувира), потому что препараты взаимно воздействуют друг на друга.
Ритонавир является сильным блокатором CYP3A4; таким образом, совместное введение лекарственных средств с препаратами, которые метаболизируются этим ферментом, может привести к значительному увеличению концентрации в плазме крови. Ряд препаратов противопоказан, потому что повышенные концентрации в плазме могут привести к серьезным неблагоприятным событиям: Альфузозин, Амиодарон, Астемизол, Терфенадин, Цизаприд, производные спорыньи, Ловастатин, Симвастатин, Аторвастатин, пероральный Мидазолам, Триазолам, Кветиапин, Хинидин, Сальметерол, Силденафил, когда они используются при легочной артериальной гипертензии. Также противопоказаны индукторы ферментов, которые могли бы поставить под угрозу вирусологическую эффективность, например Карбамазепин, Фенитоин, Фенобарбитал, Рифампицин, зверобой, Энзалутамид и блокаторы ферментов, которые могли бы увеличить концентрацию Паритапревира, например азольные фунгициды, некоторые макролидные антибиотики.
В дополнение к противопоказаниям есть и другие препараты, где необходимо проявлять осторожность и может возникнуть необходимость для коррекции дозы, изменения времени введения или дополнительного контроля. Взаимодействия должны быть тщательно рассмотрены в случае сочетанной ВИЧ-инфекции. Противопоказано назначать Атазанавир и Дару- навир, если они должны приниматься без Ритонавира и других блокаторов протеазы. Эфави- ренц, Этравирин и Невирапин противопоказаны, Рилпивирин следует применять с осторожностью с повторным ЭКГ-контролем. Концентрация Ралтегравира и Долутегравира может увеличиться, но это не связано с вопросами безопасности. Элвитегравир/Кобицистат не следует использовать из-за дополнительного усиливающего эффекта.
Рекомендации
- Многочисленные и сложные лекарственные взаимодействия возможны с ВГС ПППД, особенно когда они используются в безинтерфероновых комбинациях. Таким образом, необходимо применять строгие правила. Так как данные уже накоплены, то Руководство по противопоказаниям и корректировкам дозирования можно найти в таблицах 4А-4F этих Рекомендаций и на сайте www.hep-druginteractions.org, где они регулярно обновляются (В1).
- Использование схем лечения на основе Кобицистата, Эфавиренца, Этравирина, Невирапина, Ритонавира и любого блокатора протеазы ВИЧ, усиленного или нет Ритонавиром, не рекомендуется у ВИЧ-инфицированных пациентов, получающих Симепревир (А1).
- Суточная доза Даклатасвира должна быть скорректирована до 30 мг в день у ВИЧ- инфицированных пациентов, получающих Атазанавир/Ритонавир, и до 90 мг ежедневно у тех, кто получает Эфавиренц (B2).
- Нет сообщений о взаимодействии между Софосбувиром и антиретровирусными препаратами (А2).
- Комбинации с фиксированной дозой Софосбувира и Ледипасвира могут быть использованы со всеми антиретровирусными препаратами. Тем не менее, этот режим нельзя использовать в комбинации Тенофовир/Эмтрицитабин с Атазанавиром/Ритонавиром, Дарунавиром/Ритонавиром, Лопинавиром/Ритонавиром или Элвитегравиром/Кобицистатом или использовать с осторожностью при частом почечном контроле (В1).
- Сочетание Паритапревира, Омбитасвира и Дасабувира, усиленных Ритонавиром, не следует использовать с Эфавиренцом, Этравирином или Невирапином, а Рилпивирин следует использовать осторожно с частым ЭКГ-контролем. Атазанавир и Дарунавир должны приниматься без Ритонавира и других блокаторов протеазы в этой комбинации. Элвитегравир/Кобицистат не следует использовать в этой схеме лечения из-за дополнительного усиливающего эффекта (B1).
Лечение хронического гепатита С, в том числе больных без цирроза и пациентов с компенсированным (Класс A) циррозом
В 2015 г. и далее не получавшие предварительного лечения и прошедшие лечение пациенты с компенсированным и декомпенсированным заболеванием печени получат пользу от широкого выбора лекарственных комбинаций. Показания будут зависеть от генотипа ВГС/подтипа, тяжести заболевания печени и/или результатов предшествующей терапии. Несмотря на соответствующую затратность этих вариантов, безинтерфероновые схемы лечения являются самыми лучшими вариантами в случае доступности из-за их вирусологической эффективности, простоты использования и переносимости. Показания такие же для пациентов с ВГС-моноинфекцией и ВИЧ-инфицированных. Тем не менее, может понадобиться изменение лечения или корректировки дозировки в связи с лекарственным взаимодействием (см. лекарственные взаимодействия).
Рекомендации
- Показания для лечения ВГС у лиц с сочетанной инфекцией ВГС/ВИЧ идентичны тем, что и у пациентов с ВГС-моноинфекцией (А1).
- Несмотря на соответствующую затратность этих вариантов, безинтерфероновые схемы - самые лучшие варианты у пациентов с ВГС-моноинфекцией и у ВИЧ-инфицированных без цирроза или с компенсированным (Класс А) или декомпенсированным (Класс В или С) циррозом печени из-за их вирусологической эффективности, простоты использования и переносимости (А1).
- Те же схемы безинтерферонового лечения можно использовать у ВИЧ-инфицированных пациентов, а также у пациентов, не инфицированных ВИЧ, так как вирусологические результаты терапии являются идентичными (А1).
Для каждого генотипа ниже приведены доступные опции, а затем краткое изложение данных, доступных для данной опции, а в табл. 5 и 6 дана краткая характеристика.
Лечение инфекции ВГС 1-го генотипа
Шесть вариантов лечения доступны с 2015 г. для пациентов, инфицированных ВГС 1-го генотипа, в том числе две интерферонсодержащие и четыре безинтерфероновые схемы лечения. Комбинацию Софосбувира и Рибавирина не следует использовать у пациентов, инфицированных ВГС 1-го генотипа. В условиях, когда ни один из предложенных вариантов не доступен, двойная комбинация ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина или тройная комбинация ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина, а также Телапревира или Боцепревира остаются приемлемыми для отдельных пациентов; вероятно, эти схемы будут работать, пока новые ПППД не станут доступными и дешевыми; см. Руководство по клинической практике предыдущих EASL [5, 24].
Интерферонсодержащие варианты
Генотип 1, интерферонсодержащий вариант 1
- Пациентов, инфицированных ВГС (генотип 1), можно лечить еженедельной комбинацией ПЕГ-ИНТЕРФЕРОНА-α, ежедневной дозой Рибавирина в зависимости от веса пациента (1000 или 1200 мг у пациентов <75 кг или ≥75 кг соответственно) и ежедневно Софосбувиром (400 мг) в течение 12 недель (А1).
Примечания: эта комбинация была оценена в исследовании NEUTRINO Фаза III у не получавших предварительного лечения пациентов [25]. Общая частота УВО соста-вила 89% (259/291), 92% (207/225) для подтипа 1а и 82% (54/66) - для подтипа 1b. Пациенты с циррозом печени имели более низкую частоту УВО, чем без цирроза печени (80% против 92% соответственно). У пациентов после неудачного лечения этой схемой не выявлялись варианты ВГС, устойчивые к Софосбувиру. Нет данных по Фазе II этих режимов у пациентов, у которых предыдущее лечение ПЕГ-ИНТЕРФЕРОНОМ-α и Рибавирином оказалось неудачным. Тем не менее, на основе частоты УВО в исследованиях, данных анамнеза и исследованиях NEUTRINO FDA (Управление по контролю качества пищевых продуктов и лекарственных средств) США высказало прогноз, что 78% пациентов, у которых предыдущее лечение ПЕГ-ИНТЕРФЕРОНОМ-α и Рибавирином оказалось неудачным, могли бы достичь УВО при помощи тройной комбинации ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Софосбувира (хотя разные модели дают немного разные прогнозы) [26]. Точно так же нет никаких данных применения этого режима лечения у больных, у которых предыдущее лечение ПЕГ-ИНТЕРФЕРОНОМ-α, Рибавирином и либо Телапревиром, либо Боцепревиром оказалось неудачным. Частота УВО12 при лечении тройной комбинацией ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Софосбувира составила 74% у стационарных больных, которым не удалось достичь УВО после приема ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и исследуемого блокатора протеазы в отдельности или в комбинации с блокатором ненуклеозидной РНК-зависимой РНК-полимеразы ВГС или Ледипасвира [27]. Нет данных об этой комбинации у больных с сочетанной ВИЧ-инфекцией, а пациентов с циррозом было включено относительно небольшое число. Пока неизвестно, понадобится ли большая продолжительность лечения для трудноизлечимых групп населения.
Были представлены предварительные результаты двух крупномасштабных американских практических исследований. В исследовании ВГС TARGET 2.0 [13] общий показатель УВО4 от использования тройной комбинации ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Софосбувира был 85% (140/164; 55% - пациенты, не получавшие предварительного лечения, и 45% - ранее прошедшие лечение пациенты). Показатель УВО4 составил 90% (114/127) среди пациентов, не больных циррозом печени, но этот показатель достиг 70% (26/37) у пациентов с циррозом печени. В практическом исследовании TRIO, которое включало 58% не получавших предварительного лечения пациентов и 42% прошедших лечение пациентов, показатель УВО12 достиг 81% (112/138) среди пациентов без цирроза, не получавших предварительного лечения, 81% (25/31) - среди прошедших лечение пациентов с циррозом печени, 77% (30/39) - среди прошедших лечение пациентов без цирроза печени и 62% (53/85) - среди прошедших лечение пациентов с циррозом печени (в зависимости от назначенного лечения), которые принимали ПЕГ-ИНТЕРФЕРОН-α, Рибавирин и Софосбувир [28].
Генотип 1, интерферонсодержащий вариант 2
- Пациентов, инфицированных ВГС 1-го генотипа, можно лечить еженедельной комбинацией ПЕГ-ИНТЕРФЕРОНА-α, ежедневной дозой Рибавирина в зависимости от веса пациента (1000 или 1200 мг у пациентов <75 кг или ≥75 кг соответственно) и ежедневной дозой Симепревира (150 мг) (А1).
- Эта комбинация не рекомендуется для пациентов, инфицированных подтипом 1а, которые имеют выявляемое замещение Q80K в последовательности протеазы NS3 на исходном уровне по оценке секвенирования численности (анализ прямой последовательности) (А1).
- Симепревир следует принимать в течение 12 недель в сочетании с ПЕГ-ИНТЕРФЕРОНОМ-α и Рибавирином. ПЕГ-ИНТЕРФЕРОН-α и Рибавирин необходимо назначать отдельно еще 12 недель (общая длительность лечения 24 недели) пациентам, не получавшим предварительного лечения, и пациентам с предыдущим рецидивом, в том числе больным с циррозом печени, а также еще 36 недель (общая продолжительность лечения 48 недель) пациентам с предварительным частичным и нулевым ответом, в том числе больным с циррозом печени (В1).
- Уровни РНК ВГС необходимо контролировать относительно реакции на лечение. Лечение следует прекратить, если уровень РНК ВГС достигает 25 МЕ/мл и больше на 4-ю, 12-ю или 24-ю недели (A2).
Примечания: эта комбинация была оценена в клинических исследованиях QUEST-1 и QUEST-2 Фаза III у не получавших предварительного лечения пациентов [29, 30]. Общий уровень УВО был 80% (210/264) и 81% (209/257) соответственно. В обобщенном анализе обоих исследований пациенты, инфицированные подтипом 1b, достигли УВО в 85% случаев (228/267). Пациенты, инфицированные подтипом 1а, достигли УВО в 84% случаев (138/165), когда не была выявлена замена Q80K в последовательности протеазы NS3 на исходном уровне. УВО составил только 58% (49/84), когда была выявлена замена Q80K на исходном уровне исследования методом секвенирования численности. УВО при этой схеме лечения достигнут у 84% (317/378) пациентов с баллами F0-F2 METAVIR, у 73% (60/82) пациентов с F3 и у 60% (29/48) пациентов с циррозом (F4). Тем не менее, для пациентов, которые получили 24-недельное лечение, частота УВО была ниже у пациентов с выявляемой РНК ВГС, чем у пациентов с невыявляемой, на 4-й неделе лечения (69% против 93% соответственно) [29, 30]. У не получавших предварительного лечения ВИЧ-инфицированных пациентов, получающих эту схему лечения, УВО был достигнут у 79% пациентов (42/53) [31].
У пациентов с моноинфекцией, у которых ранее был рецидив после применения ИНТЕРФЕРОН-α/Рибавирин-терапии, УВО24 был достигнут у 86% (128/149) пациентов с подтипом 1b и у 70% (78/111) пациентов с подтипом 1a. Среди пациентов, инфицированных генотипом 1а, УВО24 был достигнут у 78% без и 47% с выявляемым замещением Q80K на исходном уровне [32]. В другом исследовании у пациентов с сочетанной ВИЧ-инфекцией с рецидивом после предшествующего лечения частота УВО составила 87% (13/15) [31].
В исследовании ATTAIN Фаза III УВО12 был достигнут у 70% (101/145) пациентов с ранними частичными ответами и у 44% (102/234) пациентов с нулевым ответом к ПЕГ-ИНТЕРФЕРОН-α/ Рибавириновой терапии, которые принимали тройное сочетание ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Симепревира, против 68% (100/146) и 46% (110/238) из тех же групп, которые получали Телапревир соответственно [33]. Среди пациентов с сочетанной ВИЧ-инфекцией 70% (7/10) пациентов с частичным ответом и 54% (15/28) пациентов с нулевым ответом достигли УВО24 в другом исследовании [31].
Безинтерфероновые варианты
Генотип 1, безинтерфероновый вариант 1
- Пациентов, инфицированных ВГС 1-го генотипа, можно лечить безинтерфероновой комбинацией с фиксированной дозой Софосбувира (400 мг) и Ледипасвира (90 мг) по 1 таблетке 1 раз в день (А1).
- Пациентов без цирроза, в том числе не получавших предварительного лечения и прошедших лечение пациентов, необходимо лечить этой комбинацией фиксированных доз в течение 12 недель без Рибавирина (А1).
- Лечение может быть сокращено до 8 недель у не получавших предварительного лечения пациентов без цирроза, если их исходный уровень РНК ВГС ниже 6 млн (6.8 Log) МЕ/мл. При этом необходимо соблюдать осторожность, особенно у пациентов с фиброзом F3, в преддверии выявления точности определения уровня РНК ВГС в этом диапазоне значений и практического подтверждения, что 8 недель лечения достаточны для достижения высоких уровней УВО (B1).
- Пациентов с компенсированным циррозом, в том числе не получавших предварительное лечение и прошедших лечение пациентов, необходимо лечить этой комбинацией фиксированных доз Рибавирина в зависимости от веса (1000 или 1200 мг у больных <75 кг или ≥75 кг соответственно) ежедневно в течение 12 недель (А1).
- Пациентам с компенсированным циррозом печени с противопоказаниями или плохой переносимостью Рибавирина следует вводить комбинацию с фиксированной дозой Со- фосбувира и Ледипасвира в течение 24 недель без Рибавирина (B1).
- Лечение комбинацией фиксированных доз Софосбувира и Ледипасвира с Рибавирином может быть продлено до 24 недель у прошедших лечение пациентов с компенсированным циррозом и отрицательными прогнозами относительно ответа, например с количеством тромбоцитов <75х103/мл (B2).
Таблица 5 Рекомендации по лечению ВГС-моноинфекции или ВГС/ВИЧ-инфицированных пациентов с хроническим гепатитом С без цирроза, включая не получавших предварительного лечения пациентов и пациентов, которым не помогло предыдущее лечение на основе ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина (РБВ)
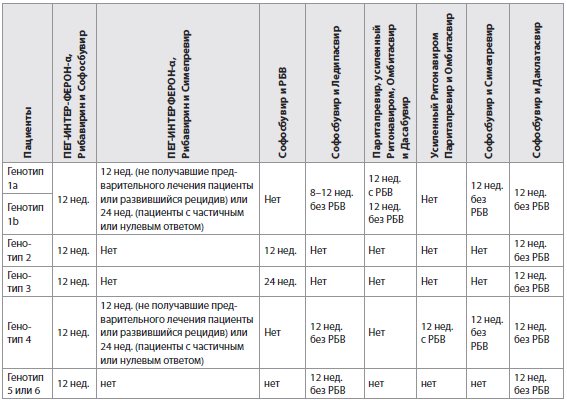
Таблица 6 Рекомендации по лечению ВГС-моноинфекции или ВГС/ВИЧ-инфицированных пациентов с хроническим гепатитом С с компенсированным (Класс А) циррозом, включая не получивших предварительного лечения пациентов и пациентов, которым не помогло предыдущее лечение на основе ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина (РБВ)
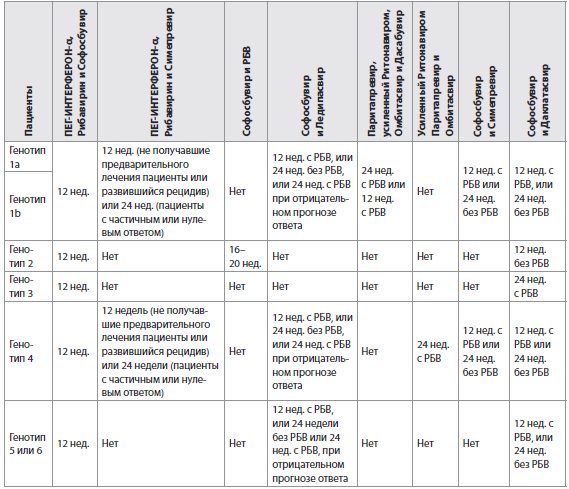
Примечания: эти рекомендации основаны на результатах исследования Фазы III ION-1, ION-2 и ION-3 [34-36]. В ION-1 не получавшие предварительного лечения пациенты, в том числе 16% с компенсированным циррозом, достигли уровня УВО12 в 99% (211/214) и в 97% (211/217) случаев после 12 недель приема комбинации фиксиро-ванных доз Софосбувира и Ледипасвира без или с Рибавирином соответственно. Уровни УВО12 составили 98% (212/217) и 99% (215/217) после 24 недель и той же комбинации без или с Рибавирином соответственно [34]. В ION-3 при лечении не получавших предварительного лечения пациентов без цирроза (F3 - только 13% пациентов, перенесших биопсию печени) уровни УВО12 составили 94% (202/215) без Рибавирина в течение 8 недель, 93% (201/216) - с Рибавирином в течение 8 недель и 95% (205/216) - без Рибавирина в течение 12 недель. Абсолютное число рецидивов после лечения, однако, было зарегистрировано через 8 недель: 11/215, 9/216 и 3/216 соответственно. Ретроспективный анализ показал, что только пациентов с уровнем РНК ВГС <6 млн (6.8 Log) МЕ/мл на исходном уровне можно лечить в течение 8 недель [36]. Тем не менее, определение уровня РНК ВГС может быть неточно в пределах этого диапазона значений у имеющихся в настоящее время РНК ВГС-анализов и могут понадобиться достоверные подтверждения для определения того, что 8 недель лечения с этой комбинацией достаточно. Интересно, что частота рецидивов составила 1% (1/84) и 1% (1/96) у женщин, которые прошли в течение 8 недель лечение с Софосбувиром и Ледипасвиром без и с Рибавирином соответственно, и 8% (10/129) и 7% (8/114) у мужчин соответственно в исследовании ION-3 [36]. В другом исследовании Фазы II лечение комбинацией Софосбувира и Ледипасвира длилось 12 недель без Рибавирина у пациентов с генотипом 1 ВГС-инфекции с сочетанной ВИЧ-инфекцией, в том числе у 13 нелеченных по поводу ВИЧ-инфекции и у 37 пациентов, которым была назначена антиретровирусная терапия. Все, кроме одного пациента, (98%) достигли УВО12 [37].
В ION-2 у прошедших лечение больных (предварительно ПЕГ-ИНТЕРФЕРОН-α и Рибавирин или ПЕГ-ИНТЕРФЕРОН-α, Рибавирин и также Телапревир или Боцепревир), включая 20% с циррозом, уровни УВО12 составили 94% (102/109) и 96% (107/111) без или с Рибавирином соответственно. Через 24 недели терапии уровни УВО составили 99% (108/109) и 99% (110/111) соответственно [37].
Комплексный анализ 513 пациентов с генотипом 1 с компенсированным циррозом, получавших комбинации фиксированных доз Софосбувира и Ледипасвира с или без Рибавирина, в разных Фазах II и III исследований показали, что общий уровень УВО12 - 95% (305/322) после 12 недель и 98% (188/191) - после 24 недель терапии [38]. Ни продолжительность лечения, ни Рибавирин не оказывают влияния на УВО12 у не получавших предварительного лечения пациентов (уровни УВО12 между 96% и 100%). Напротив, у получивших лечение пациентов уровни УВО12 составили 90% после 12 недель без Рибавирина, 96% - после 12 недель с Рибавирином, 98% - после 24 недель без Рибавирина и 100% - после 24 недель с Рибавирином. Количество тромбоцитов <75х103/мкл было связано с более низким уровнем УВО среди пациентов, прошедших лечение (28 больных) [38].
В исследовании SIRIUS при 12-недельном лечении комбинацией фиксированных доз Софосбувира и Ледипасвира с Рибавирином или 24-недельном лечении той же комбинацией без Рибавирина пациентов с компенсированным циррозом печени, которым не удалось достичь УВО после лечения ПЕГ-ИНТЕРФЕРОНОМ-α, Рибавирином, а также Телапревиром или Боцепревиром, уровни УВО12 составили 96% (74/77) и 97% (75/77) соответственно [39].
Генотип 1, безинтерфероновый вариант 2
Пациентов, инфицированных ВГС 1-го генотипа, можно лечить при помощи безинтерфероновой схемы, включающей комбинацию фиксированных доз Омбитасвира (75 мг), Паритапревира (12,5 мг) и Ритонавира (50 мг) в 1 таблетке (2 таблетки 1 раз в день с пищей) и Дасабувира (250 мг) (1 таблетка 2 раза в день) (А1).
- Пациенты, инфицированные подтипом 1b без цирроза, должны получить эту комбинацию в течение 12 недель без Рибавирина (А1).
- Пациенты, инфицированные подтипом 1b с циррозом, должны получить эту комбинацию в течение 12 недель ежедневно с Рибавирином в зависимости от массы тела (1000 или 1200 мг у больных <75 кг или >75 кг соответственно) (A1).
- Пациенты, инфицированные подтипом 1а без цирроза, должны получить эту комбинацию в течение 12 недель ежедневно с Рибавирином в зависимости от массы тела (1000 или 1200 мг у больных <75 кг или >75 кг соответственно) (A1).
- Пациенты, инфицированные подтипом 1а с циррозом, должны получить эту комбинацию в течение 24 недель ежедневно с Рибавирином в зависимости от массы тела (1000 или 1200 мг у больных <75 кг или >75 кг соответственно) (A1).
Примечания: эти рекомендации основаны на результатах 7 исследований Фазы III. В исследовании SAPPHIRE-I у не получавших предварительного лечения пациентов без цирроза, которые принимали эту комбинацию вместе с Рибавирином в течение 12 недель, уровни УВО12 составили 95% (307/322) у пациентов с подтипом 1а и 98% (148/151) - у пациентов с подтипом 1b [40]. В исследовании PEARL-IV уровни УВО12 составили 90% (185/205) и 97% (97/100) без и с Рибавирином соответственно у не получавших предварительного лечения пациентов без цирроза, инфицированных подтипом 1а. В исследовании PEARL-III уровни УВО12 составили 99% (207/209) и 99% (209/210) без и с Рибавирином соответственно у не получавших предварительного лечения пациентов без цирроза, инфицированных подтипом 1а [41]. В исследовании TURQUOISE-I у не получавших предварительного лечения больных без цирроза печени с сочетанной ВИЧ-инфекцией и стабильных при антиретровирусной терапии, содержащей Атазанавир или Ралтегравир, уровни УВО12 составили 93% (29/31) и 91% (29/32) после 12 или 24 недель лечения соответственно; УВО12 был достигнут у 91% (51/56) пациентов с подтипом 1а и 100% (7/7) пациентов - с подтипом 1b [42].
У пациентов, прошедших лечение и без цирроза печени (отказ от ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина), принимавших эту комбинацию с Рибавирином в течение 12 недель в исследовании SAPPHIRE-II, уровни УВО12 составили 96% (166/173) у пациентов с подтипом 1а и 97% (119/123) - у пациентов с подтипом 1b. В целом уровни УВО12 составили 95% (82/86) у паци-ентов с предшествующим рецидивом, 100% (65/65) - у пациентов с предыдущим частичным ответом и 95% (139/146) - у пациентов с предыдущим нулевым ответом [43]. УВО12 был достигнут в 100% (91/91) случаев без Рибавирина и в 97% (85/88) - с Рибавирином у пациентов, инфицированных подтипом 1b, которые принимали эту комбинацию в исследовании PEARL-II [44].
У не получавших предварительного лечения и получивших лечение пациентов с компенсированным циррозом уровни УВО составили 92% (191/208) после 12 недель и 96% (165/172) - после 24 недель приема комбинации Паритапревира, Омбитасвира и Дасабувира, усиленных Ритонавиром, с Рибавирином в исследовании TURQUOISE-II. УВО12 был достигнут у 92% (239/261) пациентов с генотипом 1а и у 99% (118/119) пациентов с генотипом 1b [45]. У пациентов с уровнем α-фетопротеина <20 нг/мл, тромбоцитов >90х109/л и уровнем альбумина >35 г/л до лечения показатели рецидивов составили 1% (1/87) и 0% (0/68) после 12 или 24 недель лечения соответственно; у пациентов с уровнем осфетопротеина >20 нг/мл и/или тромбоцитов <90х109/л и/или уровнем альбумина <35 г/л до лечения они составили 21% (10/48) и 2% (1/45) через 12 или 24 недель лечения соответственно [45].
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Гепатит С: лечится или нет?
Гепатит С: лечится или нет?
 Клиническая инфектология и паразитология. Часть 1
Клиническая инфектология и паразитология. Часть 1
 Клиническая инфектология и паразитология. Часть 5
Клиническая инфектология и паразитология. Часть 5
 Гепатит В и его последствия
Гепатит В и его последствия