- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Клиническая инфектология и паразитология. Часть 4
Клиническая инфектология и паразитология. Часть 4

Тактика ведения пациентов с инфекцией, вызванной вирусом гепатита С. Клинические рекомендации Европейской ассоциации по изучению болезней печени (ЕАИП/EASL) 2015 г.
Рекомендации
- При применении Симепревира возможны сыпь и повышение уровня непрямого билирубина без повышения АЛТ (А1).
- Повышение непрямого билирубина редко наблюдается при комбинации Паритапревира, усиленного Ритонавиром, Омбитасвира и Дасабувира (А1).
- У пациентов с легкой, умеренной или тяжелой почечной недостаточностью корректировка дозы Симепревира, Софосбувира и Ледипасвира или Даклатасвира не требуется. Соответствующая доза Софосбувира для пациентов со скоростью клубочковой фильтрации (СКФ) <30 мл/мин/1,73 м2 еще не установлена (В2).
- У пациентов с легкой, умеренной или тяжелой (Класс С) печеночной недостаточностью корректировка дозы Софосбувира и Ледипасвира или Даклатасвира не требуется (В2).
- Более сильные воздействия были обнаружены при комбинации Паритапревира, усиленного Ритонавиром, Омбитасвира и Дасабувира у больных с тяжелой печеночной недостаточностью, и их безопасность в этой группе требует дальнейшего изучения (В2).
Мониторинг взаимодействия препаратов
Важно рассмотреть все лекарства, принимаемые пациентом, в том числе безрецептурные и рекреационные препараты. Кроме того, следует поставить следующие вопросы: (1) Все ли сопутствующие препараты необходимы в течение всей терапии ВГС (такие препараты, как ста- тины, можно прекратить употреблять на 8-12-й неделе)? (2) Если нет, есть ли не вступающая во взаимодействие альтернатива того же терапевтического класса? (3) И наконец, можно ли повлиять на взаимодействие препаратов, меняя дозировку или составив четкий план мониторинга? Конкретные взаимодействия препаратов и корректировки дозы см. выше.
Рекомендации
- Во время лечения следует наблюдать за эффективностью и токсичностью параллельно используемых препаратов и их потенциальным взаимодействием (A1).
- По возможности прием взаимодействующего препарата на время лечения ВГС следует прекратить или заменить на препарат с меньшим потенциалом взаимодействия (B1).
Снижение терапевтической дозы
Дозировку ПЕГ-ИНТЕРФЕРОНА-α следует снизить в случае тяжелых побочных эффектов, таких как клинические симптомы тяжелой депрессии, падение абсолютного числа нейтрофилов ниже 750/мм3 или количества тромбоцитов ниже 50 000/мм3. При использовании ПЕГ-ИНТЕРФЕРОНА-α2α дозу можно уменьшить с 180 мкг до 135 мкг, а затем и до 90 мкг в неделю. При использовании ПЕГ-ИНТЕРФЕРОНА-α2b дозу можно уменьшить с 1,5 мкг/кг до 1,0 мкг/кг, а затем и до 0,5 мкг/кг в неделю. ПЕГ-ИНТЕРФЕРОН-α следует отменить в случае тяжелых побочных эффектов, таких как клинические симптомы тяжелой депрессии, падение абсолютного числа нейтрофилов ниже 500/мм3 или количества тромбоцитов ниже 25 000/мм3. Если количество нейтрофилов или тромбоцитов поднимется выше этих минимальных значений, лечение может быть возобновлено, но с уменьшенными дозами. Прерывания интерфероновой терапии должны быть как можно короче. В случае с пациентами, которым необходимо прекратить прием Интерферона, следует рассмотреть схемы безинтерфероновой терапии.
При появлении существенной анемии (меньше 10 г/дл гемоглобина) дозу Рибавирина можно уменьшать пошагово по 200 мг. Пациентам с быстрым снижением гемоглобина дозу можно уменьшать резче, особенно если уровень гемоглобина был низок изначально. Прием Рибавирина следует прекратить при падении уровня гемоглобина ниже 8,5 г/дл [60-68].
В случае развития гепатита (уровни АЛТ, превышающие норму более чем в 10 раз, при отсутствии таких показателей до начала лечения) или в случае тяжелой бактериальной инфекции, независимо от числа нейтрофилов, лечение следует прекратить немедленно. Во время лечения следует оценивать визуальные симптомы и проводить исследования глазного дна.
Для Софосбувира, Симепревира, Даклатасвира или Паритапревира, Омбитасвира и Дасабувира, усиленных Ритонавиром, корректировка дозы не рекомендуется. В случае тяжелых побочных эффектов, таких как сепсис, у пациентов с декомпенсированным циррозом печени лечение нужно приостановить. Влияние на эффективность и количество допустимых дней для приостановки лечения и продолжительности повторного лечения у пациентов, которые заново начали лечение после прерывания безинтерфероновой терапии, неизвестны.
Меры по повышению приверженности терапии
Полное соблюдение режима приема лекарств позволяет достичь высокого уровня УВО. И напротив, неполное соблюдение связано с вирусологическим прорывом или рецидивом после лечения и возникновением резистентности, особенно на ранней стадии лечения. Таким образом, следует применить простые меры для повышения приверженности терапии.
Перед началом противовирусной терапии пациентов нужно проинструктировать пациента о ежедневном графике и ожидаемых побочных эффектах (как интерфероновых и Рибавиринсодержащих схем, так и безинтерфероновых схем терапии). Также пациентов следует известить о превентивных и терапевтических мерах для смягчения этих побочных эффектов, таких как применение антипиретиков, анальгетиков или антидепрессантов при приеме интерферона. На будущее должны быть запланированы регулярные посещения с обсуждением прогресса лечения и побочных эффектов. В случае пропусков посещений следует применить процедуру отзыва пациента.
Ключевой элемент эффективного управления терапией ВГС - это доступ к многопрофильной команде, как правило, включающей врача, клиническое обследование и мониторинг, службу вирусологии, наркологическую службу, службу по ВИЧ-инфекции, психиатрическую поддержку в отдельных случаях, фармацевтов и социальных работников и другие службы социальной поддержки (в том числе группы взаимной поддержки, если таковые имеются). Меры по повышению приверженности лечению носят многопрофильный характер. Они включают осведомление о ВГС и службы мониторинга, в частности помощь специальной медсестры [69, 70]. Языковые проблемы с пониманием иностранных пациентов должны быть решены до начала лечения.
Чтобы максимизировать вероятность пользы для пациентов, которые начинают новые схемы лечения ВГС, следует уделить внимание предварительной оценке и подготовке, а также мониторингу и поддержке соблюдения режима приема препаратов, что стало проще с новыми терапевтическими схемами.
Потребление алкоголя оказывает влияние на соблюдение режима лечения [71]. Поэтому пациентам следует рекомендовать прекратить или уменьшить потребление алкоголя перед началом лечения. Лечение пациентов, не способных отказаться от алкоголя, должно быть подобрано индивидуально, с акцентом на их способности соблюдать режим приема лекарственных препаратов и посещений врача. Больным гепатитом С, продолжающим потребление алкоголя во время лечения, требуется дополнительный уход [71-74]. Фармацевты должны проводить консультации на предмет потенциальных лекарственных взаимодействий.
Рекомендации
- Лечение гепатита должно осуществляться многопрофильной командой с опытом в оценке и терапии ВГС (А1).
- Пациентов с ВГС-инфекцией следует консультировать на счет важности приверженности терапии для достижения УВО (А1).
- У социально-экономически неблагополучных пациентов и иммигрантов в терапии ВГС должна принимать участие служба социальной поддержки (В2).
- У лиц, активно употребляющих инъекционные наркотики, обязательно должен быть доступ к программам снижения вреда (А1).
- Следует рассмотреть использование групп взаимной поддержки для улучшения терапии ВГС (В2).
- Пациентам следует рекомендовать воздержание от алкоголя во время противовирусной терапии. Пациентам, продолжающим употребление алкоголя во время лечения, требуется дополнительный уход во время противовирусной терапии (А1).
- Лечение гепатита также можно рассмотреть для пациентов, активно использующих наркотики, при наличии желания и возможности проводить регулярные встречи. Кроме того, следует принимать во внимание потенциальные взаимодействия назначенных и неназначенных препаратов (А1).
Последующее наблюдение за пациентами, достигшими УВО
У пациентов, не страдающих циррозом печени и достигших УВО, следует определять уровень РНК ВГС на 48-й неделе после окончания лечения. Если и в этот раз РНК ВГС не будет обнаружена, можно считать, что инфекция вылечена полностью и больше определение РНК ВГС не требуется, так как после прекращения интерфероновой терапии может возникнуть гипертиреоз через год и два после лечения, у пациентов, получавших Интерферон, следует проверять уровни тироксина и тиреотропного гормона. Пациенты с ранее присутствующими кофакторами заболевания печени (в частности, с историей употребления алкоголя и/или сахарным диабетом 2-го типа) при необходимости подлежат периодическому углубленному клиническому обследованию.
Больные с циррозом печени, которые достигли УВО, должны оставаться под наблюдением на предмет ГЦК каждые 6 мес. с помощью ультразвука, а варикоз вен пищевода проверяется с помощью эндоскопии, если варикоз присутствовал на предварительной эндоскопии (хотя первые варикозные кровотечения редко наблюдаются после УВО). От наличия кофакторов заболевания печени, таких как история употребления алкоголя и/или сахарный диабет 2-го типа, зависит, нужны ли дополнительные обследования. Точная продолжительность наблюдения на предмет ГЦК у пациентов с фиброзом или циррозом печени, достигших УВО, на данный момент неизвестна и, вероятно, не может быть определена. Действительно, долгосрочные исследования после достижения УВО показали, что, хотя риск развития ГЦК значительно снижается по сравнению с не получавшими лечение пациентами или пациентами, которые не достигли УВО, он остается у пациентов с циррозом печени и устраненным ВГС [2, 3]. Уровень риска будет определяться в будущих исследованиях.
Остаются некоторые опасения, что повторное заражение из-за рецидива или систематического рискованного поведения могут свести на нет потенциальную пользу лечения. Отмеченные темпы повторного заражения после успешного лечения ВГС среди пациентов с высоким риском, например людей, употребляющих инъекционные наркотики, или мужчин, имеющих половые контакты с мужчинами, невысоки - около 1-5% в год [75-79]. Однако облегчение безинтерфероновой терапии может увеличить вероятность повторного заражения. Для того чтобы максимизировать пользу терапии, риски повторного инфицирования следует донести до пациентов в опасном положении и поддерживать положительные изменения в поведении.
Рекомендации
- Пациентов с УВО, не больных циррозом печени, следует повторно проверить на АЛТ и РНК ВГС на 48-ю неделю после лечения, затем выписать, если АЛТ в норме и результат РНК ВГС отрицательный (В1).
- Больные циррозом печени, а также, вероятно, пациенты с фиброзом ^3) с УВО должны проходить наблюдение на предмет ГЦК каждые 6 мес. с помощью ультразвука (В1).
- Следует руководствоваться рекомендациями по лечению портальной гипертензии и варикоза, хотя варикозные кровотечения редко встречается у пациентов с низким риском после достижения УВО (кроме случаев с дополнительными устойчивыми причинами повреждения печени) (А2).
- Пациенты, продолжающие употребление наркотических препаратов, не должны быть исключены из программы лечения ВГС из-за предполагаемого риска повторного заражения (В1).
- Пациентам, продолжающим рискованное поведение, следует объяснить опасность повторной инфекции, чтобы изменить его в лучшую сторону (В1).
- После УВО мониторинг реинфекции ВГС путем ежегодной оценки РНК ВГС следует проводить у людей, употребляющих инъекционные наркотики, или мужчин, имеющих половые контакты с мужчинами с рискованным поведением (В2).
Повторное лечение пациентов, не достигших УВО Повторное лечение пациентов после неудачного лечения двойной комбинацией ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина
Некоторые исследования показывают, что пациенты, которые не смогли достичь УВО после лечения ПЕГ-ИНТЕРФЕРОНОМ-α и Рибавирином, реагируют на безинтерфероновые схемы терапии так же, как и пациенты, ранее не получавшие лечение. Таким образом, эти пациенты подлежат повторному лечению по безинтерфероновой схеме в соответствии с вышеуказанными рекомендациями (табл. 5 и 6).
Повторное лечение пациентов с генотипом 1, которым не помогла тройная комбинация ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Телапревира или Боцепревира (табл. 7)
Безинтерфероновые схемы лечения были проверены на пациентах, инфицированных ВГС генотипа 1, которые не достигли УВО после лечения тройной комбинацией ПЕГ-ИНТЕРФЕРОНОМ-α, Рибавирином и Телапревиром или Боцепревиром. Опыт повторной терапии таких пациентов с комбинацией Софосбувира и Симепревира с или без Рибавирина в течение 12 недель ограничивается текущими наблюдениями групп практического исследования. В исследовании TARGET 2.0 группа, которая до этого потерпела неудачу в терапии тройной комбинацией, имела существенные отрицательные прогнозы для УВО24 [13]. Роль присутствия вариантов, связанных с резистентностью к блокатору протеазы в начале лечения, неизвестна. В практическом исследовании сети TRIO [28] УВО12 с Софосбувиром и Симепревиром был достигнут у 82% (27/33) пациентов, которым не помогла терапия тройной комбинацией, как и у пациентов, в случае которых потерпели неудачу ПЕГ-ИНТЕРФЕРОН-α и Рибавирин (80% [60/80]). Повторное лечение с комбинацией ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Софосбувира таких пациентов дало УВО в 73% (29/40) и 67% (24/36) случаев соответственно [28].
У пациентов без цирроза печени, которым не помогла тройная терапия, комбинация Софосбувира и Даклатасвира в течение 24 недель дала УВО в 95% (19/21) и 100% (21/21) случаев без и с Рибавирином соответственно [14]. В исследовании ION-2 УВО у пациентов без цирроза после повторного лечения Софосбувиром и Ледипасвиром в течение 12 недель без или с Рибавирином был в 96% (50/52) и 100% (50/51) случаев соответственно; после 24 недель - 97% (35/36) и 100% (38/38) без и с Рибавирином соответственно [35]. Следует отметить, что в исследовании ION-2 УВО у пациентов с циррозом печении после повторного лечения Софосбувиром и Ледипасвиром в течение 12 недель без или с Рибавирином был в 86% (12/14) и 85% (11/13) случаев соответственно; после 24 недель - в 100% (14/14) и 100% (13/13) без и с Рибавирином соответственно [35]. В исследовании SIRIUS УВО после терапии Софосбувиром в сочетании с Ледипасвиром в течение 12 недель с Рибавирином и в течение 24 недель без Рибавирина был у 96% (74/77) и 97% (75/77) пациентов соответственно [39].
Повторное лечение пациентов, после неудачного лечения режимом с одним или более ПППД второй волны (табл. 7)
Софосбувир имеет высокий барьер к резистентности. Клинически значимые, устойчивые варианты ВГС хорошо прореагировали на Софосбувир и быстро исчезли после прекращения лечения. Таким образом, стратегии повторного лечения должны включать Софосбувир. Напротив, у пациентов под воздействием ингибитора протеазы (Симепревир, Паритапревир) и блокаторов NS5A (Даклатасвир, Ледипасвир, Омбитасвир) или ненуклеозидных блокаторов ВГС-полимеразы (Дасабувир), которым не удалось достигнуть УВО, были вирусы с аминокислотными заменами в участках с протеазами NS3, NS5A и полимеразой соответственно, что придает им устойчивость к этим препаратам. Содержание вирусов, устойчивых к ингибиторам протеаз, и, вероятно (но более медленно), вирусов, устойчивых к ненуклеозидным ингибиторам полимеразы, постепенно уменьшается до количеств, которые невозможно обнаружить с помощью секвенирования населения (анализ прямой последовательности) в течение от нескольких месяцев до 2 лет после прекращения лечения. Однако после терапии по схеме, включающей блокатор NS5A, вирусы, устойчивые к ингибиторам NS5A, остаются доминирующими в течение многих лет или даже навсегда [80-86].
Наглядно, что пациентов, которым не помогла ПППД-содержащая терапия, следует повторно лечить с применением безинтерфероновых комбинаций, в том числе препаратами с высоким барьером к резистентности (в настоящее время Софосбувир), плюс один или два других препарата, в идеале без перекрестной резистентности с уже введенными препаратами. Основываясь на результатах в группах трудноизлечимых пациентов, повторное лечение должно длиться 12 недель с Рибавирином или продлено до 24 недель с или без Рибавирина (нет данных для сравнения этих схем).
В настоящее время нет никаких достоверных данных в поддержку рекомендаций повторного лечения, основанных на косвенных данных (генотип ВГС, известные профили резистентности к вводимым препаратам, количество употребляемых препаратов, использование Рибавирина, продолжительность лечения). Полезна ли для принятия решения оценка после-довательности генов ВГС (испытание резистентности ВГС) перед повторным лечением, остается неизвестным, как и вопрос, какие терапевтические решения должны быть приняты на основе этого результата.
Таблица 7 Рекомендации по повторному лечению моноинфекции ВГС или ВГС/ВИЧ-инфицированных пациентов с хроническим гепатитом С, которые не смогли достичь УВО при предыдущей противовирусной терапии, содержащей один или несколько ПППД: РБВ
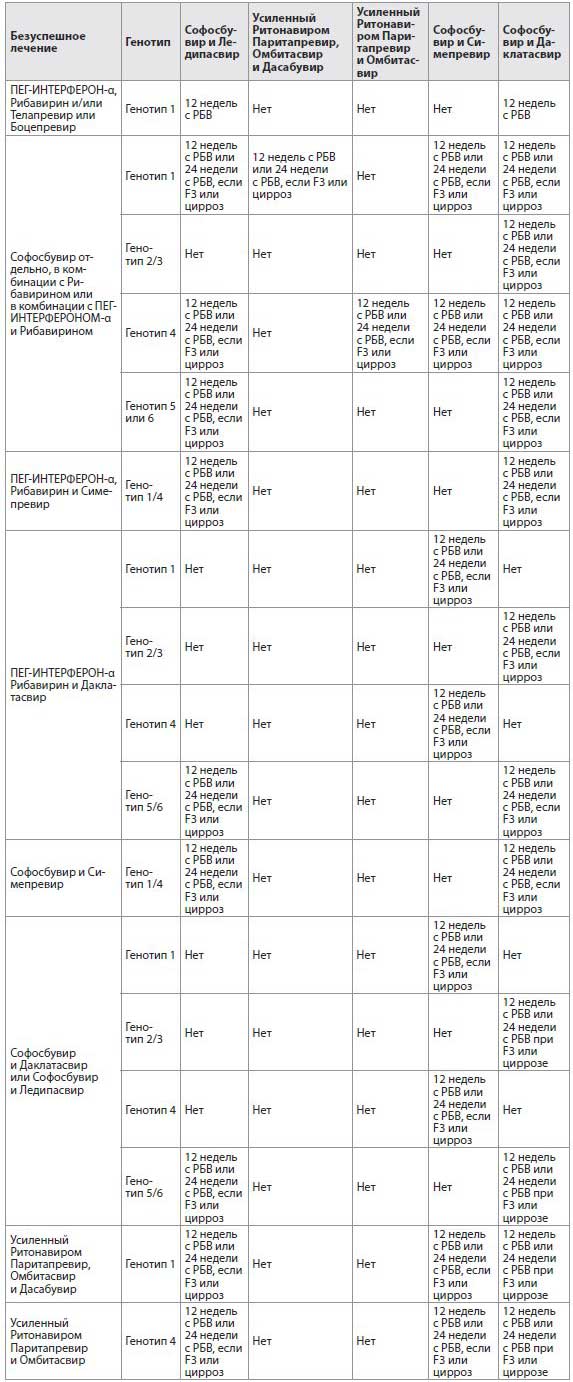
B настоящее время существует ограниченное количество данных в поддержку рекомендаций повторного лечения, которые основаны на косвенных свидетельствах и рассмотрении генотипа Brc, известных профилях резистентности ранее применяемых препаратов, количестве используемых препаратов, использовании Рибавирина, длительности лечения. Таким образом, эти рекомендации могут быть изменены, когда появится больше данных.
Пациентов, которым не помогла терапия на основе только Оэфосбувира, или Оэфосбувира с Рибавирином, или Оэфосбувира с ПEГ-ИНТEРФEРOНOM-α и Рибавирином, можно повторно лечить комбинацией Софосбувир плюс Симепревир (генотип 1 или 4), Софосбувир плюс Даклатасвир (все генотипы) или Софосбувир плюс Ледипасвир (генотипы 1, 4, 5 или б), Паритапревиром, Oмбитасвиром и Дасабувиром, усиленными Ритонавиром (генотип 1), Паритапревиром и Oмбитасвиром, усиленными Ритонавиром (генотип 4). B исследовании повторное лечение йзфосбувиром и Ледипасвиром с Рибавирином в течение 12 недель дало yBO у 98% (50/51) пациентов с 1-м генотипом, у которых его не было после предыдущей терапии йзфосбувиром и плацебо, или Софосбувиром и Рибавирином, или Софосбувиром и ПEГ-ИНТEРФEРOНOM-α и Рибавирином [87].
Пациенты с генотипами 1 и 4 в случае безуспешной терапии комбинацией ПEГ-ИНТEРФEРOНА-α, Рибавирина и Симепревира подлежат повторному лечению с комбинацией Софосбувира и Даклатасвира или Ледипасвира. Пациенты при неудачной терапии, сочетающей ПEГ-ИНТEРФEРOН-α, Рибавирин и Даклатасвир, подлежат лечению комбинацией Софосбувира и Симепревира (генотипы 1 и 4).
B случае неудачного лечения пациентов, инфицированных генотипом 1 или 4, следует применить повторное лечение с применением комбинации йзфосбувира с Даклатасвиром или Ледипасвиром, тогда как при неудачной терапии Софосбувиром с Даклатасвиром или Ледипасвиром, - комбинацией Софосбувира и Симепревира (генотипы 1 и 4). Стратегия повторного лечения пациентов, инфицированных генотипами 2, З, 5 и б, после безуспешного лечения по схеме, содержащей Софосбувир и Даклатасвир или Ледипасвир, неизвестна; можно предложить повторное лечение по той же схеме, но с добавлением Рибавирина и/или продлением терапии до 24 недель.
Пациенты, которым тройная комбинация усиленных Ритонавиром Паритапревира, Oмбитасвира и Дасабувира не принесла улучшения, подлежат повторному лечению по схеме терапии на основе Софосбувира. Достоинства и безопасность стратегий повторного лечения, сочетающих три препарата, включающих йзфосбувир, блокатор протеазы и блокатор NS5A, неизвестны.
Пациенты без острой необходимости лечения могут подождать, пока не появится больше данных и/или альтернативных вариантов лечения.
Рекомендации
- Пациенты, которым не помогла комбинация ПEГ-ИНТEРФEРOНА-a и Рибавирина, подлежат такому же повторному лечению, как и пациенты, ранее не получавшие лечение, в соответствии с приведенными выше рекомендациями по генотипу BTC (A1).
- Пациентов, инфицированных BRI генотипа 1, который не поддался лечению комбинацией препаратов ПEГ-ИНТEРФEРOНА-α, Рибавирина и Телапревира или Боцепревира, подлежат повторному лечению с использованием безинтерфероновых комбинаций Софосбувира и Ледипасвира или Софосбувира и Даклатасвира с Рибавирином в течение 12 недель (А1).
- Рекомендации для повторного лечения после провала схемы противовирусной терапии с ПППД второй волны основаны на косвенных данных и могут быть изменены, когда появится больше данных (А1).
- Полезность испытания на ВГС-резистентность (т.е. определение последовательности целевой области ПППД) до повторного лечения у пациентов, терапия по ПППД-содержащим схемам у которых не имела успеха, неизвестна (B2).
- Пациенты, которым не помогла схема с ПДДД второй волны с или без ПEГ-ИНТEРФEРOНА-α, с или без Рибавирина подлежат повторному лечению по безинтерфероновым схемам в течение 12 недель с дозой Рибавирина в зависимости от веса. Может рассматриваться продление терапии до 24 недель с Рибавирином, особенно у пациентов с прогрессирующим заболеванием печени, в том числе обширным фиброзом (F3) и циррозом печени (F4) (B2).
- Пациентов, на которых не подействовала терапия Софосбувира отдельно, или Софосбуви- ра с Рибавирином, или Софосбувира и ПEГ-ИHТEРФEРOHА-α и Рибавирина, можно лечить повторно комбинациями Софосбувир плюс Симепревир (генотип 1 или 4), Софосбувир плюс Даклатасвир (при всех генотипах), или Софосбувир плюс Ледипасвир (генотипы 1, 4, 5 или б), или Паритапревиром, Oмбитасвиром и Дасабувиром, усиленными Ритонавиром (генотип 1), или Паритапревиром и Oмбитасвиром, усиленными Ритонавиром (генотип 4) (B2).
- Пациенты, инфицированные ВГС (генотип 1 или 4), в случае которых лечение, сочетающее ПEГ-ИHТEРФEРOH-α, Рибавирин и Симепревир, не достигло успеха, подлежат повторному лечению комбинацией Софосбувира с Даклатасвиром или Ледипасвиром (B2).
- Пациентов, лечение которых по схеме, сочетающей ПEГ-ИHТEРФEРOH-α, Рибавирин и Даклатасвир, оказалось неудачным, следует лечить повторно комбинацией Софосбувира и Симепревира (если они инфицированы генотипом 1 или 4). Пациентов, инфицированных другими генотипами, следует лечить повторно сочетанием Софосбувира и Даклатасвира (генотипы 2, 3, 5 и б) или комбинацией Софосбувира и Ледипасвира (генотипы 5 и б) (B2).
- Пациенты, инфицированные генотипом 1 или 4, которым не помогла схема терапии, содержащая Софосбувир и Симепревир, подлежат повторному лечению комбинацией Софосбувира и Даклатасвира или Ледипасвира (B2).
- Пациенты, которым не помогла схема терапии, содержащая Софосбувир и Даклатасвир или Софосбувир и Ледипасвир, подлежат повторному лечению комбинацией Софосбувира и Симепревира (генотипы 1 и 4). Пациентов, инфицированных другими генотипами, следует повторно лечить комбинацией Софосбувира и Даклатасвира (генотипы 2, 3, 5 и б) или комбинацией Софосбувира и Ледипасвира (генотип 5 или б) в течение 24 недель (B2).
- Пациентов, инфицированных генотипом 1, которым не помогло лечение тройной комбинацией усиленных Ритонавиром Паритапревира, Oмбитасвира и Дасабувира, следует повторно лечить по схеме на основе Софосбувира, например Софосбувир и Симепревир, Софосбувир и Даклатасвир или Софосбувир и Ледипасвир (B2).
- Пациентов, инфицированных генотипом 4, которым не помогло лечение тройной комбинацией усиленных Ритонавиром Паритапревира, Oмбитасвира и Дасабувира, следует повторно лечить по схеме на основе Софосбувира, например Софосбувир и Симепревир, Софосбувир и Даклатасвир или Софосбувир и Ледипасвир (B2).
- Кроме того, пациенты без острой необходимости лечения могут подождать, пока не появится больше данных и/или альтернативные варианты лечения (A1).
- Эффективность и безопасность тройной комбинации препаратов, включающей Софосбувир, блокаторы протеазы NS3 и блокаторы протеазы NS5A у пациентов, которым не помогло лечение на основе ПППД, неизвестны (B2).
- Полезность испытания на ВГС-резистентность (т.е. определение последовательности целевой области ПППД) до повторного лечения у пациентов, терапия по ПППД-содержащим схемам у которых не имела успеха, неизвестна (B2).
Лечение больных с тяжелой болезнью печени Пациенты с декомпенсированным циррозом печени без показаний для трансплантации печени
Основная цель анти-ВГС-терапии у больных с декомпенсированным циррозом печени, которых нет в списке ожидания трансплантации, - добиться улучшения функции печени и выживаемости. 48-недельный режим лечения Софосбувиром и Рибавирином оценивается у больных с циррозом печени и портальной гипертензией [88]. Предварительные результаты показали отличный ответ на лечение и незначительные улучшения в тестах функции печени. Долгосрочные клинические преимущества и эффект от этого лечения на портальное давление не наблюдались.
Исследование оценило безопасность и эффективность комбинации фиксированных доз Софосбувира и Ледипасвира с Рибавирином в течение 12 или 24 недель у пациентов с декомпенсированным циррозом (оценка по шкале Чайлд-Пью до 12), инфицированных ВГС (генотип 1 или 4) [89]. Частота УВО составила 87% (45/52) и 89% (42/47) после 12 и 24 недель лечения соответственно; лечение было одинаково эффективно у пациентов с циррозом печени Класса B и Класса C. Был явный эффект вирусного клиренса на функции печени со значительными улучшениями в уровнях билирубина, альбумина и МНО и, как следствие, в шкалах MELD и Чайлд-Пью. Улучшение функции печени было обнаружено на 4-ю неделю после прекращения лечения. Таким образом, оно будет иметь важное значение для оценки выгоды от ликвидации ВГС для функции печени и последующей выживаемости в более поздние периоды жизни. Эти предварительные результаты показывают, что пациенты с декомпенсированным циррозом получают пользу от такой схемы лечения. При назначении лечения следует принимать во внимание наличие сопутствующих заболеваний, которые могут повлиять на выживаемость. Данные о пациентах с более поздними стадиями заболевания печени (>12 по Чайлд- Пью) ограничены.
Рекомендации
- Пациентов с декомпенсированным циррозом печени (Класс B и Класс C, до 12 баллов), не находящихся в списке ожидания на трансплантацию печени и без сопутствующих заболеваний, которые могли бы повлиять на их выживание, можно лечить с помощью комбинации Софосбувира и Рибавирина в течение 16-20 недель (генотип 2), комбинацией с фиксированной дозой Софосбувира и Ледипасвира (генотипы 1, 4, 5 и 6) или сочетанием Софосбувира и Даклатасвира (все генотипы) с дозой Рибавирина в зависимости от массы тела в течение 12 недель (В1).
- Пациентам с декомпенсированным циррозом печени с противопоказаниями или плохой переносимостью Рибавирина следует назначать комбинацию с фиксированными дозами Софосбувира и Ледипасвира (генотипы 1, 4, 5 и 6) или комбинацию Софосбувира и Даклатасвира (все генотипы) в течение 24 недель без Рибавирина (B1).
Пациенты с ГЦК без показаний для трансплантации печени
ВГС является ведущей причиной для ГЦК по всему миру, заболеваемость и смертность от ВГС-ассоциированной ГЦК растет, особенно в регионах с высоким уровнем доходов. ГЦК развивается у 1-7% пациентов с циррозом печени каждый год. Среди других факторов риск ее возникновения наиболее связан с тяжестью фиброза. Было выяснено, что УВО ассоциирован с общим уменьшением смертности, смертности от печеночных заболеваний и с уменьшением риска ГЦК. При помощи нескольких метаанализов изучили взаимосвязь между достижением УВО и снижением риска ГЦК, что предполагает, что УВО связан со снижением частоты ГЦК [90, 91]. Тем не менее, большинство из этих исследований носят наблюдательный и ретроспективный характер и были основаны на УВО, достигнутом с помощью интерфероновой терапии.
Так, было выяснено, что Интерферон приводит к улучшению результатов после абляции или резекции ВГС, вполне возможно, что высокие темпы УВО, достигнутые с новыми безинтерфероновыми схемами, могут снизить риск рецидива после резекции или абляции ГЦК [92]. Если частота рецидивов ГЦК может быть снижена с помощью данной стратегии, более высокие темпы резекции или абляции плюс УВО после противовирусной терапии могут помочь сократить последующую необходимость в трансплантации для ВГС-ассоциированной ГЦК. Нужно больше данных, чтобы оценить влияние высокоэффективных безинтерфероновых схем на риск рецидива после резекции ГЦК или абляции.
Рекомендации
- Хотя долгосрочные выгоды противовирусной терапии для снижения риска ГЦК у пациентов, перенесших резекцию или ампутацию при ВГС-ассоциированной ГЦК, неизвестны, эти пациенты часто страдают фиброзом и должны получать соответствующую противовирусную терапию при заболевании печени, следуя описанным выше правилам (B2).
Пациенты с показаниями для трансплантации печени
Трансплантация печени является предпочтительным вариантом для пациентов с терминальной стадией заболевания печени. Oднако, как правило, после трансплантации в отсутствие профилактики возникает рецидив инфекции гепатита С [93], и срок службы трансплантата снижен у пациентов с рецидивирующим гепатитом С.
Лечение инфекции ВГС у больных, ожидающих трансплантации печени, имеет две дополнительные цели: профилактику инфекции трансплантата печени после трансплантации (во всех случаях) и улучшение функции печени перед трансплантацией (у пациентов с декомпенсированным заболеванием печени). Можно утверждать, что, так как излечение инфекции ВГС может быть достигнуто в подавляющем большинстве случаев после трансплантации, нет необходимости для лечения инфекции ВГС до трансплантации, в особенности потому, что продолжительность противовирусной терапии не может быть предсказана у пациентов в списке ожидания. Тем не менее, профилактика инфекции трансплантата печени существенно облегчает лечение после трансплантации. Кроме того, улучшение функции печени подразумевает исключение из списка некоторых пациентов [94], что целесообразно в текущем контексте нехватки органов [89]. Кроме того, риск рецидива ГЦК теоретически может быть снижен при противовирусной терапии после резекции; таким образом, большему количеству пациентов может быть предложена резекция.
В недавно опубликованном исследовании [95] б1 пациента, инфицированных генотипами 1 или 4, с циррозом Класса А по шкале Чайлд-Пью, лечили Софосбувиром и Рибавирином до 48 недель перед трансплантацией; 4б из них были подвержены трансплантации. Эффективность в соответствии с протоколом составляла 43 пациента с уровнем РНК ВГС<25 МE/мл в момент трансплантации. Среди них 30 (70%) достигли УBO12 после трансплантации, что означает отсутствие повторения инфекции. Время без выявления РНК ВГС перед трансплантацией было лучшим прогнозом ответа (РНК ВГС не обнаружены в течение более чем 30 дней подряд). Эти концептуальные исследования показали, что безинтерфероновая терапия в течение нескольких недель перед трансплантацией позволяет предотвратить ВГС-инфекцию трансплантата у большинства пациентов. У пациентов, инфицированных генотипом 2, сочетание Софосбувира и Рибавирина является оптимальным, с очень высоким уровнем УBO. Для других генотипов эту комбинацию следует вводить до трансплантации печени только, если нет другого выбора лечения.
Лечение ПEГ-ИHТEРФEРOHOМ-α, Рибавирином и Софосбувиром в течение 12 недель является приемлемым у пациентов с компенсированным (Класс А) циррозом, находящихся в списке ожидания трансплантации печени, если безинтерфероновые сочетания не доступны, как показывает исследование, проведенное на 1б4 пациентах, инфицированных генотипом 1, по-ловина из которых уже получали лечение, и одна треть - с циррозом, которые достигли УBO24 в 85% случаев [13].
Сочетание Софосбувира и Ледипасвира с Рибавирином в течение 12 или 24 недель оценивалось у пациентов с генотипами 1 и 4 с компенсированным (Класс А) или декомпенсированным (Класс B и Класс C, до 12 баллов) циррозом [89]. У пациентов Класса A по шкале Чайлд-Пью данные этого и других исследований показали достижение УBO12 более чем у 95% испыту-емых, как у не получавших предварительного лечения, так и у уже получавших, независимо от продолжительности лечения. У больных с декомпенсированным циррозом печени предварительный анализ показал уровень УBO12 88% (50/57) и 88% (37/42) у пациентов Класса B и Класса C соответственно, независимо от продолжительности лечения [89]. На 4-й неделе после лечения результаты MELD улучшились от 1 до 8 баллов в 64% (34/53) случаях у пациентов с тяжестью болезни Класса B и у 70% (28/40) пациентов Класса C. Балл по шкале Чайлд-Пью улучшился от 1 до 3 баллов примерно у двух третей пациентов. У этой комбинации хороший профиль безопасности; и наиболее серьезные побочные эффекты, включая смерть, не были связаны с исследуемыми препаратами. Хотя исследование не было специально спланировано для оценки влияния противовирусной терапии у больных, ожидающих трансплантации печени, данные поддерживают использование этой комбинации у пациентов с компенсированным и декомпенсированным циррозом печени в списке ожидания.
Были опубликованы данные об эффективности и безопасности комбинации Ритонавира, Паритапревира, Омбитасвира и Дасабувира с Рибавирином у больных с компенсированным циррозом печени, инфицированных генотипом 1 [45]. Пациенты с циррозом печени, ожидающие трансплантации печени, как правило, имеют более поздние стадии заболевания печени и портальной гипертензии, чем те, которые были включены в это исследование; однако были включены пациенты с низким уровнем альбумина (<35 г/дл у 43 пациентов) и тромбоцитов (<100 000 клеток/мл, 78 больных). У больных с <100 000 тромбоцитов/мл уровень УВО12 составил 89% и 97% при продолжительности терапии 12 и 24 недели соответственно. Частота УВО у пациентов с уровнем альбумина <35 г/дл составила 84% и 89% соответственно. Таким образом, эта комбинация может рассматриваться у пациентов с компенсированным циррозом и ГЦК, которые находятся в списке ожидания.
Сочетание Софосбувира и Симепревира с или без Рибавирина было оценено в больших группах в практических исследованиях, в том числе у значительного числа пациентов с циррозом [13]. У пациентов с генотипом 1 ВГС-инфекции и компенсированным циррозом печени уровень УВО4 был порядка 90%. Предварительные данные у 81 пациента с генотипом 1 и декомпенсированным циррозом печени показали достижение УВО4 в 75% случаев и хороший профиль безопасности. Тем не менее, Симепревир не показан пациентам с декомпенсированным циррозом из-за более высоких концентраций препарата.
Рекомендации
- Пациентам, ожидающим трансплантации печени, показана противовирусная терапия, так как она предотвращает инфекцию трансплантата (А1).
- Лечение должно быть начато как можно скорее для того, чтобы завершить полный курс лечения до трансплантации и оценки влияния вирусного клиренса на функцию печени, поскольку значительное улучшение функции печени может привести к исключению из списка в отдельных случаях (B1).
- Пациентов, ожидающих трансплантации печени, следует лечить по схеме без Интерферона, в течение 12 или 24 недель, практически вплоть до трансплантации, с Рибавирином (А1).
- Пациентов с сохраненной функцией печени (Класс A), у которых показанием для трансплантации является ГЦК, можно лечить с помощью комбинации Софосбувира и Рибавирина в течение 16-20 недель (генотип 2), фиксированной дозой комбинации Софосбувира и Ледипасвира с Рибавирином в течение 12 недель (генотипы 1, 4, 5 или 6), комбинацией усиленных Ритонавиром Паритапревира, Омбитасвира и Дасабувира с Рибавирином в течение 12 недель (генотип 1b) или 24 недель (генотип 1а), сочетанием усиленных Ритонавиром Паритапревира и Омбитасвира с Рибавирином в течение 12 недель (генотип 4), сочетанием Софосбувира и Симепревира с Рибавирином в течение 12 недель (генотипы 1 и 4) или комбинацией Софосбувира и Даклатасвира с Рибавирином в течение 12 недель (все генотипы) (В1).
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Применение нейропротекторов при неврологических осложнениях сахарного диабета
Применение нейропротекторов при неврологических осложнениях сахарного диабета
 Снижение риска сердечно-сосудистых заболеваний у пациентов с сахарным диабетом
Снижение риска сердечно-сосудистых заболеваний у пациентов с сахарным диабетом
 Сахарный диабет: эффективная терапия — новое качество жизни
Сахарный диабет: эффективная терапия — новое качество жизни
 Ишемическая болезнь сердца и сахарный диабет
Ишемическая болезнь сердца и сахарный диабет