- Головна
- /
- Статті
- /
- Дерматокосметологія
- /
- Атопический дерматит
Атопический дерматит
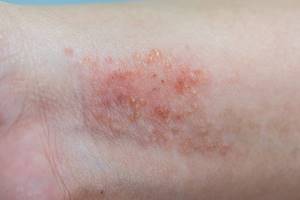
За последние десятилетия аллергические заболевания приобрели достаточно широкое распространение. По современным данным, около 30-40% населения земного шара страдают аллергией. Ежегодно в мире на приобретение противоаллергических препаратов затрачивается около 12 млрд. долларов, несмотря на все усилия врачей заболеваемость атопическим дерматитом (АД) за последние 20 лет выросла вдвое.
Термин «атопия» был предложен в 1931 году американским исследователем Coca. Под атопией понимают наследственную предрасположенность к аллергическим реакциям в ответ на сенсибилизацию организма определенными антигенами [1].
АД относят к хроническим рецидивирующим воспалительным заболеваниям кожи. Основными проявлениями заболевания являются интенсивный зуд, папулезные высыпания, лихенификация. Для этой патологии характерны возрастные особенности внешних проявлений. Атопический дерматит составляет 20-30% всех аллергических заболеваний, в 70% случаев он предваряет развитие таких болезней как: бронхиальная астма, поллиноз, крапивница, отек Квинке, аллергический ринит [2].
Долгое время в отечественной литературе АД относили к группе аллергических зудящих дерматозов, часто использовали термин «нейродермит», который отражает нейрогенную этиологию и патогенез этого заболевания. Немецкие дерматологи объединяют экзему и нейродермит в группу так называемой эндогенной экземы.
За рубежом клиницисты преимущественно пользуются термином «атопический дерматит».
Диагностические критерии АД
В 1980 году Hanifin и Rajka предложили следующие диагностические критерии АД, разделив их на две группы – обязательные и дополнительные [3].
Обязательные критерии:
- определенная морфология и локализация: у взрослых – лихенизация и расчесы на сгибательных поверхностях; у детей – поражения на лице и разгибательных поверхностях;
- хроническое рецидивирующее течение;
- зуд;
- атопия в анамнезе или отягощенная по атопии наследственность.
Дополнительные критерии:
- ксероз;
- ихтиоз/волосяной лишай (keratosis pilaris)/усиление рисунка на ладонях;
- конъюнктивиты;
- складки Денье-Моргана;
- кератоконус;
- возникновение зуда при повышенном потоотделении;
- первый тип кожной реактивности (реакция гиперчувствительности замедленного типа);
- передняя подкапсульная катаракта;
- бледность или покраснение лица;
- перифолликулярная локализация высыпаний;
- складки на передней поверхности шеи;
- повышенный уровень сывороточного IgE;
- начало заболевания в раннем возрасте;
- частые инфекционные поражения кожи;
- дерматит на коже рук и ног;
- экзема сосков;
- белый дермографизм.
Для постановки диагноза АД необходимо наличие трех и более обязательных и трех и более дополнительных признаков.
Для стандартизации постановки диагноза АД в европейских государствах разработана система SCORAD (scoring of atopic dermatitis – шкала атопического дерматита), она объединяет такие показатели, как площадь поражения тела, интенсивность клинических проявлений, а также субъективные симптомы – зуд и бессонницу. Составлен атлас референс-фотографий, показывающих интенсивность (по шкале от 0 до 3 баллов) эритемы, отечных и папулезных элементов, мокнутия, корок, экскориаций, лихенизации и сухости кожи.
Эпидемиология АД
Заболеваемость АД достигает 15 и более на 1000 населения и, по данным ВОЗ, растет во всем мире, что обусловливается неблагоприятной экологической обстановкой, загрязнением окружающей среды. Кроме того, возможным объяснением распространения АД являются усиление воздействия домашней пыли и компонентов пищи на организм человека, снижение продолжительности грудного вскармливания и повышение внимания к этому заболеванию со стороны родителей и докторов [5].
Этиология и патогенез АД
Достаточно большое количество исследований постулируют, что в основе атопии лежит наследственно обусловленная дисфункция иммунной системы: гипофункция вилочковой железы, врожденный дефицит механизмов клеточной медиации, в частности Т-лимфоцитов, повышение функциональной активности Т2-хелперов, предрасположенность к повышенному синтезу иммуноглобулинов, повышение в крови и тканях реагинов IgЕ. Все это способствует ранней сенсибилизации к различным антигенам, особенно к пищевым и пневмоаллергенам. Иммунологические изменения сопровождаются нейроэндокринными расстройствами, сдвигами в калликреин-кининовой системе, нарушением продукции катехоламинов и изменением функций защитных антител.
У больных атопическим дерматитом установлена высокая концентрация антител типа реагинов, снижение числа Т1-хелперов и повышение количества Т2-хелперов. Наиболее выраженная патология наблюдается у больных – носителей изоантигенов А, М, N и RhD+. Следовательно, иммунодефицит у больных атопическим дерматитом формируется на уровне внутриклеточной регуляции вследствие слабого функционирования генов иммунного ответа, маркерами которых являются антигены А, М, N, RhD+. У больных закономерно повышается концентрация IgG и снижается содержание IgA и IgM.
Рассматривая атопический дерматит как иммунологически гетерогенное заболевание, с помощью кластерного и пошагового дискриминантного математического анализа разработана классификация, включающая четыре иммунологических варианта развития атопического дерматита. Для первого варианта характерны нормальные уровни IgЕ при повышении числа CD8+-лимфоцитов; для второго– вариабельность количества IgЕ при его высоком среднем уровне и нормальном количестве CD4+ и CD8+-лимфоцитов; для третьего – вариабельность концентрации IgЕ и повышение уровня CD4+-лимфоцитов; четвертый вариант характеризуется значительными вариациями уровня IgЕ и снижением числа CD4+- и CD8+-лимфоцитов. Предложенная классификация может служить основой для оптимизации селективной иммунокорригирующей терапии больных атопическим дерматитом.
Важным аспектом патогенеза является также повышение концентрации низкомолекулярных продуктов активации комплемента, что позволяет обосновать роль системы комплемента при этом заболевании. Активация С4а-дезАрг-анафилатоксина у больных с высоким и нормальным уровнем IgЕ в сыворотке крови подтверждает роль комплемента в поддержании воспалительных изменений [6].
Роль генетических механизмов
Одной из ведущих ролей в этиологии и патогенезе АД признана генетическая предрасположенность. Считается, что наследуется патологический характер функционирования различных систем организма – нервной, иммунной, пищеварительной и т.д. Предполагается аутосомно-доминантный тип наследования.
Показано, что около 60% детей, родители которых болеют АД, также страдают этим заболеванием. АД развивается у 81% детей, если больны оба родителя, у 59% – если один из родителей болен АД, а другой имеет признаки атопии дыхательных путей и у 56% – когда болен только один родитель.
У больных АД 42% родственников первого колена также болеют этим заболеванием, а 28% – страдают атопией дыхательных путей. У лиц с респираторной атопией без каких-либо кожных проявлений 43% родственников также имеют дыхательную атопию, а 12% – больны АД. Различные проявления аллергии установлены в фамильном анамнезе 35,5% больных АД, в личном и фамильном анамнезе – у 47,6%.
Обследование близнецов показало, что монозиготные близнецы более конкордантны по АД (0,75), чем дизиготные (0,25). Более того, риск развития АД у одного из дизиготных близнецов, если второй болен АД, эквивалентен риску у не близнецов [4].
Нарушения нервной системы
В отечественной литературе подчеркивается ведущая роль разнообразных нервных нарушений в этиологии и патогенезе АД. Важное значение имеют функциональные нарушения корковой нейродинамики. Они могут иметь как первичный (психогенные факторы, длительные отрицательные эмоции и др.), так и вторичный (неблагоприятное воздействие разнообразных факторов внешней среды на периферический отдел кожного анализатора) характер. Существенную роль играет состояние диэнцефальной области, что, в свою очередь, обусловливает функциональные нарушения в различных отделах вегетативной нервной системы и эндокринных органах.
Различные провоцирующие факторы
Распространено мнение, что различные факторы окружающей среды определяют фенотипическое выражение генетически обусловленной предрасположенности к АД. К триггерным факторам относят контактные, ингаляционные аллергены, компоненты пищи, микроорганизмы, половые гормоны, стрессорные факторы, потоотделение и климат.
Ослабление барьерной функции кожи и аллергическая направленность кожных реакций приводит к усилению раздражающего действия контактных раздражителей и аллергенов, среди которых наиболее часто упоминаются шерсть, детергенты, дезинфектанты, никель, кобальт, ароматизаторы, ланолин, латекс, антибиотики и даже местные кортикостероиды. Среди ингаляционных триггерных факторов чаще всего отмечаются домашняя пыль, пыльца цветущих растений, плесень, перхоть человека и домашних животных. В домашней пыли могут содержаться все упомянутые ингаляционные аллергены – и пыльца, и плесень, и в большом количестве перхоть и шерсть домашних животных, и частицы тел насекомых.
Определенную роль в качестве триггерных факторов играют микробная флора (Staphylococcus aureus, Pityrosporum ovale, Candida), инфекция верхних дыхательных путей. Это подтверждается положительными иммунными тестами (как кожными, так и серологическими), а также обнаружением специфических IgE к указанной флоре.
Роль половых гормонов подтверждается обострениями или ремиссиями, которые возникают в зависимости от фазы месячного цикла, в период беременности и менопаузы.
Пищевая аллергия/непереносимость
Получены данные, подтверждающие связь пищевой аллергии и АД. Течение АД облегчается после исключения из пищевого рациона аллергенных продуктов (чаще всего – яйца, молоко, морепродукты, зерновые, арахис, рыба и бобовые) у больных с тяжелым АД. Однако во многих исследованиях показано, что пищевая аллергия/непереносимость – важный фактор тяжело протекающих АД, имеет тенденцию к преувеличению ее значения и для общей группы больных.
Поскольку больные и родители заболевших детей могут переоценивать влияние пищевой аллергии/непереносимости, очень важно объективно определить ее наличие, чтобы предотвратить небезопасную практику исключения пищевых продуктов.
Несмотря на то что роль пищевого рациона и аллергии/непереносимости пищи в развитии АД неоднозначна, можно отметить следующее:
- грудное вскармливание, особенно в сочетании с гипоаллергенной диетой у матери, позволяет значительно снизить риск возникновения АД у детей группы риска;
- аллергия/непереносимость пищи может быть триггерным агентом АД у небольших подгрупп больных и чаще у детей, чем у взрослых;
- аллергию/непереносимость пищи необходимо учитывать при ведении больных АД в случаях, когда в анамнезе имеются эпизоды обострения заболевания в результате приема какого-либо пищевого продукта и/или когда традиционные лечебные мероприятия неэффективны;
- необходимо следовать элиминационной диете при положительных кожных тестах на яйца, молоко, арахис, орехи, рыбу, сою, морепродукты, пшеницу или при наличии в анамнезе какого-либо влияния продуктов на организм;
- чувствительность к пище, за исключением арахиса, у детей обычно уменьшается со временем, т. е. спустя год можно пытаться вернуть исключенные продукты в пищевой рацион.
Клиническая картина АД
Клинические проявления АД, как правило, зависят от возраста больного, и по клинической картине заболевание можно разделить на три периода. В младенческом возрасте (до 1,5-2 лет) обычно наблюдается экссудативная форма заболевания: заболевание носит острый характер, преобладают явления гиперемии, отечности, мокнутия и коркообразования. От 2 лет до полового созревания болезнь представляет собой хроническое воспаление с элементами лихенизации, на первый план в этой стадии выступают эритемы и шелушения, признаки вегето-сосудистой дистонии. Кожа в очагах поражения гиперпигментируется, из-за сильного зуда появляются множественные экскориации. У детей старшего возраста и взрослых часто появляются инфильтрации с лихенизацией на фоне эритемы застойного характера, на коже – зудящие папулы, имеющие цвет нормальной кожи, которые сливаются в очаги сплошной папулезной инфильтрации. Обычно к 50 годам заболевание самостоятельно регрессирует.
Лечение
Лечение АД сегодня преимущественно патогенетическое, оно направлено на устранение патологических нарушений в органах и системах, а также на предупреждение обострений болезни.
В консенсусе ICAAD, принятом в Новом Орлеане (США, 2002) рекомендуется терапия, направленная на контроль атопического дерматита. Согласно этой новой концепции предполагается уменьшать тяжесть субъективных и объективных симптомов заболевания и предотвращать рецидивы дерматоза. Устойчивый терапевтический эффект обеспечивается за счет устранения прогрессирования АД. Решающее значение имеет прерывание эволюции синдрома, что коренным образом меняет течение АД. Терапевтическая тактика должна носить индивидуальный характер, включать выявление и исключение провоцирующих факторов, а также уход за кожей с помощью смягчающих и увлажняющих средств, облегчение зуда и воспаления путем использования топических кортикостероидов.
Программа ведения больных АД включает несколько направлений.
Меры, направленные на предупреждение контакта с причинными факторами.
Данный подход – мощный фактор воздействия на патогенез любых аллергических заболеваний. Часто применяют такие меры, как назначение элиминационных диет при пищевой аллергии, проведение акарицидных и фунгицидных мероприятий. Нередко прибегают к удалению домашних животных из жилых помещений при возникновении аллергических симптомов, связанных с сенсибилизацией организма к их перхоти. Большое значение имеет режим больного, который предусматривает полноценный сон и отдых, исключение переутомлений, стрессовых ситуаций.
Коррекция фоновых нарушений. С целью нормализации функции центральной нервной системы, психоэмоционального состояния пациента, уменьшения невротических реакций проводят нейрофармакологическую терапию, используя для этой цели седативные препараты, нейролептики, транквилизаторы и антидепрессанты.
При дисфункции желудочно-кишечного тракта показаны ферментные препараты, такие как мезим, фестал. При необходимости проводится лечение эндокринной патологии, дискинезии желчевыводящих путей и патологии мочевыводящих путей для дезинтоксикации и гипосенсибилизации применяют внутривенно 30% раствор тиосульфата натрия, глюконат либо хлорид кальция.
Важное значение в терапии АД имеет санация очагов хронической инфекции: кариеса зубов, тонзиллита, холецистита, отита и т. д.
Значительное распространение в лечении АД получили антигистаминные препараты и стабилизаторы тучных клеток, обладающие противозудным и противоаллергическим действием. Предпочтительно при этом назначение современных антигистаминных препаратов – лоратадина, дезлоратадина, астемизола, эбастина, цетиризина.
Системные кортикостероиды применяют с особой осторожностью, строго по показаниям, ограничивающимся резкими обострениями с выраженной экссудацией. Системные кортикостероиды используют в небольших дозах и непродолжительное время. Согласно данным литературы, детям эти препараты назначать не рекомендуется.
В связи с важной ролью иммунологических нарушений при АД в последнее время нередко используются различные препараты, влияющие на иммунную систему. Описаны наблюдения по применению препаратов тимуса, миелопида, a- и b-интерферонов и циклоспорина.
Наружное лечение. Наружная терапия АД в зависимости от стадии и клинической картины заболевания проводится с применением кератопластических и противовоспалительных паст, мазей, кремов. При выраженном мокнутии необходимы примочки с растворами резорцина, танина, борной кислоты.
При выраженном зуде и воспалении на ограниченных участках поражения используют мази, содержащие кортикостероидные препараты. Оптимально применение мазей последних поколений, содержащих метилпреднизолон или мометазон, которые обладают высокой эффективностью и минимумом побочных проявлений. При импетигинизации назначают фукорцин, пасты и мази, содержащие антибиотики – линкомицин, неомицин, тетрациклин, эритромицин.
Определенные перспективы представляет использование наружной мазевой терапии на основе пимекролимуса, играющего роль селективного ингибитора воспалительных цитокинов. Он связывается с цитозольным рецептором, макрофиллином-12, и таким образом ингибирует кальцинеурин-фосфатазу. Пимекролимус действует на Т-лимфоциты и тучные клетки, но при этом исключается влияние на клетки Лангерганса, что позволяет сохранять адекватный иммунный ответ. Препарат не воздействует на фибробласты и эндотелиальные клетки, исключая возникновение атрофии кожи. Пимекролимус нивелирует необходимость применения топических стероидов либо уменьшает продолжительность их применения.
Проведение профилактических мероприятий с целью сократить риск повышения уровня сенсибилизации и расширения ее спектра. Важное значение в комплексной терапии АД имеет проведение в ремиссионном периоде физических методов воздействия. Рекомендуются общее и селективное ультрафиолетовое облучение эритемными дозами, PUVA-терапия и селективная фототерапия, ультрафонофорез, индуктотермия области надпочечников, диатермия области шейных симпатических узлов, магнитотерапия, рефлексотерапия лазеротерапия и электропунктура. Показано санаторно-курортное лечение.
Таким образом, атопический дерматит – это заболевание, актуальность которого возрастает с каждым годом. Несмотря на то что на сегодня накоплены значительные научные сведения об этиологии и патогенезе заболевания, разработано много методик лечения, все еще нет убедительных данных о возможности полного и окончательного излечения от АД. Очевидно, дальнейшее изучение влияния на организм и взаимодействия с ним провоцирующих факторов и предикторов заболевания позволит найти более эффективные способы лечения и профилактики АД, что, в свою очередь, улучшит прогноз заболевания.
Литература
- Медицинская микробиология, вирусология, иммунология/ Под.ред. Л.Б. Борисова и А.М. Смирновой. М., Медицина, 1994, 226 с.
- Адо А.Д. Общая аллергология. М., Медицина, 1978.
- Hanifin J.M., Rajka G. Acta Derm Venerol Suppl (Stockh) 1980; 92:44-7.
- Гомберг M.A., Соловьев A.M., Аковбян В.А.. Атопический дерматит // Российский медицинский журнал, т. 6, № 20, 1998.
- Скрипкин Ю.К., Федоров С.М., Адо В.А. и соавт. //Вестник дерматологии и венерологии, 1995, № 2, с.17-19.
- Сергеев Ю. В. Атопический дерматит. Современные подходы к диагностике, терапии и профилактике// Медицина для всех, 2001, № 2.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Лекарства от бронхиальной астмы и аллергии
Лекарства от бронхиальной астмы и аллергии
 Бронхиальная астма
Бронхиальная астма
 Медикаментозная терапия при бронхиальной астме
Медикаментозная терапия при бронхиальной астме
 Базисная терапия бронхиальной астмы
Базисная терапия бронхиальной астмы