- Головна
- /
- Статті
- /
- Ендокринологія. Цукровий діабет
- /
- Системна проблема лікування та діагностики хворих із синдромом діабетичної стопи в Україні та шляхи її розв’язання
Системна проблема лікування та діагностики хворих із синдромом діабетичної стопи в Україні та шляхи її розв’язання
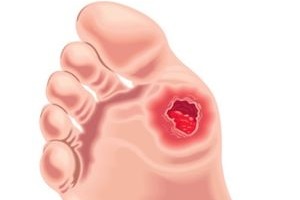
Висока частота розвитку інвалідизуючих ускладнень цукрового діабету (ЦД) та серцево-судинних захворювань визначає високий рівень смертності серед цієї категорії хворих. Одним із найбільш соціально значущих ускладнень ЦД є синдром діабетичної стопи (СДС), який розвивається у кожного шостого хворого на цю патологію. Саме ці хворі становлять основну групу пацієнтів, яким було виконано ампутації нижніх кінцівок.
Кожні 30 секунд у світі проводиться одна ампутація хворому на ЦД, щороку – понад 1 млн ампутацій. На думку більшості експертів, існує можливість уникнути близько 85% зазначеної кількості ампутацій. Так, запровадження налагодженої централізованої служби діабетичної стопи (ДС) у Бразилії, Великій Британії, Швеції та інших країнах сприяло зменшенню частоти ампутацій та важких запущених випадків гнійно-некротичних процесів. Після введення системного підходу до лікування ЦД у деяких штатах Індії там спостерігаються позитивні тенденції порівняно з сусідніми штатами із подібними соціально-економічними показниками.
 На сьогодні в Україні можна констатувати відсутність служби ДС як такої. Десятиріччя світової практики наочно показали, що єдиним дієвим методом запобігання інвалідності через розвиток гнійно-некротичних процесів нижніх кінцівок у хворих на ЦД є профілактична робота. Доведено, що розвиток таких первинних ланок профілактики, як кабінетів подолога, або «foot clinic», у країнах із різним рівнем соціально-економічного розвитку (Швеція, Велика Британія, Бразилія, Індія тощо) сприяє суттєвому зменшенню ампутацій нижніх кінцівок унаслідок ЦД.
На сьогодні в Україні можна констатувати відсутність служби ДС як такої. Десятиріччя світової практики наочно показали, що єдиним дієвим методом запобігання інвалідності через розвиток гнійно-некротичних процесів нижніх кінцівок у хворих на ЦД є профілактична робота. Доведено, що розвиток таких первинних ланок профілактики, як кабінетів подолога, або «foot clinic», у країнах із різним рівнем соціально-економічного розвитку (Швеція, Велика Британія, Бразилія, Індія тощо) сприяє суттєвому зменшенню ампутацій нижніх кінцівок унаслідок ЦД.
Не секрет, що робочий день ендокринолога поліклініки розписано по хвилинах, під його дверима завжди величезні черги хворих, і йому просто фізично не вистачає часу на огляд стопи хворого, тим більше, що це люди не молоді, й лише на роздягання-вдягання підуть усі відпущені для хворого хвилини. Зважаючи на це, доведено, що найефективнішим заходом профілактики та лікування початкових стадій СДС є створення спеціалізованих кабінетів для огляду хворих на ЦД. Згідно з офіційною статистикою в Україні активно працює понад 100 кабінетів ДС, на практиці ж лише 11-13 з них функціонують регулярно та якісно – саме в режимі кабінетів (неможливо вважати кабінетом гнійну перев’язочну хірургічного відділу).
Посилює проблему й відсутність в Україні достовірної статистики відносно розповсюдження ЦД та його ускладнень (судинні, нейрональні, пов’язані з ними ампутації – великі або малі). Загальновідомо, що наразі ми не маємо достовірної інформації навіть щодо загальної кількості хворих на ЦД, а також хворих, які отримують інсулін. На практиці програма обліку таких хворих практично не працює і не дає змоги відстежувати загальну динаміку їх стану.
На сьогодні в Україні офіційно зареєстровано близько 400 тис. хворих із різноманітними ускладненнями ЦД. За офіційними даними, щороку виконується близько 13 тис. ампутацій кінцівок, з них близько 63% – через судинну патологію, а 22-24% пов’язані з ЦД. Проте через відсутність чітких критеріїв аналізу незрозуміло, що ж таке ампутації, пов’язані з ЦД. Можливо, це ампутації, зумовлені нейропатією (адже судинні причини ампутації зазначаються окремо), чи це кількість ампутацій серед хворих на ЦД, а може, маються на увазі окремо судинні та інші (невропатичні) причини ампутацій? На жаль, дати відповідь на ці запитання неможливо. Крім того, навіть за найскромнішими підрахунками у 18-25% випадків гнійних захворювань нижніх кінцівок post factum уперше виявляють ЦД. Така ситуація зумовлена відсутністю в МКХ-10 розділу, присвяченого СДС. Згідно з найновішою класифікацією СДС можна визначити лише у випадках ангіопатії, а в разі його нейропатичної форми співвіднести захворювання з якимось шифром просто неможливо. Крім того, у звітах не зазначається рівень виконаних ампутацій, хоча саме цей показник визначає ступінь інвалідизації та прогноз життя для хворого.
На сьогодні в Україні немає розподілу на профілактичний та лікувальний рівні допомоги, відсутня первинна ланка у вигляді кабінетів ДС, де б хворі на ЦД отримували огляд стопи та амбулаторне лікування. Не секрет, що лікарі-ендокринологи на місцях часто навіть не мають ані часу, ані змоги регулярно оглядати нижні кінцівки хворих, тому виразково-некротичні дефекти здебільшого визначаються вже в запущеному стані, у той час як їх попередження й лікування на початкових стадіях було б економічно доцільнішим.
Наразі Україна не має єдиних, затверджених МОЗ методичних рекомендацій, обов’язкових для виконання, та єдиного комплексного наказу відносно ендокринологічної служби. Протоколи, що сьогодні розробляються, грунтуються на МКХ-10, тому СДС не ввійшов до розробки. Проте перший крок уже зроблено: досвідчені фахівці Українського науково-практичного центру ендокринної хірургії МОЗ України, базуючись на засадах доказової медицини, випустили методичні рекомендації стосовно профілактики та діагностики синдрому діабетичної стопи, де був врахований і власний досвід, і рекомендації закордонних клінік. Такі рекомендації в першу чергу будуть корисні для фахівців саме першої ланки лікування СДС – лікарів кабінетів діабетичної стопи.
На сьогодні в Україні існуючі кабінети ДС та відділення мають різну підпорядкованість через відсутність чіткого плану роботи, схем обстеження й лікування та іноді використання сумнівних методик і тактик лікування.
Крім того, зазначимо про анархічність і невпорядкованість наукових та дослідницьких робіт: багато праць повторюють уже відомі зарубіжні роботи, зокрема й великі мультицентрові дослідження, за результатами яких уже прийнято міжнародні протоколи. Трапляються методичні рекомендації без виваженого підходу й урахування багатофакторності проблеми, результати подаються без чіткої статистичної обробки з визначенням достовірності, ефективності тощо. Вважаємо, що клінічні роботи слід відокремити від фундаментальних та експериментальних і передати до НДІ АМН України медичного та біологічного профілів.
Шляхи розв’язання проблеми
Запровадження єдиних критеріїв відносно визначення, класифікації, профілактики та лікування СДС (спираючись на міжнародні офіційні документи). В результаті має бути опубліковано офіційний документ, затверджений МОЗ України, відносно основних принципів профілактики та лікування хворих із СДС. Для координації виконання розділу з профілактики та лікування СДС Національної програми «Цукровий діабет» пропонуємо на базі відділень обласних лікарень областей, АР Крим та м. Києва створити центри з лікування СДС, що відповідатимуть другому рівню надання допомоги (його буде описано нижче) й взаємодіятимуть із головною ендокринологічною установою регіону. Зазначені провідні установи повинні мати змогу створити мультидисциплінарні групи фахівців для лікування СДС у складі лікарів-ендокринологів, хірургів, ендоваскулярних та судинних хірургів, лікаря-ортопеда. Установи мають бути обладнані сучасним лабораторним та діагностично-лікувальним устаткуванням. Слід призначити відповідальних осіб по регіонах, бажано фахівців хірургічного профілю, оскільки в разі розвитку СДС на перше місце виступає саме хірургічний аспект проблеми. Отже, наказом МОЗ необхідно повністю регламентувати організацію служби ДС. Крім практичної роботи, лікар буде зобов’язаний вести статистику щодо ДС по регіону: дані про кількість хворих на ЦД та з його ускладненнями (зокрема кількість хворих із ДС та пов’язаними з нею оперативними втручаннями – великими чи малими ампутаціями). При цьому діагноз СДС слід зазначати першим, наприклад: синдром діабетичної стопи, суха гангрена 2-го пальця правої стопи. Цукровий діабет 2 типу в стадії неповної компенсації. Діабетична периферична полінейропатія.
Запровадження єдиної системи надання медичної та профілактичної допомоги на трьох рівнях.
Первинна ланка: кабінети профілактики ДС (можуть працювати автономно, штат 1 лікар (ендокринолог чи хірург) та 2 медсестри, які пройшли спеціальне навчання).
Процедури:
- плановий огляд стопи, взуття;
- профілактична обробка стопи, видалення гіперкератозів, корекція росту нігтів, лікування грибкових уражень, тріщин, поверхневих виразок тощо;
- визначення наявності діабетичної нейропатії за допомогою стандартних методик;
- визначення наявності периферичної ангіопатії;
- навчання пацієнтів та членів їхніх родин заходам профілактики розвитку СДС.
 Групи ризику з розвитку СДС визначаються шляхом дослідження стопи та взуття пацієнта для виявлення зон тертя, підвищеного тиску, можливих виразок та деформацій, визначення можливої діабетичної полінейропатії та ангіопатії нижніх кінцівок. Огляд проводиться відповідно до Практичних рекомендацій.
Групи ризику з розвитку СДС визначаються шляхом дослідження стопи та взуття пацієнта для виявлення зон тертя, підвищеного тиску, можливих виразок та деформацій, визначення можливої діабетичної полінейропатії та ангіопатії нижніх кінцівок. Огляд проводиться відповідно до Практичних рекомендацій.
У хворих на ЦД із низьким ризиком розвитку СДС доцільним є 1 профогляд на 6 місяців із проведенням машинної обробки стопи.
У разі виявлення невиразкової патології (гіперкератози, грибкова інфекція, бородавки, пухирі, деформація нігтів) необхідно проводити курс місцевого лікування в кабінеті ДС із подальшим оглядом 1 раз на 3 місяці.
Після визначення групи ризику СДС необхідно проводити огляд хворих 1 раз на 3 місяці. У разі виявлення початкових стадій периферичної ангіопатії та нейропатії слід призначати патогенетичне лікування – амбулаторно чи в умовах денного стаціонару.
Виявлення неглибоких негенералізованих виразок стопи передбачає одночасне проведення топічного й патогенетичного лікування.
Робота кабінетів ДС має фінансуватися за пропорційною системою – за рахунок держави та пацієнта.
Друга ланка: кабінети та перев’язочні в спеціалізованих відділеннях (ендокринологічні диспансери, відділення обласних лікарень, зокрема судинної чи гнійної хірургії).
Крім роботи першого рівня з профілактики та лікування, на цьому етапі слід приділяти увагу лікуванню власне СДС із ушкодженням глибоких шарів стопи, вираженим інфекційним процесом, периферичною ангіопатією ІІ-ІІІ ст. за TASK та діабетичної нейропатії.
Штат кабінету має включати лікаря-хірурга, 2-3 медсестри, які пройшли спеціальну подологічну підготовку.
Процедури:
- плановий огляд стопи, взуття;
- профілактична обробка стопи, видалення гіперкератозів, корекція росту нігтів, лікування грибкових уражень, тріщин, поверхневих виразок тощо;
- визначення наявності діабетичної нейропатії за допомогою стандартних методик;
- визначення наявності периферичної ангіопатії, зокрема використання УЗ-доплерографії, черезшкірного визначення парціального тиску кисню в нижніх кінцівках, ангіографії судин нижніх кінцівок;
- хірургічна обробка виразок із виконанням некректомії, дренування рани; оцінка глибини ушкодження (з проведенням зондування); виконання біопсії тканини рани для проведення бактеріологічного посіву та визначення чутливості мікрофлори до антибіотиків;
- проведення малих операцій (ампутацій) у разі нежиттєспроможності тканин;
- накладання кастінгових систем;
- тісна співпраця з лабораторіями з виробництва профілактичного та ортопедичного взуття.
Необхідні дослідження:
- обов’язкове обстеження лікарем-ендокринологом для визначення якості компенсації ЦД та діабетичної нейропатії;
- обов’язкова консультація хірурга (бажано – судинного) для визначення ступеня поліангіопатії, глибини ушкодження тощо;
- лабораторні дослідження в повному обсязі для хворих на ЦД, додатково – можливість проведення бактеріологічних досліджень біоптатів із рани та кісткової тканини;
- консультація ортопеда для можливого використання пристосувань для розвантаження ушкоджених ділянок стопи;
- дослідження прохідності периферичних та магістральних судин кінцівки: визначення тиску на гомілці (тибіальних артеріях), великому пальці стопи, та плечі пацієнта (для визначення плечо-гомілкового індексу);
- проведення доплерографії й ангіографії судин нижніх кінцівок, черезшкірного визначення парціального тиску кисню в нижніх кінцівках.
Третя ланка: 2-3 установи в Україні, які б займалися не лише наданням високоякісної допомоги, але й навчально-методичною та дослідницькою роботою, проведенням апробацій нових схем лікування, професійною підготовкою авторизованого персоналу (подологів, подіатрів) при вищих навчальних закладах післядипломної освіти з обов’язковим наданням сертифікатів. Такі фахівці мають закласти фундамент майбутньої служби на місцях і одночасно відповідати за роботу на регіональному рівні.
Крім висококваліфікованої медичної допомоги, такі установи мали б проводити розробку нових схем допомоги, створювати та модернізувати протоколи лікування, вести статистику, що дало б змогу більш чітко встановлювати потребу в медичних засобах і медичному персоналі на місцях.
Визначення стратегії й тактики державного забезпечення хворих.
З огляду на світовий досвід можна чітко вказати на необхідність державного забезпечення хворих із СДС, оскільки втрата пацієнтом нижніх кінцівок несе значні збитки й державі. Важливо прицільно спрямувати державні кошти на препарати, що довели свою ефективність і дійсно забезпечують загоєння. Враховуючи патогенез СДС, особливу увагу слід приділяти препаратам, що зменшують рівень діабетичної нейропатії (передусім препарати альфа-ліпоєвої кислоти) та відновлюють прохідність периферичних судин, адже достатня васкуляризація тканин нижніх кінцівок є абсолютно необхідною умовою загоєння рани. Реваскуляризація досягається як хірургічним методом (різні види шунтів), так і введенням медикаментів, що впливають на прохідність судин (урокіназа, простагландини І2 та Е1). Важливим є якісне топічне лікування із застосуванням сучасних перев’язувальних засобів, що мають протимікробні властивості та сприяють регенерації тканин. Оскільки практично всі випадки СДС супроводжуються гнійно-некротичними процесами, значну увагу слід приділяти забезпеченню хворих антибіотиками. При неускладнених процесах достатньо призначення напівсинтетичних пеніцилінів (флуклоксацилін, оксацилін) та цефалоспоринів І покоління (цефалексин, цефазолін), а при стійкому та запущеному процесі необхідно застосовувати фторхінолони (ципрофлоксацин, левофлоксацин), цефалоспорини ІІ-IV поколінь, фосфоміцин, карбапенем, аміноглікозиди. Крім медикаментозного лікування, необхідно забезпечити хворих ортопедичним взуттям тощо.
Основні напрями реорганізації служби ДС:
- реорганізація другої ланки надання медичної допомоги: створення на базі відділень обласних лікарень областей, АР Крим, міст Севастополя та Києва центрів із лікування СДС, які б взаємодіяли з головною ендокринологічною установою регіону;
- створення мережі діючої профілактичної служби ДС із подологічними кабінетами;
- визначення пріоритетів державних закупівель препаратів;
- створення єдиних стандартних протоколів діагностики та лікування СДС;
- розробка та впровадження системи підготовки лікарів-подологів і подіатрів;
- упорядкування галузевих наукових робіт із метою їх оптимізації та систематизації.
Як приклад розв’язання проблеми СДС можна навести діяльність Українського науково-практичного центру ендокринної хірургії МОЗ України. Слід зазначити, що Центр відповідає третьому рівню надання допомоги при СДС і є базовою установою в Україні Міжнародної робочої групи з проблеми ДС (IWGDF) ВООЗ і Міжнародної діабетичної федерації. Згідно з міжнародними рекомендаціями для підвищення якості лікування та об’єктивної обробки отриманих результатів у Центрі було створено мультидисциплінарну робочу групу з лікування СДС, до якої, крім ендокринологів, увійшли хірурги, ортопеди, судинні й ендоваскулярні хірурги. Особливості роботи цієї групи по діагностиці та лікуванню хворих з СДС наведено нижче.
Обстеження хворих з СДС проводилося згідно з рекомендаціями IWGDF, Міжнародної діабетичної федерації та ВООЗ. Стан кінцівок оцінювався за стратифікаційною шкалою PEDIS. Ступінь порушення перфузії тканин ноги визначався черезшкірним виміром парціального тиску кисню в тканинах (tcPO2), – цей показник є інтегральним, оскільки демонструє наявність можливих проблем як великих, так і дрібних судин, зокрема й артеріоловенулярного шунтування, що виникає при нейропатії. Для уточнення характеру ішемії використовувалась інтраартеріальна ангіографія, допплерографія тощо. Слід зазначити, що орієнтуватися на скарги пацієнта у випадку СДС не можна, оскільки практично всі хворі з СДС мають діабетичну полінейропатію, що може або гіпертрофувати суб’єктивні симптоми хвороби, або приховувати їх.
Ефект ангіоактивних ліків оцінювався саме за допомогою визначення показника tcPO2 через його інтегральність, позаяк поліпшення прохідності великих судин може не покращити кровопостачання тканин ноги саме через мікроангіопатію чи артеріоловенулярне шунтування. Визначенню такого важливого показника, як площа дефекту рани, допомагає розроблена в Центрі програма комп’ютерної обробки цифрових зображень, за якою можна визначити динаміку загоєння незалежно від зміни форми рани, а за необхідності – вчасно змінити схему лікування. Важливим є і визначення глибини ушкодження. Для точної верифікації пошкодження кісток однієї рентгенографії часто недостатньо, тому доцільно широко застосовувати магнітно-резонансну (МРТ) й комп’ютерну томографію (КТ). Найоб’єктивнішою методикою діагностики нейропатії є визначення швидкості нейром’язової передачі. Проте через технічні складності процедури ми обмежилися визначенням порушень тактильної (монофіламент), вібраційної (камертон), холодової та больової чутливості. Ступінь нейропатії досить складно градуювати, тому ми фіксували наявність та відсутність симптомів.
Грунтуючись на вищезазначених принципах оцінки ефективності лікування, ми вперше спробували об’єктивно оцінити наступні новітні методики ведення хворих з СДС: фібринолітичну терапію (застосування урокінази), використання засобів для топічного лікування ран (промогран) й ультразвукової методики очистки ран [5]. Антибіотикотерапія призначалась ад’ювантно згідно з рекомендаціями IWGDF з акцентом на тривале застосування.
Під час проведення дослідження з метою вивчення ефективності застосування малих доз (0,5-1 млн МО в/в крапельно 18-27 днів) урокінази при СДС було відібрано 16 пацієнтів із патологією циркуляції у дрібних судинах. Критеріями лікування були рівні фібриногену. Результат оцінювали за tcPO2 та розміром виразкового дефекту. Після лікування рівень фібриногену зменшився з 4,83±0,91 до 1,86±0,19 г/л, через 3 місяці він становив 2,67±1,01 г/л. Рівень парціального тиску кисню зріс із 12,6±4,3 (згідно з класифікацією ТАSК це ішемія, імовірність загоєння рани за таких показників становить близько 23%) до 46,5±9,4 мм рт. ст. (ймовірність загоєння – 85%). Через 1 місяць після лікування tcPO2 становив 34,5±7,3 мм рт. ст., через 2 і 3 місяці – 29,4±6,89 і 20,1±7,15 мм рт. ст. відповідно. Отже, було доведено, що в результаті лікування достовірно покращилося кровопостачання тканин ніг за рахунок зменшення в’язкості крові через зниження рівня фібриногену та розчинення дрібних тромбів в артеріолах і венулах.
Також досить переконливими виявилися дані відносно застосування методу низькочастотної ультразвукової обробки з використанням кавітаційних розчинів. Принципом роботи апарата є кавітаційний ефект, що виникає у рані під час дотику сонотроду з розчином. При цьому звукова хвиля викликає виникнення ділянок розрідження, що зумовлює деструкцію тканин рани й загибель мікроорганізмів. Порівняно з групою (114 пацієнтів), де топічне лікування проводилося за стандартною методикою (з некректомією, дренуванням та обробкою рани, антибіотикотерапією), швидкість очистки й епітелізації рани в групі, в якій застосовувався апарат (469 пацієнтів), була достовірно вищою: 9-12 днів із використанням апарата і до 22 днів – без нього (всі хворі без остеомієліту).
Також вивчалася ефективність промограну – протеаз-модулюючої матриці – засобу для прискорення епітелізації та загоєння рани. Дія промограну базується на поєднанні дії ферментів, які з одного боку посилюють ендогенні фактори росту, а з іншого – інактивують протеази, що містяться в гранулюючій рані й перешкоджають загоєнню. Було визначено точку прикладання – очищену активно гранулюючу рану. Швидкість епітелізації у разі використання препарату достовірно зростала (р<0,05) порівняно з контрольними групами (29 та 64 хворих відповідно, ступінь важкості СДС співвідноситься). Залежно від площі пошкодження динаміка загоєння становить 0,94±0,21 проти 0,39±0,47 см2/тиждень. Проте під час оцінки ефективності засобів топічного лікування слід передусім враховувати ступінь кровопостачання тканин нижніх кінцівок. При tcPO2<20 мм рт. ст. швидкість епітелізації, навіть за відсутності мікробного забруднення, однакова в обох групах і становить 0,06 см2/тиждень, тобто практично відсутня, а в разі відмови від місцевого лікування відбувається збільшення розмірів рани з прогресуючим інфікуванням і генералізацією процесу.
Висновки
- Створення мультидисциплінарних груп є запорукою якісного патогенетично обгрунтованого лікування СДС і здійснення лікування всього симптомокомплексу, а не поодиноких проявів хвороби.
- Для оцінки ефективності різних схем лікування необхідне чітке застосування критеріїв і класифікацій, розроблених і запроваджених у світовій практиці.
- Найефективнішим є використання стратифікаційної класифікації, яка розбиває СДС на складові, які, в свою чергу, оцінюються в динаміці. Оцінка важкості СДС за максимально вираженою ознакою не дає змоги оцінити ефективність лікування.
- Однією із найважливіших умов загоєння ран при СДС є достатнє кровопостачання тканин. Отже, запорукою успішного лікування СДС є відновлення кровопостачання шляхом реваскуляризації (при патології великих судин), реканалізації фібринолітиками та іншими вазоактивними препаратами (непрохідність судин малого й середнього діаметра) й ліквідація артеріовенулярних шунтів шляхом лікування полінейропатії.
Розуміння важливості проблеми СДС в Україні та нагальності проведення термінових дій підтверджено відповідним дорученням Президента України 406/50185-01 від 26.09.05. Отже, для розв’язання цієї медико-соціальної проблеми необхідна плідна співпраця практичних лікарів, організаторів системи охорони здоров’я та громадських організацій.
Література
- Горобейко М.Б., Гирявенко О.Я. Класифікація діабетичної стопи, затверджена Міжнародною робочою групою з діабетичної стопи IDF та ВООЗ // Клінічна ендокринологія та ендокринна хірургія – 2004. – № 1. – С. 83-86.
- Міжнародна угода з проблеми діабетичної стопи. – К., 2004. – С. 96.
- Практичні рекомендації з лікування та профілактики синдрому діабетичної стопи Міжнародної робочої групи з проблеми діабетичної стопи. – К., 2004. – С. 16.
- Consensus Development Conference on Diabetic Foot Wound Care – American Diabetes Association // Diabetes Care. – 1999. – Vol. 22, № 8. – Р. 1354-1360.
- Weck M. Diagnostik und Therapie des diabetischen Fusses. – Kreischa, 2002. – 67 p.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Взаимосвязь здоровья кожи и репродуктивной системы в контексте актуальных проблем современной дерматокосметологии
Взаимосвязь здоровья кожи и репродуктивной системы в контексте актуальных проблем современной дерматокосметологии
 Бородавки (венеричні) анальної ділянки та статевих органів (гострокінцеві кондиломи)
Бородавки (венеричні) анальної ділянки та статевих органів (гострокінцеві кондиломи)
 Доброкачественные новообразования век
Доброкачественные новообразования век
 Кожная сыпь у взрослых: задача с множеством неизвестных
Кожная сыпь у взрослых: задача с множеством неизвестных