- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Клиническая инфектология и паразитология. Часть 1
Клиническая инфектология и паразитология. Часть 1

Тактика ведения пациентов с инфекцией, вызванной вирусом гепатита С. Клинические рекомендации Европейской ассоциации по изучению болезней печени (ЕАИП/EASL) 2015 г.
ВВЕДЕНИЕ
Вирус гепатита С (ВГС) является одной из основных причин хронических заболеваний печени в мире [1]. Долгосрочное воздействие инфекции ВГС является высоковариабельным, изменяясь в пределах от минимальных гистологических изменений до обширных фиброзов и циррозов печени с или без гепатоцеллюлярной карциномы (ГЦК). Число хронически инфицированных лиц во всем мире, по оценкам, составляет около 160 млн, но большинство из них не знают о своей инфекции. Применение расширенных критериев для скрининга ВГС является предметом основного обсуждения между различными заинтересованными сторонами. Клиническое лечение пациентов с заболеваниями печени, связанными с ВГС, значительно продвинулось в течение последних двух десятилетий благодаря лучшему пониманию патофизиологии болезни, а также благодаря разработкам в области диагностики и улучшениям в терапии и профилактике.
Эти Рекомендации ЕАИП по лечению гепатита С предназначены в качестве помощи врачам и другим медицинским работникам, а также пациентам и другим заинтересованным лицам в процессе принятия клинических решений путем описания текущего оптимального ведения больных с острыми и хроническими инфекциями ВГС. Эти рекомендации относятся к методам лечения, которые были утверждены в Европейском союзе во время их публикации.
Стандарт лечения до 2014 г.
Основная цель терапии ВГС - устранение инфекции. Устойчивый вирусологический ответ (УВО) определяется как невыявление РНК ВГС через 12 недель (УВО12) или 24 недели (УВО24) после завершения лечения. Инфекция устраняется более чем у 99% пациентов, которые достигли УВО. УВО, как правило, связан с нормализацией состояния при болезни печени у больных без цирроза. Риск осложнений, угрожающих жизни, остается у пациентов с циррозом печени, однако фиброз печени может регрессировать, и риск осложнений, таких как печеночная недостаточность и портальная гипертензия, уменьшается. Последние данные показывают, что у больных циррозом, у которых элиминирован ВГС, риск развития ГЦК и смертность от всех причин значительно снизились по сравнению с нелечеными пациентами и пациентами без устойчивого вирусологического ответа, но не устранен [2, 3]. ВГС может также влиять на нейрокогнитивность, и эффективное подавление вируса приводит к купированию мозговых нарушений [4].
До 2011 г. сочетание пегилированного Интерферона (ПегИФН)-α и Рибавирина (РБВ) в течение 24 или 48 недель было одобренным лечением хронического гепатита С [5]. При этой схеме лечения пациенты, инфицированные ВГС 1-го генотипа, имели частоту УВО примерно 40% в Северной Америке и 50% - в Западной Европе. Более высокие показатели УВО были достигнуты у пациентов, инфицированных ВГС 2-го, 3-го, 5-го и 6-го генотипов (примерно до 80% и выше у 2-го генотипа, чем у 3-го, 5-го и 6-го генотипов), и промежуточная частота УВО была достигнута у пациентов с ВГС 4-го генотипа [6].
В 2011 г. Телапревир и Боцепревир были лицензированы для лечения ВГС 1-го генотипа. Эти два препарата являются препаратами первой волны первого поколения препаратов прямого противовирусного действия (ПППД). Оба направлены на сериновую протеазу ВГС NS3-4A и, таким образом, относятся к блокаторам протеазы. И Телапревир, и Боцепревир должны вводиться в комбинации с ПЕГ-ИНТЕРФЕРОНОМ-α и Рибавирином. В III фазе испытаний Боцепревира и Телапревира у нелеченых пациентов с ВГС 1-го генотипа с применением тройных схем терапии достигается более высокий уровень УВО, чем при двойной терапии ПЕГ-ИНТЕРФЕРОНОМ-α и Рибавирином - порядка от 65 до 75% [7-10]. Тем не менее, профили побочных эффектов этих тройных комбинированных методов лечения и затраты на УВО у пациентов с распространенным фиброзом печени таковы, что в идеале они не должны больше применяться у пациентов, инфицированных ВГС 1-го генотипа, в то время как доступны другие, более эффективные и лучше переносимые варианты.
Три новых ПППД ВГС были лицензированы в ЕС в 2014 г. для использования в качестве составной части комбинированной терапии инфекции ВГС. Софосбувир, пангенотипичный нуклеотидный аналог блокатора ВГС РНК-зависимой РНК-полимеразы, был утвержден в январе 2014 г. Симепревир, препарат второй волны первого поколения блокаторов протеазы NS3-4A, активный в отношении генотипов 1 и 4, был утвержден в мае 2014 г. Даклатасвир, пангенотипичный блокатор NS5A, был утвержден в августе 2014 г.
Каждый из этих трех ПППД может быть использован в качестве компонента в тройной комбинированной схеме ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина, что дает УВО 60-100% в зависимости от применяемого ПППД, генотипа ВГС, присутствия определяемой ранее существовавшей аминокислотной замены, придающей устойчивость к применяемому ПППД, и тяжести заболевания печени. Хотя эти комбинации лучше переносятся, чем тройные комбинации, включая Телапревир или Боцепревир, их профили побочных эффектов и ведение больных остаются сложными из-за использования ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина.
При помощи трех новых одобренных ВГС ПППД, безинтерфероновые комбинации широко использовались по всей Европе в 2014 г., первоначально как часть программ раннего доступа, а затем преимущественно у пациентов с прогрессирующим заболеванием печени (фиброз по шкале METAVIR F3 или F4). У пациентов, инфицированных ВГС, генотип 2 (12 недель) или 3 (24 недели), показано сочетание Софосбувира и Рибавирина, дающее УВО порядка 80-95%.
Безинтерфероновые комбинации Софосбувира и Симепревира с или без Рибавирина были использованы на основании результатов небольшого исследования COSMOS Фаза II у пациентов, инфицированных генотипом 1, которые достигли УВО в 93-100% случаев [11]. Последние предварительные реальные данные из США показали, что уровень УВО немного ниже, чем в исследовании COSMOS у пациентов с генотипом инфекции 1:82% УВО12 - в исследовании TRIO, 89% УВО24 - в исследовании TARGET [12, 13]. Сочетание Софосбувира и Даклатасвира с или без Рибавирина также широко используется у больных с заболеваниями печени по всей Европе на основании результатов исследования фазы II у пациентов, инфицированных генотипом 1, с уровнем УВО между 95% и 100% [14]. Эта комбинация хорошо переносилась пациентами в этом испытании, и ожидаются проверенные практикой данные.
Совет экспертов признает неоднородность доходов на душу населения и систем медицинского страхования по всей Европе и в других регионах, и, следовательно, есть необходимость продолжать использование схемы ПЕГ-ИНТЕРФЕРОНА-α и Рибавирина с или без блокаторов протеазы первой волны первого поколения, таких как Телапревир или Боцепревир. Тем не менее, появление новых ПППД подразумевает, что эти схемы не рекомендуются к применению в 2015 г. Есть надежда, что публикация обновленных рекомендаций станет основанием для возмещения (и дисконтирования) стоимости препаратов с целью согласования лечения в разных странах и регионах.
Методика
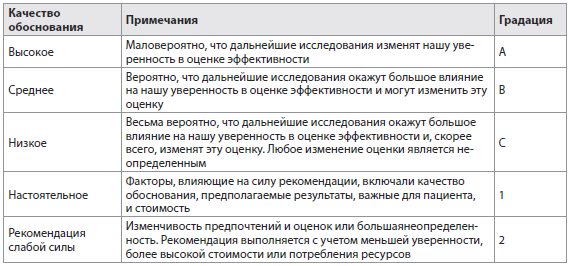
Эти рекомендации ЕАИП подготовлены коллегией экспертов, выбранных Управляющим советом ЕАИП. Эти рекомендации были одобрены Управляющим советом ЕАИП. Эти рекомендации были основаны, насколько это возможно, на информации из существующих публикаций и выступлений на международных встречах, и, если доказательства были недоступны, эксперты предоставляли личный опыт и мнения. Где это возможно, приведен уровень обоснованности и рекомендации. Обоснования и рекомендации были оценены в соответствии с системой разработки, оценкой и экспертизой степени обоснованности клинических рекомендаций (GRADE). Степень убедительности рекомендаций, таким образом, отражает качество основных обоснований. Были сформулированы принципы системы GRADE [15]. Качество обоснований в рекомендациях было классифицировано в одном из трех уровней: высокий (A), умеренный (B) или низкий (C). Система GRADE предлагает два типа рекомендаций: настоятельные (1) и рекомендации слабой силы (2) (табл. 1). Таким образом, рекомендации рассматривают качество обоснований: чем выше качество обоснований, тем более вероятны настоятельные рекомендации; чем большая изменчивость в оценках и предпочтениях или чем больше неопределенность, тем более вероятны рекомендации слабой силы.
Эти рекомендации обязательно основываются на препаратах, зарегистрированных в настоящее время. Они будут регулярно обновляться Европейским агентством по лекарственным средствам после утверждения новых лекарственных схем.
Рекомендации
Диагностика острого и хронического гепатита С
Диагноз острой и хронической инфекции ВГС основан на обнаружении РНК ВГС молекулярно-генетическим методом (нижний предел обнаружения <15 международных единиц [МЕ]/мл). Антитела к ВГС обнаруживаются с помощью иммуноферментного анализа (ИФА) у подавляющего большинства пациентов с ВГС, но результаты ИФА могут быть отрицательными в начале острого периода гепатита С и у пациентов с сильно ослабленным иммунитетом. После спонтанного или ятрогенного клиренса вируса антитела к ВГС сохраняются в отсутствие РНК ВГС, но могут снижаться и, наконец, исчезать у некоторых лиц [16, 17].
Диагноз острого гепатита С можно установить с уверенностью, только если сероконверсия антител к ВГС может быть задокументирована, так как нет серологического маркера, который доказывает, что инфекция ВГС de novo появилась после острой фазы. Не все пациенты с острым гепатитом С будут анти-ВГС-положительными при обследовании. В этих случаях можно заподозрить острый гепатит С, если клинические признаки и симптомы совместимы с острым гепатитом С (уровень аланинаминотрансферазы [ALT] > в 10 раз верхнего предела нормального, желтуха) при отсутствии в анамнезе хронических заболеваний печени или других причин острого гепатита и/или если последний вероятный источник передачи является идентифицируемым. Во всех случаях РНК ВГС можно обнаружить во время острой фазы, хотя могут возникать кратковременные периоды неопределяемого уровня РНК ВГС.
Диагноз хронического гепатита С основан на обнаружении обоих антител - анти-ВГС и РНК ВГС - в присутствии биологических или гистологических признаков хронического гепатита. Так, в случае недавно приобретенной инфекции ВГС спонтанный клиренс вируса очень редко выходит за рамки от 4 до 6 мес., диагностика хронического гепатита С может быть проведена после этого периода времени.
Рекомендации
- Антитела к ВГС являются первой линией диагностического теста для инфекции ВГС (А1).
- В случае подозрения на острый гепатит C или у пациентов с иммунодефицитом РНК ВГС-исследования должны быть частью первичной оценки (А1).
- Если обнаружены антитела к ВГС, РНК ВГС необходимо определять с помощью чувствительного молекулярного метода (А1).
- Анти-ВГС-позитивные, РНК ВГС-отрицательные пациенты должны быть повторно тестированы на предмет РНК ВГС через 3 мес., чтобы подтвердить истинное выздоровление (А1).
Скрининг хронического гепатита С
Благодаря утверждению весьма эффективных новых схем лечения гепатита, доступ к лечению должен быть расширен. Значительная доля пациентов с хроническим гепатитом С не знает о своей инфекции. Кроме того, точные данные о распространенности и заболеваемости ВГС необходимо проанализировать в масштабах пандемии в разных регионах и разработать мероприятия в области общественного здравоохранения. Таким образом, необходимо тестирование на гепатит С для идентификации зараженных лиц и их привлечение к наблюдению и лечению, необходимо также применять целевой скрининг на маркеры ВГС. Группы повышенного риска инфицирования ВГС могут быть идентифицированы и должны быть проверены. Группы риска, которые должны подвергаться скринингу, зависят от местной эпидемиологической ситуации с ВГС-инфекцией. В дополнение к ИФА могут быть использованы быстрые диагностические тесты (БДТ) для скрининга антител к ВГС. БДТ используют различные матрицы, в том числе сыворотку, плазму, а также капиллярную цельную кровь из пальца или, для некоторых из них, жидкость (кревикулярную) ротовой полости, облегчая скрининг и избегая необходимости использовать венепункцию, пробирку центрифугирования, замораживание и квалифицированную рабочую силу. БДТ просты для выполнения при комнатной температуре, без специальных приборов или углубленного обучения.
Таблица 1 Использованная градация обоснований (адаптировано из системы GRADE)
Рекомендации
- Скрининг на ВГС-инфекцию должен быть рекомендован для проведения в определенных целевых группах населения в соответствии с местной эпидемиологией инфекции ВГС, в идеале - в рамках национальных планов (А1).
- Скрининг на ВГС должен быть основан на обнаружении антител к ВГС (А1).
- Быстрые диагностические тесты могут быть использованы вместо классических иммуноферментных для облегчения скрининга антител к ВГС и улучшения доступа к методу лечения (В1).
- Если обнаружены антитела к ВГС, РНК ВГС необходимо определять с помощью чувствительного молекулярного метода для выявления пациентов с инфекцией (А1).
Цели и конечные критерии оценки ВГС-терапии
Целью терапии является лечение инфекции ВГС для того, чтобы предотвратить осложнения, связанные с заболеваниями печени из-за ВГС и внепеченочными нарушениями, в том числе некровоспаление, фиброз, цирроз печени, декомпенсации цирроза, ГЦК, тяжелые внепеченочные проявления и смерть.
Конечная точка терапии - УВО, невыявляемый уровень РНК ВГС через 12 недель (УВО12) или 24 недели (УВО24) после окончания терапии при оценке с помощью чувствительного молекулярного метода с нижним пределом обнаружения ≤15 МЕ/мл. Оба - УВО12 и УВО24 - были приняты в качестве конечных точек терапии экспертами в США и Европе, учитывая, что их совпадение составляет 99% [18]. Долгосрочные последующие исследования показали, что УВО соответствует окончательному излечению инфекции ВГС более чем в 99% случаев [19].
Рекомендации
- Цель терапии - элиминация инфекции ВГС для предотвращения цирроза печени, декомпенсации цирроза, ГЦК, тяжелых внепеченочных проявлений и смерти (А1).
- Конечная точка терапии - невыявление РНК ВГС в чувствительном тесте (≤15 МЕ/мл) на 12-й неделе (УВО12) и 24-й неделе (УВО24) после окончания лечения (А1).
- У пациентов с фиброзом и циррозом печени элиминация ВГС снижает скорость декомпенсации и снизит, хотя и не отменит, риск ГЦК. Необходимо обеспечить постоянное наблюдение таких пациентов относительно ГЦК (А1).
- У пациентов с декомпенсированным циррозом печени элиминация ВГС снижает потребность в трансплантации печени. Пока неизвестно воздействие ликвидации ВГС на уровень среднего и долгосрочного выживания у этих больных (B2).
Должны быть установлены причинно-следственные связи между инфекцией ВГС и заболеванием печени, необходимо оценить тяжесть заболевания печени, а также определить исходные вирусологические параметры, которые будут полезны для индивидуальной терапии.
Поиск других причин заболевания печени
Другие причины хронического заболевания печени или факторы, которые могут повлиять на течение или развитие заболевания печени, должны систематически исследоваться, и все пациенты должны быть проверены на наличие других гепатотропных вирусов, в частности вируса гепатита В (ВГВ) и вируса иммунодефицита человека (ВИЧ). Употребление алкоголя должно быть оценено и подсчитано, и следует предоставить конкретную психологическую помощь, чтобы прекратить любое использование алкоголя. Необходимо оценить возможные сопутствующие заболевания, в том числе алкоголизм, аутоиммунные, метаболические или генетические заболевания печени (например, генетический гемохроматоз, сахарный диабет или ожирение), и возможность ятрогенной гепатотоксичности.
Оценка степени тяжести заболевания печени
Оценку степени тяжести заболевания печени рекомендуется проводить до начала терапии. Выявление пациентов с циррозом или выраженным (мостовидным) фиброзом имеет особое значение, так как прогноз после лечения зависит от стадии фиброза. Отсутствие выраженного фиброза может также сильно влиять на стратификацию болезни и, возможно, сроки терапии. Оценка стадии фиброза не требуется у пациентов с клиническими признаками цирроза. Пациенты с циррозом печени нуждаются в наблюдении по поводу ГЦК. Так как выраженный фиброз может присутствовать у пациентов с систематически нормальным уровнем АЛТ, оценка тяжести заболевания должна быть выполнена независимо от уровней АЛТ.
Биопсия печени уже на протяжении многих лет является эталонным методом для классификации активности и гистологического развития (стадирования) заболевания. При хроническом гепатите С существенные доказательства предполагают, что неинвазивные методы теперь могут быть использованы вместо биопсии печени для оценки тяжести заболевания печени до терапии на безопасном уровне предсказуемости. Измерение жесткости печени может быть использовано для оценки фиброза печени у пациентов с хроническим гепатитом С при условии, что внимание уделяется факторам, которые могут отрицательно повлиять на его фактическое соответствие, например такие, как ожирение. Могут также применяться надежно отработанные группы анализов биомаркеров фиброза. Как измерения жесткости печени, так и биомаркеры хорошо работают при идентификации цирроза или отсутствии фиброза, но хуже при определении промежуточных стадий фиброза.
Сочетание биомаркеров крови или комбинация измерения жесткости печени и анализа крови улучшает точность и уменьшает потребность в биопсии печени для устранения неопределенности [20, 21]. Эти тесты представляют особый интерес для пациентов с нарушениями свертывания крови, хотя также можно безопасно использовать трансъюгулярную биопсию печени в этой ситуации с возможностью оценки портального давления, что является преимуществом. В случае противоречивых результатов с неинвазивными маркерами может быть показана биопсия печени. Кроме того, может потребоваться гистология в известных или подозреваемых случаях смешанной этиологии (например, ВГС-инфекции с ВГВ-инфекцией, метаболическим синдромом, алкоголизмом или аутоиммунными заболеваниями).
Показано выявление/количественное определение РНК ВГС и определение генотипа при выявлении/количественном определении РНК ВГС для пациента, который может пройти противовирусное лечение. Количественное определение РНК ВГС должно проводиться методом надежного анализа на чувствительность, а уровни РНК ВГС должны быть выражены в МЕ/мл.
Генотип ВГС, в том числе подтип генотипа 1, также необходимо оценить до начала лечения. Определение генотипа/подтипа должно выполняться при помощи анализа, который достоверно отличает подтип 1а от 1b [22].
Тестирование на резистентность ВГС к первой линии терапии не требуется. Действительно, наличие уже предсуществующих вариантов, ассоциирующихся с резистентностью, как обнаружено с помощью секвенирования численности, не имеет существенного влияния на результаты терапии и не будет влиять на решение относительно схемы лечения (за исключением эффекта замещения Q80K у пациентов с подтипом инфекции 1a, лечение при помощи комбинации ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Симепревира, см. ниже).
Определение генетического хозяина
IL28В-генотипирование потеряло свою прогностическую ценность с появлением новых высокоэффективных безинтерферо-новых схем лечения. Таким образом, И28В-генотипирование полезно в тех случаях, где доступны только ПЕГ-ИНТЕРФЕРОН-α и Рибавирин или при выборе экономичных вариантов лечения в условиях с экономическими ограничениями.
Рекомендации
- Необходимо установить причинно-следственные связи между инфекцией ВГС и заболеванием печени (А1).
- Необходимо оценить вклад сопутствующих заболеваний в развитие заболевания печени и предпринять соответствующие корректирующие меры (А1).
- Тяжесть заболевания печени должна быть оценена до начала терапии. Определение пациентов с циррозом имеет особое значение, так как их прогноз меняется, и нужно адаптировать их режим лечения (А1).
- Стадия фиброза может быть оценена с помощью неинвазивных методов на начальном этапе, биопсия печени предназначена для случаев, когда есть неопределенность и потенциальные дополнительные этиологии (А1).
- Выявление РНК ВГС и количественное определение должны быть выполнены при помощи чувствительного анализа с более низким пределом обнаружения ≤15 МЕ/мл (А1).
- Генотип ВГС и подтипы (1а/1Ь) генотипа 1 необходимо оценить до начала лечения и определиться с выбором терапии (А1).
- И28В-генотипирование не играет никакой роли при лечении гепатита С новыми ПППД (А1).
- Тест на резистентность к ВГС не должен проводиться до начала терапии, потому что уровень УВО очень высок как у пациентов без, так и с определяемым количеством вариантов, связанных с устойчивостью, посредством секвенирования численности на исходном уровне (за исключением больных, инфицированных подтипом 1а, которые получают ком-бинацию ПЕГ-ИНТЕРФЕРОНА-α, Рибавирина и Симепревира) (А1).
Противопоказания к терапии
ИНТЕРФЕРОН-α и Рибавирин
Лечение хронического гепатита С ПЕГ-ИНТЕРФЕРОНОМ-α и Рибавиринсодержащими препаратами абсолютно противопоказано в следующих группах пациентов: неконтролируемая депрессия, психоз или эпилепсия; беременные женщины или пары, не желающие соблюдать достаточную контрацепцию; тяжелые сопутствующие заболевания, включая заболевания сетчатки, аутоиммунные заболевания щитовидной железы; декомпенсированная болезнь печени.
Использование ПЕГ-ИНТЕРФЕРОНА-α не рекомендуется у пациентов с абсолютным числом нейтрофилов <1500/мм3 и/или тромбоцитов ≤90 000/мм3. Лечение больных с прогрессирующим заболеванием печени, чьи параметры выходят за пределы рекомендаций, может быть возможным в квалифицированных центрах под тщательным контролем и при наличии инфор-мированного согласия.
Утвержденные ПППД
На основании существующих знаний не существует никаких абсолютных противопоказаний к ПППД, которые утверждены в регионе ЕС в 2015 г. Необходимо соблюдать осторожность при использовании Софосбувира у пациентов с тяжелой почечной недостаточностью, так как влияние нарушения почечной функции на выведение метаболитов, образованных Софосбувиром, все еще определяется. Сочетание Паритапревира, Омбитасвира и Дасабувира, усиленных Ритонавиром, подвергается оценке у больных с декомпенсированным циррозом Класса В и противопоказано у пациентов с декомпенсированным циррозом печени Класса С (по шкале Чайлд-Пью). Продолжаются исследования по оценке фармакокинетики и безопасности Симепревира при декомпенсированном циррозе.
Показания к лечению: кого следует лечить?
Все не получавшие предварительного лечения и прошедшие лечение пациенты с компенсированным или декомпенсированным хроническим заболеванием печени, связанным с ВГС, которые готовы лечиться и у кого нет противопоказаний к лечению, должны быть рассмотрены относительно назначения терапии. Так как не каждый ВГС-инфицированный пациент может лечиться в течение следующего года или около того, необходимо определить приоритеты (табл. 2). Группа экспертов признает, что приоритеты могут меняться в соответствии с местными и/или социальными соображениями.
Приоритет лечения должен основываться на стадии фиброза, риске прогрессирования к более поздним стадиям заболевания, наличии внепеченочных проявлений инфекции ВГС и риске передачи гепатита. Лечение должно быть приоритетным у пациентов с фиброзом (METAVIR оценка F3—F4), в том числе у пациентов с декомпенсированным циррозом печени, которые имеют противопоказания к использованию ИНТЕРФЕРОНА-α, но их можно безопасно лечить при помощи безинтерфероновых схем. Действительно, данные клинических исследований и данных реальной практики показывают, что эти пациенты могут получить больше пользы от лечения инфекции ВГС в краткосрочной перспективе, потому что наблюдалось существенное сокращение баллов при оценке тяжести цирроза по шкалам Чайлд-Пью и MELD и снижение частоты клинических случаев. Тем не менее, доказательства улучшения медицинских прогнозов по-прежнему ограничены у больных с баллами Класса по шкале Чайлд-Пью выше 12 и баллами MELD выше 20. Безинтерфероновое лечение больных с декомпенсированным заболеванием должно проводиться только в квалифицированных центрах, пока не накоплены дальнейшие данные по безопасности и эффективности лечения.
Высокоприоритетные группы также включают пациентов с ВИЧ-инфекцией или сочетанным гепатитом, больных перед или после трансплантации печени, пациентов с клинически значимыми внепеченочными проявлениями (например, симптоматический васкулит, связанный со смешанной криоглобулинемией, относящейся к ВГС, ВГС-иммунная комплексозависимая нефропатия и неходжкинская лимфома В-клеток) и пациентов с изнуряющей усталостью независимо от их стадии фиброза печени.
Лечение также должно быть приоритетным независимо от стадии фиброза или внепеченочных проявлений для лиц, подвергающихся риску передачи ВГС, в том числе активных потребителей инъекционных наркотиков, мужчин, имеющих сексуальные контакты с мужчинами с сексуальным поведением высокого риска, женщин детородного возраста, которые хотят забеременеть, пациентов на гемодиализе, и у лиц, находящихся в заключении. Потребители инъекционных наркотиков и мужчины, имеющие половые контакты с мужчинами опасного сексуального поведения, должны быть осведомлены о риске повторного заражения и должны применять превентивные меры после успешного лечения.
Лечение оправдано у пациентов с умеренной степенью фиброза (METAVIR, оценка F2). Сроки и характер терапии для пациентов с минимальной стадией или отсутствием фиброза (METAVIR, оценка F0-F1) и без каких-либо серьезных внепеченочных проявлений не являются неоспоримыми, и может быть рассмотрен перенос сроков лечения. При принятии решения об изменении лечения для конкретного пациента следует рассмотреть предпочтения пациента и приоритеты, течение болезни и риск прогрессирования, наличие сопутствующих заболеваний и возраст пациента. Пациенты, лечение которых отложено, должны оцениваться на регулярной основе относительно признаков развития болезни для того, чтобы пересмотреть назначение лечения, и для обсуждения новых методов лечения по мере их появления или доступности и при приемлемом уровне затрат.
Лечение не рекомендуется для пациентов с ограниченной продолжительностью жизни из-за сопутствующих заболеваний, не связанных с заболеваниями печени.
Рекомендации
- Все не получавшие предварительного лечения и прошедшие лечение пациенты с компенсированным или декомпенсированным хроническим заболеванием печени, вызванным ВГС, должны рассматриваться относительно применения терапии (А1).
- Лечение должно быть приоритетным для пациентов со значительным фиброзом или циррозом печени (METAVIR, оценка от F3 до F4) (А1).
- Пациентов с декомпенсированным циррозом печени (Класс B и C) следует срочно лечить с помощью безинтерфероновой терапии (А1).
- Лечение должно быть приоритетным независимо от стадии фиброза у больных с ВИЧ-инфекцией или сочетанным гепатитом, больных перед или после трансплантации печени, у пациентов с клинически значимыми внепеченочными проявлениями (например, симптоматический васкулит, связанный со смешанной криоглобулинемией, относящейся к ВГС, ВГС-иммунная комплексозависимая нефропатия и неходжкинская лимфома В-клеток) и у пациентов с изнуряющей усталостью (А1).
- Лечение должно быть приоритетным независимо от стадии фиброза для лиц, подвергающихся риску передачи ВГС, в том числе активных потребителей инъекционных наркотиков, мужчин, имеющих сексуальные контакты с мужчинами с сексуальным поведением высокого риска, женщин детородного возраста, которые хотят забеременеть, пациентов на гемодиализе, и у лиц, находящихся в заключении (В1).
- Лечение оправдано у пациентов с умеренной степенью фиброза (METAVIR, оценка F2) (А2).
- У пациентов с легкой формой заболевания (METAVIR оценка F0-F1) и отсутствием вышеупомянутых внепеченочных проявлений начало и сроки терапии не могут быть определены (В1).
- Лечение не рекомендуется для пациентов с ограниченной продолжительностью жизни из- за сопутствующих заболеваний, не связанных с заболеваниями печени (В1).
- Доступные препараты в Европейском союзе в 2015 г.
- Препараты для лечения ВГС-инфекции, имеющиеся в Европейском союзе, перечислены в настоящем разделе и в табл. 3. Перечислены также их известные взаимодействия с другими лекарственными препаратами. Более полный список взаимодействия лекарственных препаратов указан в табл. 4А-F и на сайте www.hep-druginteractions.org.
- ПЕГ-ИНТЕРФЕРОН-α. ПЕГ-ИНТЕРФЕРОН-α2α следует использовать в дозе 180 мкг/неделю, в то время как ПЕГ-ИНТЕРФЕРОН-α2b следует использовать в дозе на 1 кг веса 1,5 мкг/кг/неделю.
Таблица 2 Показания для лечения хронического гепатита С в 2015 г.: кого необходимо лечить и когда?
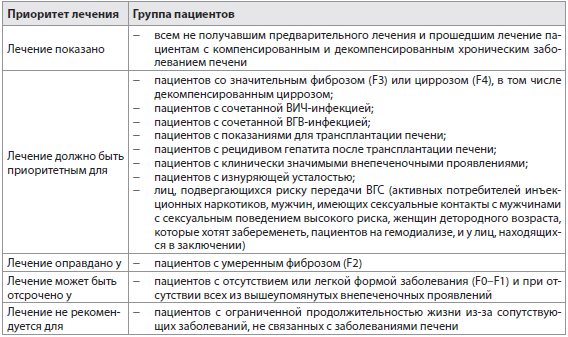
Таблица 3 Препараты для лечения ВГС-инфекции, утвержденные в Европейском союзе в 2015 г.
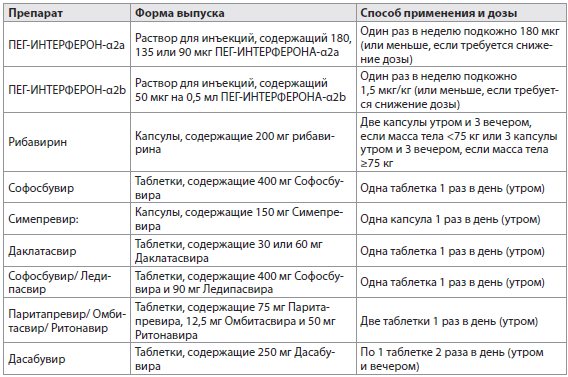
Рибавирин. Доза Рибавирина должна быть 1000 или 1200 мг/день в зависимости от веса тела (<75 кг или ≥75 кг соответственно).
Софосбувир следует принимать в дозе 400 мг (1 таблетка) 1 раз в день. Примерно 80% Софосбувира выводится из организма почками, в то время как 15% выводится с калом. Основное количество Софосбувира, выделенное с мочой, - это нуклеозид метаболит GS-331007 (78%), полученный путем дефосфорилирования, в то время как 3,5% выделяется в виде Софосбувира. Это означает, что почечный клиренс является главным способом выведения для GS-331007, большая часть которого активно выделяется. В настоящее время невозможно дать никаких рекомендаций относительно дозировки Софосбувира пациентам с тяжелой почечной недостаточностью (по оценкам скорости фильтрации клубочков [СКФ] <30 мл/мин/1,73 м2) или с терминальной стадией почечной недостаточности из-за более высокой концентрации (до 20 раз) GS-331007. Концентрация Софосбувира существенно не изменялась у пациентов с легкой печеночной недостаточностью, но она увеличивается в 2,3 раза у пациентов с умеренными нарушениями функции печени.
Софосбувир хорошо переносится в течение от 12 до 24 недель приема. Наиболее распространенные побочные эффекты (≥20%), наблюдавшиеся при сочетании с Рибавирином, были представлены повышенной утомляемостью и головной болью. Наиболее распространенные побочные эффекты (≥20%), наблюдавшиеся в сочетании с ПЕГ-ИНТЕРФЕРОНОМ-α, - повышенная утомляемость, головная боль, тошнота, бессонница и анемия. Наблюдались также небольшие подъемы креатинкиназы, амилазы и липазы без клинических проявлений.
Софосбувир не метаболизируется цитохромом Р450, но транспортируется Р-гликопротеином (Р-GР). Препараты, которые являются мощными Р-GР-стимуляторами, значительно уменьшают концентрацию Софосбувира в плазме, что может привести к снижению терапевтического эффекта. Таким образом, Софосбувир не следует вводить с другими известными Р-GP-стимуляторами, такими как Рифампицин, Карбамазепин, Фенитоин или зверобой. Другие потенциальные взаимодействия могут произойти с Рифабутином, Рифапентином, и Модафинилом. Никаких других сообщений о значительных лекарственных взаимодействиях не поступало, в частности со всеми испытанными антиретровирусными агентами, в том числе с Эмтрицитабином, Тенофовиром, Рилпривирином, Эфавиренцом, Дарунавиром/Ритонавиром и Ралтегравиром, и нет никаких потенциальных лекарственных взаимодействий с остальными антиретровирусными препаратами. Совместное введение Амиодарона (и возможно, Дронедарона) с Софосбувиром в сочетании с Даклатасвиром, Симепревиром или Ледипасвиром противопоказано из-за серьезного риска симптоматической брадикардии (есть сообщения об одном летальном случае). Механизм взаимодействия, а также роль других сопутствующих препаратов неизвестны и требуют изучения. Брадикардия наблюдается в течение от нескольких часов до нескольких дней после начала приема ПППД, но были отмечены случаи длительности брадикардии до 2 недель после начала лечения ВГС.
Таблица 4А Лекарственные взаимодействия между ВГС ПППД и ВИЧ-антиретровирусными препаратами
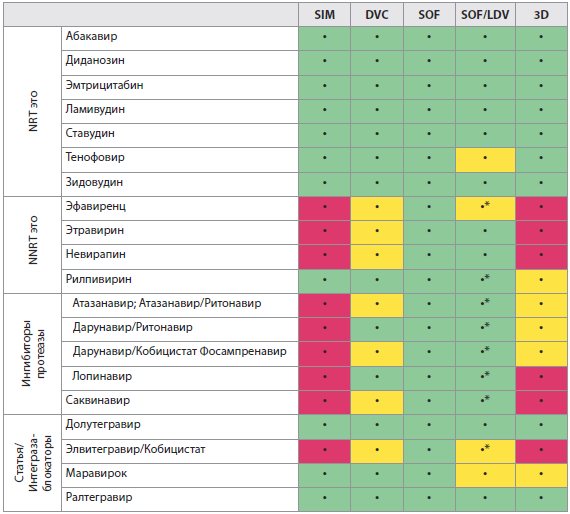
Примечания:
SIM - Симепревир;
DCV - Даклатасвир;
SOF - Софосбувир;
SOF/LDV - Софосбувир плюс Ледипасвир;
3D - Паритапревир, усиленный Ритонавиром, плюс Омбитасвир и Дасабувир.
Цветовые обозначения: зеленый: не ожидается никакое клинически значимое взаимодействие; желтый: потенциальное взаимодействие, которое может потребовать корректировку дозы, изменение времени введения или дополнительный мониторинг; красный: эти препараты нельзя вводить совместно.
Таблица 4B Лекарственные взаимодействия между ВГС ПППД и запрещенными рекреационными препаратами
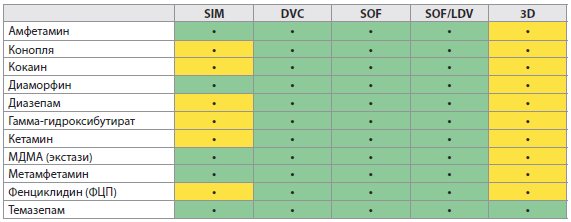
Таблица 4C Лекарственные взаимодействия между ВГС ПППД и гиполипидемическими препаратами
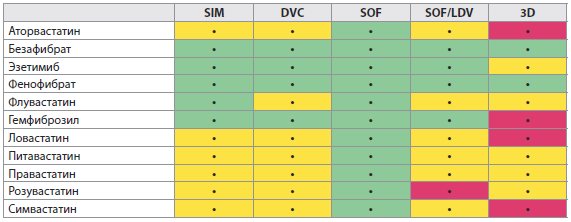
- В зависимости от функции печени может потребоваться изменение дозировки для некоторых лекарств. Пожалуйста, обратитесь к инструкции по медицинскому применению препарата для конкретных препаратов для получения совета относительно дозировки.
- Символ (зеленый, желтый, красный), используемый для ранжирования клинического значения взаимодействия препаратов, основывается на www.hep-druginteractions.org (Ливерпульский университет). Для получения дополнительной информации по взаимодействию лекарственных средств и по более широкому кругу препаратов, детализации фармакокинетического взаимодействия и корректировки дозирования обратитесь к вышеупомянутому сайту.
Софосбувир и Ледипасвир доступны в сочетании с фиксированной дозой двух препаратов, содержащих 400 мг Софосбувира и 90 мг Ледипасвира в 1 таблетке. Рекомендуемая доза этой комбинации - 1 таблетка принимается перорально 1 раз в день с едой или без еды.
Выделение неизмененного Ледипасвира с желчью является основным путем, а с мочой выводится незначительное его количество (примерно 1%), в то время как Софосбувир выделяется главным образом почками, как отмечалось выше. Средний период полувыведения Софосбувира и преобладающего метаболита GS-331007 после введения Софосбувира/Ледипасвира был 0,5 и 27 ч соответственно. Ни Софосбувир, ни Ледипасвир не являются субстратами транспортеров печеночных накоплений; является ли GS-331007 субстратом почечных транспортеров, неизвестно.
На фоне применения Софосбувира и Ледипасвира не рекомендуется использование Розувастатина (считается, из-за блокирования ОАТР Ледипасвиром) и нельзя исключать взаимодействие с другими статинами. Важно внимательно следить за побочными реакциями статинов. Так как растворимость Ледипасвира уменьшается с ростом рН, то препараты, повышающие рН в желудке (антациды, антагонисты Н2-рецепторов, блокаторы протонного насоса), могут снизить концентрацию Ледипасвира. Антагонисты Н2-рецепторов могут приниматься одновременно или через 12 ч в дозе, не превышающей 40 мг Фамотидина, а блокаторы протонного насоса одновременно в дозе, сравнимой с 20 мг Омепразола.
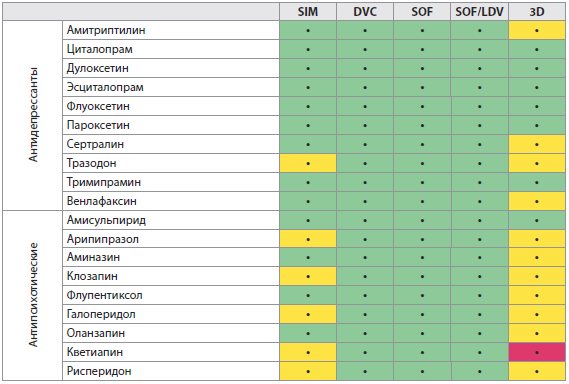
Таблица 4D Лекарственные взаимодействия между ВГС ПППД и препаратами, воздействующими на ЦНС
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Клиническая инфектология и паразитология. Часть 3
Клиническая инфектология и паразитология. Часть 3
 Клиническая инфектология и паразитология. Часть 5
Клиническая инфектология и паразитология. Часть 5
 Клиническая инфектология и паразитология. Часть 4
Клиническая инфектология и паразитология. Часть 4
 Основные принципы диагностики стабильной стенокардии в новых Европейских рекомендациях
Основные принципы диагностики стабильной стенокардии в новых Европейских рекомендациях