Генфаксон инструкция, аналоги и состав
| Показания: | Інтерферон бета–1а показаний для лікування пацієнтів з рецидивуючою формою розсіяного склерозу. У клінічних випробуваннях ця форма визначалася як наявність щонайменше 2 загострень у попередні 2 роки.Ефективність у пацієнтів зі вторинно-прогресуючим розсіяним склерозом у відсутності активного перебігу захворювання не була встановлена. |
| Форма випуска: | Розчин для ін'єкцій по 22 мкг (6 млн МО) або 44 мкг (12 млн МО) у попередньо наповнених шприцах № 3 та № 12 |
| Производитель, страна: | М.Р.ФАРМА С.А. для Лабораторія ТЮТОР С.А.С.І.Ф.І.А., Аргентина |
| Действующее вещества: | Інтерферон бета-1а - 22 мкг (6 млн МО) або 44 мкг (12 млн МО) |
| МНН: | Interferon beta-1a - Интерферон бета-1a |
| Регистрация: | 901/13-300200000з 01.03.2013 по 01.03.2018. Приказ 178 від 01.03.2013 |
| Код АТХ: |
Загальна характеристика
Міжнародна непатентована назва: interferon beta - la.
Основні властивості лікарської форми: прозорий, від безбарвного до злегка жовтуватого кольору розчин, вільний від часток.
Якісний та кількісний склад
Діючі речовини: інтерферон бета-1а – 22 мкг (6 млн МО) або 44 мкг (12 млн МО).
Допоміжні речовини: маніт, альбумін людини, натрію ацетат, кислота оцтова, вода для ін'єкцій.
Форма випуску. Розчин для ін'єкцій.
Код АТС: L03AB07. Інтерферон бета 1-а.
Імунологічні та біологічні властивості
Генфаксон – інтерферон бета-1а, який являє собою природну амінокислотну послідовність інтерферону бета людини, отриману методами генної інженерії з використанням культури клітин яєчника китайського хом'яка.
Інтерферон бета-1а має імуномодулюючі, противірусні та антипроліферативні властивості. Механізм дії препарату інтерферону бета-1а у хворих на розсіяний склероз до кінця не вивчений. Встановлено, що препарат сприяє обмеженню пошкоджень центральної нервової системи, що лежать в основі захворювання, знижує частоту і тяжкість загострень у хворих з ремітуючою формою розсіяного склерозу.
Дія препарату Генфаксон не вивчалася при первинно-прогресуючому розсіяному склерозі.
Фармакокінетика
У здорових добровольців після внутрішньовенного введення препарату спостерігалося різке мультиекспоненціальне зменшення його сироваткових концентрацій, пропорційне введеній дозі. Початковий період напіввиведення становить близько хвилини, а кінцевий період напіввиведення кілька годин, з можливим перерозподілом глибокого компартменту. Після підшкірного або внутрішньом'язового введення сироваткові рівні інтерферону бета-1а залишаються низькими, однак виявляються протягом 12-24 годин після введення. Концентрації інтерферону бета-1а після підшкірного і внутрішньом'язового введення є тотожними. Після одноразового підшкірного введення 60 мкг інтерферону бета-1а його максимальна концентрація, при визначенні імунологічним методом, становить 6-10 МО/мл і досягається в середньому за 3 години після введення. Після 4-разового підшкірного введення в тій самій дозі з інтервалом 48 годин спостерігалася помірна кумуляція (АUС збільшувалася приблизно в 2,5 рази).
Незалежно від способу дозування, значні фармакодинамічні зміни залежать від шляху введення інтерферону бета-1а. Після одноразового введення, внутрішньоклітинна і сироваткова активність 2',5'-олігоаденілат-синтетази і сироваткові концентрації бета-2-мікроглобуліну і неоптерину збільшуються протягом 24 годин після введення і поступово знижуються протягом 2-х днів. При внутрішньом'язовому та підшкірному введенні спостерігається повна співставна відповідь. Після повторного 4-разового підшкірного введення з інтервалом 48 годин, зазначені біологічні ефекти зберігаються, ознаки толерантності не розвиваються.
Інтерферон бета-1а в основному метаболізується в організмі і виводиться з жовчю і сечею.
Показання до застосування
Інтерферон бета - 1а показаний для лікування пацієнтів з рецидивуючою формою розсіяного склерозу. У клінічних випробуваннях ця форма визначалася як наявність щонайменше 2 загострень у попередні 2 роки.
Ефективність у пацієнтів зі вторинно-прогресуючим розсіяним склерозом у відсутності активного перебігу захворювання не була встановлена.
Спосіб застосування та дози
Лікування починають та проводять під контролем лікаря, який має досвід лікування розсіяного склерозу. Рекомендована доза інтерферону бету-1а 44 мкг вводиться підшкірно 3 рази на тиждень. Менша доза 22 мкг рекомендується хворим, які не можуть перенести вищу дозу, або підліткам віком 12-16 років. Якщо лікування інтерфероном призначається вперше, дозу слід поступово збільшувати задля запобігання розвитку тахифілаксії та для зменшення побічних реакцій.
Рекомендовано наступну схему початку терапії:
Таблиця 1
|
% від кінцевої дози |
Кінцева доза 22 мкг |
Кінцева доза 44 мкг |
|
|
1 - 2 тижні |
20% |
4,4 мкг |
8,8 мкг |
|
3-4 тижні |
50% |
11 мкг |
22 мкг |
|
Починаючи з 5-го тижня |
100% |
22 мкг |
44 мкг |
Інтерферон бета-1 а застосовується 3 рази на тиждень, за можливості в один і той самий час (бажано у другій половині дня) та день тижня (з інтервалом між тижнями щонайменше 48 годин). Необхідно змінювати місця підшкірної ін'єкції (див. розділ «Особливі застереження та запобіжні заходи»).
Самостійне введення препарату
а. Місце введення препарату: верхня частина стегон та нижня частина живота. Тримайте шприц, як ручку при писанні.
Рекомендується записувати і кожного разу змінювати місце ін'єкції з тим, щоб не вводити препарат двічі поспіль в одне й те саме місце і мінімізувати ризик некрозу в місці ін'єкції.
Увага! Не можна вводити препарат у місцях, де відчуваються припухлість, підшкірні вузли чи біль; проконсультуйтеся з лікарем чи медичним співробітником щодо таких симптомів.
b. Перед введенням препарату слід ретельно помити руки з милом.
c. Дістаньте шприц з препаратом Генфаксон із упаковки.
d. Перед введенням препарату протріть місце ін'єкції серветкою або тампоном, змоченим у медичному спирті. Дайте шкірі висохнути. Якщо залишки спирту залишаться на шкірі, у Вас може виникнути відчуття печіння.
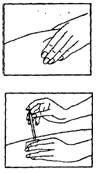 е. Обережно відтягніть шкіру навколо місця введення.
е. Обережно відтягніть шкіру навколо місця введення.
f. Тримаючи зап'ястя біля місця введення, швидким і впевненим рухом введіть голку під шкіру під відповідним кутом.
g. Вводьте препарат, повільно і рівномірно натискаючи на поршень шприца вниз до кінця (до повного спорожнення шприца).
h. Прикладіть спиртову серветку/тампон до місця ін'єкції. Видаліть шприц з голкою із шкіри.
і. Обережно помасуйте місце ін'єкції за допомогою сухого ватного тампона чи марлевої серветки.
j. Утилізуйте всі використані предмети: після завершення ін'єкції негайно покладіть використаний шприц в утилізаційний контейнер і утилізуйте.
До ін'єкції і протягом наступних 24 годин після кожної ін'єкції рекомендується застосовувати жарознижувальні болезаспокійливі засоби задля зменшення проявів грипоподібних симптомів, що можуть виникати при введенні інтерферону бета-1а.
На даний момент не встановлено, протягом якого періоду слід застосовувати препарат. Безпека і ефективність інтерферону бета-1а при тривалості лікування понад 4 років не встановлені. Рекомендується оцінювати стан хворого щонайменше кожні 2 роки протягом 4 років від початку лікування, а рішення щодо продовження лікування приймає лікар на індивідуальній основі щодо кожного пацієнта.
Побічна дія
Найбільш частими побічними реакціями, що асоціюються з терапією інтерфероном бета-1а, є симптоми грипоподібного синдрому. Грипоподібні симптоми, як правило, є найбільш вираженими на початку терапії, їх частота зменшується у подальшому при продовженні лікування. У пацієнтів, які отримують інтерферон бета-1а, виникають типові симптоми грипоподібного синдрому впродовж перших шести місяців після початку лікування. У деяких пацієнтів також виникають реакції в місці ін'єкції, переважно нетяжке запалення або почервоніння. Часто спостерігалося безсимптомне підвищення лабораторних показників функції печінки і зменшення кількості білих кров'яних тілець. Більшість побічних реакцій, що спостерігалися при терапії інтерфероном бета-1а, зазвичай є слабко вираженими й оборотними і загалом добре корегуються зменшенням дози. У випадку серйозних або стійких небажаних ефектів, лікар приймає рішення щодо тимчасового зменшення дози інтерферону бета-1а або призупинення терапії.
Побічні реакцій, про які повідомлялося в різних клінічних дослідженнях при розсіяному склерозі, описані і класифіковані нижче за класами систем органів та частотою виникнення. Побічні реакції наведено в порядку зменшення тяжкості в рамках кожної частотної групи. Залежно від частоти тих чи інших побічних реакцій вони підпадають під такі категорії: дуже часті (≥ 10 %), часті (від ≥ 1 % до < 10 %), нечасті (від ≥ 0,1 % до < 1 %), рідкі (від ≥ 0,01 % до < 0,1 %), виняткові (< 0,01 %).
Таблиця 2
|
Клас системи органів |
Дуже часті ≥ 10 % |
Часті ≥ 1% та < 10 % |
Нечасті ≥ 0,1 % та < 1 % |
Не відомо* |
|
Інфекції та інвазії |
Абсцес у місці ін`єкції |
Інфекції у місці ін`єкції, включаючи флегмону |
||
|
З боку крові та лімфатичної системи |
Нейтропенія, лімфопенія, лейкопенія, тромбоцитопенія, анемія |
Тромботична громбоцитопенічна пурпура гемолітичний уремічний синдром |
||
|
Ендокринні розлади |
Дисфункція щитовидної залози найчастіше у формі гіпотиреозу або гіпертиреозу |
|||
|
Психічні розлади |
Депресія, безсоння |
Спроби суїциду |
||
|
З боку нервової системи |
Головний біль |
Судоми, минущі неврологічні симптоми (наприклад, гіпестезія, м`язові спазми, парестезії, труднощі при ходьбі, кістково-м`язова ригідність), які можуть імітувати загострення розсіяного склерозу |
||
|
З боку органів зору |
Порушення кровообігу в судинах сітківки (наприклад, ретинопатії, ватоподібні плями і обструкція артерії або вени сітківки) |
|||
|
З боку шлунково-кишкового тракту |
Діарея, блювання, нудота |
|||
|
З боку шкіри та підшкірної клітковини |
Свербіж, висипання, еритематозний висип, макуло-папульозний висип |
Ангіоневротичний набряк, кропив`янка, еритема, шкірні реакції, подібні до мультиформної еритеми, синдром Стівенса-Джонсона, алопеція |
||
|
З боку скелетно-м`язової системи і сполучних тканин |
Міалгії, артралгії |
|||
|
Загальні порушення і реакції в місці введення |
Запалення в місці ін`єкції, реакція в місці ін’єкції, грипоподібні симптоми |
Біль в місці ін`єкції, втомлюваність, озноб, підвищення температури |
Некроз у місці ін`єкції, припухлість у місці ін`єкції |
|
|
Додаткові дослідження |
Безсимптомне підвищення рівнів трансаміназ |
Гостре підвищення рівнів трансаміназ |
||
|
З боку респіраторної системи, грудної клітини і середостіння |
Задишка |
|||
|
З боку імунної системи |
Анафілактичні реакції |
|||
|
Судинні розлади |
Тромбоемболічні явища |
|||
|
Гепатобіліарні розлади |
Гепатит з або без жовтяниці |
* Побічні реакції, виявлені в ході постмаркетингових спостережень (частота невідома)
Інтерферон бета-1а може викликати тяжкі ураження печінки. Механізм виникнення рідких випадків симптоматичних порушень функції печінки не відомий. Більшість випадків тяжкого ураження печінки мали місце протягом перших шести місяців лікування. Жодних специфічних факторів ризику не виявлено. Лікування інтерфероном бета-1а слід припинити при виникненні жовтяниці або інших клінічних симптомів дисфункції печінки (див. розділ «Особливості застосування»). Із застосуванням інтерферонів асоціювалися випадки анорексії, запаморочення, занепокоєння, аритмії, розширення судин і підвищення серцебиття, менорагії і метрорагії. На фоні лікування інтерфероном бета-1а може спостерігатися підвищене утворення аутоантитіл.
Протипоказання
• Підвищена чутливість до природного або рекомбінантного інтерферону бета-1а, сироваткового альбуміну людини або до інших компонентів препарату.
• Вагітність і лактація (див. «Застосування під час вагітності і лактації»)
• Важкі депресивні порушення та / або суїцидальні думки.
• Вік до 16 років (ефективність і безпека препарату вивчені недостатньо).
• Фармакорезистентна епілепсія
Передозування
Жодного випадку передозування не описано.
У разі передозування пацієнт повинен бути госпіталізований для спостереження і проведення при необхідності симптоматичної терапії.
Особливості застосування
Кожен попередньо наповнений шприц призначений виключно для одноразового використання. Шприц, а також будь-які невикористані продукти чи відходи, які контактували з продуктом, підлягають знищенню належним чином.
Розчин для ін'єкцій у попередньо наповненому шприці готовий до використання. Він також може бути введений за допомогою відповідного автоматичного шприца-інжектора.
Застосовується тільки однорідний, прозорий або молочно-білий розчин без сторонніх часток і без видимих ознак псування.
Пацієнти мають бути проінформованими про найбільш часті небажані (побічні) реакції, що можуть виникати при застосуванні інтерферону бета-1а; в тому числі симптоми грипоподібного синдрому (див. розділ «Побічні реакції»). Ці симптоми, як правило, є найбільш вираженими на початку терапії, в подальшому при продовженні лікування їх частота і тяжкість зменшуються.
Інтерферон бета-1а слід призначати з обережністю пацієнтам з наявним депресивним розладом або в анамнезі, зокрема, хворим з попередніми проявами суїцидальних думок (див. розділ «Протипоказання»), Встановлено, що депресивні стани і суїцидальні думки частіше виникають у популяції хворих на розсіяний склероз і у зв'язку з використанням інтерферону. Пацієнтам, які отримують лікування інтерфероном бета-1а, слід рекомендувати негайно повідомити про будь-які симптоми депресії і/або суїцидальних думок своєму лікарю. Пацієнтів, які виявляють ознаки депресії, слід взяти на ретельний контроль під час лікування інтерфероном бета-1а і лікувати відповідним чином. Зокрема, має розглядатися необхідність припинення терапії Інтерфероном бета- 1а (див. розділ «Протипоказання» та «Побічні реакції»).
Інтерферон бета-1а слід призначати з обережністю пацієнтам з епілепсією в анамнезі, а також хворим, які отримують лікування антиепілептичними засобами, особливо, якщо їх епілептична хвороба не піддається належному лікуванню цими препаратами (див. розділ «Побічні реакції»). Слід з обережністю застосовувати у пацієнтів із зазначенням на судоми в амнезі. При виникненні під час лікування судом у хворих, що раніше не страждали такими порушеннями, необхідно відмінити препарат, встановити етіологію судом і призначити проти судомну терапію перш, ніж відновити лікування Інтерферон бета-1а.
Пацієнти із захворюваннями серця, такими як стенокардія, застійна серцева недостатність або аритмія, потребують ретельного контролю щодо погіршення їх клінічного стану на початку терапії інтерфероном бета-1а. Симптоми грипоподібного синдрому, що асоціюється з лікуванням інтерфероном бета-1а, може виявитися стресом та ускладнити стан пацієнтів із захворюваннями серця.
Повідомлялося про випадки некрозу в місці ін'єкції у деяких пацієнтів, які отримували інтерферону бета-1а (див. розділ «Побічні реакції»). Задля мінімізації ризику розвитку некрозу в місці ін'єкції пацієнтам слід рекомендувати використовувати асептичні методики введення і змінювати місце ін'єкції при кожному введенні препарату. Слід періодично перевіряти, як пацієнт здійснює самостійне введення препарату, особливо при виникненні реакцій у місці ін'єкції. Якщо пацієнт відчуває будь-яке ураження шкіри, яке може бути пов'язане з набряком або відтіканням рідини з місця ін'єкції, пацієнту слід рекомендувати проконсультуватися зі своїм лікарем, перш ніж продовжити застосування інтерферону бета-1а. Якщо у пацієнта з'явилися множинні ураження, терапію інтерфероном бета-1а слід припинити до повного загоєння. Пацієнти з одиничним ураженням можуть продовжувати лікування за умови не надто великого обсягу некрозу. Спостерігалось безсимптомне підвищення рівнів печінкових трансаміназ (зокрема, аланінамінотрансферази (АЛТ), а у деяких пацієнтів підвищення рівнів печінкових трансаміназ у 5 разів перевищувало верхню межу норми (ВМН). При відсутності клінічних симптомів, сироваткові рівні АЛТ слід перевіряти до початку лікування, на 1, 3 та 6 місяці терапії і періодично у подальшому. При підвищенні рівнів АЛТ у понад 5 разів вище ВМН слід розглянути зменшення дози інтерферону бета-1а. Поступове збільшення дози можливе лише після нормалізування рівнів ферментів. Терапію інтерфероном бета-1а слід починати з обережністю у пацієнтів з тяжкими захворюваннями печінки в анамнезі, з клінічними ознаками активного захворювання печінки, а також у хворих, що зловживають алкоголем або мають підвищені рівні сироваткової АЛТ (у 2,5 разів вище ВМН). Лікування інтерфероном бета-1а слід припинити при виникненні жовтяниці або інших клінічних симптомів дисфункції печінки (див. розділ «Побічні реакції»).
Інтерферон бета-1а, як і інші бета-інтерферони, може викликати тяжкі ураження печінки (див. розділ «Побічні реакції»), включаючи гостру печінкову недостатність. Механізм виникнення випадків симптоматичної дисфункції печінки не відомий. Жодних специфічних факторів ризику не виявлено. З використанням інтерферонів асоціюються відхилення лабораторних показників від норми. Загальна частота виникнення цих порушень є дещо вищою при застосуванні інтерферону бета-1а 44 мкг, ніж інтерферону бета-1а 22 мкг. З огляду на це, окрім стандартних лабораторних аналізів, які зазвичай проводяться для моніторингу стану пацієнтів з розсіяним склерозом, рекомендується здійснювати моніторинг рівнів печінкових ферментів та повний і диференціальний підрахунок клітин крові і тромбоцитів через регулярні проміжки часу (1, 3 і 6 місяців) після початку терапії інтерфероном бета-1а і в подальшому періодично за відсутності клінічних симптомів. Ці аналізи слід проводити частіше, якщо хворому розпочинається терапія інтерфероном бета-1а 44 мкг.
У пацієнтів, які отримують лікування інтерфероном бета-1а, іноді можуть виникати нові або загострюватися існуючі відхилення функції щитовидної залози. Аналізи на функцію щитовидної залози рекомендується проводити на початку терапії і, у випадку наявності відхилень, кожні 6-12 місяців після початку терапії. Якщо результати аналізів відповідають нормі, подальші регулярні аналізи не потребуються, але підлягають проведенню у випадку виникнення клінічних ознак дисфункції щитовидної залози (див. розділ «Побічні реакції»),
З особливою обережністю і під ретельним наглядом слід призначати інтерферон бета-1а хворим з тяжкою нирковою та печінковою недостатністю, а також пацієнтам з тяжкою мієлосупресією. Можливий розвиток сироваткових нейтралізуючіх антитіл до інтерферону бета-1а. Точна частота виникнення антитіл поки не встановлена. Встановлено, що наявність антитіл ослаблює фармакодинамічну відповідь на інтерферон бета-1а (бета-2-мікроглобулін і неоптерин). Хоча клінічне значення індукції антитіл ще повністю не з'ясоване, розвиток нейтралізуючих антитіл пов'язаний зі зниженням ефективності за клінічними ознаками та змінами на магнітній резонансній томографії. У випадку слабкої відповіді на терапію інтерфероном бета-1а і за наявності нейтралізуючих антитіл у пацієнта, лікар повинен переглянути співвідношення користь/ризик щодо продовження терапії інтерфероном бета-1а.
Застосування різних тестів для виявлення сироваткових антитіл і різні визначення позитивності антитіл обмежують можливість порівняння антигенності різних препаратів.
Наявні лише поодинокі дані з безпеки та ефективності, отримані від стаціонарних хворих на розсіяний склероз. Інтерферон бета-1а до цього часу не досліджувався щодо застосування у хворих з первинно-прогресуючим розсіяним склерозом, тому його не слід призначати цій групі пацієнтів. Даний препарат містить альбумін, що є похідним людської крові. Ефективний скринінг донорів і процеси виробництва препарату забезпечують максимально низький ризик передачі вірусних захворювань та патогенів. Жодного випадку зараження вірусними захворюваннями або патогенами через альбумін не зафіксовано.
Застосування під час вагітності та лактації
Вагітність
Наявна обмежена інформація щодо використання інтерферону бета-1а у період вагітності. Наявні дані свідчать про підвищений ризик мимовільного (спонтанного) аборту. З огляду на це, починати терапію інтерферону бета-1а у період вагітності протипоказано (див. розділ «Протипоказання»). Жінкам дітородного вік слід застосовувати відповідні засоби контрацепції. Якщо жінка стає вагітною або планує завагітніти під час прийому інтерферону бета-1а, вона має бути проінформована про потенційну небезпеку, і слід розглянути можливість припинення терапії. Щодо хворих з високою частотою рецидивів до початку лікування, слід зважити ризик тяжкого рецидиву після припинення застосування інтерферону бета-1а у випадку вагітності щодо можливого підвищення ризику мимовільного (спонтанного) аборту.
Лактація
Дані про екскреції препарату в грудне молоко відсутні. З огляду на ймовірність розвитку серйозних побічних реакцій у грудних дітей, слід зробити вибір між скасуванням препарату і припиненням грудного вигодовування.
Застосування у дітей
Безпека та ефективність інтерферону бета-1а при застосуванні у дітей не вивчалися. Однак обмежені опубліковані дані свідчать, що профіль безпеки препарату при застосуванні у підлітків віком від 12 до 16 років дози 22 мкг Інтерферону бета-1а підшкірно три рази на тиждень є подібним до профілю препарату при застосуванні у дорослих (див. «Спосіб застосування та дози»). Існує дуже обмежена інформація щодо застосування інтерферону бета-1а у дітей віком до 12 років, а тому препарат не слід застосовувати для лікування хворих цієї вікової категорії.
Застосування у хворих похилого віку
Клінічні дослідження інтерферону бета-1а не включали достатню кількість осіб віком 65 років і старше для визначення того, чи відрізняється відповідь на терапію у хворих цієї групи від пацієнтів молодшого віку. Загалом, слід здійснювати обережний підбір дози для літніх пацієнтів, як правило, починаючи з нижньої межі дозування, що зумовлено значною частотою порушень печінкової, ниркової або серцевої функції та / або наявністю супутніх захворювань або застосуванням інших лікарських засобів у цій групі хворих.
Вплив на здатність до керування автомобілем та технічними засобами
Побічні реакції з боку центральної нервової системи, пов'язані з використанням інтерферону бета (наприклад, запаморочення), можуть впливати на здатність пацієнта керувати автотранспортом або працювати з механізмами (див. розділ «Побічні реакції»).
Взаємодія з іншими лікарськими засобами та інші форми взаємодії
Жодних досліджень взаємодії інтерферону бета-1а у людей не проводилося.
Повідомлялося, що інтерферони знижують активність печінкових цитохром Р450-залежних ферментів у людини і тварин. Необхідно дотримуватись обережності при призначенні інтерферону бета-1а у комбінації з лікарськими засобами, що мають вузький терапевтичний індекс і кліренс яких значною мірою залежить від печінкової системи цитохрому Р450 (наприклад, антиепілептичні засоби та деякі класи антидепресантів). Необхідно також дотримуватись обережності при одночасному застосуванні будь-яких препаратів, що впливають на систему кровотворення.
Взаємодія інтерферону бета-1а з кортикостероїдами або адренокортикотропним гормоном (АКТГ) систематично не вивчалася. Клінічні дослідження вказують на те, що хворі на розсіяний склероз можуть отримувати інтерферон бета-1а і кортикостероїди або АКТГ під час загострень.
Умови зберігання
Зберігати в оригінальній упаковці в холодильнику при температурі 2 - 8ºС. Не заморожувати.
Захищати від світла.
При амбулаторному використанні пацієнт може дістати інтерферон бета-1а з холодильника і зберігати його за температури не вище 25°С протягом одного періоду до 30 днів. Після цього інтерферон бета-1а слід повернути до холодильника і використовувати до закінчення терміну придатності.
Зберігати в недоступному для дітей місці.
Термін придатності
2 роки. Не використовувати після закінчення терміну придатності, зазначеного на упаковці
Пакування
Розчин для підшкірного введення по 0,5 мл (22 мкг) або по 0,5 мл (44 мкг) в шприцах з голкою, вміщених у пластикові контейнери.
По 3 або 12 контейнерів у картонній коробці разом з інструкцією про застосування.
Умови відпуску. За рецептом.
Виробник: М.Р. Фарма С.А. для Лабораторія Тютор С.А.С.І.Ф.І.А., Аргентина
Адреса: Ав. Хуана де Гарая, 842/48, Буенос-Айрес, Аргентина
У випадку виникнення ускладнень після застосування медичного імунобіологічного препарату необхідно направити термінове повідомлення до:
Управління лікарських засобів та медичної продукції МОЗ України (01021, м. Київ, вул. Грушевського, 7, тел. (044) 253-61-91)
Державного підприємства «Державний експертний центр Міністерства охорони здоров'я України» (03151, м. Київ, вул. Ушинського, 40, тел. (044) 393-75-86), та на адресу виробника.
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Interferon beta-1a - Интерферон бета-1a |
| Код АТХ | L03AB07 |
| Форма выпуска | раствор |
- Авонекс Біоген Айдек (Данія) Мануфактурінг АпС (вторинна упаковка, дозвіл на випуск серії)/Веттер Фарма-Фертигунг ГмбХ і Ко КГ (виробництво нерозфасованої продукції, первинна та вторинна упаковка)/Сілаг АГ (виробництво нерозфасованої продукції, первинна упаковка)
- Бетфер-1а 12 000 000 МО ПрАТ "БІОФАРМА"/ТОВ "ФЗ "БІОФАРМА", Україна/Україна
- Бетфер-1а 6 000 000 МО ПрАТ "БІОФАРМА" (виробництво, первинне та вторинне пакування, контроль якості, випуск серій), Україна
- Бластоферон 12 млн МО БІО СІДУС С.А., Аргентинська Республіка
- Бластоферон 6 млн МО БІО СІДУС С.А., Аргентинська Республіка
- Ребіф Мерк Сероно С.п.А./Мерк Сероно С.А., відділення у м. Обонн (альтернативне виробництво), Італія/Швейцарія

 На распутье дорог: нежелательная беременность - делать или не делать аборт?
На распутье дорог: нежелательная беременность - делать или не делать аборт?
 Роль магния и витамина В6 в организме
Роль магния и витамина В6 в организме
 Молочница (кандидозный вульвовагинит)
Молочница (кандидозный вульвовагинит)
 Что делать, если беременность возможна, но нежелательна?
Что делать, если беременность возможна, но нежелательна?