Соматулин Аутожель 90 мг инструкция, аналоги и состав
| Показания: | Лікування акромегалії при підвищеному рівні циркулюючого гормону росту (GH) та інсуліноподібного фактора росту (IGF-1) після оперативного втручання та/або радіотерапії, або у разі, якщо протипоказані оперативне втручання та/або радіотерапія.Лікування клінічних симптомів, спричинених акромегалією.Лікування нейроендокринних пухлин шлунково-кишкового тракту або підшлункової залози (GEP-NETs) 1-го ступеня диференціювання та підмножини пухлин 2-го ступеня диференціювання (індекс Ki67 до 10%) з первинною локалізацією у середній кишці, підшлунковій залозі або з невідомою первинною локалізацією, при виключенні локалізації з ділянок задньої кишки, у дорослих пацієнтів при нерезектабельних місцевопоширених або метастатичних пухлинах.Лікування клінічних симптомів карциноїдних пухлин. |
| Форма випуска: | Розчин для ін’єкцій пролонгованого вивільнення, 90 мг /шприц по 1 попередньо наповненому шприці для одноразового використання місткістю 0,5 мл з автоматичою захисною системою, 1 голкою (1,2х20 мм) в захисному ковпачку, у багатошаровому пакетику |
| Производитель, страна: | ІПСЕН ФАРМА БІОТЕК, Франція |
| Действующее вещества: | 1 попередньо наповнений шприц містить ланреотид (у вигляді ланреотиду ацетату) 90 мг |
| МНН: | Lanreotide - Ланреотид |
| Регистрация: | UA/13432/01/03з 23.01.2014 по 23.01.2019. Приказ 197 від 16.03.2016 |
| Код АТХ: |
Склад:
діюча речовина: lanreotide;
1 попередньо наповнений шприц містить ланреотид (у вигляді ланреотиду ацетату) 60 мг або 90 мг або 120 мг;
допоміжні речовини: кислота оцтова льодяна, вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій пролонгованого вивільнення в попередньо наповненому шприці. Для глибокого підшкірного введення.
Фармакотерапевтична група. Гормони, що уповільнюють ріст. Код АТС H01C B03.
Клінічні характеристики.
Показання.
Лікування акромегаліїпри підвищеному рівні циркулюючого гормону росту (GH) та інсуліноподібного фактора росту (IGF-1) після оперативного втручання та/або радіотерапії, або у разі, якщо протипоказані оперативне втручання та/або радіотерапія.
Лікування клінічних симптомів, спричинених акромегалією.
Лікування нейроендокринних пухлин шлунково-кишкового тракту або підшлункової залози (GEP-NETs) 1-го ступеня диференціювання та підмножини пухлин 2-го ступеня диференціювання (індекс Ki67 до 10%) з первинною локалізацією у середній кишці, підшлунковій залозі або з невідомою первинною локалізацією, при виключенні локалізації з ділянок задньої кишки, у дорослих пацієнтів при нерезектабельних місцевопоширених або метастатичних пухлинах.
Лікування клінічних симптомів карциноїдних пухлин.
Протипоказання.
Гіперчутливість до соматостатину або споріднених пептидів, а також до будь-якого з компонентів препарату.
Спосіб застосування та дози.
Соматулін Аутожель, розчин для ін’єкцій пролонгованої дії в попередньо наповненому шприці, представлений у трьох дозуваннях: 60 мг, 90 мг, 120 мг.
Акромегалія та лікування симптомів, спричинених нейроендокринними пухлинами
Початок лікування.
Акромегалія
На початку лікування рекомендована доза становить 60-120 мг кожні 28 днів.
Наприклад:
- у пацієнтів, що раніше отримували лікування Соматуліном 30 мг (порошок та розчинник для суспензії для ін’єкцій пролонгованого вивільнення (для внутрішньом’язових ін’єкцій)) кожні 14 днів, початкова доза Соматуліну Аутожелю повинна становити 60 мг кожні 28 днів;
- у пацієнтів, що раніше отримували лікування Соматуліном 30 мг (порошок та розчинник для суспензії для ін’єкцій пролонгованого вивільнення (для внутрішньом’язових ін’єкцій)) кожні 10 днів, початкова доза Соматуліну Аутожелю повинна становити 90 мг кожні 28 днів;
- у пацієнтів, що раніше отримували лікування Соматуліном 30 мг (порошок та розчинник для суспензії для ін’єкцій пролонгованого вивільнення (для внутрішньом’язових ін’єкцій)) кожні 7 днів, початкова доза Соматуліну Аутожелю повинна становити 120 мг кожні 28 днів.
Лікування симптомів, спричинених нейроендокринними пухлинами
На початку лікування рекомендована доза становить 90 мг кожні 28 днів (4 тижні) протягом 2 місяців.
Адаптація лікування.
Необхідно окремо коригувати терапію для кожного пацієнта в спеціалізованому відділенні. Дозу підбирають індивідуально, залежно від реакції пацієнта, яку оцінюють шляхом контролю за рівнем гормону росту (GH) та інсуліноподібного фактору росту (IGF-1) в плазмі, а також на підставі оцінки зміни симптомів.
Акромегалія
Рекомендується:
- зменшити дозу, якщо було досягнуто повного контролю (рівень гормону росту (GH) нижче 1 нг/мг, нормалізація рівня інсуліноподібного фактора росту (IGF-1) та/або зникнення клінічних симптомів),
- залишити дозу без змін, якщо рівень гормону росту (GH) становить 1-2,5 нг/мг;
- підвищити дозу при рівні гормону росту (GH) вище 2,5 нг/мг.
Пацієнтам, у яких на фоні лікування аналогами соматостатину було досягнуто ефективного контролю за захворюванням, можна призначити Соматулін Аутожель у дозі 120 мг кожні 42 або 56 днів.
Лікування симптомів, спричинених нейроендокринними пухлинами
У разі недостатньої реакції, що оцінюється на підставі клінічних симптомів, дозу можна підвищити до 120 мг кожні 28 днів (4 тижні).
Якщо реакція достатня, що оцінюється на підставі клінічних симптомів, дозу можна знизити до 60 мг кожні 28 днів (4 тижні).
Лікування нейроендокринних пухлин шлунково-кишкового тракту або підшлункової залози (GEP-NETs) 1-го ступеня диференціювання та підмножини пухлин 2-го ступеня диференціювання (індекс Ki67 до 10%) з первинною локалізацією у середній кишці, підшлунковій залозі або з невідомою первинною локалізацією, при виключенні походження з ділянок задньої кишки, у дорослих пацієнтів при нерезектабельних місцевопоширених або метастатичних пухлинах
Рекомендована доза становить одну ін’єкцію препарату Соматулін Аутожель 120 мг кожні 28 днів. Лікування препаратом Соматулін Аутожель слід продовжити стільки, скільки необхідно для контролю над пухлиною.
Пацієнти з порушенням функції нирок та печінки.
Зміна дози не потрібна (див. розділ «Фармакокінетика»).
Пацієнти літнього віку.
Зміна дози не потрібна (див. розділ «Фармакокінетика»).
Спосіб введення препарату.
Розчин для ін’єкцій потрібно вводити глибоко підшкірно в верхній зовнішній квадрант сідниці. Ін’єкції повинен проводити медичний працівник. У разі, якщо пацієнти, які лікуються від акромегалії або симптомів, спричинених нейроендокринним пухлинами, отримують стабільну дозу Соматуліну Аутожелю, ін’єкції може проводити сам пацієнт або його близькі після належного тренування, проведеного медичним працівником. При самостійному проведенні ін’єкції пацієнтом, препарат необхідно вводити у верхню зовнішню ділянку стегна. Рішення щодо введення препарату пацієнтом чи особою, що пройшла тренування, приймає лікар. Незалежно від місця введення ін’єкції, шкіру не слід збирати в складку, а голку потрібно вводити швидко на всю її довжину перпендикулярно до поверхні шкіри. Необхідно вводити препарат по черзі в праву та ліву сідниці або стегна.
Правила введення препарату.
Препарат поставляється в готовому для використання попередньо наповненому шприці, оснащеному автоматичною системою захисту, що автоматично фіксується після введення препарату для запобігання уколу голкою після використання.
Рис. 1
Перед використанням.
Примітка: ковпачок (рис. 1а), захисний пристрій ходу поршня (рис. 1б).
Рис. 1а Рис. 1б

Рис. 2
Після використання (голка в захисній системі).
Примітка: захисна система голки (рис. 2).
При введенні препарату дотримуйтесь нижчезазначених рекомендацій.
1. Дістаньте Соматулін Аутожель з холодильника за 30 хвилин до проведення ін’єкції. Не відкривайте пакетик до проведення ін’єкції.
2. Перед тим як відкрити пакетик, переконайтеся, що він непошкоджений і термін придатності препарату не минув (рис. 3). Дата закінчення терміну придатності вказана на картонній коробці і на пакетику. Не застосовуйте препарат після закінчення терміну придатності або якщо упаковка пошкоджена.
Рис. 3
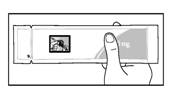
Примітка: mg (мг).
3. Вимийте руки з милом.
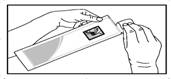
4. Відкрийте пакетик і дістаньте попередньо наповнений шприц (рис. 4).
Рис. 4
5. Виберіть місце ін’єкції: зовнішній квадрант сідниць (якщо ін’єкцію проводить медичний працівник або близька пацієнту людина) (рис. 5а) або верхня зовнішня частина стегна (якщо пацієнт самостійно вводить препарат) (рис. 5б).
Рис. 5а Рис. 5б
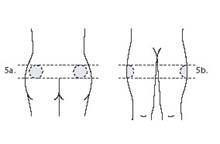
Чергуйте місце ін’єкції (правий та лівий бік) кожного разу, коли вводите препарат.
6. Продезінфікуйте місце передбачуваної ін’єкції, уникаючи розтирання шкіри.
7. Поверніть і зніміть захисний пристрій ходу поршня (рис. 6).
Рис. 6
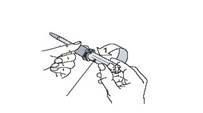
8. Видаліть ковпачок з голки (рис. 7).
Рис. 7
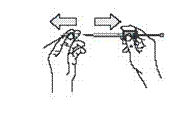
9. Тримайте шкіру навколо місця ін’єкції великим і вказівним пальцями (рис. 8а) або (рис. 8б). Без натискання на шкіру в місці ін’єкції швидко введіть голку на всю довжину (глибокі підшкірні ін’єкції) перпендикулярно до шкіри (рис. 8в).
Примітка: якщо ін’єкцію проводить медичний працівник або близька пацієнту людина (рис. 8а) або якщо пацієнт самостійно вводить препарат (8б).
Рис. 8а Рис. 8б
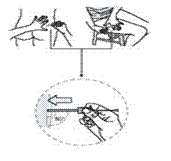
Рис. 8в
10. Вводьте препарат повільно (зазвичай необхідно 20 секунд) з рівномірним тиском на поршень до моменту, коли почуєте клацання.
Примітка: продовжуйте утримувати поршень у натиснутому стані, щоб уникнути спрацювання автоматичної захисної системи (рис. 9).
Рис. 9
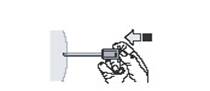
11. Не відпускаючи поршень, витягніть голку з місця ін’єкції (рис. 10).
Рис. 10
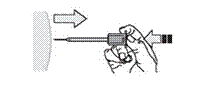
12. Відпустіть поршень. Голка автоматично втягується в захисну систему, де вона буде заблокована назавжди (рис. 11).
Рис.11
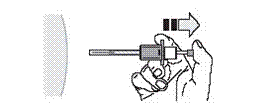
13. Прикладіть сухий ватний тампон або стерильну марлю до місця ін’єкції, щоб запобігти кровотечі. Не слід розтирати й масажувати місце ін’єкції після введення.
14. Утилізуйте використаний шприц згідно з інструкцією, наданою медичним працівником. Не викидайте пристрій в загальне сміття.
Побічні реакції.
Під час проведення клінічних досліджень були зафіксовані побічні реакції у пацієнтів, що хворіють на акромегалію. Побічні реакції подано відповідно класів систем органів та класифікації частоти: дуже поширені (≥1/10); поширені (≥1/100 до <1/10); непоширені (≥1/1000 до <1/100).
Найбільш поширеними побічними реакціями після терапії ланреотидом є порушення з боку шлунково-кишкового тракту (найчастіше-діарея, болі в животі, зазвичай слабовиражені або помірні та тимчасового характеру), жовчнокам’яна хвороба (найчастіше безсимптомна) та реакції в місці введення (біль, вузлики, затвердіння). Профіль побічних реакцій аналогічний для всіх показань.
- Лабораторні показники: поширені-підвищення аланінамінотрансферази (АЛТ)*, відхилення від норми аспартатамінотрансферази (АСТ)*, відхилення від норми аланінамінотрансферази (АЛТ)*, підвищення рівня білірубіну в крові*, підвищення рівня глюкози в крові*, підвищення рівня глікірованого гемоглобіну*, зниження маси тіла*; зменшення рівня ферментів підшлункової залози**, непоширені-підвищення аспартатамінотрансферази (АСТ)*, підвищення рівня лужної фосфатази в крові*, відхилення від норми рівня білірубіну в крові*, зниження рівня натрію в крові*.
- Порушення з боку серцево – судинної системи: поширені – синусова брадикардія*; непоширені – припливи крові*.
- Порушення з боку нервової системи: поширені – запаморочення, головний біль, летаргія**.
- Порушення з боку травного тракту: дуже поширені – діарея, рідке випорожнення*, болі в животі; поширені – нудота, блювання, запор, метеоризм, здуття живота, неприємні відчуття в животі, диспепсія, стеаторея**; непоширені – зміна кольору калових мас*.
- Порушення з боку шкіри та підшкірних тканин: поширені – алопеція, гіпотрихоз*.
- Порушення з боку обміну речовин та харчування: поширені – гіпоглікемія, зниження апетиту**, гіперглікемія, цукровий діабет.
- Загальні порушення та реакції в місці введення: поширені – астенія, стомлюваність, реакції в місці введення (біль, набряк, затвердіння, вузлики, свербіж).
- Порушення з боку гепатобіліарної системи: дуже поширені – холелітіаз; поширені – розширення жовчних протоків.
- Порушення психіки: непоширені – безсоння.
-Порушення з боку опорно-рухового апарату та сполучної тканини: поширені: скелетно м’язовий біль**, міалгія.**
* На основі досліджень, проведених за участю пацієнтів з акромегалією.
** На основі досліджень, проведених за участю пацієнтів з GEP-NETs.
Дослідження безпеки препарату після його виходу на ринок (частота невідома)
З боку шлунково-кишкового тракту: панкреатит.
З боку імунної системи: алергічні реакції (в тому числі ангіоневротичний набряк, анафілаксія, гіперчутливість).
Передозування.
У випадку передозування показана симптоматична терапія.
Застосування в період вагітності або годування груддю.
Дослідження на тваринах не виявили будь-якої тератогенної дії, пов’язаної з ланреотидом, під час органогенезу.
Кількість вагітних, які приймають ланреотид, дуже обмежена. Препарат слід призначати вагітним тільки у разі нагальної потреби.
Невідомо, чи потрапляє даний препарат у грудне молоко. Оскільки багато лікарських засобів потрапляє в грудне молоко, необхідно прийняти рішення щодо припинення годування груддю або припинення застосування препарату, беручи до уваги необхідність для матері лікування препаратом.
Фертильність.
Зниження фертильності спостерігалось у самок щурів за рахунок інгібування секреції гормону росту при застосуванні в дозах, що перевищують терапевтичні дози для людини.
Діти.
Препарат не рекомендується застосовувати у зв'язку з відсутністю інформації щодо безпеки та ефективності.
Особливі заходи безпеки.
Соматулін Аутожель 60 мг, 90 мг, 120 мг, розчин для ін’єкцій пролонгованого вивільнення в попередньо наповненому шприці, призначений для негайного застосування після відкриття захисного пакетика. Важливо чітко дотримуватися правил застосування препарату згідно з інструкцією для медичного застосування препарату. Не використовуйте препарат, якщо захисна упаковка пошкоджена або розкрита. Невикористаний препарат та відходи необхідно утилізувати згідно з інструкціями, отриманими від медичного працівника.
Особливості застосування.
- Ланреотид може знижувати моторику жовчного міхура та спричиняти жовчнокам’яну хворобу. Тому може виникнути потреба у проведенні періодичного огляду. При тривалому лікуванні рекомендується проведення ехографії жовчного міхура перед лікуванням та кожні 6 місяців.
- Ланреотид, подібно до соматостатину та інших його аналогів, пригнічує секрецію інсуліну та глюкагону. Тому у пацієнтів, які проходять лікування ланреотидом, можуть спостерігатися гіпоглікемія та гіперглікемія. Необхідно спостерігати за рівнем глюкози в крові на початку терапії ланреотидом або при зміні дози. Терапію діабету потрібно відповідно відкоригувати. Для пацієнтів, що хворіють на діабет та отримують інсулін, дозу інсуліну на початку знижують до 25 %, потім корегують згідно з рівнем глюкози в крові, який необхідно контролювати з початком лікування.
- Спостерігалось незначне зниження функції щитовидної залози при терапії ланреотидом у пацієнтів, хворих на акромегалію, хоча клінічний гіпотиреоз зустрічається рідко. При прояві симптоматики рекомендується проведення тестування функції щитовидної залози.
- У пацієнтів з акромегалією та первинною тиреотропною аденомою лікування ланреотидом повинно супроводжуватися контролем за об’ємом гіпофізарної пухлини.
- У пацієнтів, що не мають супутніх кардіологічних проблем, ланреотид може спричинити зниження частоти серцевих скорочень, хоча стан не межує неодмінно з брадикардією. У пацієнтів з доклінічною стадією серцевих порушень може проявитися синусова брадикардія. Необхідно обережно починати лікування ланреотидом пацієнтам з брадикардією.
- Прояви значного та тривалого збільшення стеатореї передбачають комплементарне призначення панкреатичних екстрактів.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Під час лікування необхідно дотримуватися обережності при керуванні автотранспортом і заняття іншими потенційно небезпечними видами діяльності, що потребують підвищеної концентрації уваги та швидкості психомоторних реакцій.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Взаємодії, що передбачають дотримання запобіжних заходів у разі застосування.
Циклоспорин (перорально): зниження рівня циклоспорину в крові (зниження всмоктування циклоспорину в кишечнику). Збільшити дозу циклоспорину з проведенням контролю за рівнем циркуляції крові та знизити дози після припинення лікування ланреотидом.
Інсулін, глітазони, репаглінід, препарати сульфонілсечовини: ризик гіпоглікемії та гіперглікемії: зниження потреби в лікуванні діабету після зниження або підвищення секреції ендогенного глюкагону. Необхідно посилити контроль за глікемією пацієнта, а дози препаратів, які застосовують у терапії діабету, слід у разі необхідності коригувати під час лікування ланреотидом.
- Сумісне застосування препаратів, індукуючих брадикардію (наприклад бета-блокаторів) може спричинити адитивний ефект на дещо знижений ритм серцевих скорочень, спричинених ланреотидом. Може бути необхідною корекція такого сумісного застосування препаратів (див. розділ «Особливості застосування»)
- Обмежені опубліковані дані показують, що аналоги соматостатину можуть знижувати метаболічний кліренс сполук, які, як відомо, метаболізуються ферментами-цитохромами Р450. Можливо, це відбувається через пригнічення гормону росту. Оскільки неможливо виключити те, що ланреотид може мати подібний ефект, інші лікарські засоби, які головним чином метаболізуються ферментом CYP3A4 та які мають невисокий терапевтичний індекс (наприклад хінідин), слід застосовувати з обережністю.
Фармакологічні властивості.
Фармакодинаміка.
Ланреотид являє собою октапептид, аналог природного соматостатину. Подібно до природного соматостатину, ланреотид пригнічує ряд ендокринних, нейроендокринних, екзокринних та паракринних механізмів. Виявлена виражена тропність ланреотиду до соматостатинових рецепторів людини SSTR 2 та 5, низька тропність до SSTR 1, 3 та 4. Вважається, що активація соматостатинових рецепторів людини SSTR 2 та 5 є основним механізмом, що лежить в основі пригнічення секреції гормону росту (GH). Ланреотид більш активний, ніж природний соматостатин, та має більш тривалу дію. При цьому виражена селективність відносно гормону росту порівняно з інсуліном дає змогу застосовувати препарат у лікуванні акромегалії.
Ланреотид, подібно до соматостатину, чинить загальну екзокринну антисекреторну дію. Він пригнічує базальну секрецію мотиліну, шлункових інгібуючих пептидів та поліпептидів підшлункової залози, але не чинить значної дії на секрецію травних ферментів або шлункову секрецію. Окрім того, він знижує рівень плазмового хромограніну А та 5-HIAA (5-гідроксиіндолоцтової кислоти) сечової кислоти у пацієнтів із GEP-NETs і підвищеним рівнем цих пухлинних маркерів. Ланреотид значно пригнічує пов’язане з прийомом їжі посилення кровообігу у верхній брижовій артерії та ворітній вені. Ланреотид значно зменшує гідроелектролітичну секрецію в порожній кишці (секрецію води, натрію, калію та хлоридів), яка стимулюється простагландином Е1. Ланреотид знижує рівень пролактину у пацієнтів із акромегалією, які отримують лікування протягом тривалого часу. Ланреотид чинить пригнічувальну дію на екзокринну кишкову секрецію, травні гормони та механізм утворення кліткових протофібрил при його застосуванні в терапії симптомів ендокринних пухлин шлунково-кишкового тракту, особливо карциноїдних пухлин.
Було проведено 96-тижневе рандомізоване, подвійне сліпе, багатоцентрове дослідження третьої фази фіксованої тривалості із застосуванням препарату Соматулін Аутожель пацієнтам із нейроендокринними пухлинами шлунково-кишкового тракту або підшлункової залози для оцінювання антипроліферативної дії ланреотиду. Пацієнти були рандомізовані 1:1 для отримання препарату Соматулін Аутожель 120 мг кожні 28 днів (n=101) або ж плацебо (n=103). Рандомізація була стратифікована за попередньою терапією та наявністю/відсутністю прогресування на вихідному рівні за оцінкою RECIST 1.0 (Критерії оцінювання відповіді при солідних пухлинах) протягом скринінгової фази тривалістю 3-6 місяців. Пацієнти страждали на неоперабельні метастатичні та/або місцевопоширені захворювання з гістологічно підтвердженими добре або помірно диференційованими пухлинами, з первинною локалізацією у підшлунковій залозі (44,6% пацієнтів), середній кишці (35,8% пацієнтів), задній кишці (6,9%) або ж із іншою/невідомою первинною локалізацією (12,7%). 69% пацієнтів із GEP-NET мали пухлини 1-го ступеня диференціювання (G1), що визначалися за індексом проліферації Ki67 ≤ 2% (50,5% від загальної популяції пацієнтів) або ж мітотичним індексом <2 мітози/10 у полі зору (18,5% від загальної популяції пацієнтів), а 30% пацієнтів із GEP-NET мали пухлини в нижньому діапазоні 2-го ступеня (G2), що визначалися за індексом Ki67>2%-≤10%. У 1% пацієнтів відомості про ступінь були недоступні. З дослідження були виключені пацієнти з GEP-NET ступеня G2 із вищим індексом проліферації клітин (Ki 67>10%-≤20%) і нейроендокринними карциномами шлунково-кишкового тракту або підшлункової залози ступеня G3 (індекс Ki 67 > 20%).
Загалом, 52,5% пацієнтів мали печінкове пухлинне навантаження ≤10%, 14,5% мали печінкову пухлинну масу >10, а ≤25% і 33% мали печінкову пухлинну масу >25%.
Основною кінцевою точкою була виживаність без прогресування захворювання (PFS), вимірювана до прогресування захворювання за RECIST 1.0 або ж смерті протягом 96 тижнів після початку лікування. При аналізі PFS використовувалося незалежне централізоване радіологічне оцінювання прогресування захворювання.
Сприятливий вплив ланреотиду на зниження ризику прогресування або смерті був постійним, незалежно від локалізації первинної пухлини, печінковою пухлинною навантаження, попередньої хіміотерапії, вихідного значення Ki67, ступеня диференціювання пухлини або ж інших попередньо визначених характеристик. Клінічно значущий позитивний ефект від лікування препаратом Соматулін Аутожель спостерігався у пацієнтів із пухлинами походженням із підшлункової залози, середньої кишки, або ж іншого/невідомого походження, як у загальній популяції дослідження. Обмежена кількість пацієнтів із пухлинами задньої кишки (14/204) вплинула на складність інтерпретування результатів у цій підгрупі. На підставі наявних даних можна припустити відсутність ефекту ланреотиду в цих пацієнтів. Перехід із плацебо на немаскований Соматулін Аутожель у розширеному дослідженні відбувся у 45,6% (47/103) пацієнтів.
Фармакокінетика.
Фармакокінетичні параметри ланреотиду після внутрішньовенного введення здоровим добровольцям виявили обмежений позасудинний розподіл з рівноважним об'ємом розподілу 16,1 л. Загальний кліренс становив 23,7 л/год, період напіввиведення-1,14 години, а середній час утримання-0,68 години. При проведенні досліджень екскреції менше 5% ланреотиду потрапляли в сечу та менше 0,5 %-у незміненому вигляді в кал, що свідчить про деяку біліарну екскрецію.
Після глибокого підшкірного введення Соматуліну Аутожелю 60 мг, 90мг і 120 мг у здорових добровольців, концентрація ланреотиду збільшується до досягнення середньої максимальної концентрації в сироватці крові 4,25, 8,39 і 6,79 нг/мл. Значення Cmax досягається протягом першої доби після введення через 8, 12 і 7 годин відповідно (середнє значення). У середньому період напіввиведення становить 23,3, 27,4 і 30,1 дня відповідно. Через 4 тижні середні концентрації ланреотиду в сироватці становили 0,9, 1,11 і 1,69 нг/мл відповідно. Абсолютна біодоступність-73,4, 69,0 і 78,4 % відповідно.
Після глибокого підшкірного введення Соматуліну Аутожелю 60 мг, 90 мг і 120 мг у пацієнтів з акромегалією значення середньої максимальної концентрації в сироватці крові 1,6, 3,5 і 3,1 нг/мл досягається протягом першої доби після введення через 6, 6 і 24 години відповідно з подальшим зниженням. Через 4 тижні після введення препарату середні концентрації ланреотиду в сироватці становили 0,7, 1,0 і 1,4 нг/мл відповідно.
Стійкий рівень ланреотиду досягається в середньому після 4 ін’єкцій кожні 4 тижні. В середньому після 4 ін’єкцій кожні 4 тижні середні значення Cmax становили 3,8, 5,7 і 7,7 нг/мл для дозувань 60 мг, 90 мг і 120 мг відповідно, середні значення Cmin становили 1,8, 2,5 і 3,8 нг/мл.
Лінійні фармакокінетичні профілі вивільнення спостерігалися після глибокого підшкірного введення препарату Соматулін Аутожель 60 мг, 90 мг і 120 мг у пацієнтів з акромегалією. Рівень ланреотиду у сироватці, отриманій після трьох глибоких підшкірних ін’єкцій препарату Соматулін Аутожель 60 мг, 90 мг або 120 мг кожні 28 днів схожий з рівнем ланреотиду у сироватці у пацієнтів з акромегалію, які раніше отримували внутрішньом'язові ін’єкції Соматуліну 30 мг кожні 14, 10 і 7 днів відповідно.
У популяції фармакокінетичного аналізу у 290 пацієнтів з GEP-NET, які отримували Соматулін Аутожель у дозі 120 мг, спостерігалося швидке початкове вивільнення з середніми значеннями Cmax 7,49 ± 7,58 нг/мл, що досягалося протягом першого дня після одноразового введення. Статична концентрація була досягнута після 5 ін’єкцій препарату Соматулін Аутожель 120 мг кожні 28 днів і підтримувалася до останньої оцінки (до 96 тижнів після першої ін’єкції). У стаціонарному стані середні значення Cmax були 13,9 ± 7,44 нг/ мл і середні рівні в сироватці складали 6,56± 1,99 нг/мл. Середній період напіврозпаду становив 49,8 ± 28,0 днів.
Ниркова/печінкова недостатність.
Учасники дослідження з гострою нирковою недостатністю показують у середньому 2-кратне зниження загального сироваткового кліренсу з поступовим підвищенням періоду напіввиведення та AUC. В учасників із помірною та гострою печінковою недостатністю спостерігалося зниження кліренсу (30 %). Об’єм розподілу та середній час утримання зросли у всіх дорослих учасників з печінковою недостатністю всіх стадій. Вплив на кліренс ланреотиду не спостерігався в популяції фармакокінетичного аналізу у пацієнтів з GEP-NET, включаючи 165 пацієнтів з легкою та помірною нирковою недостатністю (106 і 59 пацієнтів відповідно), які отримували Соматулін Аутожель. У пацієнтів з GEP-NET і тяжкими порушеннями функції нирок такі дані не вивчалися. У пацієнтів з GEP-NET та порушенням функції печінки (показники за Child-Pugh) такі дані не вивчалися. Немає необхідності змінювати початкову дозу для пацієнтів з нирковою та печінковою недостатністю, оскільки припускають, що концентрації ланреотиду в сироватці у такої групи пацієнтів буде в межах показників сироваткової концентрації, що безпечно переноситься здоровими добровольцями.
Літні пацієнти.
Літні пацієнти показують підвищення періоду напіввиведення та середнього утримання порівняно з даними показниками у здорових молодих добровольців. Немає необхідності змінювати початкову дозу для літніх пацієнтів, оскільки припускають, що концентрація ланреотиду в сироватці у такої групи пацієнтів буде в межах показників сироваткової концентрації, що безпечно переноситься здоровими добровольцями.
У популяції фармакокінетичного аналізу у пацієнтів з GEP-NET, включаючи 122 пацієнти віком від 65 до 85 років, не спостерігалося ніякого впливу віку на кліренс та об’єм розподілу ланреотиду.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості: гелеподібний розчин від білого до блідо-жовтого кольору.
Термін придатності.
2 роки.
Умови зберігання.
Зберігати у недоступному для дітей місці.
Зберігати при температурі від +2 до +8 °С в оригінальній упаковці. Не заморожувати.
Для негайного використання після відкриття пакетику.
Упаковка.
По 1 попередньо наповненому шприцу для одноразового використання місткістю 0,5 мл з автоматичною захисною системою, 1 голкою (1,2х20 мм) в захисному пластиковому ковпачку, у багатошаровому пакетику в картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
ІПСЕН ФАРМА БІОТЕК (IPSEN PHARMA BIOTECH).
Місцезнаходження.
Parc d’activites du Plateau de Signes chemin departemental № 402 83870 SIGNES, France.
Аналоги
Совпадает код ATХ + действующие вещества + форма випуска
| Международное название | Lanreotide - Ланреотид |
| Код АТХ | H01CB03 |
| Форма выпуска | раствор |
- Соматулин Аутожель 120 мг ІПСЕН ФАРМА БІОТЕК, Франція
- Соматулин Аутожель 60 мг ІПСЕН ФАРМА БІОТЕК, Франція

 Запор: от диагностики к рациональной терапии
Запор: от диагностики к рациональной терапии
 Обмен кальция и фосфора в организме и его нарушения
Обмен кальция и фосфора в организме и его нарушения
 Хронический стресс: причины, последствия, защитные действия
Хронический стресс: причины, последствия, защитные действия
 Синдром раздраженного кишечника
Синдром раздраженного кишечника