- Головна
- /
- Статті
- /
- Ендокринологія. Цукровий діабет
- /
- Диабетическая нефропатия – патогенетические лабиринты и возможные терапевтические подходы
Диабетическая нефропатия – патогенетические лабиринты и возможные терапевтические подходы
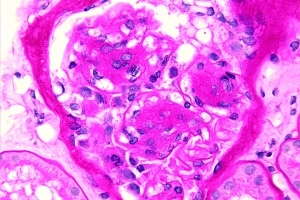
Почечная недостаточность при сахарном диабете (СД) 2 типа – медицинская проблема всемирного масштаба. Во всех странах Запада диабет, главным образом 2 типа, – самая частая причина смерти у больных с терминальной почечной недостаточностью [12]. Увеличение распространенности СД отмечается и в Украине [1, 2]. Сегодня главной задачей клиницистов является ежедневная профилактика, направленная на замедление и по возможности обратное развитие диабетической нефропатии (ДН). Любой прогресс в этой области имеет большое социально-экономической значение.
Предлагаем вниманию читателей концепцию основных механизмов развития ДН с учетом результатов исследования, проводимого в рамках государственной программы «Сахарный диабет» (руководитель программы – директор Института эндокринологии и обмена веществ им. В.П. Комиссаренко, член-корреспондент НАН и АМН Украины, профессор Н.Д. Тронько) в Институте терапии им. Л.Т. Малой АМН Украины.
Давно установлено, что классические особенности ДН, характерные для СД 1 типа, могут не присутствовать у больных диабетом 2 типа со сниженной почечной функцией [10]. В нескольких независимых локальных исследованиях установлено, что у 15-20% больных диабетом 2 типа с терминальной стадией хронической почечной недостаточности (ХПН) протеинурия отсутствовала, а сморщивание почек могло трактоваться как ишемическая нефропатия [5]. На более ранних стадиях поражения почек при СД 2 типа их гистологическая картина имеет намного меньше типичных для диабета 1 типа признаков. Часто встречаются атипичные признаки, включая тубулоинтерстициальные поражения, гиалиноз или склероз клубочков [6].
Специалисты из Гейдельберга сообщают о значительной распространенности снижения уровня клубочковой фильтрации при отсутствии альбуминурии/протеинурии, однако эти данные основывались на печально известных ненадежных значениях клиренса креатинина, к тому же не было исключено влияние лечения на результаты исследования [5]. По нашим данным, у 18% больных СД 2 типа со скоростью клубочковой фильтрации (СКФ) < 60 мл/мин в анамнезе отсутствовали данные об альбуминурии. Отсутствие альбуминурии наиболее часто определяли у пожилых женщин. Даже когда были исключены пациенты, применявшие до исследования блокаторы ренин-ангиотензиновой системы, которые могли уменьшать потери белка с мочой, распространенность нормоальбуминурии оставалась в пределах 15%. Эти данные, конечно, не отменяют исследования мочи на наличие белка и не отвергают патогенетической роли протеинурии. Тем не менее результаты показывают, что проблема более сложная, чем предполагалось ранее. Появляются все новые сведения о роли дополнительных патологических механизмов ДН не только у пожилых больных диабетом 2 типа.
Одним из пусковых моментов развития васкулопатии при СД является образование так называемых AGE – конечных продуктов необратимого гликирования, которые присоединены к свободным аминам на белках, липидах и нуклеиновых кислотах. Их формирование – комплексное и не требует участия ферментов. Рецепторы к AGE (RAGE) определяются во многих тканях организма, в том числе в клетках сосудов. У этих рецепторов имеется короткий эндоплазматический участок, который активизирует внутриклеточные пути, стимулирующие секрецию провоспалительных цитокинов, экспрессию адгезивных молекул VCAM-1, ICAM-1. При СД изменения в эндотелиальных клетках ведут к усилению прокоагулянтных свойств, увеличению экспрессии лейкоцитсвязывающей адгезивной молекулы VCAM-1 и тканевых факторов роста. По полученным в нашем отделе данным, активация нейтрофилов и моноцитов у больных СД развивается задолго до появления клинических признаков нефропатии и связана с постпрандиальной гипергликемией. На 40-й минуте после приема пищи увеличивались исследуемые показатели: экспрессия VCAM – на 38,8%, ICAM – на 16,5%, L-selectin – на 47,8%, спонтанная адгезия нейтрофилов – на 25,3% (р < 0,05). Показатели ICAM и VCAM, L-selectin и адгезии нейтрофилов к исходным значениям снижались на 120-й минуте. Стимуляция адгезивных свойств клеток белой крови способствует их прикреплению к эндотелию и развитию локальных воспалительных реакций и ангиопатии. На начальном этапе гломерулопатии эти изменения не причиняют видимых структурных нарушений, но приводят к вторичной экспрессии цитокинов и других факторов, которые привлекают моноциты/макрофаги, то есть развивается локальный воспалительный процесс в клубочках почек (рис. 1).
Центральная роль RAGE при диабетических осложнениях подтверждена в различных исследованиях in vivo. В экспериментах на животных аминогуанид, ингибитор формирования комплексов продуктов гликозилирования и RAGE, способствовал предотвращению диабетического повреждения капилляров клубочков в почках, сетчатке и нервных волокнах. Кроме того, назначение рекомбинантного RAGE, который вмешивался во взаимодействие системы – конечные продукты гликолиза/RAGE, предупреждало сосудистые поражения у животных с экспериментальным диабетом [8]. Чрезвычайно интересные и обнадеживающие данные получили недавно R. Utimura еt al., которые показали, что mycophenolate mofetil (MMF) предотвращает повреждение клубочков у крыс с диабетом [16]. Результаты исследования свидетельствуют, что MMF препятствовал развитию протеинурической гломерулопатии, подавлял активность макрофагов на ранней стадии болезни, не оказывая существенного влияния на гликемический профиль и общий иммунологический статус. Это может свидетельствовать о том, что те же самые клеточные механизмы участвуют как в иммунном, так и неиммунном повреждении клубочков. Следовательно, иммуносупрессивные препараты можно использовать в лечении различных по механизмам развития гломерулопатий.
Независимо от этиологии заболевания большинство прогрессирующих заболеваний почек приводят к необратимой потере их функции и терминальной ХПН. Основным морфологическим признаком терминальной ХПН является появление тубулоинтерстициального фиброза, который ассоциируется в настоящее время с плохим долгосрочным прогнозом и характеризуется прогрессирующим накоплением белков внеклеточного матрикса (ВМ), таких как коллагены 1 и 4 типов, фибронектин, ламинины в тубулоинтерстициальном пространстве. Повреждение канальцевых клеток вносит умеренный вклад в продукцию ВM, первичными матрикспроизводящими клетками в почечном интерстиции считаются миофибробласты. Здоровые почки лишены миофибробластов, только единичные клетки предшественники фибробластов могут быть найдены в интерстициальном пространстве.
Происхождение почечных интерстициальных миофибробластов в течении фиброгенеза – тема отдельного обсуждения, что обусловлено их центральной ролью в деструкции почечной паренхимы. Имеющиеся в настоящее время доказательства дают возможность предполагать по крайней мере четыре возможных источника этих клеток: активированные пролиферирующие резидентные интерстициальные фибробласты, перемещенные периваскулярные клетки, циркулирующие мезенхимальные клетки и трансдифференцированные канальцевые эпителиоциты. Исследования in vivo показали, что пролиферация интерстициальных фибробластов in situ в основном встречается после повреждения [14]. При интенсивном фиброгенезе увеличение количества фибробластов сопровождается их преобразованием в матрикспроизводящий фенотип миофибробласта. Еще в работах W.A. Border показано, что регулятором фиброгенеза в почечном интерстиции и других паренхиматозных органах является трансформирующий фактор роста-β1 (ТФР-β1) [4]. Однако другие клетки и межклеточные медиаторы также играют важную роль. Так, S. Lam и соавт. показали, что фибробласты почек при их экспозиции в среде с высоким содержанием глюкозы могут увеличивать синтез фибронектина и коллагена III типа независимо от эндогенного ТФР-β1 [9].
Большое значение в развитии фиброгенеза в почках придается макрофагальной инфильтрации. Предполагается, что эти клетки привлекаются в почечный интерстиций перитубулярными градиентами хемокинов или непосредственно через аутокринные и паракринные механизмы. Фактор некроза опухоли-α и интерлейкин-1a влияют на канальцевые клетки, повышая секрецию моноцитарного протеина-1, который привлекает и активизирует макрофаги, замыкая порочный круг, поддерживающий инфильтративный процесс. Связывание лейкоцитарного антигена на поверхности макрофагов с межклеточной адгезивной молекулой-1 (ICAM-1) канальцевых клеток ведет к ТФР-β-опосредованной активации фиброгенной программы в канальцевых клетках. Одним из перспективных направлений профилактики интерстициальной макрофагальной инфильтрации могло бы быть редуцирование паракринных или прямых межклеточных взаимодействий воспалительных клеток с резидуальными почечными. Установлено, что статины оказывают плейотропный эффект через ядерный фактор транскрипции NF-kb, как и преднизолон. По нашим данным, аторвастатин даже при непродолжительном применении (14 дней) достоверно снижает показатели экспрессии ICAM на 12,5%, VCAM на 11,6%, адгезию нейтрофилов на 12,7%. Более выраженное снижение показателей экспрессии адгезивных молекул и адгезии нейтрофилов отмечено в группе больных, принимающих аторвастатин на протяжении трех месяцев. При подтверждении этих данных статины могли бы получить еще одно показание для лечения больных с заболеваниями почек.
Тубулоинтерстициальный фиброз характеризуется не только прогрессирующим накоплением белков ВM, но и нарушением его расщепления. В процессе деградации ВM принимают участие две основные ферментные системы: матричные металлопротеиназы (ММ) и система активации плазминогена. Эти два пути тесно связаны и функционируют параллельно. Урокиназный и тканевой активаторы плазминогена конвертируют плазминоген в плазмин, который, в свою очередь, активирует ММ. Этот каскад регулируется ингибитором активатора плазминогена-1 (ИАП-1), который, по-видимому, играет ключевую роль в развитии почечного фиброза, как описано в множестве недавних исследований. Вместе с тем необходимо помнить, что на ингибитор активатора плазминогена прямое влияние оказывает брадикинин [11]. Индукция ИАП-1 при множестве заболеваний почек, приводящих к фиброзу и терминальной ХПН, делает ингибирование экспрессии и/или активности ИАП-1 перспективной терапевтической мишенью (рис. 2).
Долгое время полагали, что основным стимулятором образования ангиотензина II (Анг-II) – мощнейшего вазоконстриктора и провоспалительного цитокина – является ангиотензинпревращающий фермент (АПФ). В огромном количестве данных, опубликованных за прошлые два десятилетия, показано, что практически единственной группой препаратов, задерживающих почечный фиброз в моделях на животных и оказывающих антифиброзное действие в клинике, являются ингибиторы АПФ [13]. Однако в последние годы было установлено, что Анг-II может образовываться по альтернативному пути, где ключевой фермент – химаза. По нашим данным, у больных ДН активность химазы повышена по сравнению с контрольной группой. Для блокирования эффектов Анг-II предпочтительным направлением считается сочетанная терапия с применением ингибиторов АПФ, блокаторов рецепторов к Анг-II. Фармакологические эффекты ингибиторов АПФ долго приписывали блокаде конверсии ангиотензина I в Анг-II, однако АПФ также расщепляет биологически активный брадикинин. Особо необходимо отметить, что активность АПФ по отношению к брадикину в 10 раз выше, чем к Aнг-I [12]. Действительно, как показали исследования на животных и у людей, концентрация брадикинина после лечения ингибиторами АПФ увеличивается, и в настоящее время накоплено достаточно доказательств, свидетельствующих о его защитном эффекте. Данные исследований in vitro показали, что брадикинин через β2- рецепторы стимулировал активность активатора плазминогена. Это позволяет предположить, что антифиброзное влияние брадикинина связано с β2-рецепторным каскадом активации плазминогена.
При выборе тактики лечения больных ДН необходимо учитывать еще одного «участника» биохимических превращений. В расщеплении брадикина принимает участие не только АПФ (кининаза-II), но и кининаза-I. По нашим данным, активность карбоксипептидазы N (КП-N) у больных с нефропатией была повышена на 15-17%. Механизмы ее активации требуют дальнейших исследований. Установленные нами однонаправленные, по-видимому, генетически детерминированные изменения исследуемых систем – повышение в крови активности КП-N (кининазы-I) и АПФ (кининазы-II) – сопровождаются увеличением содержания в плазме крови ангиотензина II, усиливая распад брадикина.
И, наконец, еще один лабиринт, без блуждания по которому при выборе тактики лечения современному врачу не обойтись. Нет такой клинической дисциплины в медицине, где в последние десятилетия не исследовалась бы система L-аргинин/оксид азота. И по праву. Огромная площадь сосудистого эндотелия, его мощнейший потенциал как эндокринного и паракринного органа, наличие васкулопатии практически при всех заболеваниях внутренних органов вынуждают исследователей и врачей продолжать поиски путей регуляции этой системы. Среди механизмов прогрессирования ДН большое значение придают гемодинамическим нарушениям в почках, в возникновении которых особая роль отводится изменениям метаболизма оксида азота.
B. Brenner установил, что несмотря на значительное снижение массы функционирующих нефронов почки некоторое время поддерживают гомеостаз благодаря адаптационным изменениям – увеличению скорости клубочковой фильтрации и эффективному почечному плазмотоку [3]. Однако внутриклубочковая гипертензия приводит к увеличению размеров гломерул и объема мезангиального матрикса, гиалинизации и склерозу клубочков с последующим развитием ХПН. Возникающая при этом ишемия паренхимы почек приводит к нарушению окислительно-антиоксидантного гомеостаза, нарушению метаболизма оксида азота и к артериальной гипертензии.
При прогрессирующих нефропатиях нарушение локальных и системных проявлений действия NO может быть обусловлено несколькими механизмами: ремоделированием сосудов, нарушением соотношения NO-синтаз, изменением направлений метаболизма оксида азота, связыванием его в буферных депо. Недавно было показано, что при воспалительных и метаболических нарушениях в регуляции системы L-аргинин/оксид азота принимает участие семейство NO-связанных молекул, взаимодействие которых до настоящего времени недостаточно изучено у больных с заболеваниями почек. Биологическая активность NO in vivo определяется не только уровнем синтеза, но и уровнем расщепления и/или взаимодействия с другими компонентами крови, такими как молекулы, содержащие функциональные сульфгидрильные группы (рис. 3). Прежде всего, циркулирующий пул NO образует S-нитрозотиолы, которые рассматривают как буферную систему, играющую важную роль в хранении и транспортировке оксида азота. Особенно важно то, что S-нитрозотиолы способны выделять NO в местах их физиологической необходимости [7]. Это выделение может быть опосредовано ионами металлов, аскорбатом, тиоловыми соединениями и несколькими ферментами, включая плазменную глутатионпероксидазу. В последние годы большое значение в снижении эндотелийзависимой вазодилатации отводится внутриклеточному оксидантному стрессу, так как NO может реагировать с супероксидным анионом и формировать чрезвычайно активное промежуточное вещество – пероксинитрит, который, в свою очередь, может вступать в реакцию с тирозиновыми остатками, образуя нитротирозин и тиолы альбумина или глутатиона, S-нитрозотиолы. Таким образом, взаимодействие с тиолами может предотвратить накопление пероксинитрита в токсических концентрациях, оценить факторы, потенциально вовлеченные в этот процесс, включая окислительный стресс и воспалительный статус.
Наши результаты показали, что плазма больных ДН содержит значительно более высокие уровни S-нитрозотиола, чем плазма здоровых людей, что может быть связано со стимуляцией мезангиальных клеток и активацией индуцибельной NO-синтазы на этапе ранних повреждений при ДН, что приводит к резкому, токсическому повышению NO в почках. Содержание L-аргинина, наоборот, было значительно снижено, возможно, в связи с эффектом потребления. Уровни асимметричного диметиларгинина (ADMA) в плазме больных ДН с микроальбуминурией были увеличены в 2-3 раза по сравнению со здоровыми в контрольной группе. Учитывая тот факт, что АDMА является блокатором NO-синтаз [18], это может быть связано с его защитной ролью при инициации ДН, однако необходимы дальнейшие исследования по определению вида NO-синтаз, на которые он преимущественно оказывает угнетающее влияние, и по его содержанию при различных стадиях ДН. Возможно, что АDMА угнетает и конституциональную NO-синтазу, способствуя вазоконстрикции, тогда необходимы поиски методов его снижения. Кроме того, плазменные уровни S-нитрозотиола отрицательно коррелировали с уровнем нитрита и показателями антиоксидантной системы крови. Повышение плазменных концентраций S-нитрозотиола свидетельствует о наличии в циркулирующей крови метаболитов NO, имеющих потенциальную биологическую активность и, таким образом, позволяет предположить отсутствие количественного дефицита NO в буферном состоянии у больных ДН. Повышение плазменных уровней S-нитрозотиола может быть связано с нарушением антиоксидантной защиты, так как у больных ДН до лечения активность глутатионпероксидазы (ГПО), которая принимает участие в расщеплении нитрозотиолов и выделении NO, была снижена в сравнении с контролем на 19,3 %. После лечения с применением ингибиторов АПФ, блокаторов рецепторов к Анг-II и антиоксидантов (w-ненасыщенные жирные кислоты, глутаргин) содержание S-нитрозотиола уменьшалось одновременно со снижением артериального давления, активность ГПО повышалась. По-видимому, васкулопатия при диабетической нефропатии приводит к длительному перенапряжению системы L-аргинин/NO со снижением биодоступности оксида азота, что играет критическую роль в прогрессировании заболеваний почек и стабилизации гипертензии. Комбинированная терапия способствует уменьшению напряженности исследуемых систем регуляции и улучшению клинического течения заболевания.
Таким образом, патогенетические пути развития ДН требуют особого внимания при проведении специфических целенаправленных вмешательств у больных СД. Наряду с общепринятыми рекомендациями экспертов ВОЗ по лечению таких больных (АД должно быть не выше 130/70 мм рт. ст.; гликемия утром до еды – 5,1-6,5 ммоль/л; гликированный гемоглобин – <7%; максимально возможное снижение белка в моче) необходимо обращать внимание на ряд моментов, которые очевидны для нефрологов и могут сигнализировать об опасности:
- при СД 2 типа недостаточно исследовать мочу на наличие белка, необходимо учитывать возможность неальбуминурического компонента ДН и измерять уровень клубочковой фильтрации для оценки функции почек;
- сочетанное применение ингибиторов АПФ и блокаторов ангиотензиновых рецепторов позволяет более эффективно корректировать влияние ангиотензина II на развитие ДН, нивелируя влияние химазы;
- ингибирование воспалительного компонента до появления лекарственных форм в виде моноклональных антител может осуществляться назначением статинов;
- применение антиоксидантов наряду с уменьшением содержания провоспалительных цитокинов и ангиотензина II cпособствует высвобождению оксида азота из его буферного пула, снижению АД и улучшению микрогемодинамики в почках.
Список литературы находится в редакции.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Поражение почек при сахарном диабете 2 типа: взгляд нефролога
Поражение почек при сахарном диабете 2 типа: взгляд нефролога
 Эффективные средства терапии сахарного диабета и методы его профилактики (начало)
Эффективные средства терапии сахарного диабета и методы его профилактики (начало)
 Особенности инфекций мочевых путей у пациентов с сахарным диабетом
Особенности инфекций мочевых путей у пациентов с сахарным диабетом
 По материалам 42-го конгресса Европейской ассоциации по изучению сахарного диабета
По материалам 42-го конгресса Европейской ассоциации по изучению сахарного диабета