- Головна
- /
- Статті
- /
- Інфекційні захворювання
- /
- Прионовые инфекции человека
Прионовые инфекции человека
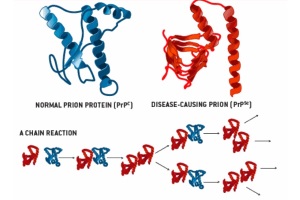
По сравнению с другими патогенами человека предложенный репликативный цикл прионов обезоруживающе прост. Он осуществляется трансформацией единичного белка – нормального клеточного протеин-приона PrPC (от cellular – клеточный) – в инфекционную форму, ассоциированную с заболеваниями и обозначаемую как PrPSc (от названия болезни овец – scrapie).
тематический номер: ИНФЕКЦИИ В ПРАКТИКЕ ВРАЧА
Последующая агрегация PrPSc и, вероятно, фрагментация агрегатов приводит к увеличению количества репликативных единиц. Хотя формальных подтверждений этой модели не существует, многочисленные доказательства указывают, что наличие патогенного прионового кода в информационной РНК не влияет на репликацию прионов. Несмотря на простоту репликативного процесса, фенотипические проявления прионовой инфекции у человека чрезвычайно разнообразны и включают спорадические, наследственные и приобретенные формы болезни Крейтцфельда-Якоба. Кроме того, прионовые инфекции встречаются у разных представителей фауны и могут распространяться как внутри отдельного вида, так и при передаче от одного вида к другому [5].
Трансмиссивные губчатые энцефалопатии (ТГЭ), или прионовые инфекции, – фатальная нейродегенеративная патология, встречающаяся у человека и многих видов животных. Хотя ТГЭ морфологически и патофизиологически во многом подобны другим прогрессирующим энцефалопатиям, таким как болезнь Альцгеймера и Паркинсона, их уникальность состоит в возможности передачи инфекции при профилактических прививках и употреблении в пищу контаминированного материала.
Первыми признаками ТГЭ являются когнитивные расстройства и атаксия. При гистологическом исследовании определяется губчатая дегенерация головного мозга при активированных астроцитах и микроглии. Эти изменения сопровождаются накоплением резистентной к протеазам формы протеин-приона PrPSc. Клеточная форма PrPС – чувствительный к протеазам сиалогликопротеин, связанный с мембраной через гликозилфосфатидилинозитольный остаток. Многие данные говорят в пользу того, что патологический протеин-прион является важной составляющей инфекционного агента, вызывающего ТГЭ [5, 6].
Наиболее распространенная ТГЭ у человека – болезнь Крейтцфельда-Якоба (БКЯ), классифицируемая как спорадическая (СпБКЯ), семейная (СБКЯ), ятрогенная (ЯБКЯ) и вариантная (ВБКЯ). Спорадическая БКЯ встречается редко с равномерной распространенностью по всему миру. В странах, где унифицированно проводится регистрация этого заболевания, распространенность СпБКЯ составляет от 0,6 до 1,2х10–6, хотя сообщается и о более высоких цифрах.
Этиология СпБКЯ до сих пор не ясна: не обнаружено каких-либо экзогенных или эндогенных причин этого заболевания. Семейные формы болезни представляют собой наследуемую по аутосомно-доминантному типу патологию, связанную с мутациями гена PRPN, который кодирует синтез протеин-приона. Напротив, ятрогенные случаи объясняют нейрохирургическими вмешательствами, трансплантацией тканей, назначением гормонов, полученных от зараженных доноров с нераспознанной ТГЭ.
В 1996 г. в Соединенных Штатах была обнаружена новая форма ТГЭ, названная впоследствии вариантной. Биологические и гистопатологические данные свидетельствуют, что ВБКЯ развивается при передаче прионов губчатой энцефалопатии крупного рогатого скота человеку.
ТГЭ встречаются у многих видов животных и включают скрапи овец, коровье бешенство, ТГЭ разводимых норок, хроническую энцефалопатию оленей и лосей. Случаи ТГЭ у домашних животных, пологорогих жвачных в зоопарках и человекообразных обезьян, как правило, являются следствием передачи коровьего бешенства [5].
Предполагаемые функции PrPC
Генно-инженерные мыши, лишенные PrPC, хотя и резистентны к прионовой инфекции, но обладают неустойчивым фенотипом. Хотя исследования с использованием лабораторных мышей значительно прояснили понимание природы ТГЭ, неустойчивый фенотип животных оставил главный вопрос без ответа: зачем нужен белок, эволюционно сохранившийся среди многочисленных млекопитающих, единственной функцией которого является индукция прионовой инфекции? Пока нет недвусмысленного толкования функции PrPC, исследователи продолжают предлагать различные объяснения. Так, существует гипотеза, рассматривающая PrPC как сигнал-преобразующую молекулу. Структурное сходство между PrPC и интегральными сигнальными пептидазами клеточной мембраны позволяет предположить, что PrPC может действовать, как протеаза. Из-за способности PrPC связывать медь некоторые исследователи считают PrPC супероксиддисмутазой, однако пока эта возможная функция PrPC не может быть подтверждена in vivo.
Кроме того, существует ряд связывающих PrPC белков, которые могут вследствие этого быть частью функционального каскада, запускаемого или поддерживаемого PrPC. Неполный список таких белков включает антиапоптотический протеин Bcl-2, кавеолин, белок-предшественник рецепторов ламинила, плазминоген, молекулу адгезии нейронов.
Недавно было опубликовано исследование, в котором изучалась роль PrPC во внедрении бактерий в клетки человека. Согласно полученным данным PrPC может взаимодействовать с пирогенным белком Brucella abortus Hsp60 и, следовательно, принимать участие в неспецифических Hsp60-зависимых защитных механизмах [5].
Природа инфекционного агента
В 1960 г. стало известно, что прионы фундаментально отличаются от ранее известных патогенов, т. к. стерилизация путем разрушения нуклеиновой кислоты в данном случае невозможна. Гипотеза, согласно которой прионы могут состоять только лишь из одних протеинов, была впервые выдвинута Griffith в 1967 г. В последующем было показано, что резистентная к протеазам форма белка прионов является основным компонентом инфекционной фракции. Считается, что прионы не содержат нуклеиновых кислот и состоят исключительно из PrPSc – неправильной конструкции резистентной протеазам изоформы нормального протеина PrPC (рис. 1), а инфекция распространяется простым увеличением массы и аутокаталитической конформационной конверсией клеточного протеин-приона в ассоциируемый с заболеванием PrPSc. Однако истинный способ распространения PrPSc остается загадкой по сей день. Существует, по крайней мере, два возможных объяснения этого феномена.
Согласно первой теории мономерный PrPSc сообщает свою конформацию мономерному PrPC, в результате чего образуется две молекулы PrPSc (рис. 2). Это подразумевает, что один белок способен вызывать изменение третичной структуры другого. И хотя это теоретически возможно, экспериментальных доказательств пока нет.
Другая теория заявляет, что PrPSc и PrPC сосуществуют в равновесии, причем в здоровом организме это равновесие может быть резко сдвинуто в сторону PrPSc исключительно малым количеством PrPSc. В случае прионовой инфекции высокоупорядоченные агрегаты PrPSc могут действовать как инфекционные агенты и способны полимеризировать мономерные молекулы PrPSc в подобные агрегаты. Существует мнение, что белок PrPSc способен вызывать заболевание тогда, когда он находится в форме высокоупорядоченных агрегатов. Эта теория также далека от доказанности, существующие экспериментальные данные в ее поддержку получены в модели прионовой инфекции на дрожжевых грибах.
Прионы очень устойчивы к различным факторам (табл.) [5]. Наиболее эффективные воздействия оказываются в дозах, которые денатурируют практически все белки. Иными словами, из всего живого прион погибает последним.
Клиническая диагностика прионовых инфекций человека
Диагноз прионовой инфекции основан на определении клинических признаков и симптомов, а также на результатах вспомогательных методов обследования. Долгое время электроэнцефалография оставалась методом выбора при диагностике ТГЭ. Из-за низкой чувствительности данного исследования его целесообразность была поставлена под вопрос. В качестве альтернативы было предложено определение титра маркеров нейронального повреждения в спинномозговой жидкости, повышение которого позволяет верифицировать предполагаемый диагноз прионовой инфекции.
Наиболее перспективен в этом отношении оказался протеин 14.3.3, но повышенные его титры встречаются также и при таких заболеваниях, как энцефалит, ишемический инсульт, паранеопластические неврологические расстройства, поэтому удовлетворительная чувствительность и специфичность может быть достигнута только в специально отобранной популяции. Недостатки данного метода не позволили рекомендовать его для скрининговых обследований на прионовые инфекции.
Новейшие открытия в магнитно-резонансной нейровизуализации могут помочь в установлении специфических признаков прионовой инфекции. В случае вариантной БКЯ при МРТ определяют симптом подушки таламуса, специфичный для данной формы заболевания и подтверждаемый у 75% больных ВБКЯ. Для спорадической БКЯ чувствительность и специфичность магнитно-резонансной нейровизуализации еще выше, что позволяет использовать ее для неинвазивной верификации диагноза прионовой инфекции [5, 3].
Гистоморфологическое и биохимическое исследование биоптатов возможно только при соблюдении адекватных мер безопасности и проводится в случаях, когда необходимо исключить наличие заболеваний, для которых существуют эффективные терапевтические возможности. До недавнего времени считалось, что PrPSc может быть обнаружен только в тканях ЦНС пациентов с прионовой инфекцией. Сегодня доказано наличие PrPSc в лимфоидной ткани у пациентов с вариантной БКЯ, в слизистой верхних носовых ходов и мышечной ткани у пациентов со спорадической БКЯ [1]. Будущие исследования прояснят перспективу использования данных методик в диагностике прионовых инфекций человека.
Спорадическая БКЯ
Спорадическая БКЯ – быстро прогрессирующая деменция, обычно приводящая к смерти в течение 12 месяцев от начала заболевания. Начальные симптомы включают когнитивные расстройства, нарушения сна, поведенческие отклонения. С прогрессированием болезни к указанным признакам присоединяются экстрапирамидные и пирамидные симптомы, атаксия, нарушение зрения и, как правило, развивается миоклонус.
Пациенты с СпБКЯ в терминальной фазе болезни не выходят из состояния акинетического мутизма вплоть до летального исхода. В отличие от других заболеваний с деменцией, таких как болезнь Альцгеймера и Паркинсона, при которых заболеваемость возрастает с возрастом, пик заболеваемости СпБКЯ приходится на возраст между 55 и 65 годами.
Выделяют несколько форм СпБКЯ в зависимости от определенных генетических, биохимических, нейропатологических и клинических признаков. При типичной, быстро прогрессирующей форме СпБКЯ определяют гомозиготность по метионину в кодоне 129 и PrPSc с относительно длинным (поэтому медленно мигрирующим) негликозилированным фрагментом. У пациентов с атипичной СпБКЯ часто определяют гетерозиготность кодона 121 и более короткий (быстро мигрирующий) фрагмент PrPSc [2, 4].
Наследственные прионовые инфекции
Эта группа состояний может быть разделена на 3 фенотипа: семейная БКЯ, синдром Герштманна-Штраусслера-Шайнкера и фатальная семейная инсомния. Тип наследования при всех указанных заболеваниях, связанных с мутациями в PRNP, – аутосомно-доминантный. СБКЯ не имеет характерных клинических признаков и может быть диагностирована установлением последовательности в PRNP. Пенетрантность мутаций PRNP, как правило, высокая, хотя существование здоровых 80-летних носителей таких мутаций подтверждает наличие других, не связанных с PRNP модифицирующих факторов.
Синдром Герштманна-Штраусслера-Шайнкера имеет уникальный нейропатологический признак – обширные мультицентрические очаги протеин-прионов. Описаны различные мутации при данном синдроме, наиболее часто определяют мутации P102L и G131V. Фатальная семейная инсомния выражается в глубоком расстройстве нормального цикла сон–бодрствование, инсомнии и повышенной симпатической активности. Клинико-патологические признаки состоят в мутации D178N с обязательным сочетанием гомозиготности по метионину в кодоне 129 [4, 5].
Приобретенные прионовые инфекции
Ятрогенная БКЯ развивается при заражении прионами во время нейрохирургических вмешательств (например, имплантация твердой мозговой оболочки донора-человека, пересадка роговицы) и при терапии с использованием трупных экстрактов гипофиза. ЯБКГ встречается редко, на сегодня сообщено о менее 300 таких пациентов. Большинство случаев связано с имплантацией твердой мозговой оболочки и инъекциями гормона роста.
Место прионовой инокуляции определяет продолжительность инкубационного периода. Например, прямое интрацеребральное воздействие прионов или пересадка контаминированной твердой мозговой оболочки ассоциированы с коротким инкубационным периодом (16-28 мес), в то время как периферическая инокуляция определяет длительный период до начальных симптомов (от 5 до 30 лет).
Кроме того, существует мнение, что путь распространения прионов влияет на клиническую картину. В случаях с пересадкой твердой мозговой оболочки и инъекциями гормона роста ЯБКЯ развивается с преимущественно атаксическим фенотипом, при поступлении прионов непосредственно в ЦНС инициальным симптомом является деменция.
Вариантная БКЯ. Это относительно новое заболевание человека, о котором впервые было сообщено в 1996 г. Согласно последним данным, ВБКЯ развивается при передаче прионов губчатой энцефалопатии крупного рогатого скота человеку. С 1996 по 2001 гг. распространенность ВБКЯ в Великобритании увеличивалась каждый год, вызывая опасения грядущей эпидемии. После 2001 г. наметилась тенденция к стабилизации заболеваемости, отдельные случаи вариантной БКЯ регистрировались за пределами Британии [7]. Несмотря на то что прогноз в плане будущей распространенности ВБКЯ все еще остается неопределенным, существует всевозрастающая вероятность, что количество пациентов с ВБКЯ будет ограничено.
Специфический клинико-патологический профиль вариантной ВБКЯ облегчает диагностику. По сравнению со спорадической БКЯ пациенты с вариантной БКЯ намного моложе (смерть от заболевания наступает в среднем в возрасте 29 лет). Начальные проявления и продолжительность болезни также различны. Около 60% пациентов с ВБКЯ имеют психиатрические симптомы, заболевание длится в среднем 14 месяцев; при СпБКЯ ранние психиатрические симптомы встречаются редко, болезнь протекает остро (смерть наступает в среднем через 6 месяцев после появления первых симптомов). Нейропатологическое исследование ЦНС пациентов с вариантной БКЯ выявляет обширные очаги протеин-прионов, часть которых окружена вакуолями (рис. 3) [5].
Терапевтические подходы
Несмотря на проведенные исследования с предполагаемыми прионостатическими веществами, доказанно эффективного лечения прионовых инфекций пока не существует. Оптимизма могут добавить проводимые в настоящее время исследования, в которых изучаются возможные терапевтические подходы для предупреждения развития инфекции.
Один из таких подходов – профилактика заболевания после инокуляции, направленная на предотвращение транспорта прионов в ЦНС по периферическим нервам. Поскольку известны предпосылки эффективного транспорта прионов в ЦНС, такие как интактная лимфоидная система и экспрессирующие PrPC периферические нервы, разрабатываются способы остановки тока прионов на уровне лимфоидных органов или периферических нервных волокон.
Другой подход – терапия, направленная на излечение, при невозможности – паллиативная терапия. Так как нейродегенеративные заболевания, в том числе прионовые инфекции, всегда сопровождаются структурным повреждением ЦНС, при манифестирующей деменцией прионовой инфекции единственно возможным средством терапии является замещение поврежденной ткани головного мозга путем регенерации или трансплантации. Исследования со стволовыми клетками продолжаются, и, возможно, этот метод лечения сможет помочь многим больным с прионовой инфекцией.
Паллиативная терапия, с другой стороны, не претендует на полное излечение и проводится с целью продления и улучшения качества жизни таких пациентов путем уменьшения выраженности когнитивных расстройств. Исследования в этой области направлены на поиск веществ, способных предотвратить прямую или непрямую трансформацию PrPC в PrPSc; в идеале в доклинических испытаниях они должны быть эффективны in vitro и in vivo.
Сегодня уже проводятся исследования с несколькими потенциальными ингибиторами образования PrPSc [5]. Большая часть этих веществ, несмотря на их эффективность, не может применяться с лечебными целями, однако терапевтический потенциал некоторых низ них не вызывает сомнения. Раздел науки, изучающий прионы, развивается настолько стремительно, что, возможно, в недалеком будущем будут доступны эффективные фармакологические препараты для лечения прионовых инфекций.
Литература
- Aguzzi A., Glatzel M., Montrasio F., Prinz M., Heppner F.L. Interventional strategies against prion diseases. Nat Rev Neurosci. 2001; 2:745-749.
- Alperovitch A., Zerr I., Pocchiari M., et al. Codon 129 prion protein genotype and sporadic Creutzfeldt-Jakob disease. Lancet. 1999; 353:1673-1674.
- Budka H., Aguzzi A., Brown P. et al. Neuropathological diagnostic criteria for Creutzfeldt-Jakob disease (CJD) and other human spongiform encephalopathies (prion diseases). Brain Pathol. 1995; 5:459-466.
- Gambetti P., Kong Q., Zou W., Parchi P., Chen S.G. Sporadic and familial CJD: classification and characterisation. Br Med Bull. 2003; 66:213-239.
- Glatzel M., Ott P.M., Lindner T. et al. Human prion diseases: epidemiology and integrated risk assessment. Lancet Neurol. 2003; 2:757-763.
- Glatzel M. et al. Human Prion Diseases. Molecular and Clinical Aspects. Arch Neurol. 2005; 62:545-552.
- Valleron A.J., Boelle P.Y., Will R., Cesbron J.Y. Estimation of epidemic size and incubation time based on age characteristics of vCJD in the United Kingdom. Science. 2001; 294:1726-1728.
Подготовил Алексей Гладкий
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Ботулизм: как избежать беды
Ботулизм: как избежать беды
 Инфекции и аллергия: размышления на свободную тему
Инфекции и аллергия: размышления на свободную тему
 Слизистые оболочки – важный участок защитного барьера организма
Слизистые оболочки – важный участок защитного барьера организма
 Глистная инвазия или паразит человеку враг
Глистная инвазия или паразит человеку враг