- Головна
- /
- Статті
- /
- Кардіологія
- /
- Шлуночкова пароксизмальна тахікардія: стандарти діагностики, невідкладної допомоги та профілактики на основі даних доказової медицини
Шлуночкова пароксизмальна тахікардія: стандарти діагностики, невідкладної допомоги та профілактики на основі даних доказової медицини
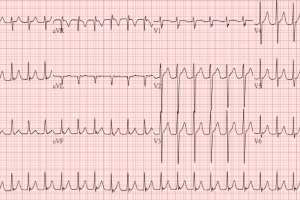
Шлуночкова пароксизмальна тахікардія (ШПТ) – це напади раптового серцебиття з частотою серцевих скорочень (ЧСС) 140-220/хв із правильним (регулярним) ритмом. Відомо, що ШПТ більш прогностично несприятлива, ніж суправентрикулярна, оскільки може переходити в фібриляцію шлуночків (ФШ), викликати ознаки хронічної серцевої недостатності (ХСН). За даними Американської асоціації кардіологів, від раптової серцевої смерті (РСС) у результаті виникнення ШПТ кожний рік помирає 400 тис. пацієнтів (приблизно одна смерть за хвилину і більше тисячі – за день).
У ході проведених в Україні за останні 17 років судово-медичних досліджень РСС від екзо- та ендогенних причин було зафіксовано найвищі показники раптової серцевої смерті в промислових областях (Донецькій, Харківській, Дніпропетровській та Запорізькій), а найнижчі – в сільськогосподарських (Житомирській, Хмельницькій, Львівській, Закарпатській, Рівненській) [4].
Етіологія. Здебільшого ШПТ має органічне походження і виникає при інфаркті міокарда, постінфарктному та дифузному кардіосклерозах, кардіоміопатіях, дифузному міокардиті, набутих і вроджених вадах серця, артеріальних гіпертензіях, синдромі подовженого інтервалу QT. Поряд із цим вона зустрічається при передозуванні серцевими глікозидами, адреноміметиками (адреналіном, норадреналіном, дофаміном, мезатоном), β-адреностимуляторами (сальбутамолом, беротеком, ізопротеронолом), а також при виникненні гіпокаліємії, гіпомагніємії, декомпенсованому метаболічному ацидозі, алкалозі тощо.
Факторами ризику ШПТ є:
- часта шлуночкова екстрасистолія (ШЕ) – > 10 уд./хв;
- політопні ШЕ;
- «залпові», групові ШЕ та транзиторні ШПТ.
Основні патогенетичні ланки ШПТ:
- Класичним механізмом розвитку ШПТ є механізм re-entry (рання та пізня деполяризації), який визначався картуванням при моделюванні порушень ритму серця у собак на відкритому серці. Аритмія за механізмом ранньої постдеполяризації моделюється за допомогою аконітину, пізньої постдеполяризації – строфантину, хлориду барію, хлориду кальцію (тригерного механізму); re-entry – перекису водню [1, 2, 5, 7, 8].
- Співставлення клініко-інструментальних параметрів у хворих із ІХС показали, що в 59,5% хворих на ШЕ зумовлена механізмом пізньої постдеполяризації – механізмом re-entry [7].
- При тяжких пошкодженнях міокарда виникає ШПТ, яка свідчить про електричну нестабільність міокарда. Патогенетичною основою електричної нестабільності міокарда при ХСН є не окремо взята ознака, а комплекс взаємозв’язаних між собою структурно-метаболічних змін, які реалізуються на тканинному, клітинному, субклітинному та мембранно-молекулярному рівнях. У механізмі розвитку передвісників електричної нестабільності міокарда значну роль відіграє активація ренін-ангіотензин-альдостеронової системи, симпатичної нервової системи [6].
- У розвитку електричної нестабільності міокарда ШПТ і виникненні ФШ значну роль відіграють іонні порушення в кардіоміоцитах і перевантаження їх, перш за все, Са2+.
Н. Трибулова, М. Моноах вважають, що будь-який антиаритмічний препарат (ААП) повинен зменшувати частоту ФШ, посилювати чи заново встановлювати міжклітинні контакти, перешкоджати міжклітинному електричному роз’єднанню шляхом підвищення рівня внутрішньоклітинного цАМФ і зниження іонізуючого Са2+ та/чи попереджувати перевантаження кардіоміоцитів Са2+ [9].
J.T. Bigger [11] запропонував прогностичну класифікацію ШПТ:
- Безпечні аритмії – будь-які екстрасистоли та епізоди ШПТ, які не викликають порушення гемодинаміки, в осіб без ознак органічного ураження серця.
- Потенційно небезпечні аритмії – шлуночкові аритмії, які не викликають порушення гемодинаміки, в осіб з органічними ураженнями серця.
- Небезпечні (злоякісні) аритмії – епізоди ШПТ, які супроводжуються порушеннями гемодинаміки чи фатальними аритміями. У хворих із небезпечними для життя шлуночковими аритміями, як правило, спостерігаються виражені органічні враження міокарда (чи «електрична хвороба серця»: синдром подовженого інтервалу Q T, синдром Бругада).
Критерії діагностики ШПТ наведені в алгоритмах 1 та 2.
Необхідно відзначити, що у хворих із перехідним ПТ із широким комплексом QRS під час нормального ритму ЕКГ може спостерігатися виражене порушення деполяризації з депресією сегменту ST.
Невідкладна допомога при ШПТ наведена в алгоритмах 3 та 4.
При ідіопатичній ШПТ із комплексами типу блокади правої ніжки пучка Гіса та відхиленням електричної вісі серця вліво найбільш ефективним є призначення верапамілу внутрішньовенно (10 мг) чи перорально (240-320 мг).
При ШПТ початкова доза ААП ІВ класу лідокаїну повинна становити 1,5 мг/кг (менша доза неефективна). Загальна доза лідокаїну при повторному введенні не повинна перевищувати 3 мг/кг маси тіла, а підтримуюча доза – 2-3 мг/хв (зрідка – 1-4 мг/хв). Доведено, що превентивне введення лідокаїну для попередження розвитку шлуночкових аритмій при інфаркті міокарда підвищує летальність.
При неефективності лідокаїну препаратом вибору є новокаїнамід, але при ШПТ його застосування обмежують, оскільки він викликає артеріальну гіпотензію. Цей препарат ризиковано вводити при ШПТ на тлі синдрому подовженого інтервалу Q T, який його потенціює і може викликати ФШ. Варто зауважити, що засобами вибору для припинення мономорфної ШПТ в Україні є новокаїнамід або аміодарон (уводити внутрішньовенно).
При злоякісних шлуночкових порушеннях ритму у хворих із тяжкою дисфункцією лівого шлуночка безпечним препаратом вибору є аміодарон можливо в комбінації з малими дозами β-адреноблокатора (метопрололу у дозі 6,25; 25; інколи 50 мг тричі на добу) і, звичайно, інгібітором АПФ. За відсутності тяжкого ураження міокарда, його дисфункції і/або СН можна застосовувати соталол у терапевтичній дозі 160-320 мг/добу.
Купірування ШПТ типу «пірует» може досягатися шляхом прискорення серцевого ритму за допомогою інфузії ізопротеронолу (від 2 до 20 мг/хв) чи проведення прискорювальної електрокардіостимуляції. Однак прискорення ЧСС у таких пацієнтів є фактором ризику виникнення ФШ, тому ці методи не знайшли широкого застосування.
Застосування препаратів калію при ШПТ не є серйозним базовим ААП, окрім випадків гіпокаліємії. У якості ж допоміжного засобу ці препарати застосовують переважно перед кардіоверсією.
Профілактика ШПТ на основі доказової медицини
Дані рандомізованого контрольованого дослідження CASCADE свідчать, що в осіб, які перенесли клінічну смерть унаслідок первинної ФШ, емпірично призначений аміодарон набагато ефективніше попереджував рецидиви ШПТ і ФШ, ніж три препарати І класу (хінідин, новокаїнамід і флекаїнід), що знаходилися під контролем холтерівського моніторування ЕКГ та електрофізіологічного дослідження. Ефективність зазначених препаратів становила відповідно 41 і 20% [15-17].
У ході важливих рандомізованих контрольованих досліджень ESVEM та CASCADE було показано, що ААП ІІІ класу соталол та аміодарон збільшують тривалість потенціалу дії в результаті сповільнення реполяризації, блокують калієві канали в ІІ та ІІІ фазах потенціалу дії, повільні кальцієві канали та β-адренорецептори. На ЕКГ під впливом соталолу та аміодарону відбувається сповільнення інтервалу P-Q за відсутності змін комплексу QRS та визначається подовження інтервалу Q T, що стає показником насичення цими препаратами.
Слід відмітити, що β-адреноблокатори, антиаритмічна ефективність яких щодо подолання ШЕ відносно слабка, мають здатність зменшувати ризик РСС у різних категорій пацієнтів і запобігати аритмогенним діям препаратів ІС класу. Ефективність β-адреноблокаторів у профілактиці РСС доведена для метопрололу, карведілолу та бісопрололу.
При порівняльному вивченні соталолу з аміодароном та тривалому лікуванні спонтанної тривалості ШПТ у хворих на ІХС встановлено, що соталол ефективніший за аміодарон. Однак ретроспективний аналіз 13 досліджень (загальне число хворих – 2030; спостереження тривало до 2 років) з вивчення ефективності тривалого застосування аміодарону для профілактики рецидивів ШПТ і ФШ дозволив виявити позитивний клінічний результат у 39-79% (у середньому 51%) випадків [13].
У результаті метааналізу рандомізованого контрольованого дослідження із вивчення ефективності різних ААП при ШЕ було встановлено, що найбільш ефективними антиаритмічними препаратами ІІІ класу є аміодарон (ефективність – 90-95%), соталол (75%) та ААП ІС класу (75-80%) [14].
Під час великомасштабного рандомізованого контрольованого дослідження САSТ (1989) встановлено, що у хворих із перенесеним інфарктом міокарда ефективне усунення ШЕ за допомогою флекаїніду, енкаїніду, етмозину призвело до статистичного підвищеного ризику смерті в 2,5 раза порівняно з плацебо [12].
У результаті рандомізованих контрольованих досліджень CAMIAT (Канада) та EMIAT (Європа) була підтверджена ефективність аміодарону в профілактиці ризику РСС у хворих із ШЕ, котрі перенесли інфаркт міокарда.
Додаткове призначення β-адреноблокаторів до аміодарону призводить до допоміжного зниження РСС від аритмії в 2,2 раза, ризику смерті від серцево-судинних захворювань – в 1,8 раза та ризику смерті від усіх причин – в 1,4 раза.
У результаті інших рандомізованих контрольованих досліджень було встановлено, що тривалість застосування аміодарону у хворих із потенційно злоякісними шлуночковими аритміями статистично достовірно знижує не тільки частоту РСС, але і смертність від усіх причин.
Результати метааналізу 138 рандомізованих контрольованих досліджень із вивчення ефективності ААП при ШЕ у хворих із інфарктом міокарда (98 тис. пацієнтів) показали, що призначення ААП І класу завжди призводить до підвищення ризику смерті, особливо ААП ІС класу. Аналогічна тенденція спостерігається при застосуванні антагоністів кальцію. Водночас ризик смерті зменшується в результаті застосування аміодарону та β-адреноблокаторів [16].
Дослідження ALIVE свідчить, що ефективність застосування аміодарону у хворих із високими факторами ризику РСС і асистолією в анамнезі майже удвічі вища, ніж при застосуванні лідокаїну. У ході дослідження EPAMSA було встановлено, що аміодарон у дозі 800 мг/добу протягом двох тижнів, а потім по 400 мг/добу до року зменшує загальну смертність у 2,8 раза, а РСС – у 2,9 раза порівняно з групою плацебо. У постінфарктних пацієнтів єдиним антиаритмічним засобом, для якого отримані докази доцільності застосування первинної профілактики РСС, залишається аміодарон. Одним із найбільш відомих став метааналіз АТМА, в якому було проаналізовано 13 рандомізованих досліджень (6 553 пацієнти) і встановлено, що ризик РСС при тривалому (протягом років) застосуванні аміодарону достовірно зменшився на 29%, а загальна смертність – на 13%.
Водночас рандомізоване контрольоване дослідження MADIT (1996) показало, що в профілактиці шлуночкових аритмій і виникненні РСС у пацієнтів після перенесеного інфаркту міокарда, нестійкої ШПТ і ФВ ≤ 35% провідне значення має імплантація кардіовертерів-дефібриляторів (смертність становила 5%) порівняно з медикаментозною терапією (смертність – 38%).
Враховуючи отримані дані в багатьох РКД, нами складено алгоритм 5 профілактики рецидивів ШПТ.
Отже, впровадження доказової медицини в практику стандартів діагностики, невідкладної допомоги та попередження нападів ШПТ має велике значення, оскільки допоможе зменшити, перш за все, РСС та загальну смертність при серцево-судинних захворюваннях.
Список літератури знаходиться в редакції.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення

 Мифы и неправильные представления о хроническом запоре
Мифы и неправильные представления о хроническом запоре
 Проблема запоров в терапевтической практике
Проблема запоров в терапевтической практике
 Запор. Выбираем решение
Запор. Выбираем решение
 Запор: от диагностики к рациональной терапии
Запор: от диагностики к рациональной терапии